玄归滴丸联合布洛芬治疗痛经的药效作用特点
2022-09-13胡静孟凡钰王彬李雪丽张琳庄朋伟天津中医药大学中药学院天津市中药药理学重点实验室天津301617
胡静,孟凡钰,王彬,李雪丽,张琳,庄朋伟(天津中医药大学中药学院,天津市中药药理学重点实验室,天津 301617)
原发性痛经是青春期女性的常见病和多发病,常伴随痉挛性、阵发性疼痛,临床常用非甾体抗炎药(NSAIDs)治疗,其中布洛芬(IBU)最为常用,尽管治疗效果显著,但布洛芬引起胃肠道并发症的风险不容忽视。临床调查显示,定期服用治疗剂量布洛芬的人发生消化道出血的可能性是不服用的3倍[1-2]。中药也常用于痛经的治疗,如由当归、延胡索、干姜组成的玄归滴丸,具有温经散寒、化瘀止痛功效,可用于治疗寒凝血瘀引起的经期小腹疼痛,伴月经量少、有血块、畏寒肢凉等症状[3-4]。有研究发现玄归滴丸的有效成分可以有效降低子宫缩宫素受体的表达[5],具有良好的镇痛、抗炎作用[6],且文献报道玄归止痛滴丸对大鼠、小鼠均无明显的急性、长期毒性作用[7]。但中药往往存在起效慢、作用缓和等缺点,因此中西药联合应用在临床防病治病过程中展现了巨大优势。基于上述问题,从中西药联合应用出发,通过比较玄归滴丸、布洛芬与联合用药在镇痛效果、缩宫素致小鼠扭体反应、离体子宫平滑肌收缩的抑制作用,明确联合用药与单独用药治疗痛经作用的优势与特点,通过比较玄归滴丸、布洛芬和联合用药对肠道出血风险的安全性,明确联合用药是否具有降低NSAIDs肠道出血风险的潜在作用,为临床中西药联合应用、增效减毒提供数据支撑。
1 材料
1.1 实验动物
ICR小鼠,雌性,体质量(20±2)g;SD大鼠,雌性,体质量(200±10)g [北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006]。饲养于天津中医药大学动物中心动物屏障系统,温度20~26℃,相对湿度40%~70%,气压恒定,昼夜12 h交替。
1.2 试药
玄归滴丸(天津中新药业第六中药厂,批号:609002,每丸40 mg);布洛芬(福建太平洋制药有限公司,批号:190317、201216,规格:0.3 g);缩宫素注射液(上海全宇生物科技动物药业有限公司,批号:200407);苯甲酸雌二醇注射液(宁波第二激素厂,批号:200804);醋酸地塞米松(天津力生制药股份有限公司,批号:1710043);4%组织固定液(Solarbio,P1110);Eastep Super 总RNA提取试剂盒(上海普洛麦格生物产品有限公司);FastKing gDNA Dispelling RT SuperMix、SuperReal PerMix Puls(SYBR Green)(天根生化科技北京有限公司);引物委托上海生工生物工程股份有限公司合成。
1.3 仪器
热板仪(淮北正华生物仪器设备有限公司);DZKW-D-2电热恒温水浴锅(北京市永光明医疗仪器有限公司);张力换能器(规格:0~50 g;批号:MLTF050/ST);分析天平(上海精密科学仪器有限公司天平仪器厂);离心机(Eppendorf 5424R,made in Germany);Scientz-48L冷冻型高通量组织研磨器(宁波新芝生物科技股份有限公司);核酸分析仪(基因有限公司,NanoDrop One);PCR扩增仪(Bio-rad T100 Thermal Cycler);实时荧光定量PCR仪(Bio-rad CFX96 Real-time System)。
2 方法
2.1 玄归滴丸联合布洛芬的药效作用
2.1.1 对小鼠镇痛效果的影响 智能热板仪的温度调节为(50±0.5)℃,ICR小鼠置于智能热板仪上,小鼠足底在接触热板至因痛出现舔后足的时间定为痛阈值。筛选反应潜伏期在10~30 s内的合格小鼠48只,随机分为6组,正常对照组,玄归滴丸组(4倍临床等效剂量,624 mg·kg-1),布洛芬高剂量组(200 mg·kg-1),布洛芬低剂量组(100 mg·kg-1),联合用药高剂量组(布洛芬200 mg·kg-1+玄归滴丸624 mg·kg-1),联合用药低剂量组(布洛芬100 mg·kg-1+玄归滴丸624 mg·kg-1),每组8只。预先测试小鼠痛阈值,连续灌胃给药3 d,末次给药后,分别测定给药后0、0.25、0.5、1、2 h各小鼠的痛阈两次,比较各组给药后不同时间点痛阈值差异。
2.1.2 对缩宫素所致小鼠痛经的影响 将48只小鼠随机分成6组,正常对照组、模型组、玄归滴丸组、布洛芬高剂量组、布洛芬低剂量组、联合用药低剂量组。灌胃给予相应药物(剂量同“2.1.1”项下)连续7 d,同时第5、6日腹腔注射苯甲酸雌二醇20 mg·kg-1(0.1 mL/10 g),第7日灌胃给药30 min后,腹腔注射缩宫素(0.1 mL·10 g-1)。测定并记录注射缩宫素后30 min内小鼠的扭体次数、扭体潜伏期。观察结束后,处死并解剖小鼠取子宫,精确取各组动物同侧同位段的新鲜子宫,生理盐水冲洗2次,拭干,称取子宫的质量,计算子宫系数[子宫系数(%)=子宫质量/体质量×100%],取另一侧子宫置于4%组织固定液中固定,进行石蜡包埋,HE染色,分析各组之间的病理差异。
2.1.3 对大鼠离体子宫平滑肌的影响 取未孕健康雌性SD大鼠,于实验前24 h腹腔注射苯甲酸雌二醇(2 mg·kg-1),以增加子宫平滑肌对药物的敏感性。迅速剖腹,取出子宫,立即置于盛有台式液的玻璃皿中。取一侧子宫的中段1 cm,轻柔剥离结缔组织和脂肪组织,一端固定于盛有台式液45 mL的麦氏浴槽的钩上;另一端与张力换能器相连,下为(37±1)℃的恒温浴箱。进入LabChart生物信号采集系统,选择张力通道,待标本稳定后,在浴槽中加入缩宫素0.2 mL,诱发子宫平滑肌痉挛性收缩。
将大鼠随机分为4组,正常对照组,玄归滴丸组(0.3789 mg·mL-1,试药均为蒸馏水配制),布洛芬高剂量组(0.1754 mg·mL-1),联合用药低剂量组(0.5495 mg·mL-1)。加入缩宫素15 min后,从麦氏浴槽上方加入各组受试液0.4 mL,观察并记录10 min时子宫收缩幅度(最大值)和频率变化。记录离体子宫平滑肌收缩频率、收缩张力,计算离体子宫活动力,分析联合用药后对子宫痉挛性收缩的影响(子宫活动力=子宫平均收缩张力×子宫收缩频率)。
2.2 玄归滴丸联合布洛芬对肠道出血风险的影响
2.2.1 分组及给药 ICR小鼠60只,依据文献方法[8]和前期预实验结果,随机分为5组,分别为正常对照组、玄归滴丸组、布洛芬高剂量组、布洛芬低剂量组、联合用药低剂量组,受试药物以蒸馏水为溶剂配制成对应浓度的混悬液。各组小鼠腹腔注射地塞米松(75 mg·kg-1)连续4 d,最后一次注射地塞米松1 h后各组小鼠灌胃给予相应药物(剂量同“2.1.1”项下)。给药8 h后处死小鼠,分离出整个肠道,观察肠道是否有出血点。取小鼠部分结肠病变组织,在4%组织固定液中固定,石蜡包埋,HE染色,分析各组之间的病理差异。
2.2.2 肠道组织生化指标检测 按照试剂盒要求提取小鼠结肠病变组织样本中的RNA,利用核酸分析仪检测总RNA的浓度,对RNA进行反转录合成cDNA,以cDNA为模板进行RT-qPCR反应,扩增条件如下:95℃预变性15 min;95℃变性10 s,60℃退火30 s,循环反应40次;循环完成后,将温度升至95℃,持续30 s,然后升至65℃,持续5 s,最后加热至95℃。以GADPH作为内参,使用2-ΔΔCt方法进行数据的相对定量分析,比较各组炎性细胞因子TNF-α、IL-1β、IL-6表达的差异。内参与目的基因引物序列如表1所示。

表1 引物序列Tab 1 Primer sequence
2.3 统计学处理
所有数据用±s表示,实验数据采用SPSS 26.0和GraphPad Prism 8.0.2统计软件进行单因素方差分析,多组间两两比较进行多重比较t检验,P<0.05表示差异有统计学意义。
3 结果
3.1 对小鼠痛阈值的影响
如图1所示,正常对照组各个时间点及各组0 h痛阔值均无显著差异;与正常对照组相比,玄归滴丸给药后0.5 h、1 h痛阈值显著升高(P<0.01),其他各组给药后各时间点痛阈值均显著升高(P<0.05,P<0.01),并且联合用药低剂量组与布洛芬高剂量组相比,差异没有统计学意义(P>0.05)。结果提示玄归滴丸与布洛芬联合用药提高了痛阈值。

图1 玄归滴丸与布洛芬镇痛效果比较研究( ±s,n=8)Fig 1 Analgesic effect of XGDP and IBU( ±s,n=8)
3.2 对缩宫素所致小鼠痛经模型的影响
3.2.1 对小鼠扭体反应和子宫质量的影响 如图2所示,与正常对照组比较,模型组小鼠扭体次数明显增多(P<0.01),子宫系数显著变大(P<0.01),说明模型制备成功。与模型组比较,玄归滴丸组扭体次数显著减少(P<0.01),潜伏时间、子宫系数差异不明显(P>0.05);布洛芬高、低剂量组和联合用药低剂量组扭体次数均显著减少(P<0.01),子宫系数均显著变小(P<0.01)。各组扭体发生率由高到低排序为:玄归滴丸组>布洛芬组>联合用药低剂量组。表明联合用药对缩宫素所致小鼠的疼痛具有明显的抑制效果。
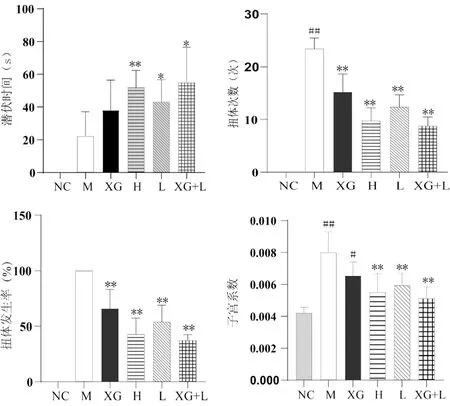
图2 药物对小鼠扭体反应的影响( ±s,n=8)Fig 2 Effect of drugs on the writhing responses of mice( ±s,n=8)
3.2.2 子宫病理结果 如图3所示,与正常对照组相比,模型组子宫壁增厚,腺体内有中性粒细胞团,炎性细胞浸润,说明模型制备成功;与模型组相比,玄归滴丸组,布洛芬高、低剂量组和联合用药低剂量组子宫壁厚度减轻,炎性细胞减少。

图3 子宫病理图(HE染色,×10)Fig 3 Pathology of uterus(HE staining,×10)
3.3 对离体子宫平滑肌的影响
3.3.1 对大鼠离体子宫收缩张力的影响 与正常对照组比较,加入缩宫素后,子宫平滑肌呈现强烈且持续的收缩,各组大鼠子宫平均收缩张力、张力最大值与最小值均较造模前显著提高(P<0.001),表明缩宫素能够引起离体子宫的痉挛性收缩(见表2)。与造模后比较,正常对照组对子宫收缩张力无明显变化(P>0.05),而单独给予布洛芬、玄归滴丸以及联合用药均可显著降低子宫平均收缩张力、张力最大值和最小值(P<0.01,P<0.001),且联合用药降低大鼠离体子宫收平均缩张力的作用比玄归滴丸降低更明显(P<0.001)(见表3)。
表2 缩宫素对大鼠离体子宫收缩张力的影响( ±s)Tab 2 Effect of oxytocin on the contraction tension of rat uterus in vitro ( ±s)

表2 缩宫素对大鼠离体子宫收缩张力的影响( ±s)Tab 2 Effect of oxytocin on the contraction tension of rat uterus in vitro ( ±s)
注:与造模前比较,**P<0.001。Note:vs before the model,**P<0.001.
组别 平均收缩张力/g 最大张力值/g 最小张力值/g造模前 造模后 造模前 造模后 造模前 造模后正常对照组 3.19±0.17 6.17±0.05** 4.95±0.34 6.42±0.09** 1.43±0.14 5.93±0.04**玄归滴丸组 1.05±0.37 4.11±0.17** 1.61±0.65 4.63±0.18** 0.50±0.06 3.59±0.16**布洛芬高剂量组 2.19±0.34 5.62±0.15** 4.36±0.68 5.87±0.16** 0.02±0.17 5.38±0.05**联合用药低剂量组 1.75±0.12 4.06±0.13** 2.19±0.23 4.61±0.12** 1.32±0.09 3.51±0.14**
表3 玄归滴丸联合布洛芬对大鼠离体子宫收缩张力的影响( ±s)Tab 3 Effect of XGDP combined with IBU on contraction tension of rat uterus in vitro ( ±s)

表3 玄归滴丸联合布洛芬对大鼠离体子宫收缩张力的影响( ±s)Tab 3 Effect of XGDP combined with IBU on contraction tension of rat uterus in vitro ( ±s)
注:与正常对照组比较,**P<0.001;与玄归滴丸组比较,##P<0.01。Note:vs the normal control group,**P<0.001;vs the XGDP group,##P<0.01.
组别 平均收缩张力变化值/g 最大张力值变化值/g 最小张力值变化值/g造模前后差值 给药前后差值 造模前后差值 给药前后差值 造模前后差值 给药前后差值正常对照组 2.98±0.16 -0.01±0.10 1.47±0.39 0.02±0.15 4.50±0.18 0.01±0.09玄归滴丸组 3.06±0.36 -2.73±0.22** 3.03±0.69 -2.71±0.36** 3.09±0.15 -2.75±0.29**布洛芬高剂量组 3.43±0.22 -3.39±0.19** 1.50±0.72 -3.29±0.20** 5.36±0.32 -3.50±0.19**联合用药低剂量组 2.31±0.07 -3.35±0.10**## 2.42±0.16 -3.64±0.17**## 2.20±0.10 -3.06±0.13**##
3.3.2 对大鼠离体子宫收缩频率与活动力的影响 由表4可见,正常对照组大鼠离体子宫收缩频率与活动力在给药前后无显著变化(P>0.05);玄归滴丸组与布洛芬组给药后小鼠子宫收缩频率、子宫活动力均显著降低(P<0.01,P<0.001),且与玄归滴丸相比,联合用药对降低大鼠离体子宫收缩频率和活动力具有统计学意义(P<0.05,P<0.01),与布洛芬相比,联合用药低剂量无统计学意义(P>0.05)。
表4 玄归滴丸联合布洛芬对大鼠离体子宫收缩频率和活动力的影响比较( ±s)Tab 4 Effect of XGDP on the contraction frequency and activity of the rat uterus in vitro ( ±s)

表4 玄归滴丸联合布洛芬对大鼠离体子宫收缩频率和活动力的影响比较( ±s)Tab 4 Effect of XGDP on the contraction frequency and activity of the rat uterus in vitro ( ±s)
注:与正常对照组比较,*P<0.01,**P<0.001;与玄归滴丸组比较,#P<0.05,##P<0.01。Note:vs the normal control group,*P<0.01,**P<0.001;vs the XGDP group,#PP<0.05,##P<0.01.
组别 收缩频率/(次/10 min) 活动力/(次/10 min)造模前后差值 给药前后差值 造模前后差值 给药前后差值正常对照组 12±2.12 -2±6.29 112.64±17.44 -12.47±38.38玄归滴丸组 8±1.48 -5±3.83* 67.23±5.35 -58.95±9.42**布洛芬高剂量组 10±2.68 -7±3.80* 90.15±14.55 -83.44±15.23**联合用药低剂量组 9±3.23 -9±3.35**# 62.79±7.82 -73.69±7.13**##
3.4 玄归滴丸联合布洛芬对肠道出血风险的影响
3.4.1 对肠道出血发生率的影响 取肠道组织进行观察,结果见图4,与正常对照组相比,玄归滴丸对小鼠肠道没有产生宏观损伤;布洛芬高剂量组小鼠下消化道出现了严重出血和宏观病变,而联合用药组减轻了肠道出血风险。肠道出血发生率由低到高:正常对照组≈玄归滴丸组(0%)<联合用药组(25.00%)<布洛芬低剂量组(41.67%)<布洛芬高剂量组(100%)。

图4 玄归滴丸对小鼠肠道出血的影响(n=12)Fig 4 Effect of XGDP on the intestinal bleeding in mice(n=12)
3.4.2 对小鼠肠道病理的影响 肠道病理切片HE染色结果如图5,正常组小鼠的肠组织结构清晰,黏膜完整。玄归滴丸组的肠组织黏膜上皮细胞完整,绒毛清晰;布洛芬高剂量组小鼠肠道组织病变明显,主要表现为局部黏膜层丢失,杯状细胞增多;而联合用药组的肠组织黏膜层损伤减轻。
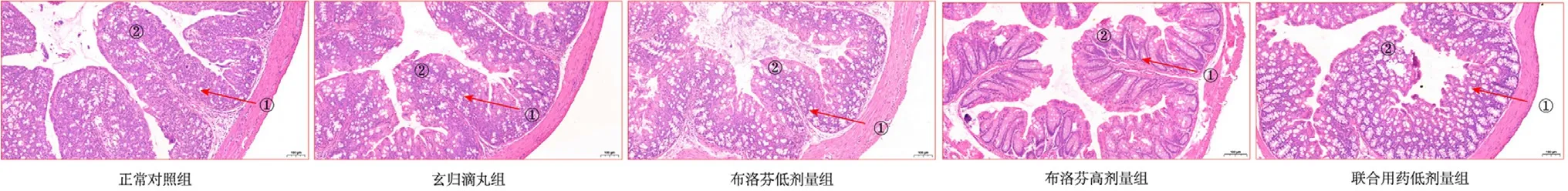
图5 玄归滴丸与布洛芬对小鼠肠道病理的影响(HE染色,×10)Fig 5 Effect of XGDP and IBU on the intestinal pathology in mice(HE staining,×10)
3.4.3 对肠道组织中TNF-α、IL-1β、IL-6的影响 肠道的炎性细胞因子mRNA水平表达结果如图6所示,与正常对照组相比,玄归滴丸组TNF-α、IL-1β、IL-6的表达水平无显著变化(P>0.05),布洛芬低、高剂量组和联合用药组中TNF-α、IL-6的表达水平均有不同程度的升高(P<0.05,P<0.01),联合用药组中IL-1β的表达有上升趋势,但差异无统计学意义;与布洛芬高剂量组相比,联合用药组中TNF-α、IL-1β、IL-6的表达水平均显著下降(P<0.05,P<0.01)。结果表明玄归滴丸与低剂量布洛芬联合应用会显著减轻布洛芬高剂量所带来的肠道出血炎性症状。

图6 玄归滴丸对肠道组织中TNF-α,IL-1β及IL-6表达的影响Fig 6 Effect of XGDP on the expression of TNF-α,IL-1β,and IL-6 in the intestinal tissues
4 讨论
原发性痛经的主要病理过程为子宫平滑肌、血管痉挛,子宫腔压力增大,血流量减少,子宫进一步缺血缺氧加剧挛缩状态,引起剧烈疼痛[9]。玄归滴丸源于古方玄归汤,是治疗妇女痛经之良药。前期对月舒滴丸(玄归滴丸)治疗实验性痛经模型进行了药效学研究,发现月舒滴丸对子宫收缩具有明显的缓解作用,同时具有良好的镇痛、抗炎作用[6]。布洛芬可明显抑制子宫内膜前列腺素的合成,减少子宫平滑肌收缩,达到缓解疼痛的效果。临床上常采用中西医结合或联合疗法治疗原发性痛经,可增加疗效,减少不良反应,提高治愈率。如在临床研究上,元胡止痛滴丸、温经散寒活血方、少腹逐瘀颗粒等中成药联合布洛芬共同治疗原发性痛经均具有明显的疗效,有一定的临床推广应用价值[9-11]。
在前期预实验中,为确定玄归滴丸镇痛效果的最佳量效关系,设置玄归滴丸低(临床等效剂量,156 mg·kg-1)、中(312 mg·kg-1)、高(624 mg·kg-1)3个剂量组,最终选择玄归滴丸临床等效4倍剂量组进行后期实验。利用热板实验确定玄归滴丸、布洛芬和联合用药具有显著的镇痛效果,利用缩宫素诱导的痛经模型和离体子宫平滑肌实验对治疗痛经药效进行了进一步研究,实验得出高剂量布洛芬与低剂量布洛芬联合玄归滴丸的镇痛效果相比没有显著差异。玄归滴丸和布洛芬联合用药能显著升高机体痛阈值,降低痛经模型扭体次数,舒张子宫平滑肌,从而治疗痛经。
在确定药效的基础上,研究联合用药的安全性。高剂量布洛芬(200 mg·kg-1)在抗炎镇痛的同时有明显的胃肠道不良反应(胃溃疡、十二指肠溃疡、小肠炎症、出血等)。根据文献,高剂量地塞米松(75 mg·kg-1)通过诱导小鼠GR信号,可明显加重布洛芬在小鼠小肠中的急性毒性所诱导的小肠损伤,而本身没有明显的不良反应,更方便观察小肠发生病变的宏观现象[8]。目前,在肠道出血风险分析中,引起肠道损伤的原因主要围绕在氧化损伤、炎症介质、微生态平衡失调、胃肠道黏膜免疫功能受损等方面[12]。通过HE染色结果可知,肠道出血伴随着炎症的发生,细胞因子是炎症发生的主要参与者,所以检测肠道组织中炎症细胞因子在肠道出血时的变化情况,可以进一步说明玄归滴丸、布洛芬以及联合用药在肠道出血风险上的差异。IL-1β由巨噬细胞产生,能够引起炎症介质和蛋白的释放,进而引起肠道炎症反应和局部组织的损伤,并与IL-6,TNF-α有协同作用[13]。IL-6是细胞因子的核心成员,能促进T淋巴细胞增殖,刺激细胞毒性T细胞反应,同时还能间接促进单核细胞和巨噬细胞的增殖,加剧机体炎症反应[14-15]。研究发现,TNF-α的表达上调,可以破坏肠道上皮细胞进而造成组织病理损伤[16]。本研究结果表明,高剂量布洛芬通过激活IL-1β、IL-6、TNF-α的高表达,引起较为严重的肠道出血,而联合用药后的肠道出血症状较之减轻。
综上,玄归滴丸联合低剂量布洛芬应用可以达到增强疗效的作用,且在此基础上可以显著降低肠道出血的发生率,显示出中西药联合应用的安全性和潜在的增效减毒作用,为临床联合用药实现增效减毒作用提供一定的实验数据支撑,但本文未深入探究所其涉及的机制问题,还需进行后续研究。
