雄黄的形态砷与价态砷在体内的转化和蓄积
2022-09-13陈杨王楚茵姚妮赵希彤张谦关君北京中医药大学中药学院北京102488
陈杨,王楚茵,姚妮,赵希彤,张谦,关君(北京中医药大学 中药学院,北京 102488)
雄黄,又名石黄、鸡冠石等,属于传统矿物类中药,在我国古代应用广泛,具有解毒杀虫、燥湿祛痰、截疟的功效。现代医学研究表明雄黄还兼具抗肿瘤的功效,可用于治疗肝癌、宫颈癌、白血病等多种恶性疾病。但雄黄中含有重金属砷元素,长期、大量服用雄黄,会导致砷在体内蓄积中毒,造成多种组织和器官的损伤。
雄黄的功效和毒性与其含有的砷元素的形态和价态密切相关。若能基于雄黄的已有研究开发出毒性小且疗效好的形态砷,将大大促进雄黄的临床应用。然而,目前已有的形态砷和价态砷的综述多集中在水、土壤、植物等研究领域。虽然,雄黄在人体、实验动物体内的形态砷、价态砷方面的研究众多,但尚未见详实的综述总结。有鉴于此,本文综述了现有的关于形态砷和价态砷的研究,以期为雄黄药用的安全性和科学性提供理论依据。
1 雄黄的形态砷和价态砷及其毒性研究
1.1 形态砷
1.1.1 雄黄在体外的形态砷 雄黄性温,味辛苦,有毒,入心肝二经。历版《中国药典》都将雄黄记载为:“硫化物类矿物雄黄族雄黄,主含二硫化二砷(AsS)”。但是,已有的研究结果表明,雄黄主要成分很可能为四硫化四砷(AsS),而AsS为其分解产物。关于雄黄的主要成分,争议颇多。一方面,由于X射线衍射法难以检测到含量低于下限值的物相(每个物相具有不同的下限值),也无法检测到没有对应的标准衍射卡片(powder diffraction file,PDF 卡片)的物相;另一方面,雄黄的组成成分复杂,存在多样的同分异构体,给X 射线衍射分析造成了很大的困难。
基于量子化学计算方法,AsS有两种稳定存在的异构体(可以看作是两种不同的形态砷),见图1。AsS也有两种可能稳定存在的异构体,见图2。

图1 As4S4 的两种异构体[11]Fig 1 Two isomers of As4S4[11]
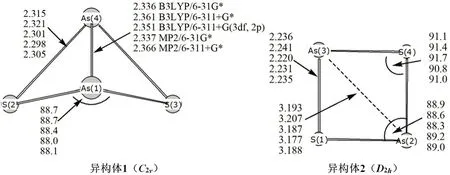
图2 As2S2 的两种异构体[16]Fig 2 Two isomers of As2S2[16]
1.1.2 雄黄在体内转化而成的形态砷 AsS在室温下能以固体形式存在,但难溶于水,难以吸收,在机体内的生物利用度低。因此,雄黄入药后主要起治疗作用和毒性的成分应该为其可溶性成分,即可溶性砷。如无机砷中的As(Ⅲ)、As(Ⅴ),有机砷中的一甲基砷酸(MMA)、二甲基砷酸(DMA)等。在酶催化下,砷在体内可进行氧化还原、生物甲基化、生物合成等多种过程,并产生多种形态砷,在机体内发挥主要作用。
已有多项研究证实,雄黄中的主要成分AsS进入机体后会代谢成不同的形态砷。雄黄中的砷在生物体内的存在形式主要包括四类:无机砷,如亚砷酸盐(AsO,Ⅲ)、砷酸盐(AsO,Ⅴ)等;有机砷小分子,如MMA、DMA、三甲基氧化砷(TMAO)、四甲基砷离子(TMAs)等;砷的有机化合物,如砷甜菜碱(AsB)、乳酸三甲基砷、砷胆碱(AsCh)、砷酯(AsL)、砷糖、二甲基砷氧基乙醇、二甲基砷氧基核苷、二甲基砷氧基核苷硫酸酯、O
-磷酸酰三甲基砷乳酸等;含砷的生物大分子,如砷化物(Ⅲ或V)与转铁蛋白或血红蛋白的结合物。1.2 价态砷
砷属于氮族元素,有四种常见的氧化值,分别为-3、0、+3 和+5[备注:在国际纯化学和应用化学联会(IUPAC)尚未推荐使用氧化值这个概念之前,人们通常用“化合价”或“价态”来表示元素原子的成键能力,且“价态”的说法一直沿用至今]。砷元素的四种常见氧化值可以分别表示为-Ⅲ、0、Ⅲ和Ⅴ四种价态。价态砷这种说法,重点强调在不同形态砷中砷元素的氧化值,因为该氧化值与形态砷的毒性密切相关。
1.3 形态砷和价态砷的毒性研究
雄黄的主要成分AsS经研究显示其口服吸收有限,大多随粪便排泄出体外,对机体毒性较小。同时药代动力学研究表明,雄黄中的砷在人体内可利用率较低。因此,雄黄进入人体内经生物转化后,产生毒性的多为其形态砷和价态砷。雄黄的不同形态砷和价态砷之间的毒性差异较大。研究表明,无机砷的毒性大于有机砷,其中,从价态的角度,无机砷(Ⅲ)的毒性又大于无机砷(Ⅴ),有机砷(Ⅲ)的毒性大于有机砷(Ⅴ)。因此,价态砷的毒性排序通常为:无机砷(Ⅲ)>无机砷(Ⅴ)>有机砷(Ⅲ)>有机砷(Ⅴ)。
过往研究表明,雄黄中的形态砷和价态砷能对人体造成多种毒性。Yi 等连续给予雄黄30 d 后观察大鼠体内的形态砷蓄积和毒性,结果显示亚砷酸盐[iAs(Ⅲ)]主要积累于肝脏中,而DMA 在肝、肾都有一定蓄积,推测雄黄引起的肝肾毒性可能与DMA 有关。Zhang 等采用无标记定量蛋白质组学方法探讨雄黄的肾毒性机制,检测出多种可能影响细胞凋亡过程和氧化应激的蛋白发生变化,说明雄黄诱导肾毒性机制可能与细胞凋亡和氧化应激有关。而该团队进一步通过考察雄黄诱导的急性肾损伤小鼠的血清和肾脏内源性代谢物谱,证实氨基酸代谢、脂质代谢、谷胱甘肽(GSH)代谢和嘌呤代谢途径与雄黄肾毒性呈现主要相关模式。Zhang 等采用非靶向代谢组学法研究雄黄对小鼠神经系统的影响,结果显示雄黄能通过加重氧化损伤和脂质功能障碍从而引发神经毒性。
陈吴越等分析了大鼠服用六神丸后肝脏组织中的四种砷形态,显示六神丸中的无机砷代谢后转变为毒性较小的DMA,安全性提升。刘敏敏等应用原子荧光光谱法(AFS)和液相色谱-原子荧光联用法(HPLC-AFS)测定出含雄黄制剂和标准砷溶液中砷的主要形态砷,其毒性由大到小的顺序为:亚砷酸盐、砷酸盐、MMA、DMA 和AsB、AsCh,后两者几乎无毒。
2 雄黄的形态砷和价态砷在生物体内的转化与蓄积
在机体内,不同形态砷和不同价态砷之间能相互转化。无机砷在体内经过氧化甲基化过程(主要在肝脏中进行)和还原过程(主要在血液中进行),产生多种甲基化砷的代谢产物。因为砷甲基化化合物的急性毒性较小,与组织大分子的反应较小,而且在尿液中排泄速度比无机砷快,因此,无机砷的甲基化过程通常被认为是生物体对砷的一种解毒机制。
2.1 雄黄中的形态砷和价态砷在体内的转化途径
砷在体内的经典代谢过程如图3 所示,其中iAs(V)表示砷酸盐、MMA(Ⅲ)表示一甲基砷酸(Ⅲ)、MMA(Ⅴ)表示一甲基砷酸(Ⅴ)、DMA(Ⅲ)表示二甲基砷酸(Ⅲ)、DMA(Ⅴ)表示二甲基砷酸(Ⅴ)。iAs(V)通过GSH 反应还原为iAs(Ⅲ),iAs(Ⅲ)在砷甲基转移酶作用下,以S
-腺苷甲硫氨酸(S
-adenosylmethionine,SAM)或者甲基钴胺素(甲基维生素B)作为甲基供体,将iAs(Ⅲ)转化为一甲基砷和二甲基砷化合物,或者进一步生成挥发性的三甲基砷化合物TMAs 等。
图3 雄黄中砷在体内的简要代谢过程[21]Fig 3 Brief metabolism process of arsenic in realgar in vivo[21]
同时,砷还有另外一种代谢模式学说。如图4 所示,这种学说认为iAs(Ⅲ)通过砷甲基转移酶(Cyt19)代谢并通过砷-谷胱甘肽(As-GSH)复合物代谢、转化为DMA(Ⅴ),而不是通过重复和氧化甲基化。该模式的机制如下:iAs(Ⅴ)被还原为iAs(Ⅲ)后,iAs(Ⅲ)与GSH 生成复合物砷-三谷胱甘肽(ATG),ATG 在SAM和Cyt19 的存在下被甲基化为单甲基胂二谷胱甘肽(MADG),MADG 可转化为MMA(Ⅲ),再进一步氧化形成MMA(Ⅴ)。同样的,MADG也能被Cyt19 进一步甲基化为二甲基胂谷胱甘肽(DMAG),DMAG 不稳定,转化为DMA(Ⅲ)后快速转化为DMA(Ⅴ)。该机制中As-GSH 复合物(ATG、MADG 和DMAG)稳定与否取决于GSH 的浓度。
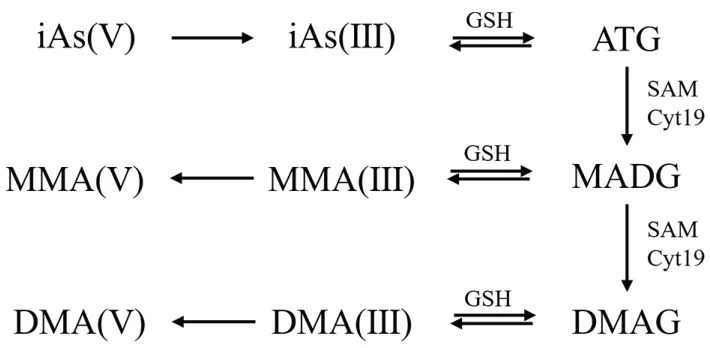
图4 雄黄中砷在体内代谢的另一过程[31]Fig 4 Another metabolism process of arsenic in realgar in vivo[31]
2.2 雄黄及其复方中形态砷和价态砷在机体内蓄积研究
多项研究探讨了雄黄进入机体后在机体内存在的形态砷和价态砷。张云静等给大鼠灌胃雄黄和牛黄解毒片后考察大鼠血浆中砷的形态,结果显示大鼠血浆中的主要形态砷为DMA,其他形态砷如iAs(Ⅲ)、MMA(Ⅴ)和iAs(V)等,在各时间点均未检测到,表明无机砷进入体内后被迅速甲基化。Zhang 等的实验显示Beagle犬经口服给予雄黄和牛黄解毒片后,血浆中的主要砷形态为DMA,并有少量iAs(Ⅴ),未测到iAs(Ⅲ)和MMA。强淑萍等使用高效液相色谱-氢化物发生原子荧光光谱(HPLC-HG-AFS)联用法测定并比较灌胃给药牛黄解毒片或雄黄后Beagle 犬血浆中的形态砷变化,结果显示Beagle犬血浆中主要的形态砷为DMA,并有少量iAs(Ⅴ);相比雄黄组,牛黄解毒片组的血浆中DMA 浓度较低,消除较快,说明该复方中其他味中药能减少形态砷的蓄积。Wu 等考察了含雄黄中成药(如牛黄解毒片)中的砷在大鼠体内的药代动力学和蓄积情况,结果显示,长期用药砷在大鼠体内的消除半衰期(t
)长,积累指数(AI)高,且在多个组织中蓄积,血浆中DMA 占比最多,而牛黄解毒片组的组织损伤低于雄黄组,且其组方中其他中药能降低大鼠体内砷的浓度,减少砷在体内的蓄积。姜新等对大鼠口服雄黄与纳米雄黄后血清、肝、肾、脾中iAs(Ⅲ)、iAs(Ⅴ)、MMA、DMA 四种砷形态进行定量分析,结果显示,在血清和肾脏中四种砷形态均被检出;在肝脏中只检测到 iAs(Ⅲ)、iAs(Ⅴ) 和 DMA,脾脏中只检测到 iAs(Ⅴ)和 DMA。这些实验结果均证实了雄黄进入机体经简要代谢后,其主要成分转化为多种形态砷并在机体内各器官中蓄积。目前,常用高效液相色谱-电感耦合等离子质谱(HPLC-ICP-MS)联用技术测定雄黄中多种形态砷的含量,该方法融合了几种检测方法的优点,具有高效性、高灵敏、高重现性、低检测限、宽线性范围等特点,用该法测定雄黄及含雄黄制剂中可溶性砷含量,效果良好;王启铮等用HPLC-ICP-MS 法测定对比雄黄和六神丸中可溶性砷含量,结果显示六神丸复方可显著抑制雄黄中可溶性砷的溶出,从而降低雄黄毒性。陈绍占等用HPLC-ICP-MS 法分析雄黄在大鼠脏器中代谢的砷形态,表明雄黄代谢后大鼠肝脏中砷形态主要以DMA 形式存在,还存在少量的iAs(Ⅲ)和未知物2;肾脏中主要存在DMA、MMA、iAs(Ⅲ)、未知物1、未知物2 和未知物3。同时,经牛黄解毒片暴露后大鼠血清中检出AsB、DMA(Ⅴ)、未知砷化物U1 和U2,其中DMA(Ⅴ)和U1 为经牛黄解毒片暴露后主要的代谢产物,少量的AsB 来源于饲料;砷化物U1 可能为DMA(Ⅲ),砷化物U2 尚不能确定。张庆丽等研究了Beagle 犬服用不同剂量雄黄和六神丸后组织中总砷及各形态砷的分布情况,结果显示Beagle 犬组织中总砷含量、iAs(Ⅲ)、DMA 含量呈现一定的剂量依赖性;含相同剂量雄黄的六神丸组与雄黄组相比,多数组织中总砷含量降低,所有组织中的iAs(Ⅲ)和DMA 浓度均降低,而肝、脾、肾中的AsB 浓度升高,表明六神丸复方配伍后对雄黄具有一定的减毒作用。而在Shi 等的研究中,通过分析食蟹猴静脉和灌胃给药三氧化二砷后的血液,结果显示iAs(Ⅲ)是一种有效的抗癌物,食蟹猴体内组织中含量最多的形态砷为DMA,为最终代谢产物。
研究员们多关注雄黄在机体内各组织器官的蓄积情况,以及通过尿液代谢的情况,较少关注雄黄在动物、人类大脑的蓄积情况。2007年,Rubio 等研究了大鼠在慢性砷暴露后冻干脑切片中的砷浓度,发现砷可进入大鼠脑内,且存在体积砷浓度的饱和值。研究发现iAs 在大脑的蓄积会损伤大鼠的周围感觉器官和中枢神经系统,破坏信息传递,且有机砷化合物比无机砷化合物更容易在大脑中蓄积。同时,Masuda 等对染砷食蟹猴的中枢神经系统的实验显示,有机砷二苯基砷酸(DPAA)容易在食蟹猴大脑中蓄积,且半衰期长于大鼠。由于食蟹猴基因与人类相近,说明DPAA 可能在人类的中枢神经系统中蓄积。多项研究探讨了雄黄对未成年大鼠脑组织中氨基酸(如天冬氨酸、谷氨酸等)水平的影响,结果显示,雄黄在体内的代谢产物为iAs、MMA 和DMA,大鼠脑中砷蓄积形态以DMA、MMA 为主,具有剂量依赖性,说明MMA 和DMA 可通过血脑屏障进入大脑;雄黄染毒可使大鼠脑内氨基酸水平失调,产生神经系统毒性。另有研究表明,脑组织也可能具有砷甲基化能力,无机砷在脑内可以被甲基化代谢成MMA 和DMA,且脑中砷蓄积形态以DMA 为主;在脑组织中未检测到iAs。杨钊等研究雄黄中砷对大鼠新事物识别能力的影响,使用氢化物发生-冷阱捕集-原子吸收光谱法(HG-CT-AAS)测定大鼠脑组织中iAs、MMA 和DMA 的含量。结果显示在雄黄组大鼠大脑中检测到MMA、DMA,且呈时间-剂量-效应关系。以上研究结果均显示雄黄代谢物能通过血脑屏障进入动物脑内并蓄积,产生神经系统毒性进而损伤大脑功能,但其机制有待更深入的研究。
关于雄黄代谢产物在脑部分区中蓄积与分布规律也有研究。Huo 等将大鼠暴露于雄黄6 周,检测雄黄对大鼠的神经系统作用及海马体中砷水平,结果显示大鼠出现认知能力缺陷,且雄黄中的砷通过血脑屏障在大鼠海马体中蓄积。Sánchez-Peña 等检测经iAs(Ⅲ)暴露后小鼠不同脑区的砷种类,结果表明甲基化砷代谢物存在于所有研究的脑区(大脑皮层、海马体、丘脑等),垂体中蓄积最多。而Shila 等的研究证实经过iAs 暴露的大鼠其大脑皮质、下丘脑、纹状体、小脑和海马区GSH 水平及相关酶活性受砷影响降低。
3 肠道菌群对雄黄代谢的作用
雄黄以及含雄黄的复方中药多以口服给药为主,其经人体代谢后主要随粪便排泄,说明胃肠道是雄黄排泄的主要场所。肠道是人口服中药后体内代谢的重要场所,肠道内含有丰富的微生物,统称为肠道菌群。肠道菌群不仅影响药物在人体内的生物转化,同时还关联相当多的疾病。人类的肠道菌群非常复杂,主要包括厚壁菌门、拟杆菌门、变形菌门、放线菌门、梭杆菌门、疣微球菌门、蓝细菌门等 7 个门,其中厚壁菌门和拟杆菌门在肠道内最具优势。目前,关于肠道菌群对雄黄的作用的研究已有一定进展,雄黄通过与肠道菌群相互作用,起到减毒增效的作用,同时对其菌群产生一定影响。
3.1 肠道菌群对雄黄的作用研究
罗世林等探讨了雄黄在肠道菌群作用下的初步代谢规律,将雄黄中可溶性砷与肠道菌群共同在厌氧培养系统中进行温孵化培育,采用HPLC-ICP-MS 法测定其形态砷。结果显示,随着时间延长,雄黄中可溶性砷中的iAs(Ⅲ)在肠道菌群作用下呈减少趋势,而iAs(Ⅴ)在0 ~12 h呈上升趋势,12 ~48 h 呈下降趋势。这可能与肠道菌群中GSH 的浓度有关。Chi 等使用肠道菌群干扰小鼠模型考察肠道菌群在砷的生物转化中的作用,结果显示砷代谢基因表达下降,其生物转化受到干扰,导致毒性加重,表明肠道菌群对雄黄中形态砷的代谢起重要作用。Xu 等同样使用肠道菌群破坏小鼠模型来探究肠道菌群对雄黄中砷蓄积的影响,结果显示肠道菌群被破坏的小鼠全血中砷浓度更高,说明肠道菌群对雄黄起到一个减毒的作用。Coryell 等的研究也证实了肠道菌群能防止急性砷中毒小鼠的死亡,研究选用初级砷解毒酶As3mt 缺失小鼠并分为菌群破坏组和对照组,结果显示与正常小鼠比较,菌群破坏的正常小鼠和菌群破坏的缺酶小鼠器官中砷蓄积量大,给缺酶的菌群破坏小鼠移植人类粪便(含微生物)后,能使其免于砷中毒所引发的死亡。
3.2 雄黄对肠道菌群的作用研究
雄黄对肠道菌群也具有一定的作用。孙宇婷等通过给予小鼠不同剂量的雄黄,探究了雄黄对肠道菌群的影响,结果显示各给药组小鼠肠道中乳酸菌属均减少,瘤胃球菌属、黏放线菌属增多,证明临床应用雄黄后会造成肠道菌群的紊乱,保护性菌减少,产生炎症,引发肠道不良反应。Xu 等的研究中显示高剂量(750 mg·kg)雄黄组中,菌群破坏小鼠和对照组小鼠间砷蓄积无显著差异,说明高剂量的雄黄会破坏肠道菌群稳态。Guo 等研究了砷和铁共同暴露下对肠道菌群的影响,结果显示砷和铁共同暴露能一定程度缓解两者单独使用对肠道菌群的影响,从而影响宿主代谢。
4 雄黄中形态砷和价态砷分析在中药领域中的应用
对雄黄中的形态砷和价态砷进行分析研究,一方面可以明确雄黄在机体内的代谢过程,探究其中起到治疗作用的药效成分;另一方面有助于完善雄黄及含雄黄复方中药的质量评价标准。同时,由于雄黄的临床应用广泛,分析其所含的形态砷和价态砷,能为探究雄黄配伍使用的减毒机制提供理论依据,提高雄黄在临床应用的安全性和科学性。
目前,雄黄及其复方的质量控制多以其中的总砷含量来评价,但由于雄黄在人体内主要发挥作用的是其可溶性砷部分,以总砷含量来评价雄黄的毒性并不科学,可溶性砷才是评价毒性的关键。因此雄黄的质量控制应检测其总砷和不同形态砷、价态砷的量。许珺辉等使用氢化物发生-原子荧光光谱法(HG-AFS)测定雄黄、含雄黄中草药中的形态砷,结果显示少数雄黄样品中有 MMA,而在牛黄清心丸、安宫牛黄丸未检出MMA 和DMA,其含有的 iAs(Ⅲ)和 iAs(V)也低于雄黄样品。
雄黄因其毒性以及易在人体内蓄积,临床上很少单用,而是常用一些含有雄黄的复方,如牛黄解毒片、安宫牛黄丸、牛黄清心丸等。研究表明,雄黄与其他中药配伍可以显著减少雄黄的毒性。Wu 等研究了牛黄解毒片中砷在大鼠体内的积累及安全性,结果显示与单用雄黄相比,牛黄解毒片组方中其他中药能显著减轻雄黄所致的组织损伤,降低血浆中砷浓度。复方配伍能削弱雄黄对机体的毒性的机制,推测可能与雄黄中形态砷和价态砷与复方中其他中药的有效成分发生化学反应有关。
5 讨论
雄黄中的形态砷和价态砷影响其疗效和毒性。本文从形态砷和价态砷的毒性研究、形态砷和价态砷在体内的转化与蓄积以及肠道菌群对雄黄生物转化的影响等方面对雄黄相关研究进行了综述。雄黄中的主要成分AsS难溶于水,生物利用度低,并不能很好地起到治疗作用。而雄黄进入体内分解后的可溶性砷——iAs(Ⅲ)、iAs(Ⅴ)等无机砷,MMA、DMA、TMAO、AsB 等有机砷,才可能是雄黄发挥药性和毒性的来源。不同的形态砷和价态砷在体内吸收、分布、代谢、蓄积和毒性上具有较大差异。不同形态砷经过甲基化后相互转化,最终主要以DMA 的形态蓄积在体内,再经肠道通过粪便排泄。
目前,肠道菌群的相关研究火热,肠道菌群在人体的各种疾病以及药物代谢中发挥重要作用。研究表明,中药经口服后,其有效成分必须经过肠道菌群代谢后才能被人体吸收,从而发挥药理作用。雄黄中的形态砷和价态砷经肠道菌群作用后,能有效促进其代谢,减少形态砷在人体内的蓄积,从而削弱雄黄对人体的毒性。但同时,大剂量、长期服用雄黄也会损害肠道菌群的稳态,使菌群失调,引发炎症。
近年来,雄黄因其显著的抗肿瘤作用,越来越受到医药研究者的关注。但雄黄中的砷毒性及其在人体内蓄积的问题影响着雄黄的临床应用。如何减弱雄黄的毒性,增强其疗效,更好地利用雄黄来治疗恶性疾病是研究的重点。雄黄进入机体后发挥主要作用的是可溶性砷,研究雄黄在机体内的形态砷和价态砷的代谢及蓄积能更好地实现雄黄的减毒增效,提高其临床应用水平。目前这方面的研究较少,还需研究者们进行更加深入、更加系统的研究,为提高雄黄临床用药的安全性和科学性提供依据。
