香烟烟雾颗粒通过MAPK和NF-κB信号通路上调内皮素受体诱导大鼠肠系膜动脉平滑肌收缩
2022-09-13张盼王钰莹王婷史永恒刘继平徐仓宝胡锐王川陕西中医药大学药学院陕西咸阳72046陕西省中医药管理局中药药效机制与物质基础重点研究室陕西咸阳72046西安医学院基础与转化医学研究所陕西省缺血性心血管疾病重点实验室西安7002
张盼,王钰莹,王婷,史永恒,2,刘继平,2,徐仓宝,胡锐,2*,王川,2*(.陕西中医药大学药学院,陕西 咸阳 72046;2.陕西省中医药管理局中药药效机制与物质基础重点研究室,陕西 咸阳 72046;.西安医学院基础与转化医学研究所/陕西省缺血性心血管疾病重点实验室,西安 7002)
吸烟是危害人类健康的主要因素之一。吸烟不仅对人类呼吸系统产生严重的损害,导致哮喘、慢性阻塞性肺病、肺癌等多种肺部疾病,而且也是冠心病、高血压、中风等多种疾病的危险因子。烟草烟雾中有4000 多种化学物质,其中尼古丁、一氧化碳、多环芳香烃和氧自由基等与心血管的损害直接相关。大量的临床研究和动物实验均证实,吸烟可以显著增加心血管系统疾病的患病风险。据《中国心血管健康与疾病报告》报道,全球每年约190 万人因烟草使用或二手烟暴露引发的冠心病而失去生命,约占全球因冠心病死亡的20%。内皮素(endothelin,ET)是一种强烈且持久收缩血管的多肽,主要由血管中的内皮细胞合成及分泌。内皮素受体(endothelin receptor)有两种亚型,分别为A 亚型(ETA)和B 亚型(ETB),在生理条件下,ETA 受体主要存在于血管平滑肌细胞中,介导血管收缩,而ETB 受体主要在血管内皮细胞上表达,促进一氧化氮和前列环素的产生,诱导血管舒张;然而,在病理条件下,ETB 受体在平滑肌细胞中大量表达,并且介导血管收缩。内皮素及其受体与多种心血管疾病的发病相关,在高血压和冠心病患者中,血管平滑肌上ETA 和ETB 受体上调。越来越多的证据表明,吸烟和血管痉挛可能与血管平滑肌细胞中内皮素受体的上调有关。丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK) 信号通路主要包括胞外信号调节激酶1 和2(extracellular signal-regulated protein kinase 1 and 2,ERK1/2)、c-Jun N 端激酶(c-Jun N-terminal kinase,JNK)和P38 蛋白激酶通路,调控细胞内的信号转导,在心血管疾病中具有重要的作用。核因子κ
B(nuclear factor-kappa B,NF-κ
B) 是MAPK 下游的重要转录因子之一,调控基因的表达。MAPK/NF-κ
B 信号通路的激活与动脉血管收缩密切相关,大量的研究表明,低密度脂蛋白、细颗粒物PM和香烟烟雾颗粒(DSP)等均可以损伤动脉血管,激活MAPK/NF-κ
B 信号转导通路介导的转录和翻译,合成新的收缩性受体(如血栓素受体、肾上腺素受体和内皮素受体等),导致血管平滑肌收缩,甚至引起血管痉挛。本课题组前期的研究也表明,DSP 通过ERK1/2 信号通路上调肾上腺素α
受体诱导血管平滑肌收缩。内皮素受体在血管收缩中起重要作用,但DSP 对ETA 和ETB 受体的作用机制还不十分清楚。为了进一步研究其作用机制,本实验采用SD 大鼠离体肠系膜动脉培养模型,将分离的大鼠肠系膜动脉,制成血管环进行器官培养,将特异性的细胞内信号通路抑制剂加到培养基中,以检验不同信号通路的参与情况;并通过肌张力描记技术记录血管环的张力变化,依次在血管环浴槽中加入选择性受体激动剂,观察内皮素受体介导的血管收缩;Western blot 法检测相关蛋白的表达,通过研究DSP 调节ETA 和ETB 受体的作用及机制,为预防和治疗与吸烟有关的心血管疾病提供新的思路。1 材料
1.1 动物
雄性SD 大鼠,SPF 级,6 ~8 周龄,体质量200 ~250 g [成都达硕实验动物有限公司,实验动物许可证号:SCXK(川)2020-030],动物饲养于陕西中医药大学中药药理实验室,饲养期间动物自由饮水进食。动物实验经陕西中医药大学伦理委员会批准。
1.2 试药
角蝰毒素6C(S6C,ETB 受体激动剂,Sigma-Aldrich,批号:097M4843V)、ET-1(Sigma-Aldrich,批号:088M4849V)、U0126(ERK1/2 通路抑制剂,批号:19826)、SP600125(JNK 通路抑制剂,批号:13775)、SB203580(P38 通路抑制剂,批号:10206)和Bay-117082(NF-κ
B 通路抑制剂,批号:17893)(MedChemExpress 公司);ETA 受体抗体(Abcam,批号:ab117521),ETB 受体抗体(GeneTex,批号:39603),p-ERK1/2(批号:4370S)、ERK1/2(批号:4695S)、p-P38(批号:4511S)、P38(批号:8690S)、p-NF-κ
B P65(批号:3039S)和NF-κ
B P65(批号:8242S)抗体(CST 公司);β
-actin 抗体(武汉博士德,批号:17353873);青霉素/链霉素溶液-双抗(HyClone 公司,批号:J190033)。1.3 仪器
DMT 630M 离体微血管张力测定系统(丹麦DMT 公司);CO培养箱(美国Thermo Scientific公司);Powerlab 生物信号采集处理系统(澳大利亚ADI 公司);电泳仪、转膜仪及化学发光系统(美国Bio-rad 公司)。
2 方法
2.1 DSP 的制备
将点燃的3 支万宝路香烟通过负压经过脱脂棉球,将脱脂棉球浸入1 mL DMSO 中使其附着物充分溶解,过滤除菌即得DSP。
2.2 肠系膜动脉环培养及分组、给药
SD 大鼠断颈处死,体视显微镜下分离出肠系膜动脉,使用Triton X-100 去除内皮,肠系膜动脉剪成约2 mm 的血管环,每段血管环加入DMEM 高糖培养基1 mL,按不同实验设计进行分组与给药:在培养基中加入DSP 或溶剂对照(DMSO)或MAPK 信号通路抑制剂(U0126、SP600125、SB203580) 或NF-κ
B 通路抑制剂(Bay-117082),培养板置于CO培养箱中培养24 h。2.3 离体肌张力描记
将培养的动脉环穿入两根直径为40 μm 的金属丝,一根金属丝与可调节预张力的张力微调装置相连,另一根连接张力换能器。恒温离体浴槽内加入5 mL Na-PSS 溶液(Na-PSS 液组成为NaCl 119 mmol·L,NaHCO15 mmol·L,KCl 4.6 mmol·L,MgCl1.2 mmol·L,NaHPO1.2 mmol·L,CaCl1.5 mmol·L和葡萄糖 5.5 mmol·L)。固定好的动脉环平衡40 min 后,施加2 mN 的预张力,加入5 mL 60 mmol·LK-PSS 液(K-PSS 液组成为NaCl 63.6 mmol·L,NaHCO15 mmol·L,KCl 60 mmol·L,MgCl1.2 mmol·L,NaHPO1.2 mmol·L,CaCl1.5 mmol·L和 葡 萄糖 5.5 mmol·L)检验动脉环收缩活性,使用乙酰胆碱检测内皮功能,若乙酰胆碱引起的舒张率<10%,认为内皮已被去除。采用梯度累加法加入特异性ETB 受体激动剂S6C 和ETA 受体激动剂ET-1,观察浓度-收缩曲线。
2.4 Western blot 检测相关蛋白的表达
培养的大鼠肠系膜动脉使用RIPA 裂解液提取总蛋白,采用BCA 法检测蛋白含量,蛋白样品经10%聚丙烯酰胺凝胶电泳后转印至PVDF膜,5%脱脂牛奶室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育1 h,ECL 发光试剂显影,使用化学发光成像系统进行拍照,检测目标条带的光密度值,分析相关蛋白表达。
2.5 统计学分析
所有数据用均数±标准差表示。激动剂在血管环上引起的收缩用K-PSS 溶液引起的收缩的百分数表示,E
是激动剂产生的最大收缩。使用SPSS 25.0 软件采用单因素方差分析(ANOVA)进行多组数据间的比较,P
<0.05 为差异有统计学意义。3 结果
3.1 DSP 对ETA 和ETB 受体介导的收缩反应的影响
离体动脉血管在含DSP(0.1、0.2 和0.4 μL·mL)的培养液中培养24 h,梯度累加法加入S6C(1×10~1×10mol·L), 图1B 结果显示,与DMSO 对照组相比,DSP 0.2 μL·mL对S6C 引起的收缩增强,量效曲线显著左移(P
<0.01)。ETB 受体激动剂S6C 加入浴槽60 min 后,收缩曲线回到基线,使ETB 受体脱敏,再按梯度累加法加入ET-1(1×10~1×10mol·L),激动ETA 受体,结果表明,DSP 0.2 μL·mL和DSP 0.4 μL·mL可以明显地增强ET-1 的收缩作用,浓度-收缩曲线明显左移(P
<0.05 或P
<0.01),因此DSP 的使用浓度选择为DSP 0.2 μL·mL。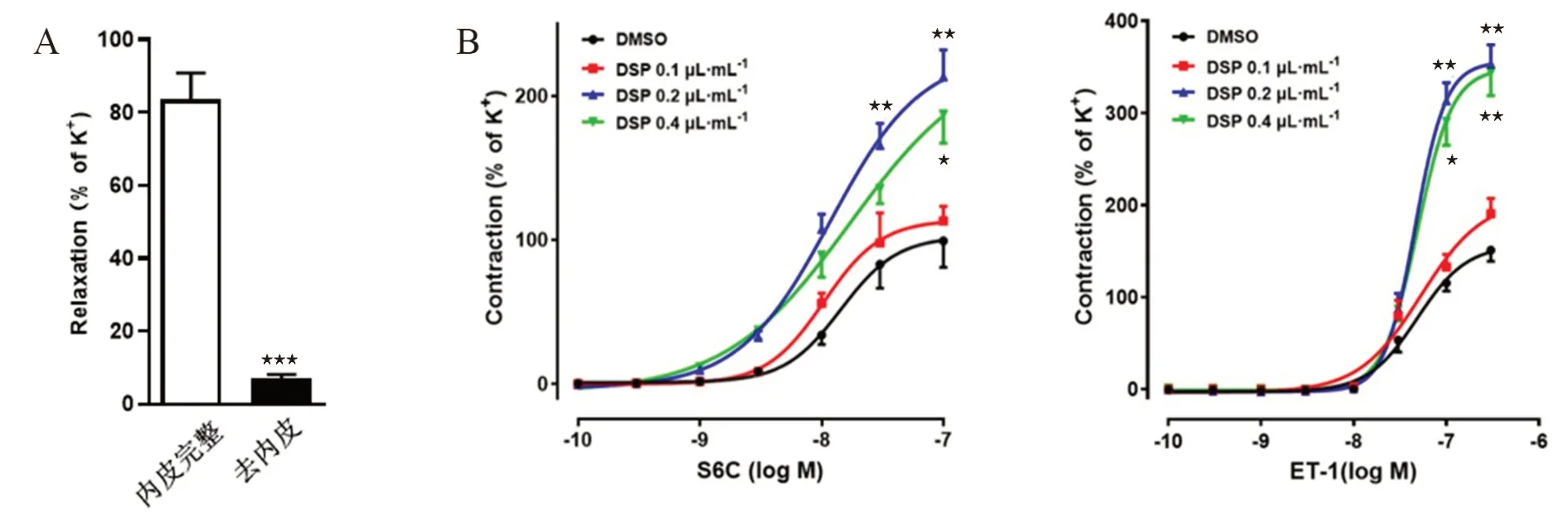
图1 DSP 对S6C 和ET-1 诱导的浓度-收缩曲线的影响Fig 1 Effect of DSP on concentration-contractile curves induced by S6C and ET-1 in a concentration-dependent manner
3.2 MAPK 通路抑制剂对DSP 诱导ETA 和ETB受体介导的收缩反应的影响
为了考察MAPK 通路是否参与了内皮素受体介导的动脉收缩,采用0.2 μL·mL的DSP与U0126、SP600125 或SB203580(浓度均为10 μmol·L)共同培养24 h。结果如图2 所示,与DSP 组相比,U0126 可以抑制ETB 受体激动剂S6C 和ETA 受体激动剂ET-1 诱导的收缩反应,S6C 诱导收缩的E
从(204.3±29.5)%降低为(2.56±1.17)%(P
<0.01),ET-1 诱导收缩的E
从(372.5±60.3)%降低为(123.1±26.7)%(P
<0.01);SP600125 对S6C 和ET-1 诱导的收缩反应没有显著影响;SB203580 可以显著抑制ETB受体激动剂S6C 和ETA 受体激动剂ET-1 诱导的收缩反应,S6C 诱导收缩的E
从(200.6±26.9)%降低为(38.9±9.8)%(P
<0.01),ET-1 诱导收缩的E
从(343.8±33.2)%降低为(239.3±42.4)%(P
<0.05)。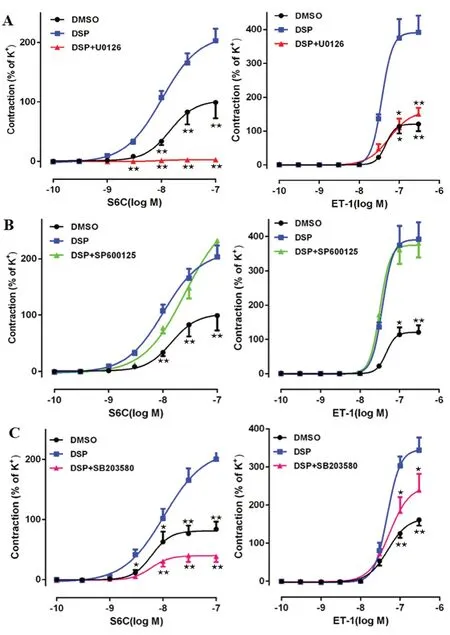
图2 MAPK 抑制剂对S6C 和ET-1 介导收缩的影响Fig 2 Effect of MAPK inhibitors on S6C and ET-1 induced contraction
Western blot 检测结果表明,DSP 组ETB 和ETA 受体蛋白表达升高,DSP +U0126 组ETB 和ETA 受体蛋白表达降低,DSP 组p-ERK1/2 蛋白的表达升高,DSP +U0126 组p-ERK1/2 蛋白的表达降低;DSP +SB203580 组ETB、ETA 受体蛋白和p-P38 蛋白的表达均降低(P
<0.05 或P
<0.01)。以上结果表明ERK1/2 和P38 可能参与了DSP 上调ETA 和ETB 受体引起的血管收缩(见图3)。
图3 肠系膜动脉ETA、ETB 受体和MAPK 通路蛋白的表达Fig 3 Protein expression of ETA,ETB receptor and MAPK pathways in mesenteric arteries
3.3 NF-κB 通路抑制剂对DSP 诱导ETA 和ETB受体介导的收缩反应的影响
为了研究NF-κ
B 信号通路是否参与了DSP诱导的收缩,采用NF-κ
B 通路抑制剂Bay-117082(10 μmol·L)与0.2 μL·mLDSP 共培养24 h。图4A 结果显示,与DSP 组相比,Bay-117082 可以显著抑制S6C 诱导的收缩反应,DSP 组的E
为(214.6±56.2)%,DSP +Bay-117082 组 的E
为(165.9±30.2)%(P
<0.05);与DSP 组相比,Bay-117082 对ET-1 诱导的收缩反应没有明显影响。Western blot 结果表明,Bay-117082 可以显著抑制ETB 受体的表达,而对ETA 受体的表达没有明显影响。与DMSO 组相比,DSP 显著增加了p-P65 蛋白表达;与DSP 组相比,DSP +Bay-117082 组p-P65 蛋白表达降低。以上结果表明NF-κ
B 信号通路可能参与了DSP 上调ETB 受体介导的血管收缩(见图5)。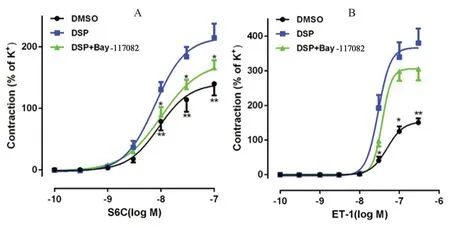
图4 NF-кB 抑制剂Bay-117082 对S6C(A)和ET-1(B)介导收缩的影响Fig 4 Effect of NF-кB pathway inhibitor Bay-117082 on S6C(A)and ET-1(B)induced contraction

图5 肠系膜动脉ETA、ETB 受体和p-P65 蛋白的表达Fig 5 Protein expression of ETA,ETB receptor and p-P65 in mesenteric arteries
4 讨论
吸烟与心血管疾病的发病密切相关,然而,吸烟导致血管痉挛的分子机制尚不清楚。内皮素与多种心血管疾病的发病机制有关,ET-1 是目前作用最强的内源性血管收缩剂,引起血管强烈且持久的收缩,ET-1 通过与血管平滑肌表面特异性内皮素受体(ETA 和ETB)结合,产生收缩血管的作用,刺激血管平滑肌细胞增殖、迁移,引起动脉血管重塑以及细胞外基质合成等多种生物学效应,使动脉血管的血管壁增厚和顺应性降低,导致血管阻力增加。内皮素还参与了原发性高血压、动脉粥样硬化、冠心病、充血性心力衰竭、肺动脉高压、脑血管疾病急性肾衰竭、多囊肾病和慢性肾脏疾病。大量的实验证明,在高血压患者的动脉、心肌梗死患者缺血区的动脉和自发性高血压大鼠动脉等中内皮素受体的表达上调,内皮素受体介导的动脉收缩参与了心血管疾病的发生与发展。
本研究通过离体血管培养技术,从大鼠肠系膜动脉平滑肌收缩功能和相关蛋白表达方面研究了DSP 对内皮素受体作用及其相关信号通路。研究结果表明,DSP 可以使肠系膜动脉环对S6C(ETB 受体激动剂)的收缩作用呈浓度依赖性,收缩量效曲线左移,与DMSO 相比,0.2 μL·mLDSP 使血管的收缩反应明显增强。在ETB 受体脱敏后按累加浓度法加入ET-1,激动ETA 受体,DSP 对ETA 受体介导的收缩反应也明显增强。MAPK 信号通路在血管痉挛和动脉高反应性中发挥着重要的作用,部分心血管危险因子刺激动脉平滑肌细胞上的G 蛋白偶联受体而激活MAPK 信号转导通路参与平滑肌收缩反应,如5-羟色胺、血管紧张素Ⅱ、血栓素、肾上腺素α
1 和内皮素等G 蛋白偶联受体引发的收缩机制中均有MAPK 通路参与。本课题组前期的研究也表明,DSP 激活ERK1/2-MAPK 信号通路,上调肾上腺素α
受体的表达,使血管收缩作用增强。本研究使用MAPK 信号通路抑制剂与DSP 共培养研究MAPK 通路对DSP 刺激引起的ETA 和ETB 受体上调的影响,发现U0126(ERK1/2 通路抑制剂)和SB203580(P38 通路抑制剂)可以显著抑制S6C 和ET-1 诱导的收缩反应;DSP 上调ETA 和ETB 受体的表达,活化ERK1/2 和P38 通路, 而U0126 和SB203580 抑制了ETA 和ETB 受体的表达,降低了p-EKR1/2或p-P38 的蛋白表达,表明ERK1/2 和P38 通路可能参与了DSP 上调ETA 和ETB 受体介导的血管收缩,而JNK 抑制剂SP600125 对S6C 和ET-1诱导的收缩反应没有显著影响,提示DSP 诱导内皮素受体的上调可能与JNK 信号通路无关。DSP激活MAPK 信号通路中的ERK1/2 和P38 通路,而不激活JNK 通路,介导动脉平滑肌ETA 和ETB 受体上调,导致血管平滑肌呈高反应性,增强血管收缩,甚至引起血管痉挛。NF-κ
B 是MAPK 下游的重要转录因子之一,Bay-117082(NF-κ
B 抑制剂)可以显著的抑制S6C 诱导的收缩反应,而对ET-1 诱导的收缩反应没有明显的影响。Western blot 结果也表明,Bay-117082 可以抑制ETB 受体的表达,而对ETA 受体没有明显的影响。P-65 蛋白是NF-κ
B家族中的代表蛋白,DSP 激活使p-P65 蛋白的表达增加,而Bay-117082 可以降低p-P65 蛋白的表达,表明NF-κ
B 可能参与了DSP 上调ETB 受体介导的血管收缩,而ETA 受体上调可能与NF-κ
B信号通路无关,提示ETA 受体的上调可能与转录后机制有关,后续将进一步深入研究。本研究也存在一定局限性,香烟烟雾中有4000 多种成分,我们无法得知香烟中的哪些成分刺激血管平滑肌导致内皮素受体上调;其次,血管内皮被去除,主要目的在于排除内皮功能的影响,针对性地研究DSP 引起平滑肌内皮素受体介导的收缩反应,但内皮细胞与平滑肌细胞的相互作用无法体现。
综上所述,DSP 通过激活MAPK/NF-κ
B 通路,激活转录及翻译,合成新的内皮素受体,使血管平滑肌内皮素受体表达上调,从而增强血管收缩。因此,阻断MAPK 和NF-κ
B 信号转导通路,抑制内皮素受体上调,改善血管平滑肌高反应性,有望成为治疗血管痉挛等心血管疾病的新思路和药物开发的新靶点。