超声波辅助提取油莎豆淀粉工艺优化及其理化特性
2022-09-13吕程龙朱春阳王栋董子研夏子慧赵世通左金潇田双起
吕程龙,朱春阳,王栋,董子研,夏子慧,赵世通,左金潇,田双起
(河南工业大学粮油食品学院,河南郑州 450001)
油莎豆L),又称地果、油豆、人参豆,还拥有虎坚果、地下核桃等称号,属多年生单子叶植物。油莎豆营养丰富,经济效益高,其油、蛋白质、淀粉含量分别占比20%~35%、10%~15%、20%~25%,并含有丰富的微量元素,其综合营养成份位于大多数谷物之上。油莎豆淀粉中直链和支链淀粉含量比值大概有1:3,使其具有许多优良的特性,包括透明度、溶解度以及膨胀度等。此外,油莎豆凝胶淀粉耐酸性强,热糊和冷糊稳定性优良,且具有明显优于玉米淀粉的冻融稳定性。
油莎豆有着广泛的应用前景,国内大多是将油莎豆当作油料作物,而关于淀粉的研究还不够完善,仍处于初期阶段,产品质量无法保障,标准也缺乏统一。王璐阳等研究了油莎豆压榨饼淀粉,得出了油莎豆淀粉具有优良的凝胶特性。于淑艳等指出油莎豆淀粉的冻融稳定性优于玉米淀粉。在国外,人们大多将油莎豆磨成粉而制作成面制品,也有人做成豆乳汁食用,以及做成油莎豆饮料、糖果等。Manek 等研究了油莎豆淀粉的提取工艺和理化特性,指出了油莎豆淀粉可作为一些药物的粘合剂的研究方向。Busola 等则直接研究了油莎豆淀粉在甲硝唑片剂中的应用。因此油莎豆淀粉在食品、制药方面有很大的应用前景,研究其提取工艺和理化特性具有重要价值。
目前对于油莎豆提取工艺的研究大多单纯的使用碱法将蛋白质去除,然后得到淀粉。王璐阳等研究油莎豆压榨饼的淀粉的提取工艺,通过正交试验优化提取条件,得到油莎豆压榨饼的最大提取率为77.61%。陈星等通过正交试验优化碱法的液料比、温度等因素,所得到的油莎豆淀粉最大提取率为89.9%。Meng 等通过石灰水浸泡法,通过正交试验优化浸泡液pH、液料比和浸泡时间,得到油莎豆淀粉的含量为35.4%。超声波辅助提取淀粉研究已被广泛应用,但是用于提取油莎豆淀粉的研究较少。由于这种方法提取淀粉不仅能够提高产率和缩短提取时间,而且所得淀粉的功能性质也更好,所以本试验将石油醚脱脂-超声波辅助碱法作为去除油莎豆中的蛋白质,得到油莎豆淀粉的方法,并优化超声条件,以提高淀粉提取率。通过单因素实验和响应面试验研究最适宜的超声辅助碱法提取的条件。通过对油莎豆淀粉与小麦淀粉等五种淀粉进行扫描电镜分析、傅里叶红外变换分析、X 射线衍射分析、DSC 分析,分析油莎豆淀粉与其它淀粉的不同特性,为研究油莎豆淀粉在食品中的应用提供依据。
1 材料与方法
1.1 材料与仪器
油莎豆 定州老位油莎豆;小麦、木薯、玉米、红薯、马铃薯五种淀粉 新乡良润全谷物食品有限公司;氢氧化钠 分析纯,天津市晶科化工有限公司;盐酸 分析纯,扬州市华富化工有限公司;石油醚分析纯,天津大茂化学试剂厂;硫酸锌 分析纯,天津登峰化学试剂厂;亚铁氰化钾 分析纯,天津恒兴化学试剂制造有限公司。
101AS-3 干燥箱 南通华泰实验仪器有限公司;SGW-537 旋光仪 上海仪电分析仪器有限公司;BSA224S 电子天平 北京赛多利斯科学仪器有限公司;KQ-300E 超声清洗机 昆山超声仪器有限公司;JSM-IT200 扫描电子显微镜 日本电子珠式会社;Nicolet iS50 傅里叶红外光谱仪 赛默飞世尔科技公司;D2 PHASERX 射线衍射仪 德国布鲁克;DSC2500 差示扫描量热仪 美国TA 公司。
1.2 实验方法
1.2.1 原料预处理 将新鲜油莎豆放于干燥箱中烘干,水分控制在15%左右,用粉碎机粉碎后过40 目筛,使用石油醚去除油脂后粉碎过60 目筛,得到油莎豆豆粕粉。
1.2.2 提取方法及淀粉提取率的测定 采用湿法提取淀粉。称量预处理得到的油莎豆豆粕粉20.00 g放入250 mL 烧杯中,加入一定比例的NaOH 溶液摇匀,在超声仪器中处理油莎豆豆粕粉一段时间,通过超声波处理,淀粉和蛋白质、非淀粉多糖等物质的结合能力降低,淀粉细胞破碎,从而减少淀粉的提取时间并提高提取率。超声波处理之后,在磁力搅拌锅中室温下搅拌30 min,使碱液进一步作用,蛋白质被充分去除,使油莎豆淀粉纯度提高。使用离心机,4000 r/min 离心15 min 后,弃去上清液,向沉淀物中加入适量蒸馏水,用200 目左右的细纱布过滤,得到的滤下物继续离心过滤,重复三次,离心沉淀物通过鼓风干燥箱进行干燥,温度40 ℃,时间24 h,即得油莎豆淀粉。
称取过40 目的油莎豆淀粉2.50 g,采用旋光法测定淀粉含量,采用以下公式计算油莎豆淀粉含量和提取率。

式中:油莎豆淀粉的比旋光度为203°。

1.2.3 单因素实验 单因素实验采用控制变量法,确定液料比、浸泡时间、浸泡温度、浸泡液pH 四个因素,并用以考察对油莎豆淀粉提取率的影响,为响应面试验确定最佳提取率的因素范围。
1.2.3.1 温度对淀粉提取率的影响 在液料比9:1 mL/g,浸泡时间40 min,浸泡液pH10 的条件下,依次以20、30、40、50、60、70 ℃,6 个梯度的温度考察温度对淀粉提取率的影响。
1.2.3.2 时间对淀粉提取率的影响 在液料比9:1 mL/g,浸泡温度40 ℃,浸泡液pH10 的条件下,依次以10、20、30、40、50、60 min,6 个梯度的时间考察时间对淀粉提取率的影响。
1.2.3.3 液料比对淀粉提取率的影响 在浸泡时间40 min,浸泡温度40 ℃,浸泡液pH10 的条件下,依次以3:1、6:1、9:1、12:1、15:1、18:1 mL/g,6 个梯度的液料比考察液料比对淀粉提取率的影响。
1.2.3.4 pH 对淀粉提取率的影响 在液料比9:1 mL/g,浸泡时间40 min,浸泡温度40 ℃的条件下,依次以pH8、9、10、11、12、13,6 个梯度的pH,考察pH 对淀粉提取率的影响。
1.2.4 响应面试验 响应面试验以单因素实验为基础,借助Design-Expert8.0 软件,每个因素在最高提取率周围选择三个条件,进行29 组实验。响应面分析因素及水平见表1。

表1 响应面分析因素及水平Table 1 Factors and levels of response surface analysis
1.2.5 扫描电镜测定方法 分别取油莎豆淀粉和小麦、木薯、玉米、红薯、马铃薯五种淀粉,沾到导电胶上,在真空环境中喷金处理,然后上机测试,观察颗粒的形态结构。
1.2.6 红外变换测定方法 分别取油莎豆淀粉和小麦、木薯、玉米、红薯、马铃薯五种淀粉,采用常规压片的方法,范围4000~400 cm。
1.2.7 X 射线衍射测定方法 分别取油莎豆淀粉和小麦、木薯、玉米、红薯、马铃薯五种淀粉,采用粉末状样品常规衍射法测定,扫描速度为10°/min。
1.2.8 糊化特性测定方法 分别取油莎豆淀粉和小麦、木薯、玉米、红薯、马铃薯五种淀粉,称取2 mg,加入70%(m/m)的蒸馏水,从10 ℃扫描到110 ℃,升温速率10 ℃/min,使用差示扫描量热仪进行测定,观察其加热糊化过程中的相变行为和热焓值的变化。使用TA Universal Analysis Q2000 软件分析糊化开始温度、峰值温度和终止温度(分别为To、Tp 和Te)等。
1.3 数据处理
单因素实验和响应面试验重复两次,测定六种淀粉性质实验重复一次,使用Origin 2019 作图,Design-Expert 8.0 处理响应面试验数据,平行实验的之间的差异通过标准差反映,并通过Excel 2010 计算提取率与标准差。
2 结果与分析
2.1 油莎豆淀粉提取单因素实验结果
2.1.1 温度对油莎豆淀粉提取率的影响 超声波辅助下温度对淀粉提取率的影响如图1 所示。

图1 温度对淀粉提取率的影响Fig.1 Effect of temperature on the starch extraction rate
刚开始提取率随着温度的增加而增加。温度40 ℃时,提取率达到最大,为88.04%。随着温度的上升,提取率逐渐下降,这可能是因为随着温度的升高,淀粉的溶解度和膨胀度增加。当温度达到70 ℃时,油莎豆豆粕粉溶液变成黏稠的胶体溶液,无法进行过滤等操作,此时测定其淀粉提取率无实际意义。因此确定超声波辅助提取油莎豆淀粉的最佳提取温度为40 ℃。
2.1.2 时间对油莎豆淀粉提取率的影响 超声波辅助下时间对淀粉提取率的影响如图2 所示。

图2 时间对淀粉提取率的影响Fig.2 Effect of time on the starch extraction rate
随着超声时间的增加,油莎豆淀粉的提取率也随之增加,在40 min 时,提取率达到最大值,为88.04%,但是随着时间继续增加,提取率开始呈现下降趋势。可能是因为随着超声时间的增加,细胞破碎程度提升,淀粉与其它成分结合的强度降低,使得淀粉更容易被提取,但是随着时间继续增加,蛋白质和可溶性糖的溶解度达到饱和,且淀粉的溶解度和膨胀度增加,使得提取率呈现下降趋势。因此确定超声波辅助提取油莎豆淀粉的最佳提取时间为40 min。
2.1.3 液料比对油莎豆淀粉提取率的影响 超声波辅助下液料比对淀粉提取率的影响如图3 所示。
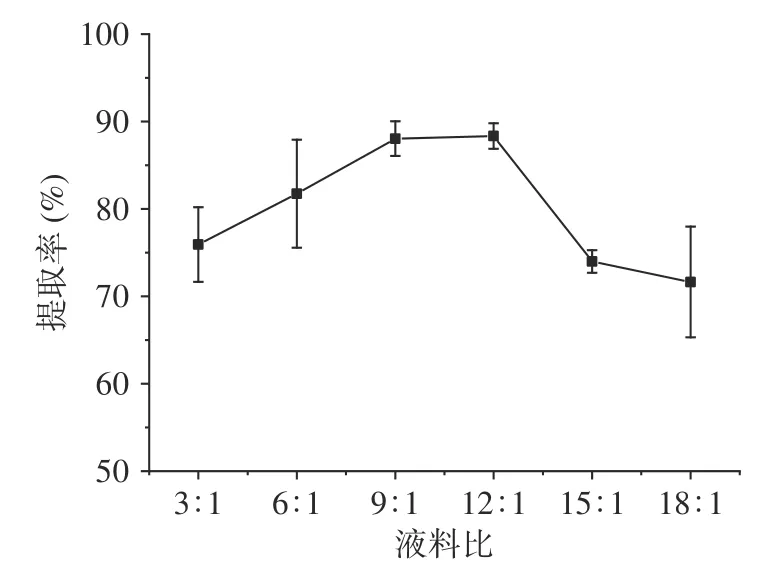
图3 液料比对淀粉提取率的影响Fig.3 Effect of liquid-to-material ratio on the starch extraction rate
随着液料比的增加,提取率也逐渐增加,当液料比为12:1 mL/g 时,提取率最大,为88.34%,这可能是因为在水的作用下淀粉与蛋白质的结合力降低。但是随着液料比的继续增加,提取率却逐渐下降,因此确定超声波辅助提取油莎豆淀粉的最佳提取液料比为12:1 mL/g。
2.1.4 pH 对油莎豆淀粉提取率的影响 超声波辅助下pH 对淀粉提取率的影响如图4 所示。

图4 pH 对淀粉提取率的影响Fig.4 Effect of pH on the starch extraction rate
当提取液的碱性增加时,提取率逐渐增加,当pH 达到9 时,提取率最大,为90.62%,随着碱性继续增加时,提取率开始逐渐下降。这可能是因为碱性较弱时,蛋白质未完全溶解,导致粗淀粉纯度较低,提取率较低,当溶液呈强碱性,淀粉在碱液的作用下,溶解性和膨胀性增加,导致提取的粗淀粉的质量降低,提取率呈下降趋势。因此确定超声波辅助提取油莎豆淀粉的最佳提取pH 为9。
2.2 响应面法优化提取油莎豆淀粉工艺条件分析
2.2.1 回归方程的建立及显著性分析 Box-Behnken试验设计及结果见表2。

表2 Box-Behnken 试验设计及结果Table 2 Box-Behnken experimental design and results
利用Design-Expert8.0 软件进行多元回归拟合,得到油莎豆淀粉提取率对温度(A)、时间(B)、液料比(C)、pH(D)的回归方程为:
Y=84.58−2.61A−0.55B−1.17C+0.69D−1.27AB−1.53AC+1.27AD+1.09BC−7.34BD−3.40CD+0.37A+0.63B−0.65C−3.17D
通过回归方程中各项系数的正负和绝对值的大小判断各因素对响应值的影响程度和方向,各因素对提取率的主次关系为:A>C>D>B,即温度>液料比>pH>时间。
对回归模型进行方差分析,结果见表3。
由表3 可知,该模型的=0.0019<0.01,表示此模型具有显著性。回归模型失拟项不显著(=0.1118>0.05),决定系数=0.8391,说明本试验模型与试验值拟合程度良好,试验误差小,可以对油莎豆淀粉提取率进行良好的预测。模型中一次项A,二次项BD 和D对响应值的影响极显著(<0.01),二次项CD 显著(<0.05),其余不显著(>0.05)。
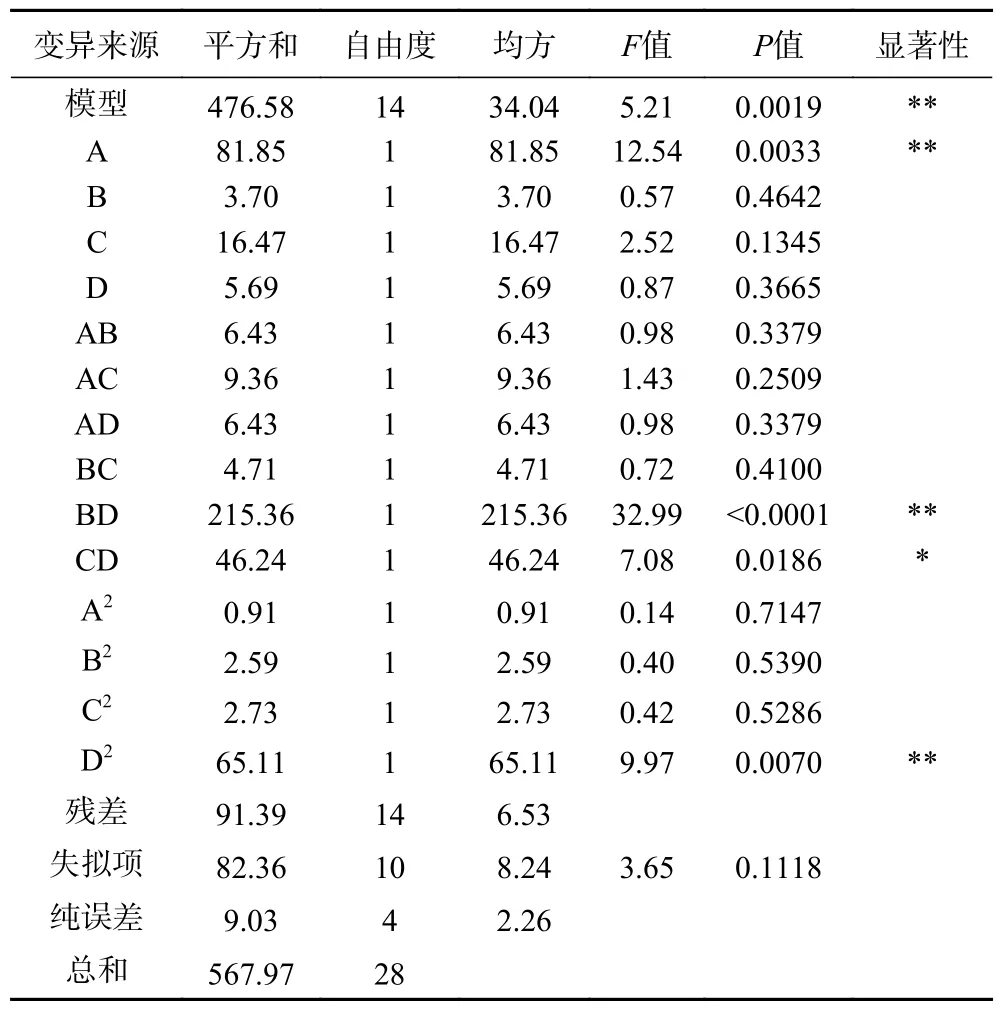
表3 回归模型的方差分析Table 3 Analysis of variance of the regression model
2.2.2 因素交互作用 如图5 所示为时间和液料比、液料比和pH、温度和液料比的交互作用的响应面和等高线。响应面坡度越陡则交互作用越显著,反之,越平缓则交互作用越不显著。由图5 中pH 和时间的响应面图可知,随着pH 和时间的增大,淀粉提取率也随之增大,而在pH 的方向上,响应面的坡度更陡,因此相对时间而言,pH 对淀粉提取率更显著。由图5 中pH 和液料比的响应面图可知,随着pH 和液料比的增大,淀粉提取率也随之增大,而在液料比的方向上,响应面的坡度更陡,因此相对pH 而言,液料比对淀粉提取率更显著。由图5 中温度和液料比的响应面图可知,随着液料比和温度的增大,淀粉提取率也随之增大,而在温度的方向上,响应面的坡度更陡,因此相对液料比而言,温度对淀粉提取率更显著。分析表明:各因素对提取率的主次关系为:A>C>D>B,即温度>液料比>pH>时间,与方差分析的结果一致,该模型具有良好的预测性。
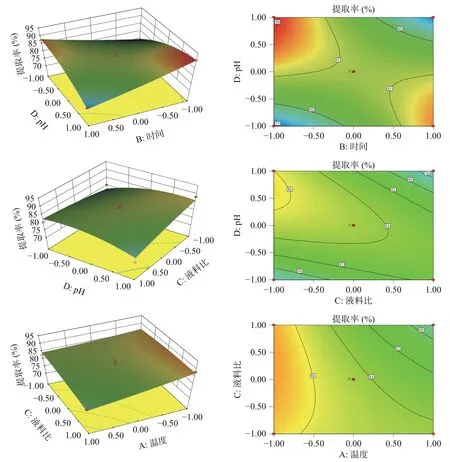
图5 交互作用显著的响应面和等高线图Fig.5 Response surface and contour map with significant interaction
2.2.3 回归模型的验证 通过Design-Expert 8.0 软件分析得出,超声波辅助提取油莎豆淀粉最佳工艺参数为:温度30.00 ℃、时间49.93 min、液料比14.99:1、pH8,此条件下油莎豆淀粉提取率为97.78%,可信度为0.918。考虑实际操作,将上述最佳参数中的温度调至30 ℃,时间为50 min,液料比15:1 mL/g,pH8,其余不变,在此条件下重复3 次试验,油莎豆淀粉提取率分别为90.83%、92.79%、93.05%,平均值为92.22%±0.99%,与理论预测值相比,其相对误差约为5.69%,在可接受范围内,此方案可行。
2.3 油莎豆淀粉的理化特性
2.3.1 扫描电镜分析 淀粉的颗粒大小决定了它的用途。研究表明,粒径偏小的淀粉可用于制作淀粉基生物膜和淀粉降解材料等。如图6 所示,不同种类的淀粉颗粒在形状上有不同特点。从形态上看,呈球形、多面体形、椭圆形、扁平形等,可以根据这些特点确定淀粉的种类。从图6 可以看出,红薯淀粉颗粒多为半球形且中心凹陷;马铃薯淀粉颗粒为块茎形;木薯淀粉颗粒与红薯淀粉颗粒形状类似;小麦淀粉颗粒大小不一,且大颗粒呈扁平状;油莎豆淀粉颗粒呈卵球形,表面光滑,粒径范围2~15 μm,与于淑艳等人的观察一致;玉米淀粉颗粒呈多面体结构,部分未熟粒为球形。与其它五种淀粉相比,油莎豆淀粉粒径偏小,属于中小粒度的淀粉。

图6 油莎豆等六种淀粉的扫描电镜图(1000×)Fig.6 Scanning electron micrographs of six kinds of starches including Cyperus esculentus L.(1000×)
2.3.2 傅里叶红外变换分析 由图7 可知,图中1162、1084、1023 cm出现的吸收信号,是C-O-H中的C-O 拉伸和C-O-C 中的C-O 拉伸;在2933 cm处为C-H 伸缩振动;3387 cm处对应O-H 拉伸。如图7 所示,玉米淀粉和油莎豆淀粉在1084、1023 cm处的红外信号波动降低,说明二者C-O 拉伸程度较低。在2933 和3387 cm处,玉米淀粉和油莎豆淀粉的红外信号波动降低,说明二者C-H 和O-H 伸缩振动程度较低。

图7 油莎豆等六种淀粉的傅里叶红外变换图Fig.7 Fourier infrared transform diagrams of six kinds of starches such as Cyperus esculentus L.
2.3.3 X 射线衍射分析 Jane 等的研究表明,B 型淀粉的晶体结构比A 型淀粉更容易水解。通过XRD分析确定油莎豆淀粉颗粒的晶型并与小麦淀粉等五种淀粉颗粒的晶型进行对比,如图8 所示为油莎豆等六种淀粉的XRD 衍射图谱,马铃薯在5.6°、17°、22°、24°有较强的衍射峰出现,属于B 型淀粉。油莎豆淀粉与小麦淀粉、木薯淀粉、红薯淀粉、玉米淀粉的淀粉颗粒的晶型相似,在15°、17°、18°、23°有较强的衍射峰,属于A 型淀粉。由此也可以得知油莎豆淀粉较马铃薯淀粉不易水解。

图8 油莎豆等六种淀粉的X 射线衍射图Fig.8 X-ray diffraction patterns of six kinds of starches including Cyperus esculentus L.
2.3.4 糊化特性分析 差示扫描量热仪可以通过物体相变的过程,体现其热力学性质,也可用来区分支链淀粉结晶、直链淀粉结晶。根据表4,油莎豆淀粉的在DSC 实验中起始温度、峰值温度和终止温度较高,分别为68.03、72.47、79.59 ℃,表明油莎豆淀粉的支链淀粉丰富。马铃薯淀粉的凝胶化焓值最大,为15.75 J/g,油莎豆淀粉的焓值位于其它五种淀粉之间。

表4 油莎豆淀粉等六种淀粉的DSC 热力学参数Table 4 DSC gelatinization thermodynamic parameters of six kinds of starches including Cyperus esculentus L.
3 结论
在单因素和响应面试验下得到超声波辅助提取油莎豆淀粉的最佳条件为:温度30 ℃、时间50 min、液料比15:1 mL/g、pH8,此条件下油莎豆淀粉提取率为92.22%,且响应面试验结果表明4 个因素对油莎豆淀粉提取率影响大小依次为:温度>液料比>pH>时间。
在对油莎豆淀粉理化特性的分析中,扫描电镜分析表明,油莎豆淀粉颗粒成卵球形,表面光滑,颗粒度较小;傅里叶红外变换分析表明,油莎豆淀粉CO 和O-H 拉伸程度较低,C-H 的伸缩振动程度较低。X 射线衍射分析表明,油莎豆淀粉与小麦淀粉、木薯淀粉、红薯淀粉、玉米淀粉的晶型相似,属于A 型淀粉,而马铃薯属于B 型淀粉。DSC 分析表明,油莎豆淀粉的起始温度、峰值温度仅低于红薯淀粉,终止温度低于红薯淀粉和玉米淀粉。
综上所述,油莎豆淀粉粒径相对较小,可将其作为淀粉基生物膜和淀粉降解材料。其起始糊化温度略低于红薯淀粉,终止糊化温度低于红薯淀粉和玉米淀粉说明它具有丰富的支链淀粉结构。另外油莎豆淀粉属于A 型淀粉,与B 型淀粉相比不易水解,但是与其它A 型淀粉水解程度的差异,还需进一步研究。
