壮药扶正方对TAMs与肿瘤细胞共培养体系A549细胞生物学行为的影响
2022-09-09张顺荣莫娟梅甘芷川李琼谦李婵娟唐伟智文海迪黄振飞
张顺荣 莫娟梅 甘芷川 李琼谦 李婵娟 郑 盼 梁 潇 唐伟智 唐 璜 苏 运 文海迪 黄振飞
(1 广西国际壮医医院肿瘤科,南宁,530201;2 广西中医药大学,南宁,530200)
虽然近年来肺癌的诊断水平及治疗效果取得长足进展,但总体5年生存率仍仅有15%左右[1]。近些年来,肺癌一直是世界范围发病率及死亡率最高的恶性肿瘤,严重危害人类健康和生命[2]。随着免疫治疗在肿瘤领域接连取得重大突破,从免疫角度探索新的肺癌治疗模式越来越受到重视。作为肿瘤免疫细胞浸润微环境中优势群体,肿瘤相关巨噬细胞(Tumor-associated Macrophages,TAMs)通常表现出免疫抑制的M2表型,已经证实其能促进肿瘤生长、血管生成、进展、转移和免疫抑制[3-4]。越来越多科研工作者开始重视制定策略来改变TAMs以阻止肺癌的进展,如促进从M2复极化到M1亚型,或防止基质环境中TAMs的M2极化,这为肿瘤免疫治疗提供了一个新靶点。
中医药在我国肺癌治疗中扮演着重要角色,现代研究表明中药单体或复方均在一定程度上调节肺癌免疫微环境[5-7]。肿瘤的发生、进展、治疗及预后的全程中通常伴随着正虚表现,故“扶正”为主的治则治法应贯穿肺癌诊治的全过程[8]。从免疫微环境角度观察“扶正法”治疗肿瘤的病机具有重要的临床意义。
壮医药归属中医药范畴,在肺癌防治中扮演重要角色。目前,关于壮药复方作用TAMs发挥抗肿瘤的研究尚少。我们前期临床观察发现壮药扶正方能够提高肺癌患者生命质量、增强患者免疫力、延长生存期[9]。为进一步探讨壮药扶正方治疗肺癌的可能机制,本研究采用上清共培养模型模拟肿瘤微环境,观察壮药扶正方含药血清对共培养体系A549细胞生物学行为的影响,探讨其抗肿瘤的免疫机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞 无特定病原体(Specific Pathogen Free,SPF)级SD大鼠40只,体质量(200±20)g,雌雄各半,购自广西医科大学实验动物(生产许可证号:SCXK桂2014-0002),于SPF级动物房进行饲养,饲养条件:温度20~24 ℃,相对湿度40%~60%,12 h明暗循环,标准饲料和水喂养。本实验过程符合中华人民共和国科技部2006年颁布的《关于善待实验动物的指导性意见》相关规定,且通过广西国际壮医医院动物伦理委员会审查(伦理审批号:【2021】-041)。人急性白血病单核细胞株THP-1和人肺癌细胞株A549均购自深圳锐奥博生物科技有限公司。
1.1.2 药物 五指毛桃饮片、黄花倒水莲饮片、黄芩饮片均购自广西国际壮医医院民族药房,且经广西中医药大学药学院教研室鉴定为地道药材,符合质量标准,并由广西国际壮医医院民族药制剂室制成浓缩浸膏,1 g浸膏相当于生药量6 g,灌装灭菌,置于4 ℃冰箱中备用。
1.1.3 试剂与仪器 主要试剂:RT-PCR试剂盒(康为世纪,货号:CW2677);白细胞介素-10[爱必信(上海)生物有限公司,货号:abs551807];白细胞介素-12[爱必信(上海)生物有限公司,货号:abs510012]、MTT试剂盒(Sigma公司,美国,货号:M2128);Trans-well共培养小室(Corning公司,美国,货号:3422)。主要仪器:CIM-plate16细胞迁移检测板[艾森生物(杭州)有限公司,型号:05665817001];多功能酶标仪(BioTek公司,美国,型号:SynergyHTX);台式冷冻离心机(SIGMA公司,德国,型号:TGL-16gR);荧光PCR仪[伯乐生命医学产品(上海)有限公司,美国,型号:CFX96 Touch];实时细胞分析仪(ACEA Biosciences公司,美国,型号:RTCA DP)。
1.1.4 含药血清制备 依据随机数字表将SD大鼠分成4组,分别为生理盐水对照组、壮药扶正方高剂量组4.474 g、壮药扶正方中剂量组2.237 g、壮药扶正方低剂量组1.119 g,每组10只。壮药扶正方组灌胃2 mL/次,2次/d(9am,4pm),连续7 d。空白对照组灌服等量生理盐水。末次给药后1 h行腹主动脉采血,同组大鼠的血液混匀后合装,56 ℃水浴30 min后取出,放入4 ℃冰箱过夜,凝固后经离心(重力加速度17 000×g),15 min后收集上清,0.22 μm滤膜过滤除菌,标记,置于-80 ℃冰箱贮存备用。
1.2 方法
1.2.1 MTT法检测含药血清对TAMs细胞增殖的影响 参考文献[10-11]建立TAMs体外模型,取对数生长期细胞(活力>95%)以1×106细胞接种于96孔培养板内,每组设置6孔,同时设3个复孔,每孔200 μL,用无血清RPMI-1640培养细胞24 h处于G0期。然后用各组含药血清培养细胞24 h、48 h、72 h后更换培养液,按MTT试剂盒操作完成实验,采用多功能酶标仪检测各孔的吸光度(A)值。根据公式计算每组平均抑制率(IR),并绘制细胞抑制率曲线IR=1-A药物组均值/A对照组均值×100%。
1.2.2 实时定量PCR检测含药血清干预TAMs后白细胞介素-10、白细胞介素-12、诱导型一氧化氮合酶及CD206基因表达 采用Trizol法分别提取各组含药血清干预后的细胞各个时段总RNA,测定其浓度及纯度,再将总RNA逆转录为cDNA,在qPCR仪上进行白细胞介素-10、白细胞介素-12、诱导型一氧化氮合酶及CD206基因检测,所需引物序列见表1。

表1 荧光定量qPCR引物序列
1.2.3 ELISA检测细胞因子表达 按照ELISA试剂盒说明书操作检测细胞因子白细胞介素-10、白细胞介素-12含量,采用多功能酶标仪检测各孔的吸光度(A)值,计算细胞因子的质量浓度。
1.2.4 MTT法检测上清共培养体系中A549细胞增殖水平 将培养至对数生长期的肺癌A549细胞用0.25%胰酶消化,调整浓度为1×106细胞/L接种于96孔板,每孔200 μL,培养24 h贴壁。更换培养液,分为5组:空白对照组(A549)、共培养组(A549+TAMs)、壮药扶正方低、中、高剂量组(A549+TAMs+壮药扶正方含药血清低、中、高)。处理24、48、72 h后每孔加入MTT工作液20 μL,置于37 ℃、5% CO2条件下继续孵育4 h,离心(重力加速度17 000×g)吸去上清液,每孔加入150 μLDMSO,摇床低速振荡10 min。采用多功能酶标仪测各孔的吸光度(OD)值,并计算抑制率。
1.2.5 实时细胞分析技术(RTCA)检测含药血清对上清共培养体系中A549细胞迁移的影响 参照文献[12],在CIM-Plate 16孔板的下板中加入含血清培养基165 μL,同时快速组装上板并于上板内加入无血清培养基30 μL,并将其放入培养箱平衡30 min测基线。胰酶消化肺癌A549细胞,调整浓度为1×106细胞/L,每孔加入100 μL,6 h贴壁后吸去同量上层培养液,空白对照组加入无血清培养基,共培养组加入TAMs上清,壮药扶正方各剂量组加入不同壮药扶正方药物浓度处理TAMs上清各100 μL。每组设3个复孔,37 ℃ 5% CO2恒温培养箱培养,RTCA-DP仪器实时监测72 h。
1.2.6 Transwell实验检测上清共培养体系中A549细胞侵袭能力 将基质胶(Matrigel)在4 ℃提前1 d融化,室温过夜液化稀释为工作液,加入Transwell小室底部膜上室,37 ℃培养箱培养30 min胶化Matrigel;空白对照组、共培养组、壮药扶正方低、中、高剂量组按照每孔5×103个的密度接种于上层腔室,在下层培养基中加入空白血清1640培养基。置于37 ℃ 5% CO2恒温培养箱培养24 h、48 h、72 h,取出小室,用PBS洗涤1次,70%冰乙醇溶液固定1 h,弃70%乙醇溶液,每孔加入0.1%结晶紫溶液1 mL,染色30 min后用磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)洗3次,晾干。用棉签小心擦去小室内没有迁移的细胞,在倒置显微镜下拍照、计数。
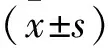
2 结果
2.1 壮药扶正方含药血清对TAMs细胞增殖活力的影响 与空白对照组比较,壮药扶正方含药血清低、中、高剂量组在分别刺激TAMs细胞24 h、48 h、72 h后的OD值均降低,并与刺激时长负相关(P<0.05,P<0.01)。抑制率(IR)依次升高并与刺激时长正相关。见表2、图1。
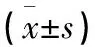
表2 壮药扶正方含药血清对TAMs增殖的影响
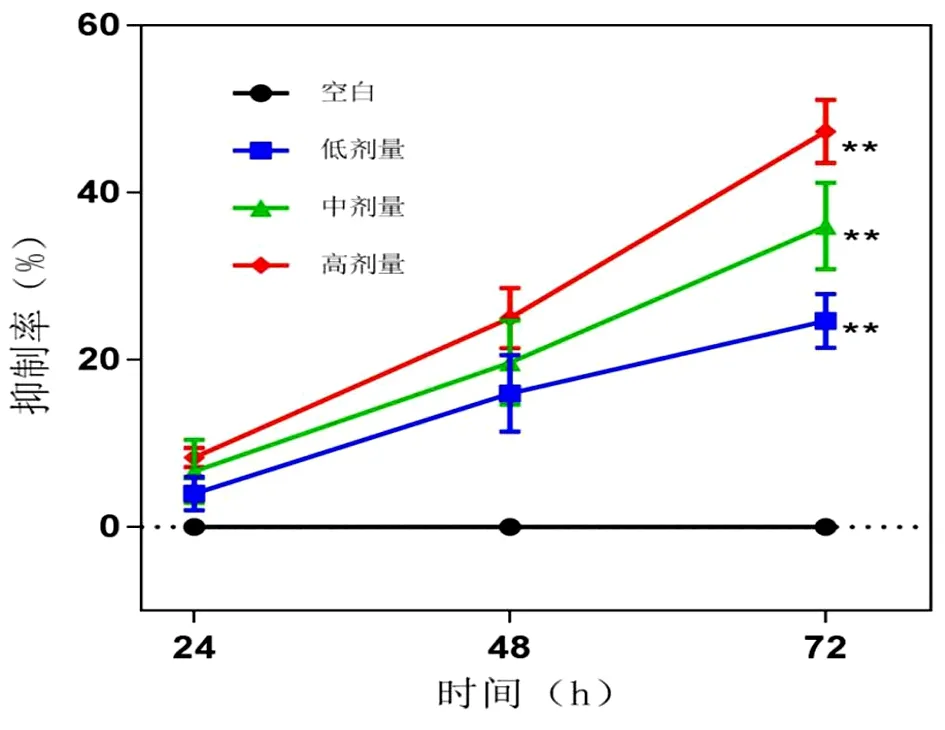
图1 不同剂量壮药扶正方含药血清对TAMs增殖的影响
2.2 壮药扶正方含药血清干预TAMs后能够调节其表型改变 与空白对照组比较,壮药含药血清处理各剂量组均能下调M2型标志物CD206、白细胞介素-10的mRNA相对表达量(P<0.05,P<0.01),上调M1型标志物诱导型一氧化氮合酶、白细胞介素-12的mRNA相对表达量(P<0.05,P<0.01),且呈剂量依赖性;同时各表型基因表达水平具有一定时间依赖性,在48 h时明显变化。见表3、图2。结果表明不同剂量的壮药扶正方含药血清能明显上调细胞因子白细胞介素-12的表达(P<0.01),同时下调白细胞介素-10的表达(P<0.01)。见图3。
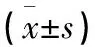
表3 不同剂量的壮药扶正方含药血清对TAMs指标的影响
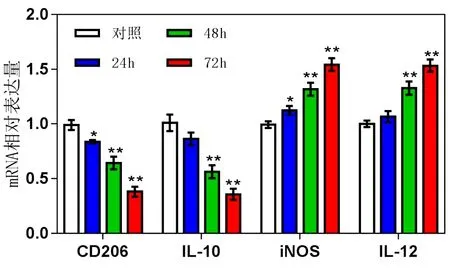
图2 不同用药时间对TAMs中CD206、白细胞介素-10、诱导型一氧化氮合酶、白细胞介素-12基因表达的影响

图3 各组细胞因子白细胞介素-10、白细胞介素-12的表达量比较
2.3 壮药扶正方含药血清对上清共培养体系中A549细胞增殖的影响 经低、中、高剂量组壮药扶正方含药血清处理的TAMs,取不同上清作用A549细胞24 h、48 h、72 h,观察其增殖情况。与空白对照组比较,共培养组肺癌A549细胞增殖水平增加(P<0.01);与共培养组比较,含药血清各剂量组肺癌A549细胞的增殖水平下降(P<0.05),呈剂量依赖性。见图4。

图4 不同剂量的壮药扶正方含药血清对上清共培养体系A549细胞增殖的影响
2.4 壮药扶正方含药血清对上清共培养体系中A549细胞迁移能力影响 与空白对照组比较,共培养组A549细胞迁移能力明显增强(P<0.01);与共培养组比较,壮药扶正方含药血清各剂量组A549细胞迁移能力明显降低,与48 h后比较差异有统计学意义,且呈量效关系(P<0.05)。见图5。
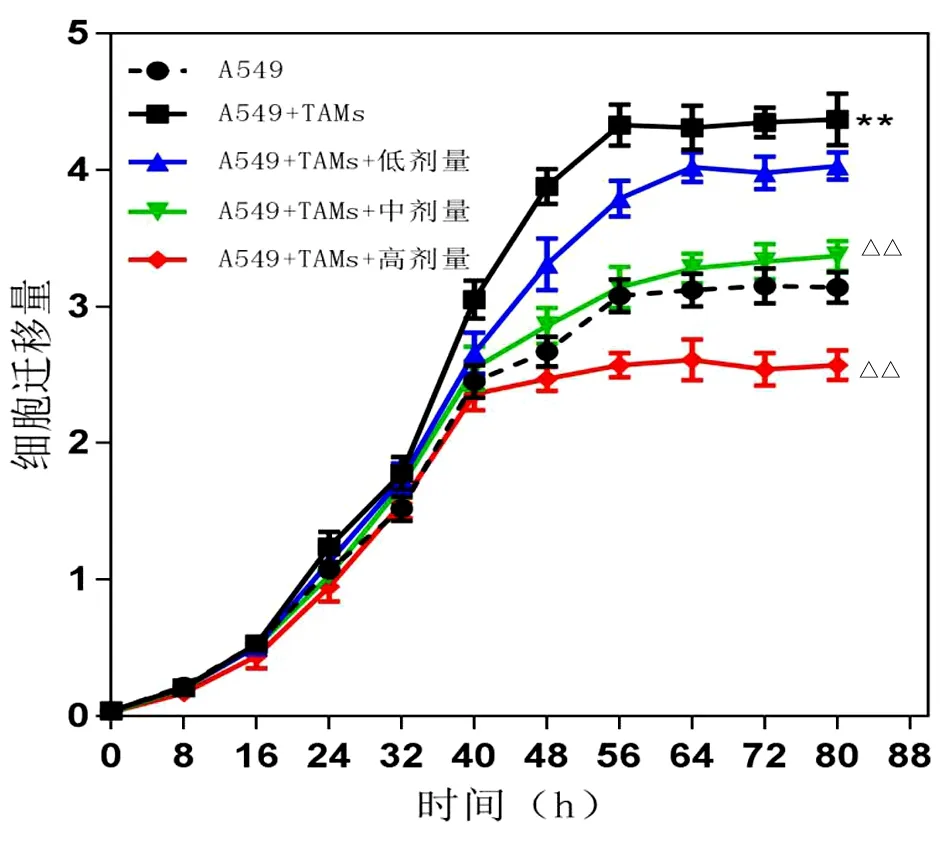
图5 壮药扶正方含药血清对共培养体系中A549细胞迁移的时效关系
2.5 壮药扶正方含药血清对上清共培养体系中A549细胞侵袭的影响 根据Transwell实验可看出,空白对照组穿过小室细胞数为(286±18)个,共培养组穿过小室细胞数为(553±24)个,经由不同浓度壮药扶正方含药血清共培养的TAMs处理后的A549细胞穿过小室的细胞数为分别为(509±20)个、(318±38)个、(204±24)个。与空白对照组比较,共培养组细胞明显增多;与共培养组比较,药物组细胞明显减少(P<0.01),且呈剂量依赖性。见图6。说明壮药扶正方含药血清能够通过调节TAMs表型来抑制A549细胞侵袭。
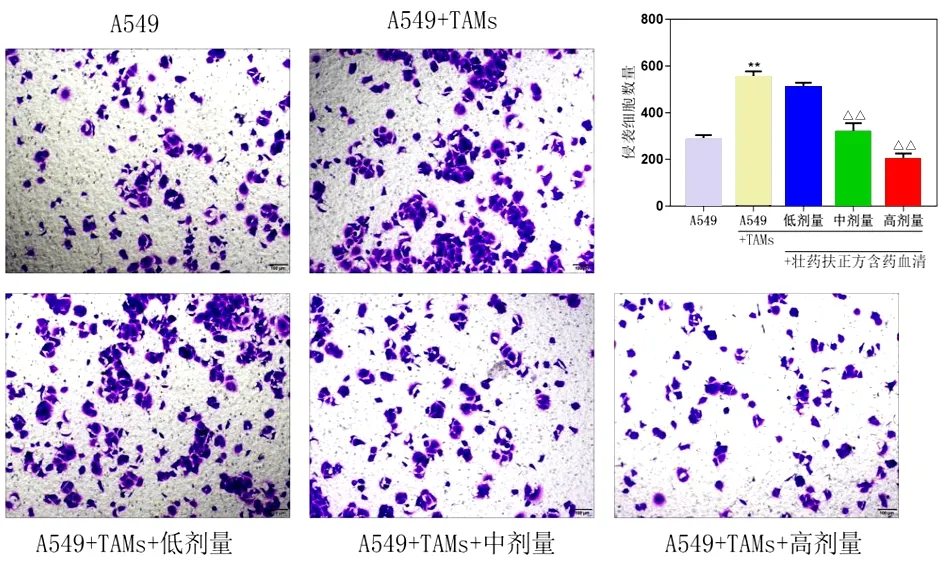
图6 壮药扶正方含药血清对共培养体系中A549细胞侵袭的影响(结晶紫染色,×100)
3 讨论
《外证医案》云:“正气虚则成岩。”《医宗必读》说:“积之成也,正气不足而后邪气踞之。”《灵枢·刺节真邪》说肿瘤为“虚邪之入于身也深,寒与热相搏,久留而内著”。以上论述均说明“正虚”是引起肺癌发生的内在因素。有研究通过统计学方法分析肺癌常用中药频率,结果显示如黄芪、人参等补益药为治疗肺癌的首要核心药物,说明“扶正”为治法应贯穿肺癌治疗全程[13]。研究表明,中医药的扶正作用在调控肺癌免疫微环境方面发挥重要作用[14-16]。因此应从抗癌中药(含民族药)中寻找具有调控TAMs潜力单体或复方,为肺癌综合治疗提供新的治疗策略。
现代研究表明五指毛桃、黄花倒水莲、黄芩能够调节肿瘤患者免疫功能,具有一定抗肿瘤作用[17-20]。作为壮药扶正类药物,五指毛桃、黄花倒水莲、黄芩的药效很多,其化学成分的研究已经比较详细,但是对其药理作用的研究虽有涉及,却欠完备,如对其扶正功效在巨噬细胞介导的肿瘤免疫微环境研究甚少。本文通过构建共培养模型,模拟肿瘤免疫微环境,进一步研究壮药扶正方抗肿瘤的作用机制。
本实验结果显示,不同浓度的壮药扶正方含药血清可以上调体外诱导的TAMs中M1型标志物,如白细胞介素-12、诱导型一氧化氮合酶,同时下调M2型标志物,如白细胞介素-10、CD206。在上清共培养系中,共培养组A549细胞明显增殖,迁移、侵袭作用增强;而经药物处理过的TAMs上清能够抑制A549细胞增殖,迁移侵袭作用也受抑制。本研究提示,壮药扶正方可能是通过调节TAMs表型影响A549细胞的生物学行为。但复方成分复杂,通过对免疫微环境的调节发挥抗肿瘤机制的成分尚不明确,有待进一步研究证实。
