乙脑/寨卡嵌合病毒株的生物学特性及免疫原性鉴定
2022-09-09黄荣冷生玲冯亚岚唐丽萍袁磊杨健
黄荣,冷生玲,冯亚岚,唐丽萍,袁磊,杨健
(1.川北医学院基础医学与法医学院,四川 南充 637000;2.绵阳市中心医院感染科,四川 绵阳 621000)
寨卡病毒(zika virus,ZIKV)属黄病毒科黄病毒属,是单链RNA病毒,编码3个结构蛋白(C,prM,E)和7个非结构蛋白(NS1,NS2A,NS2B,NS3,NS4A,NS4B和NS5)[1]。ZIKV主要传播媒介为伊蚊,性传播也有报道[2]。成人感染症状轻微,但有研究[3-4]显示,ZIKV感染与新生儿小头畸形、成人格林巴利综合征(GBS)存在密切联系。ZIKV主要在热带和亚热带地区流行,2015~2016年巴西寨卡病毒病大暴发,导致全球约150万人感染,WHO将ZIKV感染列为国际关注的突发公共卫生事件[5]。ZIKV对全球已造成较大的经济和健康负担,尚且无特效药,接种疫苗成为防控最有效的方式。一些DNA疫苗、灭活病毒疫苗等作为ZIKV疫苗候选株已进入临床试验阶段[6]。
目前ZIKV的毒力机制及其介导的免疫效应尚不清晰,嵌合减毒活疫苗较DNA疫苗、灭活疫苗来说,免疫原性更强,安全性更高,更适合作为ZIKV疫苗研发的发展方向。自90年代来,嵌合疫苗技术已用于开发了多种不同血清型的黄病毒疫苗候选株[7-8],该方法将黄病毒的prM/E序列嵌合已许可上市的其他黄病毒减毒活疫苗的骨架中,均获得良好的结果。本课题组在前期以乙脑疫苗株SA14-14-2为骨架嵌合ZIKV的prM/E序列,成功构建并拯救乙脑/寨卡嵌合病毒JE/ZIKA,本研究以此为基础,进一步探索该嵌合病毒作为疫苗候选株的安全性和有效性,分析JE/ZIKA作为ZIKV嵌合疫苗的可行性。
1 材料与方法
1.1 材料
地鼠肾(BHK21)细胞为川北医学院病原中心实验室保存,嵌合病毒JE/ZIKA为本室拯救保存。清洁级昆明鼠,体重10~14 g,由川北医学院实验动物中心提供。病毒学实验于川北医学院病原中心BSL-2实验室进行,动物实验方案经川北医学院动物实验伦理委员会批准通过。
1.2 方法
1.2.1 病毒的噬斑形态鉴定 将连续10倍等比稀释的嵌合病毒液和乙脑疫苗株SA14-14-2病毒液分别接种于铺满BHK21细胞的6孔板中,0.4 mL/孔,每个梯度设置复孔,于37 ℃ 5% CO2培养箱中吸附1 h,每隔20 min摇晃6孔板1次,使得病毒液与细胞均匀吸附。吸掉病毒液,将含4%FBS MEM培养基和2%低熔点琼脂糖等体积混合后加入6孔板中覆盖细胞,2 mL/孔,待孔中覆盖物冷却后将6孔板放置于37 ℃ 5% CO2培养箱中培养4~5 d,用4%甲醛溶液固定30 min,接着用10 g/L结晶紫染色10 min,流水冲洗,比较嵌合病毒和SA14-14-2的噬斑大小。
1.2.2 复制能力检测 分别以MOI=0.1、0.01、0.001将嵌合病毒接种到铺满单层BHK21细胞的75 cm2的培养瓶中,以MOI=0.01将SA14-14-2同样接种BHK21细胞作为对照组,继续培养,每隔12 h取200 μL上清液于-80 ℃冻存,直到细胞全部病变死亡。收集1~7 d样本,用噬斑实验逐一检测各个上清样本中病毒的滴度,以感染时间为横坐标,病毒滴度为纵坐标,绘制生长曲线。
1.2.3 神经毒力LD50和神经侵袭力检测 用嵌合病毒JE/ZIKA(2.7×106PFU/mL)分别通过皮下和腹腔途径(辅脑内空刺)、脑内途径接种昆明鼠,乙脑疫苗株SA14-14-2做对照,观察14 d,计算小鼠死亡率。10倍系列稀释嵌合病毒至10-7,从10-2稀释度开始,每个稀释度脑内接种昆明鼠各6只,0.03 mL/只,接种后3 d内死亡者不计,饲养14 d,用Reed-Muench法计算神经毒力LD50。
1.2.4 免疫原性分析 嵌合病毒JE/ZIKA(2.7×106PFU/mL)分别以皮下和腹腔途径各接种50只成鼠,皮下途径0.1 mL/只,腹腔途径0.5 mL/只。于免疫后第1~10周每周采血(每次各采集5只小鼠),分离血清,测定中和抗体效价(PRNT50),以 PRNT 50>10为阳转,计算 GMT。
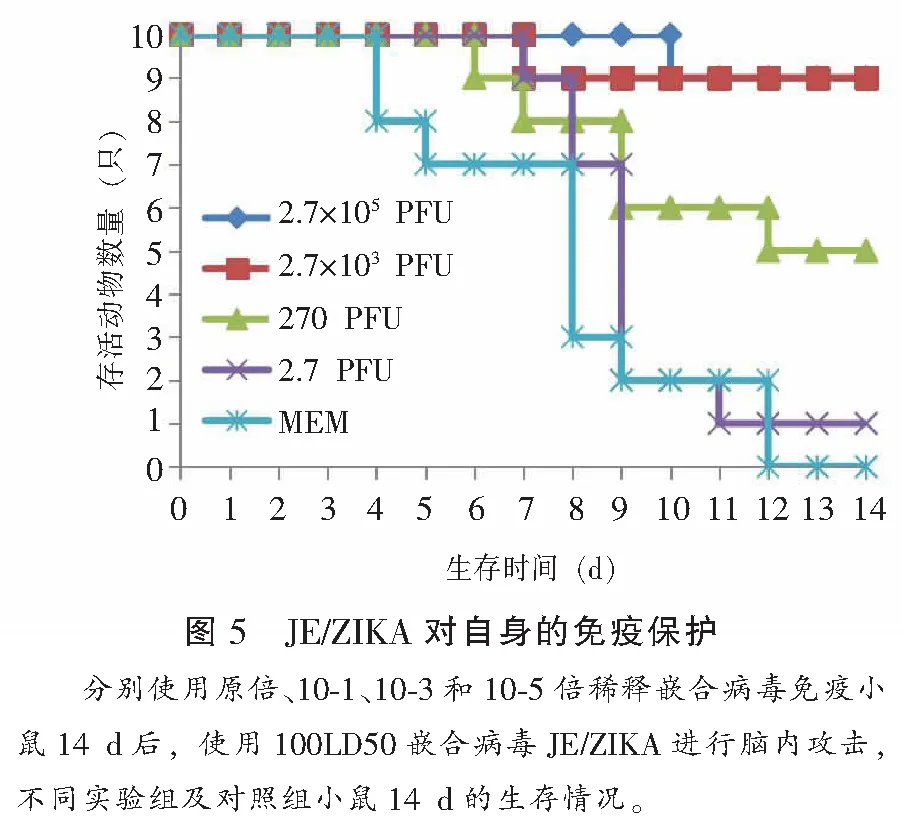
1.2.5 嵌合病毒JE/ZIKA免疫对自身的免疫保护 嵌合病毒JE/ZIKA(2.7×106PFU/mL)用不含血清的MEM进行10倍系列稀释至10-5,分别用原倍病毒、10-1、10-3和10-5倍稀释病毒免疫体重为10~12 g 的昆明鼠共40只,每组各10只,每只皮下注射0.1 mL,免疫14 d后,小鼠脑内注射0.03 mL(滴度为100 LD50)嵌合病毒,观察14 d,计算5组小鼠的死亡率。
1.2.6 嵌合病毒接种对小鼠乙脑病毒脑炎的交叉保护 嵌合病毒JE/ZIKA(3.45×106PFU/mL)皮下免疫昆明鼠10只,0.1 mL/只,免疫14 d后,用乙脑野毒株SA14(滴度为100LD50)腹腔攻击,观察14 d,记录小鼠死亡情况。
2 结果
2.1 嵌合病毒噬斑鉴定结果
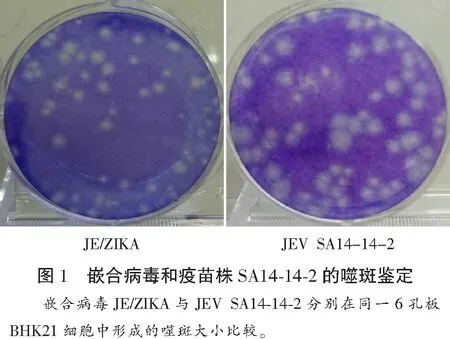
将嵌合病毒JE/ZIKV和乙脑疫苗株病毒JEV SA14-14-2在BHK21细胞上噬斑进行比较,发现嵌合病毒JE/ZIKA噬斑直径小于JEV SA14-14-2的噬斑直径。见图1。
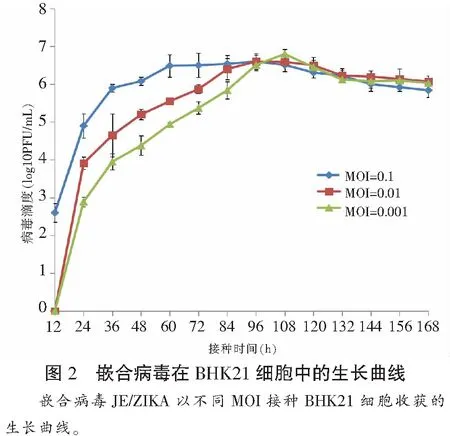
2.2 病毒的增殖曲线
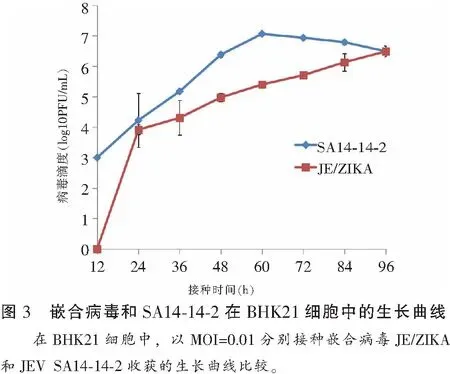
不同MOI收获的嵌合病毒峰值均可达到6.5 lg PFU/mL左右,滴度均在接种后第108 h左右达到高峰,随后滴度缓慢下降。MOI=0.001接种组病毒滴度上升较慢,但高峰滴度较另外两组略高。用JE/ZIKA和JEV SA14-14-2分别接种BHK21细胞(MOI=0.01),JEV SA14-14-2于接种后60 h内病毒增殖较快,在60 h出现复制高峰后开始缓慢下降,而JE/ZIKA在接种后增殖速度较JEV SA14-14-2快,接种96 h也未达到高峰滴度。见图2及图3。
2.3 神经毒力和神经侵袭力检测结果
通过皮下及腹腔途径接种嵌合病毒,各组昆明鼠均未出现发病或死亡情况,而脑内途径接种组小鼠于14 d全部死亡,SA14-14-2接种组小鼠均健存。分别用10倍梯度系列稀释JE/ZIKA脑内接种昆明鼠,测定JE/ZIKA对3周龄昆明鼠的LD50为2.4 PFU(0.03 mL),见表1及表2。
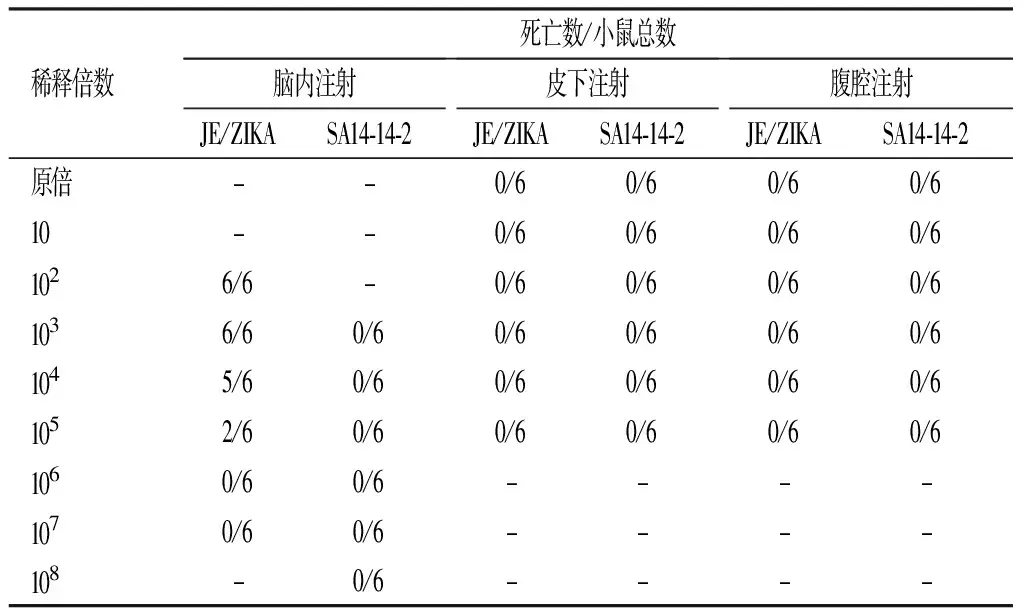
表1 嵌合病毒对3周龄小鼠的神经毒力和神经侵袭力检测结果

表2 嵌合病毒对3周龄小鼠的神经毒力LD50
2.4 免疫原性分析
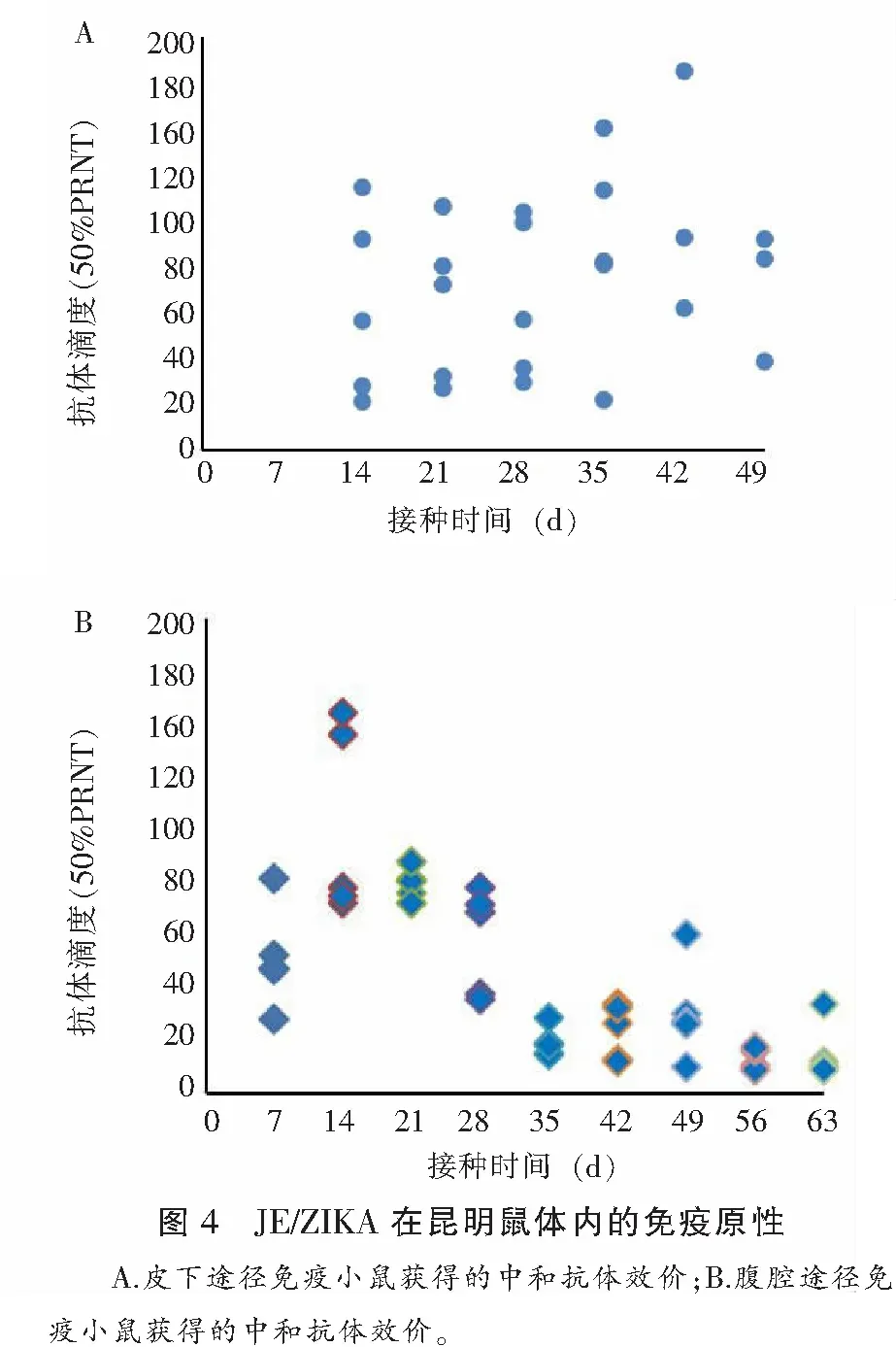
对皮下和腹腔接种嵌合病毒小鼠分别每周采血分离血清,皮下途径免疫的小鼠,中和抗体效价在免疫后第6周达到高峰,GMT达到109;腹腔免疫组,在免疫后两周达高峰,GMT为107,但以后迅速下降。所有样本PRNT50≥10,阳转率为100%。见图4及表3。
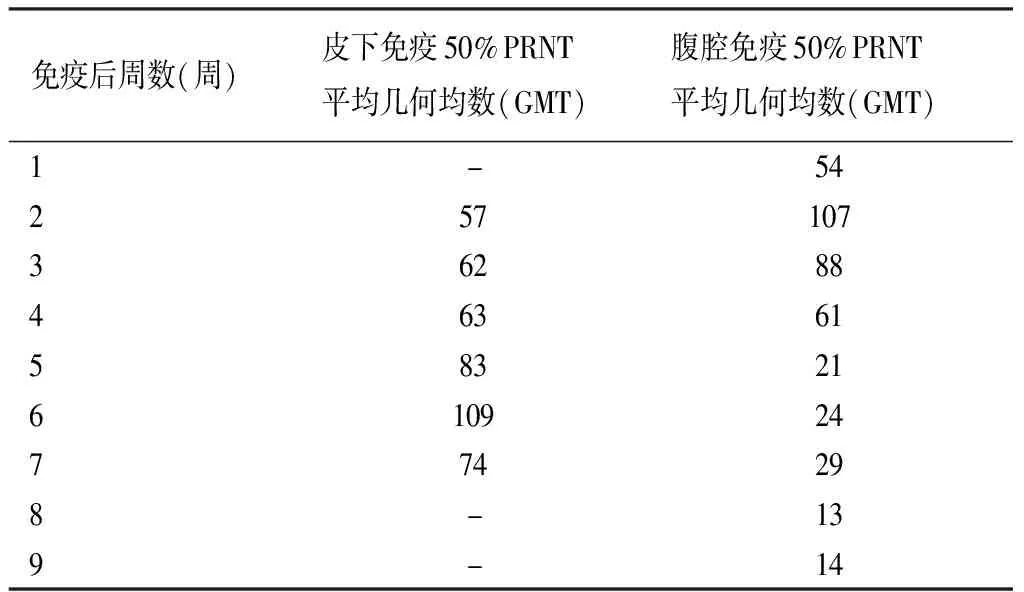
表3 嵌合病毒皮下、腹腔免疫后小鼠中和抗体产生情况
2.5 嵌合病毒JE/ZIKA免疫对自身的免疫保护
稀释度为10-6和10-5PFU量的嵌合病毒可以对小鼠产生90%的脑内攻击保护,随着病毒量的降低,保护效力也随之降低,说明病毒颗粒量与小鼠免疫保护效力的产生存在正相关关系。见图5。
2.6 嵌合病毒接种对小鼠乙脑病毒脑炎的交叉保护作用
滴度为3.45×106PFU/mL的嵌合病毒JE/ZIKA免疫,可对小鼠受致死量乙脑野毒株SA14的腹腔攻击产生40%保护率。见图6。

3 讨论
本课题组前期采用反向遗传学技术用相应ZIKV标准株MR766序列替换了乙脑疫苗株SA14-14-2的prM/E序列,构建并拯救获得稳定的嵌合病毒JE/ZIKA,进行初步毒力检测发现该重组嵌合病毒对昆明鼠有较强的脑内神经毒力[9],以此为基础,本研究对嵌合病毒JE/ZIKA的安全性和有效性进行了进一步评价。在BHK21细胞中进行生物学特性检测,发现相对于骨架乙脑疫苗株SA14-14-2,嵌合病毒JE/ZIKA表现出更小的噬斑,为类似母本株MR766的小噬斑[10],说明JE/ZIKA可能具有较弱的细胞浸润能力,其侵染细胞后形成的噬斑形态主要由结构蛋白的特征决定。对比骨架株SA14-14-2,嵌合病毒生长曲线相对更平缓,峰值出现较晚,提示其具有较慢的复制效率。Yang等[11]研究结果显示,嵌合病毒JE/DENV2在细胞中的复制效率明显低于两种母本株病毒,由于不同黄病毒的蛋白结构及信号序列特点不同,导致黄病毒的种间嵌合可能表现出比母本病毒更低的复制效率。随后本研究小组对嵌合病毒的神经侵袭力进行了评价,发现JE/ZIKA皮下注射(辅脑内空刺)或腹腔途径接种小鼠均无发病,说明该嵌合病毒皮下和腹腔神经侵袭力弱,猜测可能与其母本病毒MR766神经侵袭力较弱有关[12]。进一步对该嵌合病毒进行免疫原性评估,发现在使用JE/ZIKA免疫昆明鼠后第1周,小鼠血清中即检测出具有保护效力的中和抗体,抗体在单次免疫7周后保护效果依然可观,由于课题组无ZIKV野毒株MR766及ZIKV其它野毒株,该中和抗体效力仅针对嵌合病毒本身,但依然可认为JE/ZIKA具有良好的免疫原性。该结果在昆明鼠体内实验中得到进一步证实,中高浓度的病毒量能够保护90%的小鼠免受病毒的致死性攻击,而随着免疫原病毒量降低,其对小鼠的保护效力也随之下降,说明病毒颗粒量与小鼠抗体产生存在一定范围内的剂量依赖性。
有研究[11,13-14]以SA14-14-2为骨架嵌合DENV不同血清型拯救的嵌合病毒在动物模型中均表现出良好的免疫原性,而且同时具有良好的抗 JEV和抗DENV感染免疫保护效果。为了检测嵌合病毒JE/ZIKA是否具有该特性,使用JE/ZIKA免疫小鼠后,用乙脑野毒株SA14进行腹腔攻击,结果显示嵌合病毒JE/ZIKA可对SA14产生40%的保护效力。Li等[15]报道JEV NS1蛋白在抗病毒免疫中有重要作用,因此推测可能是由于JE/ZIKA骨架区SA14-14-2的非结构蛋白NS1诱发了免疫保护力。ZIKV与JEV同属黄病毒属,E蛋白是关键的保护性抗原[16],不同黄病毒间E蛋白结构相似,其中ZIKV的结构与DENV存在高度同源性,DENV2序列与ZIKV一致性高达54%[17],有学者[18]报道,ZIKV与其他黄病毒间存在较大的交叉反应,因此也不排除交叉反应的可能性。
Li等[19]使用ZIKV亚洲分离株FSS13025的prM/E替换SA14-14-2中的相应区域,成功获得嵌合型chinZIKV,该嵌合病毒与本研究所获嵌合病毒JE/ZIKV相比较,于埃及伊蚊体内未检测到传染性,在Balb/c小鼠体内神经毒力弱,同时免疫原性强,可以产生垂直保护。本实验选用的非洲标准株MR766神经毒力强[20],这可能是导致嵌合病毒JE/ZIKA对小鼠脑内毒力强的主要原因之一,但对小鼠基本无神经侵袭力,具有良好的免疫原性。此外,ZIKA动物模型及免疫策略的选择会对嵌合病毒的免疫原性和保护效力评价产生一定影响。本实验选用动物为清洁级昆明鼠,是神经系统损伤性疾病的重要造模动物,对神经细胞损伤易感,在脑内接种病毒后较Balb/c小鼠神经系统症状明显且发病率高,更适合用于ZIKV引起的中枢神经系统损伤机制研究,但昆明鼠并非ZIKV感染的敏感动物模型[21]。
综上所述,嵌合病毒JE/ZIKA具有良好的免疫原性,可作为潜在的疫苗候选株,但神经毒力较强,在后续实验中我们还将进一步尝试对该嵌合病毒进行位点改造以期降低其神经毒力,同时探索JE/ZIKA在ZIKV敏感动物模型中的免疫原性和安全性。
