非酒精性脂肪肝差异基因的生物信息学分析#
2022-09-08刘洁陈树嘉李嘉
刘洁 * 陈树嘉 李嘉Δ
(1.天津医科大学研究生院,天津 300203;2.天津市第二人民医院肝病科,天津 300192)
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)已成为第一大慢性疾病及肝功异常的首要原因[1]。非酒精性单纯性脂肪肝(Non-alcoholic fatty liver,NAFL)及非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis, NASH)是NAFLD的不同进展阶段,NASH是发生纤维化和肝硬化重要的中间阶段,是导致NAFLD进展的关键步骤,与肝硬化、肝癌发生密切相关[2];尽早诊断NASH并进行干预,可有效改善NAFLD患者的预后[3]。目前认为NAFLD的发生是遗传、环境共同作用的结果,NAFLD的发病机制尚不完全清楚[4],目前认为NAFL进展为NASH的机制为多种因素共同导致[5],其临床表现隐匿,早期诊断受多种因素干扰,因此检测NAFL及NASH的差异基因,寻找分子诊断标记物具有重要意义。本研究基于美国国家生物技术信息中心的基因表达数据库(Gene expression omnibus database,GEO)中的NAFLD基因芯片GSE33814进行生物信息学分析,以期获取NAFLD相关的关键基因,为后续寻找分子标记物提供理论基础。
1 材料与方法
1.1 材料
从 GEO(http://www.ncbi.nlm.nih.gov/geo/)中检索NAFLD相关的数据集,组织来源为“人肝脏组织”。最终选定基因表达谱芯片GSE33814数据集(GPL6884)。该数据集包含44例样本,正常对照组13例,NAFL组19例,NASH组12例。
1.2 方法
1.2.1 DEGs筛选
采用 GEO2R 在线分析程序(http://www.ncbi.nlm.nih.gov/geo/geo2r/)从 GSE33814数据集中分别筛选出 NAFL组与健康对照组(Healthy controls,HC)及NASH组与HC组的DEGs。差异基因筛选标准:校正后P值(adjustP-value)<0.05,|logFC|> 0.5。
1.2.2 GO功能富集和KEGG通路富集分析
通过R语言(3.6.3版本,使用ggplots包)对差异表达基因在GO中注释其参与的生物学过程,包括生物过程(Biological process,BP)、细胞组成(Cellular component,CC)及分子功能(Molecular function,MF),并进行KEGG通路富集分析同时绘制气泡图。
1.2.3 蛋白互作网络(Protein-Protein Interaction,PPI)构建及关键基因筛选
使用STRING 11.5数据库 (http://cn.stringdb.org)对DEGs对应蛋白质进行相互作用关系分析,阈值条件设置为综合评分大于 0.4,采用Cytohubba插件的最大集团中心性(Matthews correlation coefficient,MCC)算法,依照基因在PPI网络的重要性筛选评分前10位作为关键基因。
1.2.4 靶基因-miRNA网络和靶基因-转录因子(Transcription factors,TF)网络的构建
miRNA及TF在特定的疾病状态时,在转录后阶段通过与靶基因相互作用控制基因的表达。我们应用 NetworkAnaly在线数据库(https://www.networkanalyst.ca/NetworkAnalyst/home.xhtml)、miRTarBase工具及ENCODE工具整合靶基因-miRNA网络和靶基因-TF网络。
2 结果
2.1 DEGs筛选
由GSE33814数据集得到NAFL患者相对于HC的DEGs共219个,其中上调基因147个,下调基因72个,火山图见图1A。NASH相对于HC的DEGs共1992个,包括988个上调基因和1004个下调基因,火山图见图1B。将两组DEGs分别取交集,得到DEGs共193个,上调基因133个,下调基因60个,制作韦恩图如图2所示。

图1 GSE33814数据集中差异基因的表达

图2 GSE33814数据集中上调基因及下调基因韦恩图
2.2 DEGs GO功能富集和KEGG通路富集分析结果
利用R语言对DEGs相关的MF、BP、CC进行分析,结果显示:DEGs主要参与中性粒细胞活化与免疫反应、脂肪酸的代谢分解、小分子物质代谢、氨基酸分解代谢等生物过程;DEGs主要存在于线粒体基质、细胞基质结等;在MF方面,DEGs主要与辅酶结合、氧化还原酶活性及NADP结合等。KEGG通路富集结果显示,DEGs主要参与柠檬酸循环(TCA循环)、丙酸盐循环、色氨酸代谢及cGMP-PKG等信号通路。GO和KEGG富集分析显著性排名前10的条目见图3。

图3 差异基因的功能和通路富集分析
2.3 PPI网络的构建及核心基因的筛选
将 193个 DEGs带入 STRING数据库进行PPI网络分析,阈值条件设置为综合评分大于0.4,剔除 PPI 网络中具有不同表达倾向和孤立节点的 DEGs后,共包含147个节点和277条边,平均节点度为3.77(图4A)。将PPI结果进一步导入Cytoscape软件,并利用CytoHubba插件在PPI网络中筛选出一个重要的功能模块,择取排列前10的关键基因,分别是:ACO2、MAPK1、DLD、MAP2K1、SND1、FGA、LMNA、MAP2K2、ALDH18A1、PMPCB。这些基因即为PPI网络中的关键基因(图4B)。

图4 DEGs网络中的PPI网络图及功能模块中的关键基因
2.4 靶基因-miRNA网络和靶基因-TF网络的构建
miRNA的前三个靶向 DEGs是由 183个miRNA调控的MAKP1,由52个miRNA调控的MAP2K2和由30个miRNA调控的SND1。控制最大数量的DEGs(3个基因)的miRNA是hasmir-16-5p(图5A)。TF的前三个目标 DEG 是LMNA,由75个TF调控,ACO2由36个TF调制,DLD由29个调控(图5B)。
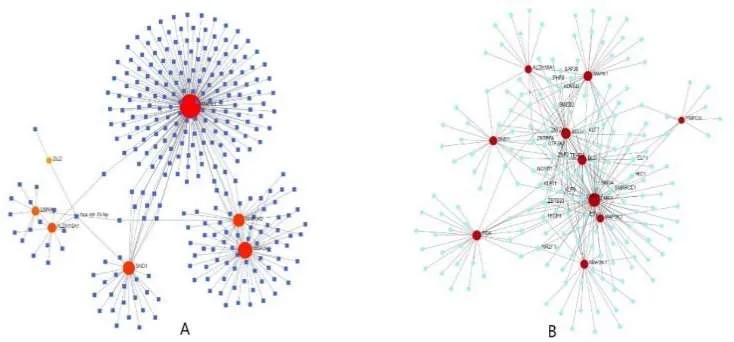
图5 靶基因-miRNA网络和靶基因-TF网络
3 讨论
非酒精性脂肪肝与肥胖、2型糖尿病、心脑血管疾病等密切相关,其发生发展严重威胁着人们的生命健康,据报道,约9%~20%的NASH患者于发病 15年内进展为肝硬化甚至肝癌[6]。因此,获取NAFLD相关的关键基因,可以为后续分子标记物寻找提供理论基础。
本研究结果显示,从 GEO数据库中的GSE33814数据集筛选到与 NAFLD疾病进展有关的193个DEGs,对其GO富集分析显示其功能主要富集于中性粒细胞活化及免疫反应等生物过程。炎症反应在整个NAFLD的发生发展过程中产生着重要的影响,大部分肝脏细胞均参与免疫及炎症反应,炎症反应常继发于肝脏对外源性和内源性损伤的免疫反应,即NASH发生、发展的“二次打击”学说[7]。激活的中性粒细胞释放炎性细胞因子可导致肝细胞的氧化损伤;而且中性粒细胞相对于淋巴细胞的比例增加可以进一步加重NASH[8]。肝脏还富含各种免疫细胞,包括固有免疫细胞和适应性免疫细胞,在肝损伤时迅速聚集到肝脏。固有免疫细胞在NASH的发病机制中发挥重要作用。在急性或慢性肝病时,Kupffer细胞被病原体相关分子模式和损伤相关分子模式激活,释放促炎细胞因子,从而导致免疫状态的紊乱。免疫细胞比例失衡可进一步促进NASH的发生[9]。此结果与既往文献结论一致。通路富集结果表明 DEGs主要集中在柠檬酸循环(TCA循环)、丙酸盐循环、色氨酸代谢及cGMP-PKG等信号通路等信号通路。TCA循环是脂肪氧化的场所,也是糖异生的代谢前体,该循环功能的诱导与肝脏氧化应激和炎症的发生密切相关。cGMP/PKG信号通路是细胞内重要的信号转导通路之一,以往报道多关注 cGMP-PKG信号转导通路在缺血再灌注损伤中发挥着重要的作用,近来有研究发现,PKG-1基因的过表达可以通过抑制脂肪合成相关基因的表达,减少肝脏的脂肪积累,抑制炎症反应,并降低肝细胞纤维化程度,这预示着cGMP/PKG信号通路可调节NAFLD的发生发展。此外,本研究富集多条氨基酸代谢通路,提示氨基酸的代谢在脂肪肝发生发展中起重要作用。最近,朱健等在Molecular Cell上发表文章提示必需氨基酸摄入不足是造成营养不良人群患上脂肪肝病的“罪魁祸首”[10]。当必需氨基酸匮乏时,肝细胞中的E3泛素连接酶Ubr1失活,不能催化脂滴保护蛋白Plin2的多聚泛素化降解。Plin2蛋白水平的升高则会抑制肝脏脂肪的分解,从而造成脂肪肝病。上述研究为氨基酸代谢在脂肪肝发生发展方向开辟了新的思路。
在PPI网络中进一步筛选出更有研究价值的关键基因,分别为ACO2、MAPK1、DLD、MAP2K1、SND1、FGA、LMNA、MAP2K2、ALDH18A1和PMPCB。ACO是脂肪酸分解代谢中的关键酶,存在于线粒体中,催化脂酰 CoA生成乙酰CoA并进入三羧酸循环继续被氧化,对脂肪的β氧化非常重要[11]。MAPK是真核细胞内广泛存在的一类丝氨酸/苏氨酸蛋白激酶,能够被包括 ROS在内的多种因素激活,参与细胞增殖、凋亡、炎症反应等多种生理、病理活动;其磷酸化水平的降低可预测脂肪肝的发生[12]。MAP2K1/2基因编码MEK1/2蛋白激酶,属于双重特异性蛋白集美家族成员,参与细胞增殖、分化、基因转录调控和发育过程,其表达的蛋白水平及磷酸化水平在TRIB1的调控下影响肝脏脂肪生成和糖生成[13]。DLD属于嘧啶核苷酸-二硫氧化还原酶家族,参与丙酮酸的氧化脱酸反应,参与机体能量代谢,既往报道DLD修饰后可促进胃癌的发生发展,但尚无脂肪肝相关报道,故此基因可为脂肪肝的疾病进展研究提供新的靶点[14]。SND1可以在转录水平激活脂肪形成相关基因的表达,并且调控脂肪细胞的分化[15];FGA的表达可作为妊娠期糖尿病的的早期诊断因子[16],但目前尚未发现在脂肪肝患者中的特异性表达。ALDHs 家族成员ALDH18A1参与了多种肿瘤表观遗传学调控的中间产物的生成,对脂肪肝发生发展的调控机制仍需进一步研究[17]。LMN基因突变可导致脂肪细胞的更新障碍,其对于靶向器官的印象仍需进一步研究。PMPCB参与脂肪肝的发生发展,有报道称其与肝细胞癌患者对索拉菲尼产生耐药的主要基因[18],故对于合并脂肪肝的肝细胞癌患者或脂肪肝所致肝细胞癌患者需警惕。
总体而言,本研究利用生物信息方法预测NAFLD发生发展过程中的重要靶点基因,以上靶点基因在脂肪炎症、免疫、疾病进展等起着至关重要的作用,但仍需分子生物学实验验证,为NAFLD的早期筛查、诊断及治疗等提供新的研究方向及可靠依据。
