不同运动方式对2型糖尿病大鼠骨骼肌Rab5蛋白及糖代谢的影响*
2022-09-08关东如朱嫚子柏友萍
关东如,方 明,朱嫚子,王 克,崔 勇,柏友萍△
(1.安徽师范大学体育学院,芜湖 241000;2.青岛体育事业发展中心,山东 青岛 266071;3.皖南医学院,安徽 芜湖 241003)
Ras相关蛋白5(Ras-related proteins 5,Rab5)因其在机体代谢的重要作用受到广泛关注,Rab5蛋白是Rab蛋白家族的成员之一,是早期胞吞途径中一个重要的限速成分,在骨骼肌、肝脏和心脏等多组织均有表达。相关研究表明,Rab5参与调节细胞膜上葡萄糖转运蛋白4(glucose transporte 4,GLUT4)的转运,GLUT4是骨骼肌葡萄糖发生转运的主要蛋白,仅位于肌肉和脂肪的胰岛素敏感组织中。Rab5表达减少可能造成外周GLUT4的转录和翻译能力降低,引起组织糖代谢稳态失衡,进而引起血糖升高[1]。
规律性运动可增加胰岛素敏感性、提高骨骼肌质量并增强其糖脂代谢能力,改善2型糖尿病(type 2 diabetes mellitus,T2DM)患者体成分及骨骼肌病理损伤[2]。骨骼肌作为运动的主要功能器官,占人体总比重40%左右,摄取和代谢机体约80%的葡萄糖,因此,深入研究骨骼肌对于揭示T2DM状态下骨骼肌代谢紊乱尤为重要[3]。目前,有关运动是否可以通过影响骨骼肌Rab5转录与翻译,进而影响骨骼肌GLUT4转运能力及调控血浆Rab5含量,发挥对T2DM保护作用的问题目前尚不清楚。本实验室在前期的研究中,以运动为平台,通过建立相关实验模型,在运动对肥胖、机体IR、糖脂代谢等方面的影响进行多方面研究,为本研究奠定良好的基础[4,5]。因此,本研究设计持续运动、间歇负重运动两种不同的运动方案进行动物实验,探讨其不同运动方式对2型糖尿病大鼠骨骼肌Rab5及糖代谢的影响,旨在为优选T2DM运动疗法提供理论依据。
1 材料与方法
1.1 主要试剂
STZ购自美国Sigma公司;RAB5A Antibody购自美国Proteintech公司;山羊抗兔IgG HL购自美国Abcam公司;Trizol购自美国Invitrogen公司;GLUT4 Polyclonal Antibody购自中国Abclonal公司;BCA蛋白浓度测定试剂盒购自中国碧云天公司;GHb ELISA试剂盒购自美国研域公司;RT逆转录试剂盒购自德国Fermentas公司;Rab5 ELISA试剂盒购自美国研域公司;TEMED购自中国碧云天公司。
1.2 T2DM建模与分组
购自上海西普尔-必凯实验动物有限责任公司(许可证:SCXK(沪)2018-0006)的雄性7周龄SPF级SD幼鼠。分笼饲养,自由饮食饮水。进行3 d的适应喂养,随机选取8只为空白对照组(CR),普食喂养;其余为实验组,高脂高糖喂养,喂养6周后,实验组禁食不禁水12 h,腹腔注射STZ,72 h后采用罗氏血糖仪(YZB-GER/5513-2014,德国)测随机血糖,随机血糖≥16.7 mmol/L为糖尿病建模成功。选取T2DM大鼠24只,按组间血糖无差异原则(P>0.05)分为3组,每组8只,组别(简写):糖尿病模型组(DRM)、持续运动组(DCRE)、间歇负重运动组(DWRE)。所有实验动物的操作均符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》要求,获得安徽师范大学动物保护和伦理委员会批准(2020023)。
1.3 运动方案
本次运动方案设计以本实验室前期运动方案为基础,针对T2DM大鼠的运动能力进行设计与实施。运动采用大鼠跑台训练(安徽正华,中国),进行适应性练习4 d,每天3~5次,跑台坡度为0°,负重跑步训练器由本实验室自主设计(专利号:ZL 2019 2 1996838.5)。持续运动方案:前1~2周采用准备活动15 m/min(10 min)、运动20 m/min(40 min)、整理活动15 m/min(10 min),后3~8周为18 m/min(10 min)、25 m/min(40 min)、15 m/min(10 min);间歇负重运动方案:采用1~2周负荷重量15%、3~4周为30%、5~8周为45%,运动均为15 m/min(5 min),共12组,组间休息3 min,负荷重量百分比=负重重量/大鼠体重×100%。
1.4 样本采集与处理
末次运动结束后,每组大鼠腹腔注射10%水合氯醛溶液(3.0 ml/kg)进行麻醉,取腹主动脉血,保存于-80℃的冰箱中待测Rab5和GHb浓度;采集大鼠腓肠肌组织分装在已灭菌的EP管中放-80℃保存,用于大鼠骨骼肌组织Rab5、GLUT4 mRNA和Rab5蛋白的测定。每组随机留取1只大鼠施以灌注固定,用于HE染色观察骨骼肌组织形态学变化,免疫荧光组化测定Rab5蛋白。
1.5 HE染色测骨骼肌组织形态和免疫荧光组化测骨骼肌Rab5蛋白表达
选取大鼠后腿腓肠肌组织用多聚甲醛固定、脱水、洗脱、包埋及切片(4μm)。HE染色选择骨骼肌的切片脱蜡、洗涤及酒精梯度脱水,苏木素-伊红滴染,二甲苯透明处理封片,光学显微镜(Olympus/BX43日本)拍片。免疫荧光组化测骨骼肌Rab5蛋白表达:选择骨骼肌切片,经过脱蜡和水化,PBS漂洗,枸橼酸缓冲液中经不同时间高火和低火进行抗原修复,自然冷却PBS漂洗。PBT打孔,加入荧光封闭液,敷Rab5抗体(一抗),4℃过夜,二抗孵育,PBS漂洗,滴入抗衰剂,封片,共聚焦显微镜(LAICA/SP8 M德国)及配套软件进行图像的拍摄。
1.6 实时荧光定量PCR测骨骼肌Rab5与GLUT4 mRNA表达
骨骼肌组织用液氮研磨后,分别用Trizol、氯仿、异丙醇等试剂提取组织总RNA,RNA定量后按照试剂说明书进行逆转录合成cDNA,进行PCR扩增,Rab5与GLUT4引物序列见表1,以荧光定量PCR仪(西安天隆/TL988 中国)检测,β-actin为内参引物,△Ct=Ct(目的基因)-Ct(β-actin),以2-△Ct进行分析(计算相对量,结果扩大1 000倍)。
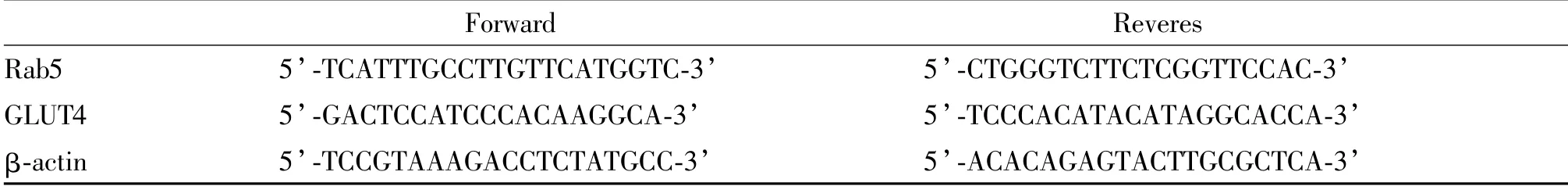
Tab.1 Primer sequences for real-time PCR
1.7 Western blot测骨骼肌Rab5蛋白表达
组织用液氮研磨后,用RIPA裂解液(RIPA∶PMSF=99∶1)冰上裂解30 min,蛋白样品定量变形后,SDS-PAGE凝胶电泳分离样品,而后蛋白转移至PVDF膜上,5%脱脂奶粉封闭1 h。滴加Rab5抗体,在4℃条件下孵育过夜,TBST清洗,每次10 min,清洗3次,敷二抗,室温孵育1 h,ECL极超敏发光液,A∶B=1∶1,将配制的发光液滴在PVDF膜上,用凝胶成像系统成像并拍照,采用Image J灰度分析软件进行图像定量分析,将目的蛋白条带的灰度值与内参蛋白(β-actin)条带灰度值的比值作为蛋白表达量。
1.8 ELISA测血浆Rab5与GHb浓度
严格按照ELISA试剂盒说明书进行操作,结束后立即放入酶标仪中,在450 nm波长处测定各孔OD值,Rab5的线性回归方程为y=0.018+0.034x(ng/ml),相关系数R=0.999;GHb回归方程为y=0.008+0.001x(ng/ml),相关系数R=0.998,将方程输入SPSS 21.0软件中,得到相应的浓度值,再将浓度值扩大5倍得到样本实际浓度值。
1.9 统计学处理
2 结果
2.1 两种运动方式对T2DM大鼠骨骼肌病理形态的影响
CR骨骼肌细胞形态正常,肌外膜完好,肌纤维排列规则,细胞间间隙清晰,组织结构完整;与CR相比,DRM骨骼肌组织结构发生轻微改变,出现骨骼肌肌纤维面积缩小,细胞间隙增大,结缔组织增多,个别细胞存在肿大,表现出病理性损伤;与DRM相比,DCRE和DWRE的骨骼肌肌纤维面积有所增加,细胞间隙变小,结缔组织有所减少,骨骼肌组织形态明显改善(图1)。
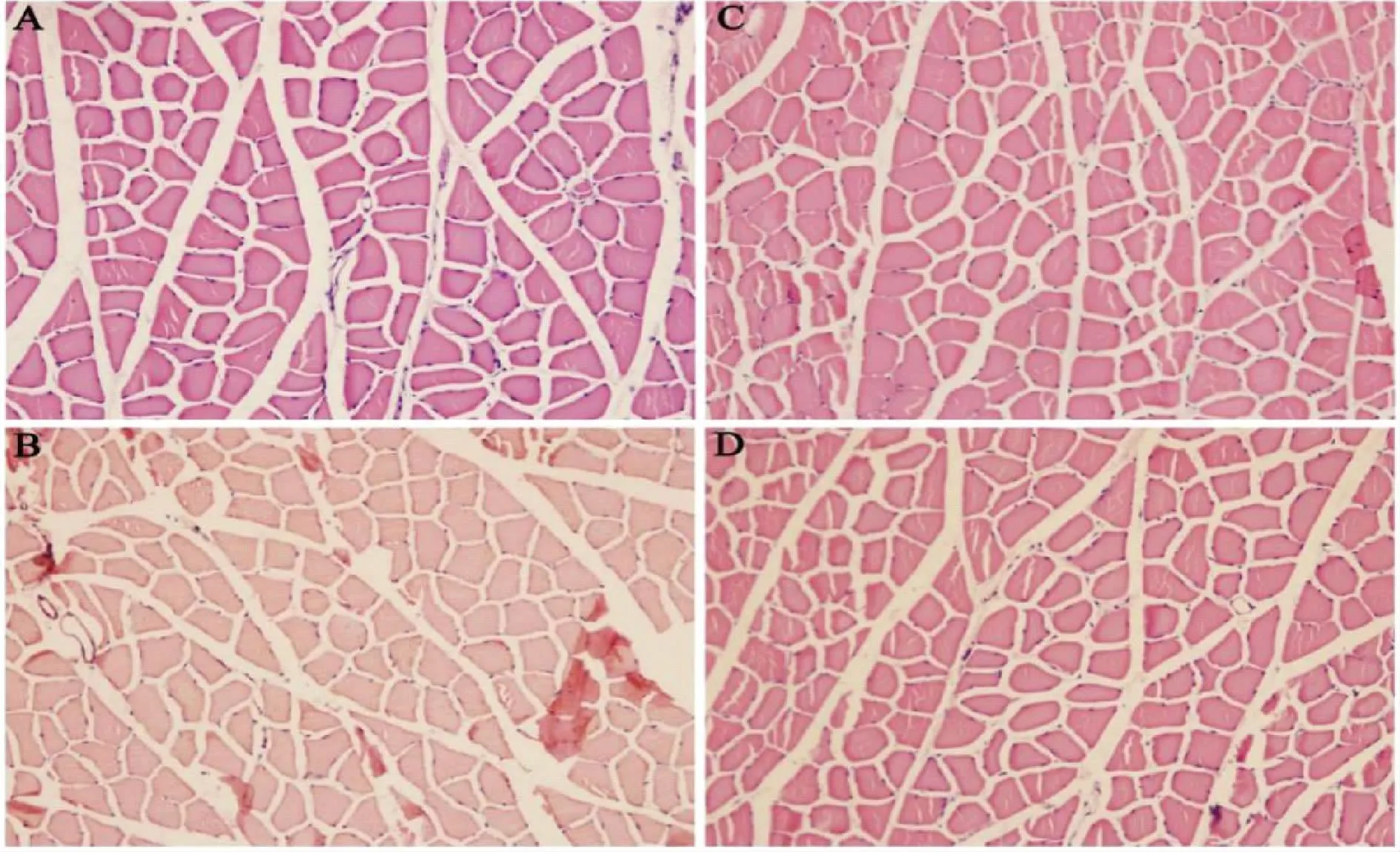
Fig.1 Comparison of HE staining in skeletal muscle among groups(×200)
2.2 两种运动方式对T2DM大鼠骨骼肌Rab5免疫荧光蛋白表达的影响
各组别Rab5荧光蛋白表达均位于肌细胞膜上;与CR相比,DRM荧光表达量显著较低,亮度强度减弱,蛋白表达减少;与DRM相比,DCRE、DWRE荧光表达量增多,亮度有所增强,蛋白表达量有所提高(图2)。

Fig.2 Comparison of Rab5 fluorescence expression in skeletal muscle among groups(×200)
2.3 两种运动方式对T2DM大鼠骨骼肌Rab5 mRNA和蛋白表达及血浆Rab5浓度的影响
骨骼肌Rab5 mRNA表达:与CR相比,DRM显著降低(P<0.01);与DRM相比,DCRE显著增高(P<0.01),DWRE显著增高(P<0.05);DCRE高于DWRE,但无统计学差异(P>0.05,表2)。
骨骼肌Rab5蛋白表达:与CR相比,DRM Rab5蛋白表达显著降低(P<0.01);与DRM相比,DCRE、DWRE Rab5蛋白表达均显著升高(P<0.05),DCRE和DWRE之间无统计学差异(P>0.05,表2,图3)。
血浆Rab5浓度:与CR相比,DRM显著升高(P<0.01);与DRM相比,DCRE和DWRE血浆Rab5浓度均显著降低(P<0.01);DWRE血浆Rab5浓度低于DCRE,但无统计学差异(P>0.05,表2)。
Tab.2 Comparison of the Rab5 mRNA and protein expressions in skeletal muscle,and plasma Rab5 concentration among groups(±s)

Tab.2 Comparison of the Rab5 mRNA and protein expressions in skeletal muscle,and plasma Rab5 concentration among groups(±s)
*P<0.05,**P<0.01 vs CR;#P<0.05,##P<0.01 vs DRM
Group Rab5 2-Δct(n=6)Rab5(n=5)Rab5(ng/ml)(n=6)CR 173.78±45.70 1 13.109±0.97 DRM 110.88±28.84**0.86±0.05**17.584±2.13**DCRE 191.80±45.27##0.97±0.08#13.908±1.35##DWRE 161.68±27.49#0.97±0.07#13.161±1.53##
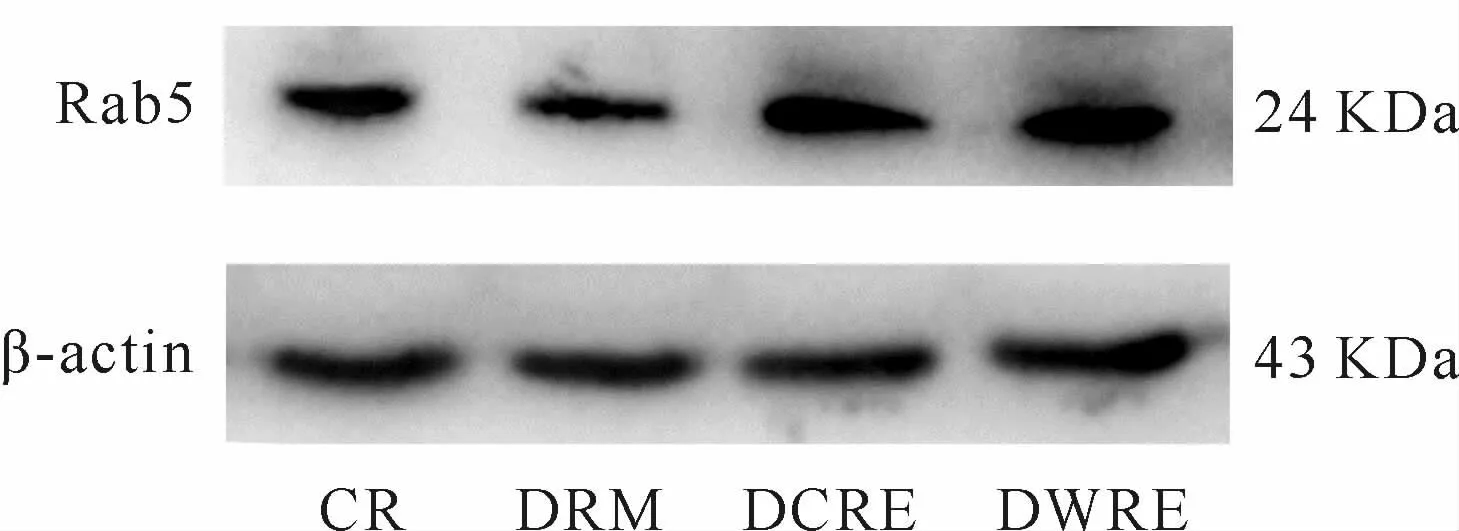
Fig.3 Comparison of Rab5 protein expression in skeletal muscle among groups(n=5)
2.4 两种运动方式对T2DM大鼠骨骼肌GLUT4 mRNA表达和血浆GHb浓度的影响
骨骼肌GLUT4 mRNA表达:与CR相比,DRM GLUT4mRNA表达显著降低(P<0.01);与DRM相比,DCRE和DWRE GLUT4 mRNA表达均显著升高(P<0.05,P<0.01),DCRE和DWRE之间无统计学差异(P>0.05,表3)。
血浆GHb浓度:与CR相比,DRM血浆GHb浓度显著升高(P<0.01);与DRM相比,DCRE和DWRE血浆GHb浓度均显著降低(P<0.05,P<0.01);DWRE血浆GHb浓度低于DCRE,但无统计学差异(P>0.05,表3)
Tab.3 Comparison of GLUT4 mRNA expressions in skeletal muscle among groups(±s,n=6)

Tab.3 Comparison of GLUT4 mRNA expressions in skeletal muscle among groups(±s,n=6)
*P<0.05,**P<0.01 vs CR;#P<0.05,##P<0.01 vs DRM
Group GLUT4 2-Δct GHb(ng/ml) CR 247.54±78.31 729.29±136.06 DRM 103.47±24.70** 1025.00±60.90**DCRE 210.81±75.69# 922.86±34.62#DWRE 225.27±82.65## 896.43±73.64##
3 讨论
骨骼肌作为糖消耗的主要组织,也是T2DM高糖状态下损害的重要靶位,深入研究其疾病状态下病理形态对于阐明糖尿病发生发展有着重要病理意义[6]。本实验的骨骼肌HE染色表明:T2DM大鼠骨骼肌组织结构发生轻微改变,出现骨骼肌肌纤维面积缩小,细胞间隙增大,结缔组织增多,个别细胞存在肿大,表现出病理性损伤。8周的持续运动和间歇负重运动均可改善T2DM大鼠骨骼肌病理损伤,两种运动方式之间无明显的优劣。
T2DM骨骼肌转录水平和代谢组学均发现通过转录水平和转录后翻译水平改变骨骼肌的蛋白合成而影响骨骼肌重塑、减少糖摄取,最终影响糖脂代谢和运动能力[7]。在骨骼肌中,有众多相关蛋白影响骨骼肌对糖、脂吸收和利用,影响机体代谢进程。其中有关Ras酶超家族成员之一的Rab5蛋白对机体代谢影响的研究备受关注。它类属GTP酶,被认为是最早参与蛋白分选和维持胞内系统稳态的成员,在骨骼肌、肝脏等代谢组织中均有表达,调控机体代谢稳态过程[8]。代谢组学及相关机制研究表明:Rab5含量下降或功能发挥异常,会影响信号的正常传递,导致葡萄糖利用率降低进而出现胰岛素抵抗(insulin resistance,IR);敲除骨骼肌中Rab5基因,骨骼肌感应胰岛素能力减弱,出现IR和葡萄糖不耐受等代谢失衡症状[9];Rab5在骨骼肌再生修复中参与调控胰岛素样生长因子(insulin-like growth factor,IGF)信号传导,协调骨骼肌内胰岛素敏感性和代谢活动[10,11]。因此,根据已查阅相关文献可以证明,Rab5是骨骼肌和葡萄糖代谢的重要蛋白。
有关在T2DM骨骼肌中Rab5含量变化的研究鲜有报道,因此,在本研究免疫荧光技术观察Rab5在骨骼肌肌细胞中定位的结果表明,活化的Rab5存在于肌细胞胞膜中,且在T2DM大鼠中,骨骼肌Rab5蛋白明显降低,这提示高糖状态下Rab5的含量已经发生改变。在此基础上,本研究又通过qRTPCR及Western blot技术进行进一步实验,其结果表明三者在一定程度上具有相似性。Rab5在T2DM大鼠骨骼肌中的蛋白表达下降,可能参与调节骨骼肌糖代谢。据报道Rab5与GLUT4关系密切,Rab5参与调控GLUT4从细胞内转移到细胞外膜并与之相互融合的过程[12]。因此,本研究推测在T2DM中,骨骼肌Rab5含量降低可能影响GLUT4表达出现异常。基于这一假设,本研究通过检测大鼠骨骼肌GLUT4 mRNA表达发现:在T2DM骨骼肌中,GLUT4基因表达显著降低。因此,该结果提示,在高糖状态下骨骼肌Rab5含量降低可能是导致GLUT4表达量减少的重要原因,进而引起葡萄糖转运能力出现障碍,糖代谢出现紊乱。
相关研究显示,运动可以通过调控骨骼肌GLUT4水平,改变骨骼肌代谢能力,在该环节中,运动通过提高或抑制诸多骨骼肌中与糖代谢有关的蛋白含量成为GLUT4转运能力增强的关键因素。例如,Blüher等[13]研究发现,运动可能通过磷酸腺苷活化蛋白激酶(adenosine 5′-monophosphate(AMP)-activated protein kinase,AMPK)相关途径提高GLUT4的表达,增强骨骼肌组织葡萄糖的摄取和利用及脂肪酸的氧化,改善IR。Sylow等[14]研究发现,GLUT4转运水平的提高,可能是通过运动刺激小鼠Rac1水平升高从而增强骨骼肌对葡萄糖的摄取。张新霞[15]采用运动疗法后发现,T2DM大鼠骨骼肌GLUT4 mRNA和蛋白表达水平升高,这可能是通过抑制FOXO1实现对T2DM大鼠体内炎症反应的缓解。在本实验中,通过8周持续运动和间歇负重运动均提高T2DM大鼠骨骼肌Rab5基因及蛋白表达,同时也可提高骨骼肌GLUT4 mRNA表达。该结果表明,Rab5可能是不同运动方式提高骨骼肌GLUT4含量的关键蛋白。
为了进一步验证运动提高Rab5蛋白表达并增强GLUT4转运能力对机体血糖水平的影响。本研究选取糖化血红蛋白(glycosylated hemoglobin A1c,GHb)作为机体血糖水平指标,GHb短期变异性较低,不受降糖药物、空腹、抽血时间等影响,可反映2~3个月的血浆葡萄糖平均水平,被视为临床评估血糖控制的“金标准”,对及时了解糖尿病患者血脂及血糖水平有着重要价值[16,17]。本实验中,T2DM大鼠血浆GHb浓度明显增加,而在8周持续运动和间歇负重运动中均明显减少血浆GHb浓度,说明持续运动与间歇负重运动均能降低机体的高血糖水平,但两种运动方式对降糖的作用尚未见明显的差异性。
本实验T2DM大鼠血浆中Rab5浓度明显升高,血浆Rab5浓度与骨骼肌Rab5的基因与蛋白表达呈现不一致性,有关血浆Rab5浓度改变的文献相对较少,尤其在T2DM的机体中。其原因可能是在高血糖状态下,机体代谢紊乱导致血浆Rab5浓度增高,机体对应激状态的代偿性反应,具体原因有待于进一步研究。通过8周的持续运动与间歇负重运动均降低血浆Rab5浓度,两种运动方式之间对Rab5浓度的影响没有明显的差异。运动可使T2DM血浆Rab5浓度趋于正常,这可能与该干预方式缓解高糖状态下机体代谢紊乱有关,但还需要后期进行大量的实验加以证明。
综上所述,持续运动和间歇负重运动均能提高T2DM大鼠骨骼肌Rab5的转录和翻译水平,增强GLUT4转运能力,减轻高血糖引起的骨骼肌肌纤维损伤。本研究结果表明,运动可能通过提高骨骼肌Rab5的蛋白表达,在缓解T2DM大鼠骨骼肌糖代谢稳态失衡过程中发挥一定的作用,但两种运动方式对其影响未见明显差异。
