控根处理对胡桃楸播种苗根系构型和养分质量分数的影响1)
2022-09-08徐立清张勇李红丽剡丽梅何瑞雪段嘉靖巩瑞王庆成
徐立清 张勇 李红丽 剡丽梅 何瑞雪 段嘉靖 巩瑞 王庆成
(东北林业大学,哈尔滨,150040)
控根育苗是苗木生产中控制根系形态和生长、调控苗木地上、地下生物量分配的常用方法[1-2]。控根苗具有许多优点,包括提高水分利用效率[3-4]、改善果实品质[5]、增加根瘤生长[6]、增加叶片养分和光合等[7]。控制苗木根系的方法通常包括胚根短截、化学控根、物理控根[8]。胚根短截是先将种子催芽,待胚根达到一定长度时,切除部分胚根后播种的控根技术[9]。短截后的胚根在截断处分支,形成多条根系,代替了原有单一主根的生长,使主根变短[10-11],同时改变了地上地下生物量分配,提高了苗木整体质量和造林效果[12-14]。物理控根是通过在根系生长的方向加入具有固定形状的物体,通过改变根系的走向而达到控根效果[15]。物理控根可以促进侧根生长,增大根系生物量,减少移栽时根系的损伤[16],同时也提高了造林移栽成活率,减短了育苗周期[17]。化学控根是在育苗容器的内壁或者底部,涂抹铜或锌离子制剂,当根尖与制剂接触时,根尖生长受到抑制,从而引起众多的侧根向周围生长,进而达到根的顶端修剪,形成发达舒展的根团[18-19]。采用化学控根后根的体积减少,运输根生物量有所增加[1],且与1级侧根相比,2级侧根上须根的比例明显增加[20]。化学控根后的根系构型对幼苗的后期生长,养分吸收、生理响应,以及移栽后的成活率都有直接影响[15]。
控根影响根系形态及生物量,进而改变苗木质量[21],但对于控根引起的苗木内部养分补偿机制的变化则需要更多的研究加以证实。根系作为苗木重要的地下部分,在水分吸收、养分吸收、转化和储藏过程中其形态起重要作用[22]。苗木控根后,限制了其土壤养分的吸收能力,此时生理活动主要依赖于控根前体内储存的养分[23],且这些养分通过苗木内转移到达根系,从而促进苗木根系生长,形成紧凑、发达、纤维化程度高的根系,增加从土壤中获取养分的能力[24]。
胡桃楸(Juglansmandshurica)是东北地区用材林和经济林中栽植的重要树种。多年的重采轻育导致后备资源严重不足[25],大力营造和培育胡桃楸人工林是解决这一问题的重要措施。优良苗木的培育是成功营造人工林的基础[26],是确保苗木成功更新的关键[27]。胡桃楸为深根性树种,其播种苗也具有主根发达、侧根发育较弱的特点,导致起苗时根系易受损、须根不发达、栽植易窝根,从而造成苗木损失,影响造林成活率、保存率和幼树生长[28]。本研究以胡桃楸播种苗为对象,设置胚根短截、物理控根和化学控根处理,研究控根处理对胡桃楸播种苗根系构型及养分含量的影响,为胡桃楸优质壮苗的培育提供参考。
1 研究区概况
本试验在黑龙江省尚志市东北林业大学帽儿山实验林场苗圃(127°30′~127°34′E,45°21′~45°25′N)进行。该地区属寒温带大陆性季风气候,年平均气温2.8 ℃。1月平均气温-23 ℃,最低气温-44 ℃;7月平均气温23 ℃,最高气温34.8 ℃。年平均降水量723 mm,年均蒸发量1 094 mm。全年无霜期120~140 d。海拔300 m左右。
2 材料与方法
2.1 种子采集与催芽处理
胡桃楸种子于2018年9月采集自哈尔滨市方正县转山试验林场天然林,种子质量7 g/粒。10月下旬,将种子进行消毒处理,消毒时间大约30 min,所用试剂为0.5%的高锰酸钾。选择阴凉、排水良好的地方,进行混沙层积催芽。第2年春季播种前1周筛出种子,置阳光下晾晒,过干时喷水,待多数种子裂嘴进行播种。
2.2 苗圃地准备及播种
圃地深翻30 cm左右,播种前3 d喷洒1%的硫酸亚铁溶液5 kg/m2进行土壤消毒,消毒后作一个长度约30 m,宽度约110 cm,步道宽40 cm,高大于15 cm的苗床,搂平、镇压。用辛硫磷(3.748 g/m2)喷洒防治地下害虫[29]。播种方式为点播,间距10 cm×10 cm。在床面均匀打孔,孔深5 cm,种尖朝下,播后覆土3 cm,播种量为100粒/m2。
2.3 试验设计
共设置3种类型9个控根处理,即胚根短截(RC)、物理控根(PP)和化学控根(CP)。胚根短截:取部分裂口的种子于湿沙上先进行发芽,待胚根长至5~6 cm时,用75%酒精棉消毒后的剪刀分别截取胚根长度的1/2(RC1)和1/3(RC2),不截作为对照(CK1),播种。物理控根:作床前,在不同土壤深度(15 cm(PP1)、20 cm(PP2)、CK1为直接播种)铺1层厚度1.5 mm的油毡纸(奥邦斯;主要成分沥青)。油毡纸上预先打孔,密度150孔/m2,孔径2 mm,以便通气透水。覆土、做床,播种。化学控根:做床前,在土壤15 cm深度铺1层油毡纸,将无水CuSO4与乳胶漆(主要成分为合成树脂乳液)分别配置成CK2(0)、CP1(100 mg/L)、CP2(150 mg/L)、CP3(200 mg/L)的CuSO4控根剂,并用刷子按试验设计分别涂抹到对应小区的油毡纸上,待控根剂风干后覆土、做床、播种。每个处理设置3组重复,每次重复播种100粒种子。
2.4 取样与测定
2019年9月初,苗木生长结束之前,每处理每重复随机选取10株生长正常的苗木。先采用精度0.01 mm游标卡尺和精度1 mm卷尺测定苗高、地径,然后用水边冲边将苗木连根取出,保持根系完整。在根茎处剪断,分别装于自封袋中,冷藏带回实验室。将茎和叶在烘箱中70 ℃烘干至恒质量,用电子天平测定生物量(精确到0.001 g),并参照卫星[30]等方法计算出苗木质量指数。根系则先用蒸馏水洗净后用滤纸将其表面水分吸干,再用根系扫描仪进行扫描,扫描后的图像采用根系形态学和结构分析系统WinRHIZO(Pro 2004b)软件进行根长、根系直径、根表面积、根体积等指标分析。将扫描完成的根系按照直径d<2 cm、2 cm≤d<4 cm和d≥4 cm分装于信封中,烘干和称质量。测定完干质量后用粉碎机将苗木根、茎、叶按3组重复分别混合进行粉碎,过孔径为0.125 mm的筛用于测定C、N、P、K质量分数。苗木各部分C、N质量分数用元素分析仪测定,P质量分数用紫外-可见光分光光度计测定,K质量分数用火焰光度计测定。
2.5 数据分析
数据均采用SPSS 18.0进行分析。首先对数据进行正态检验和方差齐性检验,满足条件后再进行单因素方差分析和多重比较(α=0.05),最后用Excel作表。
3 结果与分析
3.1 控根对胡桃楸播种苗地上部分的影响
不同控根处理对苗高、地径和高径比无显著影响,对苗木质量指数影响显著(表1)。苗木质量指数中,胚根短截和物理控根各处理与对照(CK1)相比无显著差异,但RC2显著大于PP1。化学控根中,各处理与对照相比无显著差异,但随着控根剂质量浓度的增加,苗木质量指数逐渐降低。
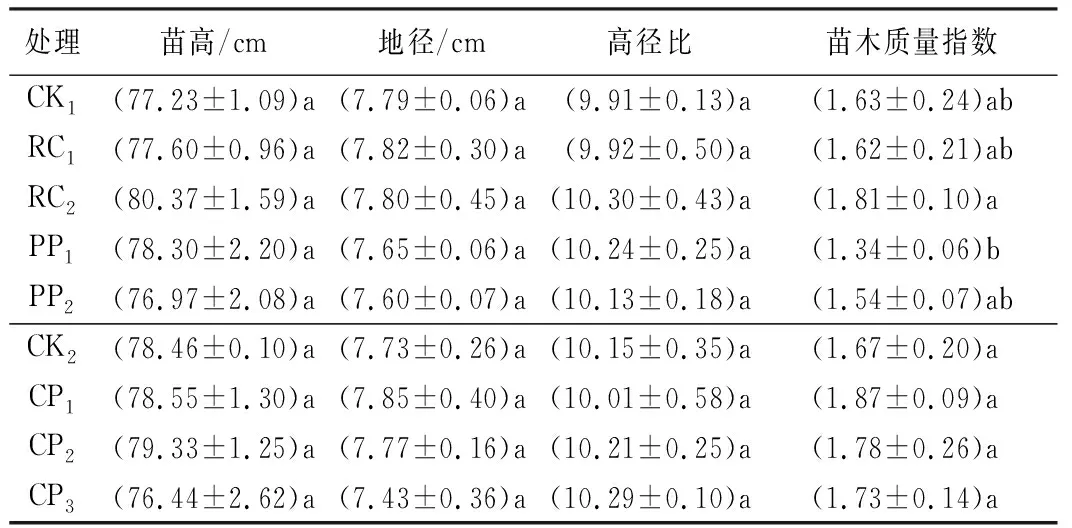
表1 不同控根处理时胡桃楸播种苗苗高、地径、高径比和苗木质量指数
3.2 控根对胡桃楸播种苗根系构型的影响
不同控根处理对胡桃楸播种苗的主根长、根系总长、平均直径、根系表面积、体积、1级侧根数和根尖数都有显著影响(P<0.05,表2)。胚根短截两个处理显著抑制了胡桃楸播种苗主根长度,其中RC2抑制效果最显著。RC2和CP1处理中,除CP1处理下根系1级侧根数与对照无显著差异外,两处理根系总长、根系表面积、根系体积、1级侧根数和根尖数均大于对照(P<0.05);且CP2处理下的根系表面积和根系体积也大于对照(P<0.05)。胚根短截和物理控根中,随短截长度的降低和控根深度的增加,各指标有上升趋势,而在化学控根中,随控根剂质量浓度的增加,各指标逐渐降低(表2)。
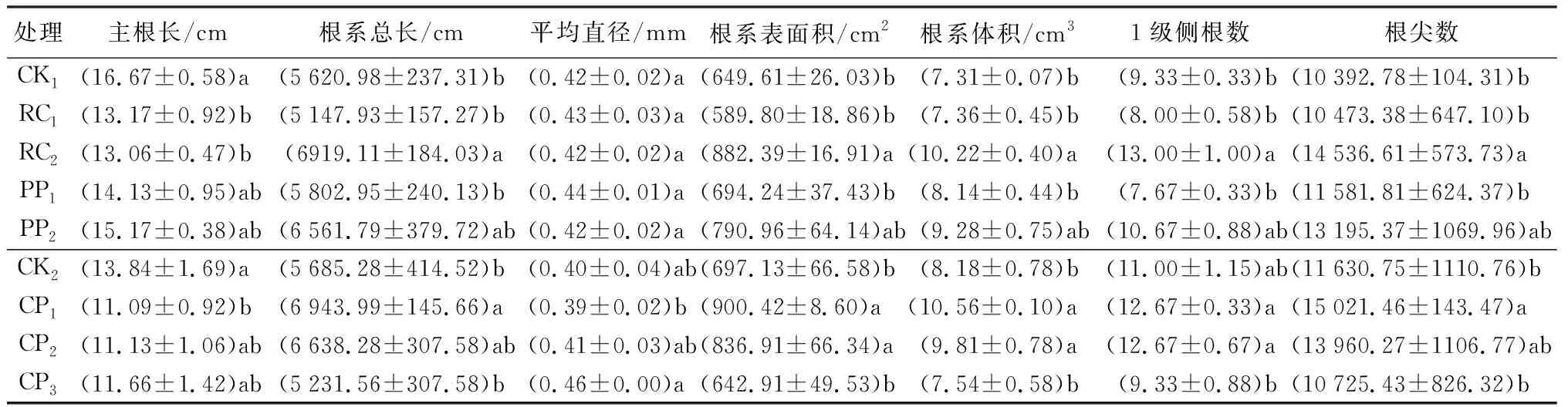
表2 不同控根处理时胡桃楸播种苗根系特征
3.3 控根对胡桃楸播种苗生物量的影响
不同处理下,除根系生物量和茎根比之外,其余各器官生物量无显著差异,但都为RC2和CP1最大(表3)。RC2处理的根系生物量显著大于PP1处理(P<0.05)。CP1处理下的茎根比显著大于对照(CK2)和CP2处理(P<0.05,表3)。
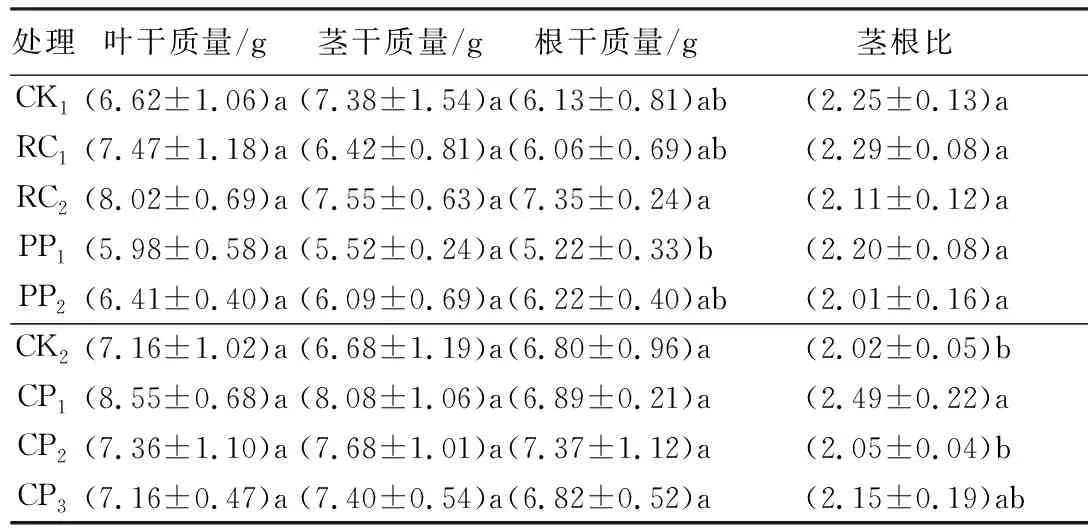
表3 不同控根处理时胡桃楸播种苗生物量
3.4 控根对胡桃楸播种苗C、N、P、K质量分数的影响
除化学控根CP3处理中苗木茎的C质量分数显著大于CP1和CP2外(P<0.05),其余各处理下,叶片、茎和根中C质量分数均无显著差异(表4)。胚根短截和物理控根中,RC1和RC2处理叶片N质量分数显著大于CK1和PP2(P<0.05);茎中仅RC1显著大于CK1和PP2(P<0.05,表5)。2 cm≤d<4 cm根系N质量分数中,PP1显著大于CK1,d≥4 cm的根系中,RC2显著大于CK1,也大于PP1(P<0.05)。

表4 不同控根处理时胡桃楸播种苗叶片、茎、根系中C质量分数
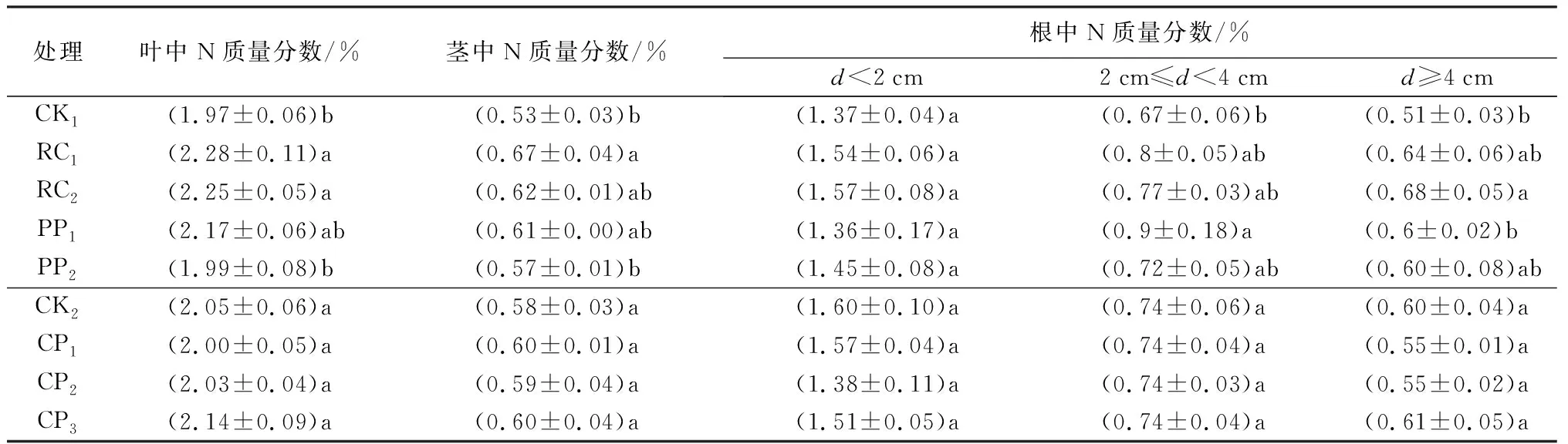
表5 不同控根处理时胡桃楸播种苗叶片、茎和根系中N质量分数
不同控根处理对叶片P质量分数影响不显著,对茎和根中P质量分数影响显著(P<0.05)。胚根短截和物理控根中,RC2的茎中P质量分数显著小于CK1(表6);RC1、RC2和PP1在根系直径2 cm≤d<4 cm中显著小于CK1,且RC1在d≥4 cm根系中也小于CK1(P<0.05)(表6)。化学控根中,CP2中茎P质量分数显著小于CP3,而CP3在d≥4 cm的根系P质量分数中显著小于CK2(表6)。
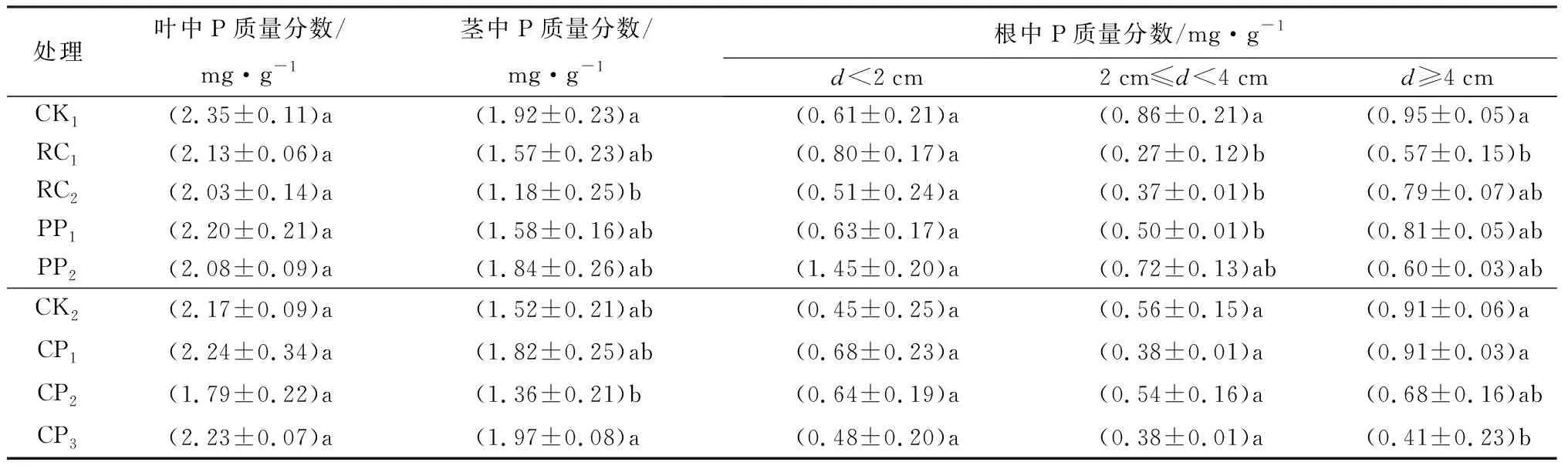
表6 不同控根处理时胡桃楸播种苗叶片、茎和根系中P质量分数
胚根短截和物理控根各处理对叶片和茎K质量分数无显著影响;化学控根对茎中K质量分数影响显著,为CP3显著小于CK2(P<0.05)(表7)。胚根短截和物理控根中,随短截长度的减小和控根深度的增加,叶片和茎中K质量分数逐渐降低;化学控根中,随控根剂浓度的增加,叶片和茎中K质量分数先增加后减小(表7)。不同控根处理对d<2 cm和2 cm≤d<4 cm的根系中K质量分数影响显著(P<0.05),对d≥4 cm的根系中K质量分数无显著影响;d<2 cm的根系中,CP2显著大于CK2;2 cm≤d<4 cm的根系中,RC2显著小于RC1(表7)。
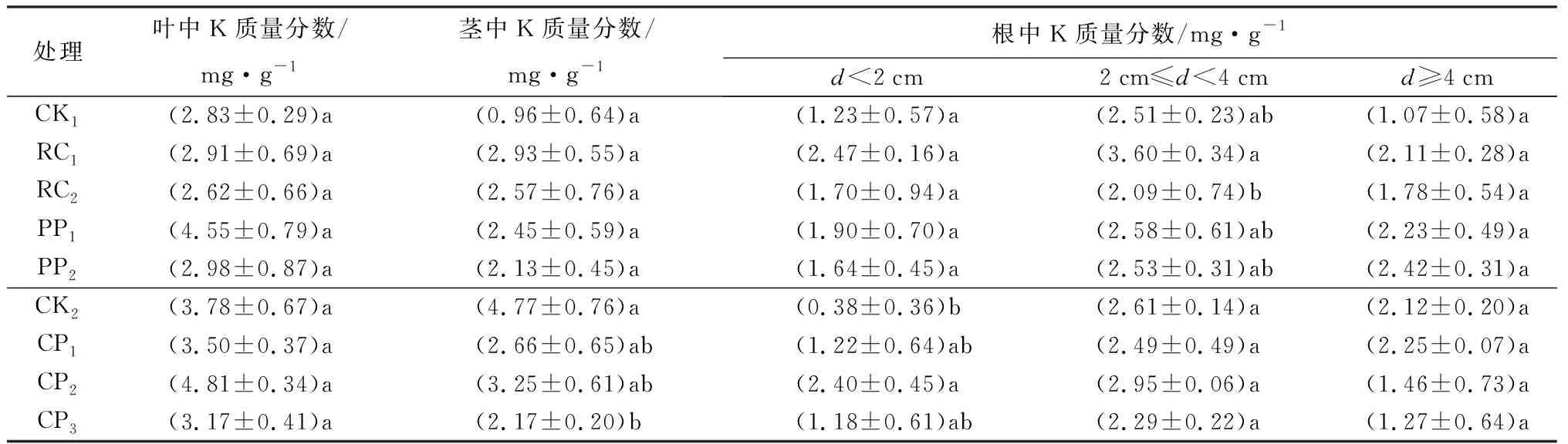
表7 不同控根处理时胡桃楸播种苗叶片、茎和根系中K质量分数
4 讨论
4.1 控根对胡桃楸播种苗形态和生物量的影响
研究发现,胚根短截1/3(RC2)处理胡桃楸播种苗苗高生长最好,100 mg/L CuSO4(CP1)处理地径生长最好,这与以往研究结果有部分相似之处。李鑫等[31]发现部分控根处理的紫楠幼苗在速生期过后,苗高和地径均高出对照。刘勇等[20]在对兴安落叶松化学控根的研究中发现,仅100 g/L的CuCO3增加了地径和生物量,其余各处理对苗木未产生明显影响。这也印证了本研究结果,低质量浓度的Cu2+对苗木的地上发育有促进作用,这可能与铜的性质或树种的生物学特性有关,Cu2+促进根系产生有利信号,如生长素含量上升等,导致产生了更多的细根[1],而细根数量的增加为根系吸收能力的提高及地上部分的生长提供了保障[30]。
主根较长在苗木移栽过程中的潜在影响是非常严重的[21]。控根可以在抑制苗木主根生长的同时刺激产生更多的侧须根,并调整地上部分与地下部分的比例,提高苗木造林效果[13]。本研究表明,胚根短截1/3(RC2)和100 mg/L CuSO4(CP1)处理显著抑制了胡桃楸播种苗主根的生长,且增加了根系总长、根系表面积、根系体积以及侧根数和根尖数,达到了理想的控根效果,这与周志春[28]、杨喜田[16]等分别对侧柏、红豆杉(Taxuswallichianavar.mairei)的研究结果类似。适度控根不仅可以控制主根的生长,还可以促进侧根和细根的发育,从而增加根系的吸收面积[32],为地上部分提供足够的水分和养分,加快苗木的生长[33-34]。Wenny et al.[34]也发现,使用Spinout控根剂可以增加1级侧根数和侧根长度,同时根尖数和根系体积也随之增加。本研究中CuSO4控根剂的原理在控根剂的作用下,苗木主根的生长受到抑制,将更多的生物量分配到次级侧根上,形成了分布均匀的侧须根,这有利于其充分吸收养分和水分[15]。孙盛[1]以银杏苗木为材料,采用不同质量浓度的铜制剂进行控根研究也发现,控根处理增加了幼苗0~2 mm径级的根系数量和体积,显著提高了银杏幼苗对水分和养分的利用效率,从而显著增加了整株生物量。
植物生物量是植物在生长发育过程中能量累积的一个特征,植物可以通过调整生物量的分配模式来适应环境的变化[35],改变各组织生物量的分配格局[36]。本研究发现,胚根短截1/3(RC2)和100 mg/L CuSO4(CP1)处理促进了各器官生物量的积累,其中根系生物量的积累最大。这也说明适度的控根处理可以通过引导更多的同化物进入地下来增加根系的生长,从而恢复内部的平衡[37]。Jacobs et al.[38]研究也证实,修根后根系生物量较大的苗木,移栽后更易生长和成活,生长优势更明显。而物理控根15 cm(PP1)和200 mg/L CuSO4(CP3)处理降低了部分器官的生物量,这也表明幼苗调节生物量分配的补偿反应并不能抵消过度的根系处理。当控根强度过大时,尽管细根与总根生物量比值和比根长(SRL)仍有增加,但全株干质量明显下降[39]。茎根比量化了植物吸收养分和水分过程中用于地上碳同化的资源量[40]。本研究中100 mg/L CuSO4(CP1)处理下胡桃楸播种苗的茎根比显著大于对照(CK2)和150 mg/L CuSO4(CP2)处理,表明低质量浓度的化学控根剂并不会对根系的生长产生抑制作用,这种处理下苗木的生长不会受到养分和水分吸收的限制,因为细根的再生补偿了部分受损的根系,这有利于移栽苗木的存活[20]。
4.2 控根对胡桃楸播种苗养分质量分数的影响
植物组织中的养分含量可以反映植物的营养状况和养分需要量[41]。控根破坏了植物原有的生长平衡,改变了植物的同化能力和养分分布水平[34]。本研究发现,各处理下叶片的C、N质量分数中除100和150 mg/L CuSO4处理下略低于对照,其余均高于对照,且胚根短截1/3(RC2)处理达到最大值。说明胚根短截可以增加胡桃楸幼苗叶片的C、N质量分数,从而促进各器官的生长。这可能与叶片代谢活动的强弱有关:受到损伤的根系为愈合伤口、重建根系结构而消耗了大量的碳水化合物,这就需要叶片改变自身的分配策略,为其提供充足的碳源,以保障根系的构建[31]。本研究还发现,胚根短截降低了茎和根系中P的质量分数,而化学控根中100和150 mg/L CuSO4处理增加了茎和根系K的质量分数,这可能是控根影响了各组织对营养离子的吸收。根据最优分配理论与功能平衡原则,植物生长受到胁迫或损害时,会增加和优先配置一些能获得该资源的器官和组织以抵御胁迫环境和受损器官,因此会导致各器官对不同养分的选择产生差异[42]。而由于缺乏相关试验结果的支持,控根后不同器官间养分分配所产生的差异有待进一步论证。
5 结论
研究发现,胚根短截和化学控根处理均能显著抑制胡桃楸播种苗主根长度,其中胚根短截1/3(RC2)和化学控根100 mg/L CuSO4(CP1)对幼苗主根的抑制效果最好,且对1级侧根数量、细根数量、根尖数量和细根生物量等的促进效果也最明显。同时,胚根短截1/3(RC2)增加了播种苗部分器官养分的承载,而化学控根各处理仅增加了茎和根中K的质量分数。总体看,胚根短截1/3处理最能达到理想的控根效果,在有效控制主根长度的同时,增加侧根数量和生物量,并且苗木体内的养分承载更高,能在提高栽植质量和效率的同时,提高苗木的成活率,加快苗木生长。
