盐碱胁迫对元宝枫幼苗生长和生理特性的影响1)
2022-09-08李悦蔡亚南任安琦韦淋馨张钰晗张若溪李庆卫
李悦 蔡亚南 任安琦 韦淋馨 张钰晗 张若溪 李庆卫
(北京林业大学,北京,100083)
目前,占世界陆地面积10%的土地处于盐碱化状态,严重威胁了全球农业生产和生态环境[1-2]。根据全国第二次土壤普查数据,我国的盐碱土总面积约3 600万hm2,主要分布在西北、华北、东北和沿海地区,占我国可利用土地面积的4.88%[3]。土壤盐胁迫分为中性盐胁迫、碱性盐胁迫和混合盐胁迫,中性盐胁迫多以NaCl为主,碱性盐胁迫多以NaHCO3为主,中性盐和碱性盐共存称为混合盐胁迫,我国的盐碱土则常以混合盐的形式存在[4]。盐碱地土壤会对植物产生渗透胁迫,直接毒害植物,制约植物的生长发育。适宜生活在盐碱土的植物非常有限,因此,筛选耐盐植物对丰富盐碱地景观和改善城市环境具有重要意义。
元宝枫(Acertruncatum)是我国特有的槭树科槭属落叶乔木,原产东北、华北、西北以及江苏、河南等地,其树形优美,叶形奇特,叶色丰富,是城市园林绿化中广泛应用的秋色叶树种之一[5]。同时,元宝枫也是重要的经济树种,其叶片是优质的蛋白质资源,富含黄酮类化合物和绿原酸,果实是重要的油料资源,果皮、果翅和种皮含大量优质缩合性单宁,是制革和印染工业的原料资源[6-7]。元宝枫是三北地区的乡土树种,而我国三北地区存在大量的盐碱土,了解元宝枫的耐盐性对于其在三北地区的栽培应用是十分有必要的。
目前对元宝枫抗逆性的研究主要侧重于干旱胁迫[8]、高CO2浓度[8]、重金属胁迫[9]、硬化地表[10]、酸雨[11]等方面,对于元宝枫的耐盐机理研究较少。因此,本研究采用盆栽试验法探究了盐碱胁迫对2年生元宝枫幼苗生长和生理特性的影响,筛选元宝枫耐盐碱的关键指标,为元宝枫在盐碱地区的栽培应用提供指导意见。
1 材料与方法
试验在北京林业大学科技园苗圃进行,供试材料为2年生元宝枫扦插苗。2018年3月将生长健壮、长势一致的苗木栽植于规格为30 cm×20 cm×30 cm的塑料花盆内,盆底放置托盘。盆内装6.0 kg基质,按V(草炭土)∶V(珍珠岩)∶V(洗净河沙)=2∶1∶1的比例混合而成。
1.1 试验设计
2019年6月下旬,试验苗进入旺盛生长期,先将盆土控水7 d,使土壤干燥利于盐分扩散。设置0(CK)、100(S1)、200(S2)、300(S3)、400(S4)、500 mmol·L-1(S5)6个盐浓度水平,盐溶液以n(NaCl)∶n(NaHCO3)=1∶1配制而成。盐分的添加分5 d完成,从高浓度处理组开始逐天加入盐溶液,其他处理组浇等量清水,第5天各处理达到预设浓度,此时记为盐胁迫开始的第1天。每个处理设5个重复,处理后进行常规管理,土壤田间持水量保持在60%~80%。在盐处理后的0(浇盐前)、10、20、30、40 d测定光合和叶绿素荧光参数并采样。
1.2 生长指标的测定
盐害指数和盐害率测定:盐处理结束后观察元宝枫的受害情况,统计盐害数量和盐害等级,计算盐害指数和盐害率[12]。
叶长、叶宽、地径生长量:试验开始前(0 d)和结束后(40 d)测定,测量差值为盐碱胁迫下的相对生长量。叶长和叶宽取标记好的10枚植物中上部成熟叶片进行测定,地径采用十字交叉的方式[13]在植株基部同一位置进行测定。叶长、叶宽、地径均采用游标卡尺测量,精度为0.01 cm。
1.3 生理指标的测定
在盐处理后的0(浇盐前)、10、20、30、40 d取植株新梢中上部功能叶后,立即用液氮处理,置于-80 ℃保存,用于测定生理生化指标(其中叶片组织含水量、相对电导率和叶绿素在叶片采后立即测定)。叶片组织含水量采用烘干法测定[14];质膜相对透性采用电导率法测定;叶绿素质量分数采用丙酮乙醇混合法测定[15];丙二醛(MDA)质量摩尔浓度采用硫代巴比妥酸法测定[16];超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)比色法测定[14];过氧化物酶(POD)活性采用愈创木酚法测定[16];过氧化氢酶(CAT)活性采用紫外吸收法测定[17];抗坏血酸过氧化物酶(APX)活性采用酶联免疫吸附法(ELISA)测定;可溶性蛋白质量分数采用考马斯亮蓝G-250染色法测定[16];可溶性糖质量分数采用蒽酮比色法测定[16];游离脯氨酸(Pro)质量分数采用酸性茚三酮比色法测定[16]。
1.4 光合指标的测定
采用便携式光合系统测定仪LI-6400于上午09:00—11:00,测定植株叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2摩尔分数(Ci)和蒸腾速率(Tr)。测定光合有效辐射为1 000 μmol·m-2·s-1,CO2摩尔分数为380~390 μmol·mol-1,温度为31~35 ℃。选取生长良好的功能叶,做好标记,保持叶片的叶倾角和方位角不变,重复3次。
1.5 叶绿素荧光参数的测定
采用便携式调制叶绿素荧光仪PAM-2500于上午09:00—11:00进行测定,选择生长良好的中上部功能叶片,做好标记,每次测定相同叶片。测定前充分暗适应30 min,测定PSⅡ最大光化学量子产量(Fv/Fm)、PSⅡ实际光化学量子产量(Y(Ⅱ))、光化学淬灭系数(qP)。每处理重复3次。
1.6 数据处理
使用Microsoft Excel 2016进行数据统计,使用SPSS 22.0对不同处理之间的试验数据进行单因素方差分析、相关性分析和主成分分析,使用GraphPad Prism 8.0.2绘制图片。对原始数据进行无量纲化处理,根据公式得到各项指标耐盐系数(α):α=(处理组平均值/对照组平均值)×100%[18],在此基础上对各项指标的α值进行Person相关性分析和主成分分析。
2 结果与分析
2.1 盐碱胁迫对元宝枫生长指标的影响
2.1.1 盐碱胁迫对元宝枫表观性状的影响
盐胁迫结束后,元宝枫受盐害程度逐渐加重(图1),盐害指数和盐害率随盐浓度增加逐渐上升(表1)。盐浓度为100~300 mmol·L-1时,元宝枫盐害指数为5%~55%,盐害率为20%~100%;盐浓度大于300 mmol·L-1时,元宝枫表观受害严重,盐害率均达到100%。综合盐害指数和盐害率(表1),根据Logistic回归方程y=0.240x-31.000(回归系数b=0.240)计算得出盐害指数为50%时元宝枫耐盐阈值为295.833 mmol·L-1。

图1 不同浓度盐碱胁迫40 d后元宝枫表观性状对照图

表1 不同浓度盐碱胁迫40 d后元宝枫盐害指数和盐害率
2.1.2 盐碱胁迫对元宝枫生长量的影响
胁迫结束后,元宝枫叶长、叶宽、地径生长量均随盐浓度的升高而降低,在盐浓度为500 mmol·L-1时降至最低(表2),说明盐处理均抑制了元宝枫的生长,随着盐浓度增加抑制作用加强。盐浓度为200 mmol·L-1时,元宝枫叶长、叶宽、地径生长量相比CK均不显著;盐浓度为300 mmol·L-1时,与CK相比叶长生长量显著降低(P<0.05),叶宽和地径生长量则无显著差异。盐浓度为500 mmol·L-1时,与CK相比,叶长、叶宽、地径生长量分别显著降低59.38%、75%、66.67%(P<0.05)。

表2 不同盐浓度时2年生元宝枫生长量
2.2 盐碱胁迫对元宝枫生理指标的影响
2.2.1 盐碱胁迫对元宝枫叶片组织含水量的影响
随着盐浓度增加和胁迫时间延长,元宝枫叶片组织含水量呈现出“下降-上升-下降”趋势(表3)。短期盐胁迫后含水量降低,盐胁迫30 d后则有所回升,除S5处理外其余处理与CK差异均不显著。胁迫40 d后,S1、S2、S3处理与CK相比含水量差异不显著,S4、S5处理与CK相比含水量显著降低了13.81%和20.00%(P<0.05)。

表3 不同盐浓度时2年生元宝枫叶片组织含水量
2.2.2盐碱胁迫对元宝枫相对电导率和MDA质量摩尔浓度的影响
随着盐浓度增加和胁迫时间延长,元宝枫叶片相对电导率和MDA质量摩尔浓度均呈上升趋势(表4)。胁迫30 d后,S1、S2处理下的相对电导率与CK相比无显著差异;胁迫40 d后,各处理与CK相比分别显著增加了9.58%、11.22%、45.20%、45.68%和49.78%(P<0.05)。胁迫各时期,S1处理下的MDA质量摩尔浓度与CK相比均无显著差异。胁迫40 d后,S2、S3、S4、S5处理的MDA质量摩尔浓度与CK相比分别显著增加了18.93%、34.12%、32.84%和45.01%(P<0.05)。相对电导率和MDA质量摩尔浓度均可体现植物膜系统受损程度,盐胁迫30 d后,S3、S4、S5处理与CK相比两者均显著上升,说明元宝枫在高盐浓度下膜系统受害严重。
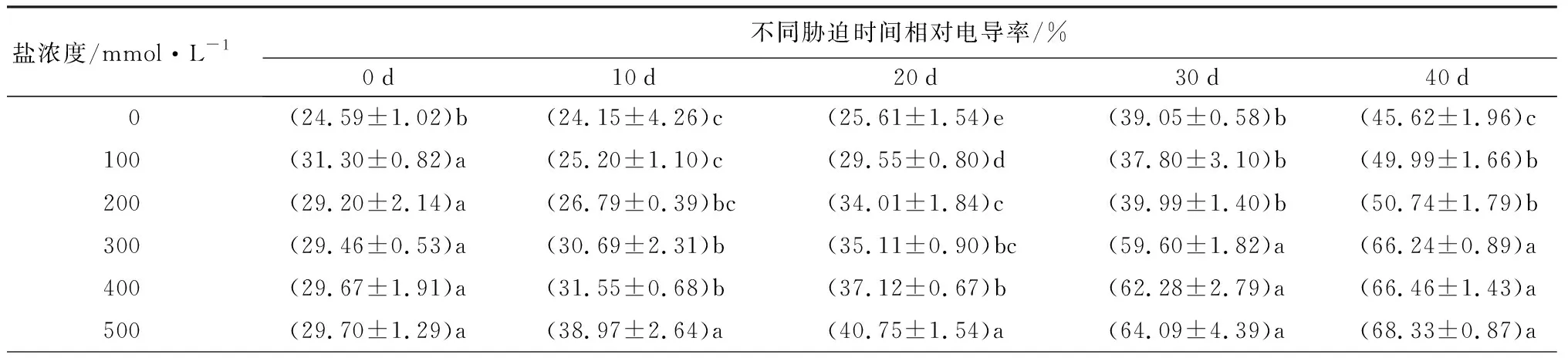
表4 不同盐浓度时2年生元宝枫相对电导率和MDA质量摩尔浓度
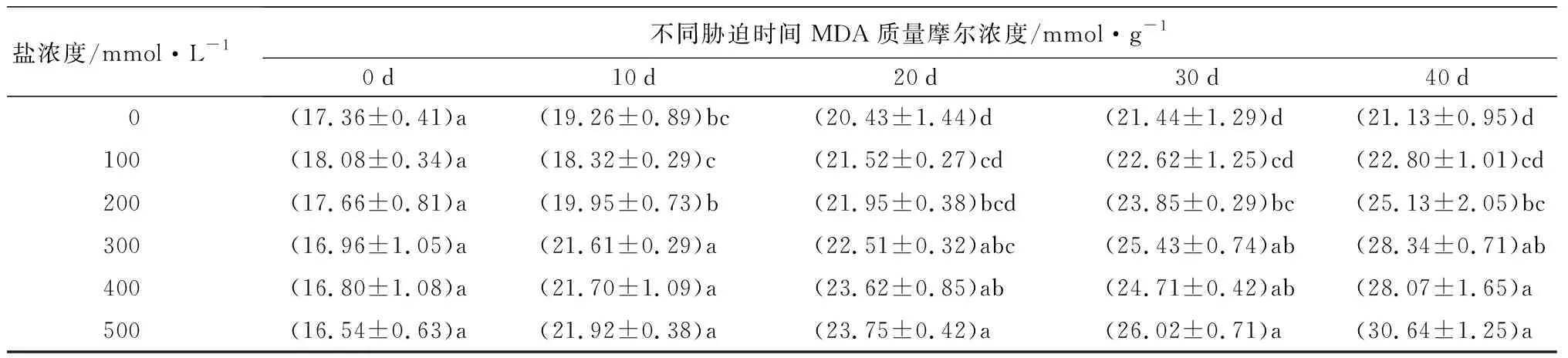
盐浓度/mmol·L-1不同胁迫时间MDA质量摩尔浓度/mmol·g-10d10d20d30d40d 0(17.36±0.41)a(19.26±0.89)bc(20.43±1.44)d (21.44±1.29)d(21.13±0.95)d100(18.08±0.34)a(18.32±0.29)c(21.52±0.27)cd(22.62±1.25)cd(22.80±1.01)cd200(17.66±0.81)a(19.95±0.73)b(21.95±0.38)bcd(23.85±0.29)bc(25.13±2.05)bc300(16.96±1.05)a(21.61±0.29)a(22.51±0.32)abc(25.43±0.74)ab(28.34±0.71)ab400(16.80±1.08)a(21.70±1.09)a(23.62±0.85)ab(24.71±0.42)ab(28.07±1.65)a500(16.54±0.63)a(21.92±0.38)a(23.75±0.42)a(26.02±0.71)a(30.64±1.25)a
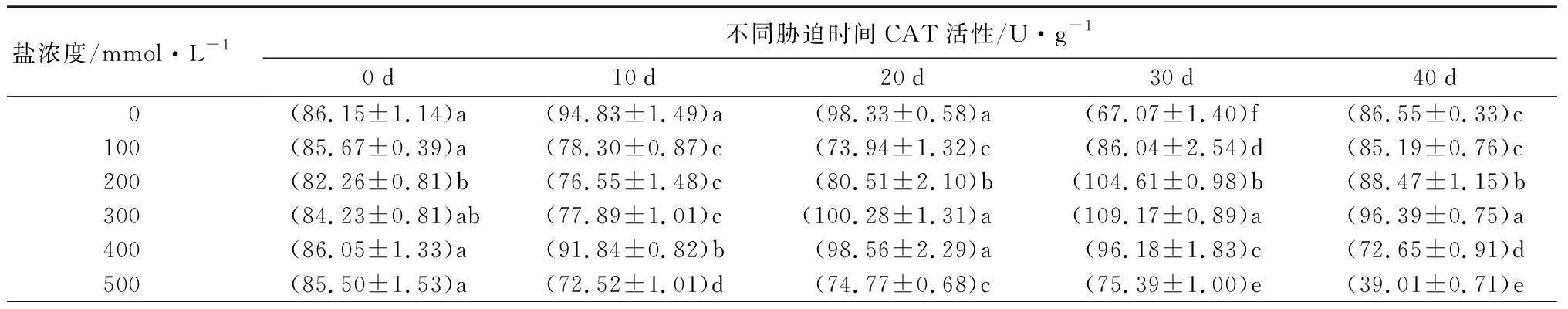
2.2.3盐碱胁迫对元宝枫SOD、POD、CAT、APX活性的影响
随着盐浓度增加,元宝枫SOD活性总体呈先上升后下降趋势(表5);胁迫10 d时,S1、S2、S3处理下SOD活性与CK差异不显著,此时S4、S5处理的SOD活性升至最高且显著高于CK13.30%和17.70%(P<0.05);胁迫30 d时,S1、S2处理下的SOD活性升至最高,分别显著高于CK10.55%和10.96%,S5处理则显著低于CK且降至最低(P<0.05);胁迫40 d后,除S3处理外,各处理与CK相比差异不显著。随盐浓度增加和胁迫时间延长,POD活性整体呈先上升后下降趋势(表5);胁迫30 d时,各处理POD活性均显著高于CK,分别显著升高217.66%、76.62%、68.88%、35.12%和56.04%(P<0.05);胁迫40 d后,S4、S5处理与CK差异不显著,S3处理下POD活性较CK显著增加67.89%,S1、S2处理则显著低于CK(P<0.05)。CAT活性随盐浓度增加整体呈先上升后下降趋势(表5);胁迫30 d时,各处理下CAT活性显著高于CK且较CK增幅最大,分别为28.28%、55.96%、62.77%、43.40%和12.41%(P<0.05);胁迫40 d时,S1处理较CK无显著差异,S2、S3处理下CAT活性显著上升,S4、S5处理相比CK显著下降(P<0.05)。APX活性在胁迫20 d内随盐浓度升高呈先上升后下降趋势(表5),且各处理组均显著低于CK(P<0.05);胁迫30 d后随盐浓度升高呈下降趋势,此时S1、S2处理的APX活性显著高于CK,S3、S4、S5处理则显著低于CK(P<0.05);胁迫40 d时,S3处理与CK无显著差异,S1处理下APX活性升至最高,显著高于CK31.11%,S2、S4处理则降至最低且显著低于CK35.62%(P<0.05)。
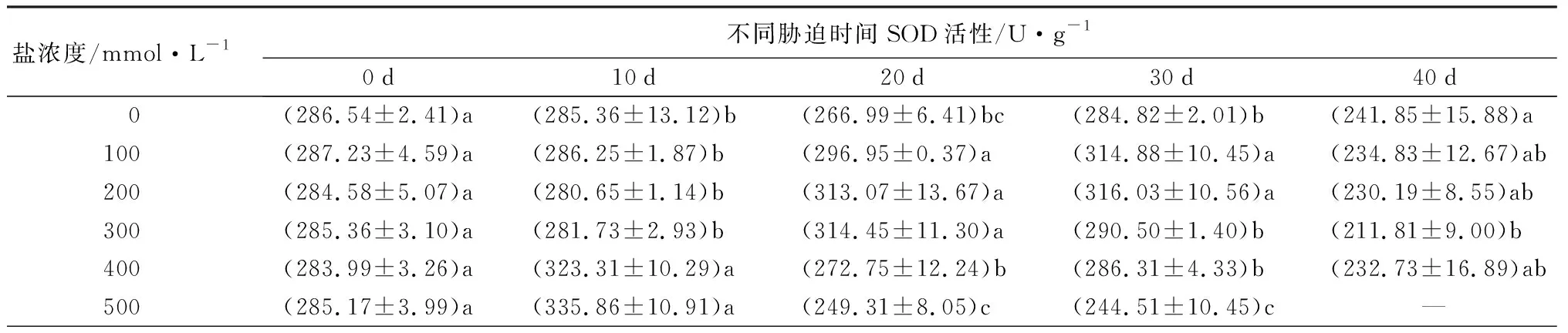
表5 不同盐浓度时2年生元宝枫SOD、POD、CAT、APX活性
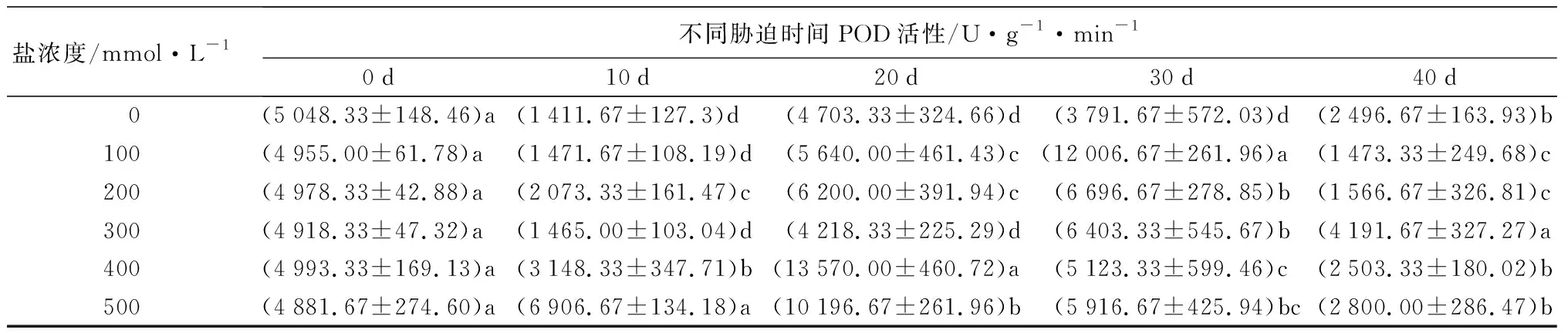
盐浓度/mmol·L-1不同胁迫时间POD活性/U·g-1·min-10d10d20d30d40d 0(5048.33±148.46)a(1411.67±127.3)d(4703.33±324.66)d(3791.67±572.03)d(2496.67±163.93)b100(4955.00±61.78)a(1471.67±108.19)d(5640.00±461.43)c(12006.67±261.96)a(1473.33±249.68)c200(4978.33±42.88)a(2073.33±161.47)c(6200.00±391.94)c(6696.67±278.85)b(1566.67±326.81)c300(4918.33±47.32)a(1465.00±103.04)d(4218.33±225.29)d(6403.33±545.67)b(4191.67±327.27)a400(4993.33±169.13)a(3148.33±347.71)b(13570.00±460.72)a(5123.33±599.46)c(2503.33±180.02)b500(4881.67±274.60)a(6906.67±134.18)a(10196.67±261.96)b(5916.67±425.94)bc(2800.00±286.47)b
续(表5)
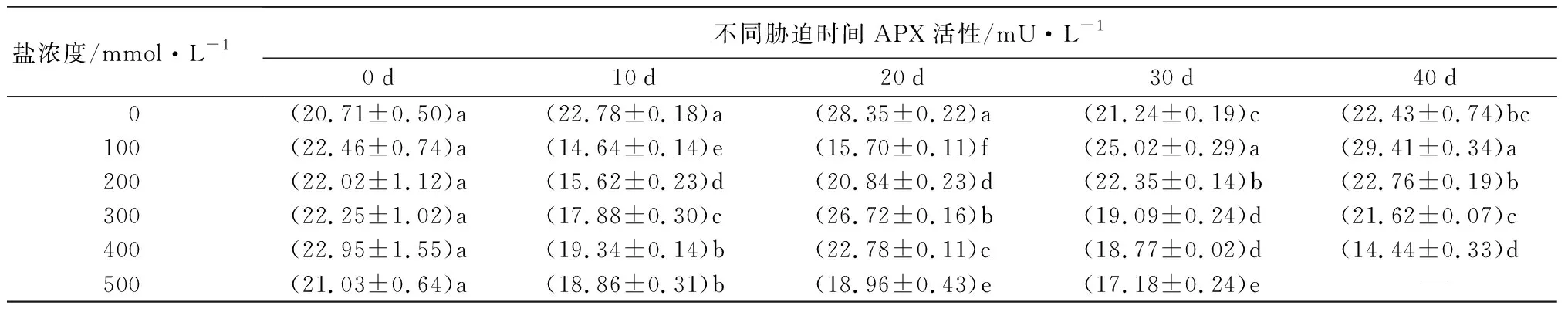
盐浓度/mmol·L-1不同胁迫时间APX活性/mU·L-10d10d20d30d40d 0(20.71±0.50)a(22.78±0.18)a(28.35±0.22)a(21.24±0.19)c(22.43±0.74)bc100(22.46±0.74)a(14.64±0.14)e(15.70±0.11)f(25.02±0.29)a(29.41±0.34)a200(22.02±1.12)a(15.62±0.23)d(20.84±0.23)d(22.35±0.14)b(22.76±0.19)b300(22.25±1.02)a(17.88±0.30)c(26.72±0.16)b(19.09±0.24)d(21.62±0.07)c400(22.95±1.55)a(19.34±0.14)b(22.78±0.11)c(18.77±0.02)d(14.44±0.33)d500(21.03±0.64)a(18.86±0.31)b(18.96±0.43)e(17.18±0.24)e—
2.2.4盐碱胁迫对元宝枫可溶性蛋白、可溶性糖和脯氨酸质量分数的影响
元宝枫可溶性蛋白质量分数在胁迫各阶段随着盐浓度增加整体呈先升高后降低趋势(表6),S1~S3处理组在胁迫10 d时增幅最大,相比CK分别显著增加1.28、1.44、1.18倍(P<0.05),随胁迫时间延长增幅逐渐降低,说明短期的中低盐胁迫下元宝枫可通过调整自身代谢合成大量可溶性蛋白来维持细胞的渗透平衡。可溶性糖质量分数在胁迫前30 d随盐浓度增加呈“下降-上升”趋势(表6),胁迫40 d时随盐浓度增加而逐渐升高,此时S3~S5处理组相比CK显著增加0.88倍、1.74倍和2.12倍(P<0.05),S1和S2处理组与CK无显著差异。脯氨酸质量分数随盐浓度增加和胁迫时间延长整体呈先上升后下降趋势(表6),胁迫40 d时,除S1处理组与CK相比显著升高14.73%外,其余处理组均显著低于CK,且随盐浓度增加而下降(P<0.05)。
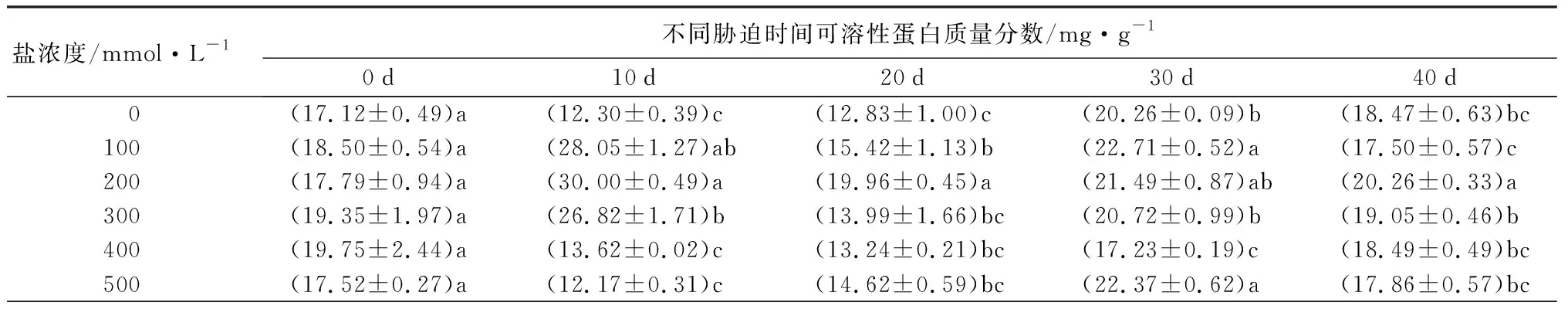
表6 不同盐浓度时2年生元宝枫可溶性蛋白、可溶性糖、脯氨酸质量分数
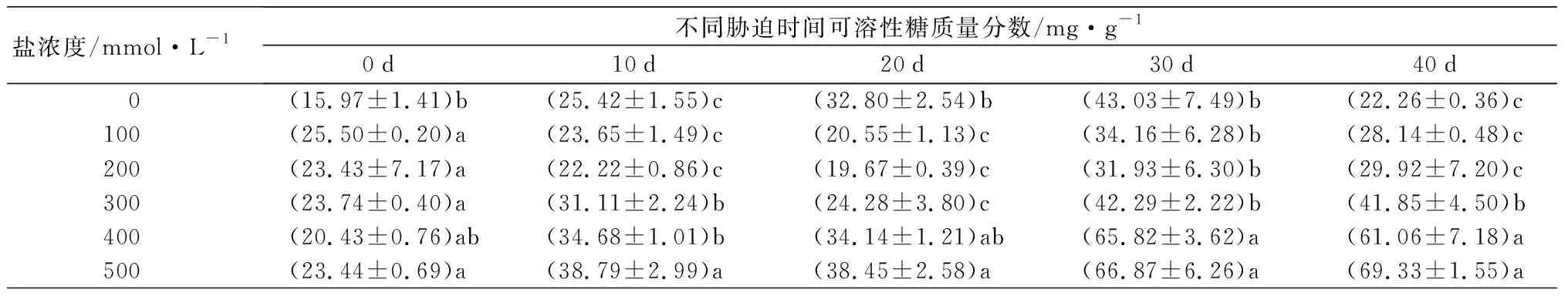
盐浓度/mmol·L-1不同胁迫时间可溶性糖质量分数/mg·g-10d10d20d30d40d 0(15.97±1.41)b(25.42±1.55)c(32.80±2.54)b(43.03±7.49)b(22.26±0.36)c100(25.50±0.20)a(23.65±1.49)c(20.55±1.13)c(34.16±6.28)b(28.14±0.48)c200(23.43±7.17)a(22.22±0.86)c(19.67±0.39)c(31.93±6.30)b(29.92±7.20)c300(23.74±0.40)a(31.11±2.24)b(24.28±3.80)c(42.29±2.22)b(41.85±4.50)b400(20.43±0.76)ab(34.68±1.01)b(34.14±1.21)ab(65.82±3.62)a(61.06±7.18)a500(23.44±0.69)a(38.79±2.99)a(38.45±2.58)a(66.87±6.26)a(69.33±1.55)a
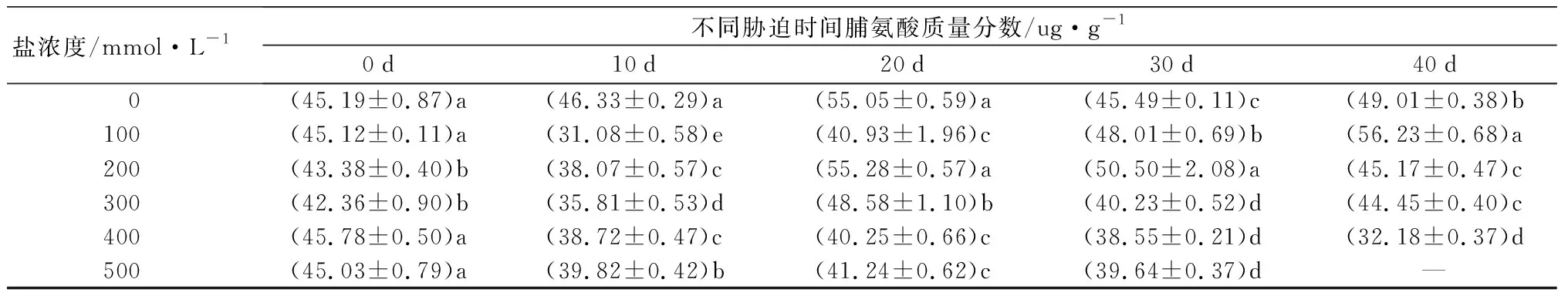
盐浓度/mmol·L-1不同胁迫时间脯氨酸质量分数/ug·g-10d10d20d30d40d 0(45.19±0.87)a(46.33±0.29)a(55.05±0.59)a(45.49±0.11)c(49.01±0.38)b100(45.12±0.11)a(31.08±0.58)e(40.93±1.96)c(48.01±0.69)b(56.23±0.68)a200(43.38±0.40)b(38.07±0.57)c(55.28±0.57)a(50.50±2.08)a(45.17±0.47)c300(42.36±0.90)b(35.81±0.53)d(48.58±1.10)b(40.23±0.52)d(44.45±0.40)c400(45.78±0.50)a(38.72±0.47)c(40.25±0.66)c(38.55±0.21)d(32.18±0.37)d500(45.03±0.79)a(39.82±0.42)b(41.24±0.62)c(39.64±0.37)d—
2.3 盐碱胁迫对元宝枫光合指标的影响
2.3.1 盐碱胁迫对元宝枫叶绿素质量分数的影响
随盐浓度增加和胁迫时间延长,元宝枫叶绿素质量分数整体上呈先上升后下降趋势(表7)。胁迫20 d后,S4、S5处理组叶绿素质量分数达到最高值,之后下降;胁迫30 d后,S1、S2、S3处理组叶绿素质量分数达到最高值。胁迫40 d后,各处理组叶绿素质量分数均低于CK,S1、S2处理下与CK差异不显著,说明长时间胁迫下,低盐处理下的元宝枫仍然能够保持较好的生长状态,当盐浓度达到300 mmol·L-1时,元宝枫受到一定伤害。
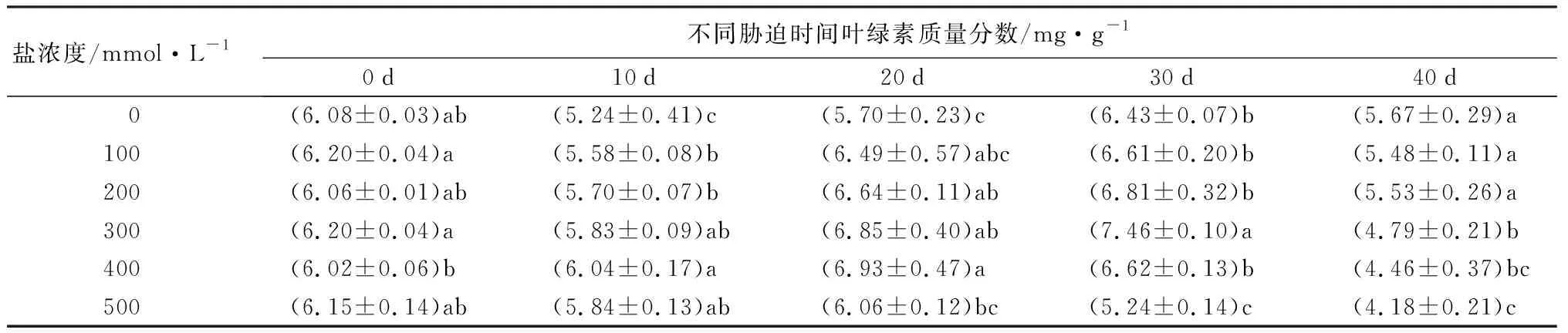
表7 不同盐浓度时2年生元宝枫叶绿素质量分数
2.3.2 盐碱胁迫对元宝枫光合作用的影响
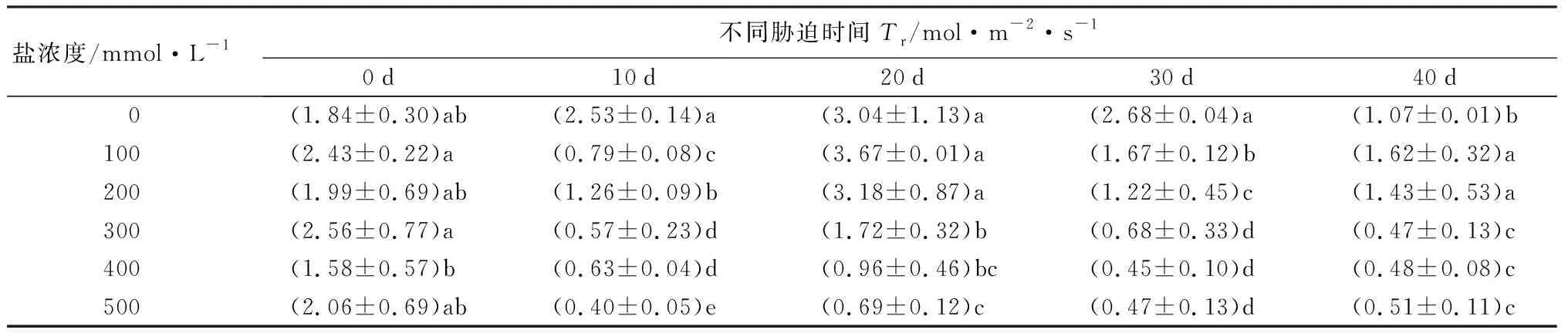
随着盐浓度增加和胁迫时间延长,元宝枫净光合速率(Pn)整体呈下降趋势(表8)。胁迫40 d后,S1、S2处理Pn值高于CK,但差异不显著;S4、S5处理相比CK则分别显著降低41.75%和49.00%(P<0.05)。气孔导度(Gs)随盐浓度升高和胁迫时间延长整体呈下降趋势(表8)。在胁迫20~40 d时,S1处理下Gs值与CK差异不显著;胁迫40 d时,S2、S3、S4、S5处理组Gs分别显著低于CK组16.67%、50.00%、50.00%、50.00%(P<0.05),此时S1处理Gs高于CK,但差异不显著,并且S3、S4、S5 3组之间差异不显著。胞间CO2摩尔分数(Ci)在盐胁迫的前20 d整体呈小范围波动变化;胁迫30 d时随盐浓度增加而下降,S2、S3、S4、S5处理下均显著低于CK(P<0.05);胁迫40 d时随盐浓度增加呈先下降后上升趋势,S3处理显著低于CK 32.58%(P<0.05),其余处理组与CK无显著差异。胁迫40 d,当盐浓度为300~500 mmol·L-1时,Ci在Gs不变的情况下出现升高的现象(表8),说明在较高浓度的盐碱胁迫下,非气孔因素是元宝枫净光合速率降低的主导因素。蒸腾速率(Tr)随盐浓度增加和胁迫时间延长整体呈下降趋势(表8);胁迫40 d后,S1、S2处理显著高于CK 52.83%和34.91%,S3、S4、S5处理则显著低于CK 55.66%、54.72%和51.89%(P<0.05)。综合上述结果,说明元宝枫长时间在低于200 mmol·L-1的盐浓度下可通过自身调节保持良好的生长状态。
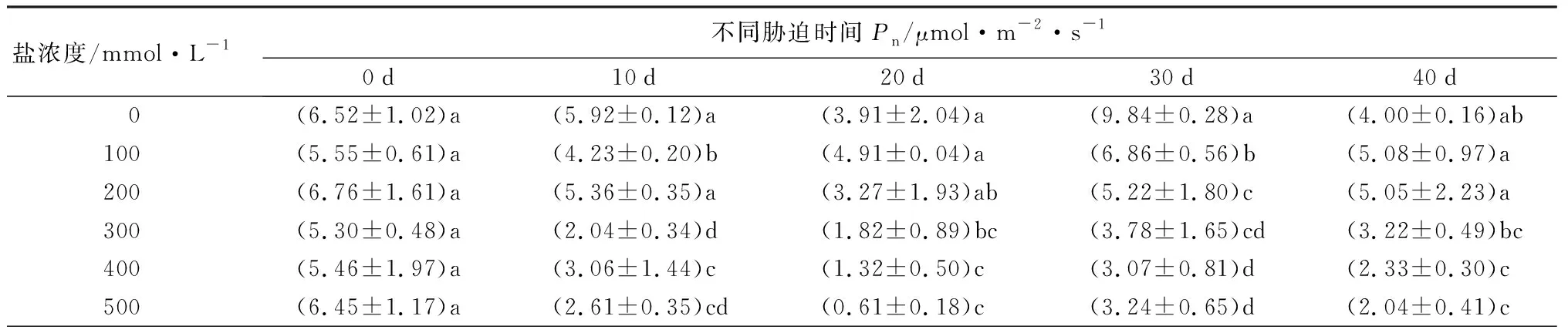
表8 不同盐浓度时2年生元宝枫光合作用
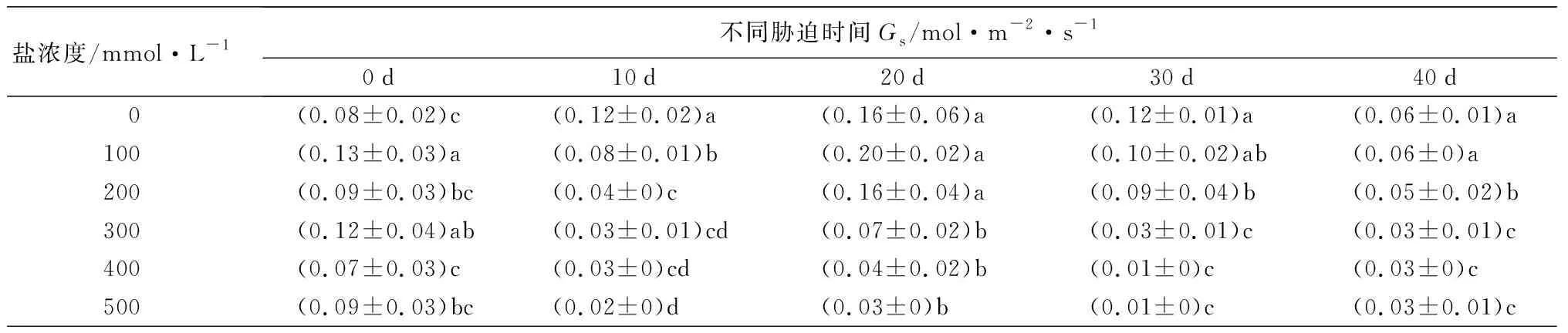
盐浓度/mmol·L-1不同胁迫时间Gs/mol·m-2·s-10d10d20d30d40d 0(0.08±0.02)c(0.12±0.02)a(0.16±0.06)a(0.12±0.01)a(0.06±0.01)a100(0.13±0.03)a(0.08±0.01)b(0.20±0.02)a(0.10±0.02)ab(0.06±0)a200(0.09±0.03)bc(0.04±0)c(0.16±0.04)a(0.09±0.04)b(0.05±0.02)b300(0.12±0.04)ab(0.03±0.01)cd(0.07±0.02)b(0.03±0.01)c(0.03±0.01)c400(0.07±0.03)c(0.03±0)cd(0.04±0.02)b(0.01±0)c(0.03±0)c500(0.09±0.03)bc(0.02±0)d(0.03±0)b(0.01±0)c(0.03±0.01)c
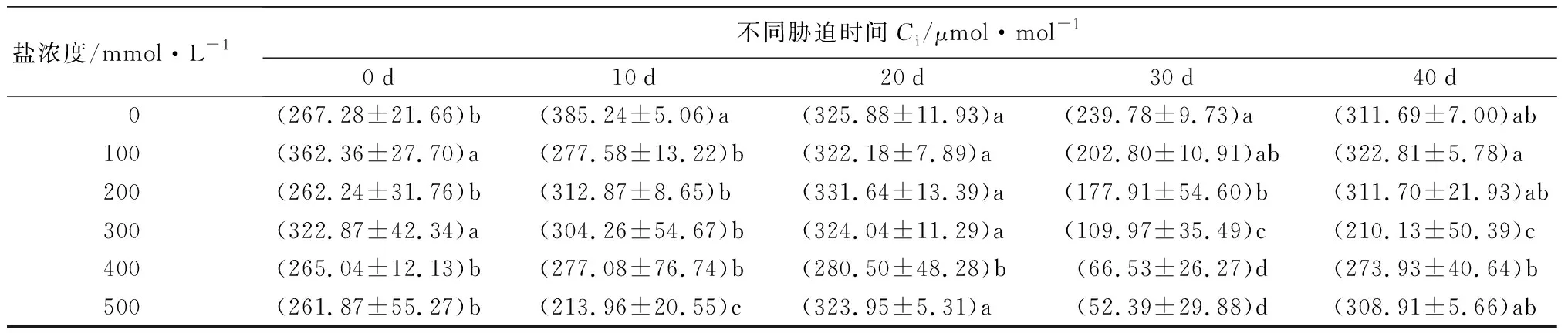
盐浓度/mmol·L-1不同胁迫时间Ci/μmol·mol-10d10d20d30d40d 0(267.28±21.66)b(385.24±5.06)a(325.88±11.93)a(239.78±9.73)a (311.69±7.00)ab100(362.36±27.70)a(277.58±13.22)b(322.18±7.89)a(202.80±10.91)ab(322.81±5.78)a200(262.24±31.76)b(312.87±8.65)b(331.64±13.39)a(177.91±54.60)b(311.70±21.93)ab300(322.87±42.34)a(304.26±54.67)b(324.04±11.29)a(109.97±35.49)c(210.13±50.39)c400(265.04±12.13)b(277.08±76.74)b(280.50±48.28)b(66.53±26.27)d(273.93±40.64)b500(261.87±55.27)b(213.96±20.55)c(323.95±5.31)a(52.39±29.88)d(308.91±5.66)ab
续(表8)
2.4 盐碱胁迫对元宝枫叶绿素荧光参数的影响
随着盐浓度增加和胁迫时间延长,元宝枫叶绿素荧光参数(Fv/Fm、Y(Ⅱ)、qP)整体呈下降趋势(表9)。胁迫40 d后,与CK相比,Fv/Fm值除S1处理无显著差异,S2~S5处理分别显著下降5.19%、7.79%、14.29%、27.27%(P<0.05);此时各处理Y(Ⅱ)值相比CK分别显著降低10.15%、11.59%、23.19%、31.88%、49.28%(P<0.05);各处理组qP值相比CK分别显著降低8.25%、16.50%、22.68%、27.84%、39.18%(P<0.05)。随着盐浓度升高,叶绿素荧光参数下降,反映出元宝枫PSⅡ反应中心受到了严重伤害,受到的光抑制程度增加。
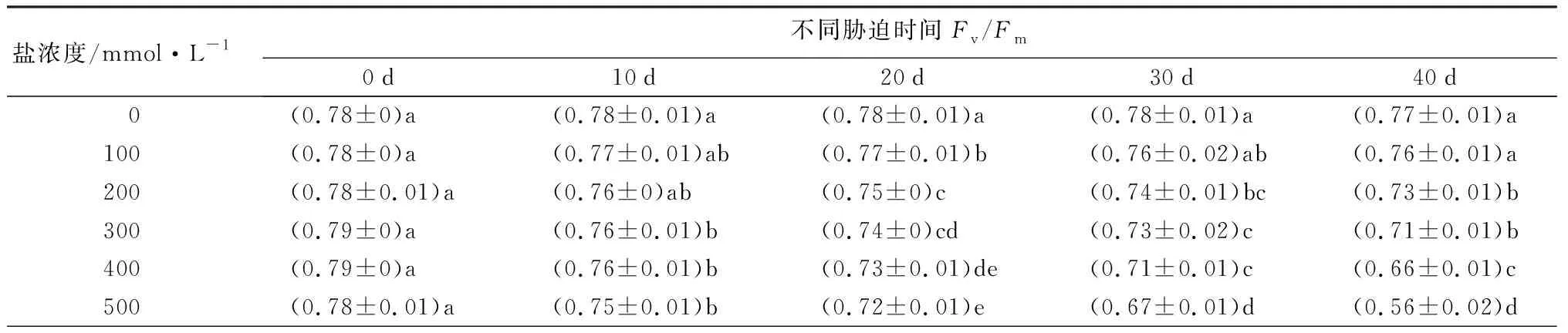
表9 不同盐浓度时2年生元宝枫叶绿素荧光参数
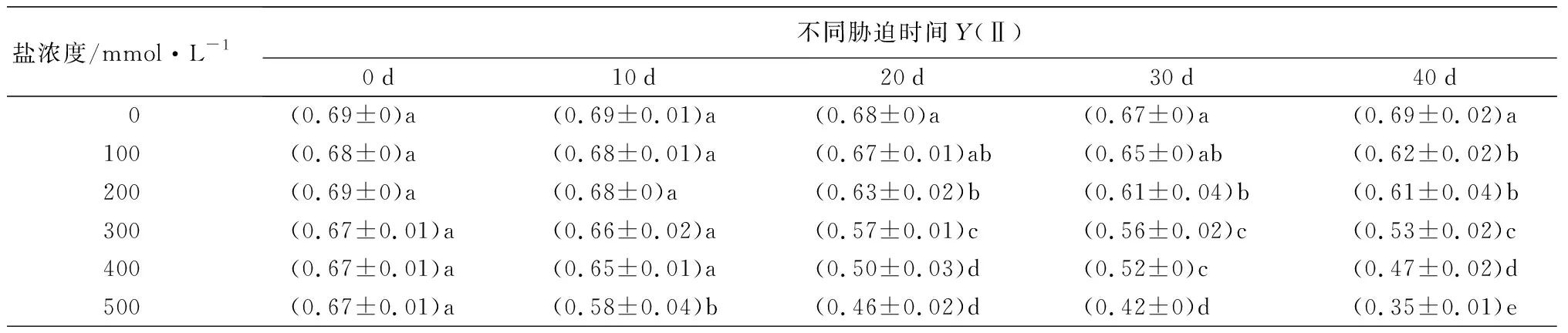
盐浓度/mmol·L-1不同胁迫时间Y(Ⅱ)0d10d20d30d40d 0(0.69±0)a (0.69±0.01)a(0.68±0)a (0.67±0)a (0.69±0.02)a100(0.68±0)a(0.68±0.01)a(0.67±0.01)ab(0.65±0)ab(0.62±0.02)b200(0.69±0)a(0.68±0)a(0.63±0.02)b(0.61±0.04)b(0.61±0.04)b300(0.67±0.01)a(0.66±0.02)a(0.57±0.01)c(0.56±0.02)c(0.53±0.02)c400(0.67±0.01)a(0.65±0.01)a(0.50±0.03)d(0.52±0)c(0.47±0.02)d500(0.67±0.01)a(0.58±0.04)b(0.46±0.02)d(0.42±0)d(0.35±0.01)e
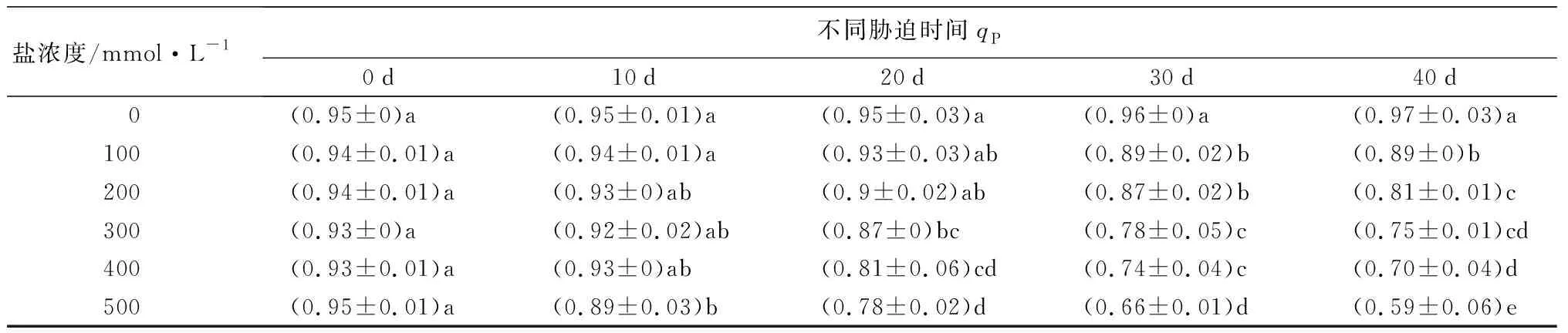
盐浓度/mmol·L-1不同胁迫时间qP0d10d20d30d40d 0(0.95±0)a (0.95±0.01)a(0.95±0.03)a(0.96±0)a (0.97±0.03)a100(0.94±0.01)a(0.94±0.01)a(0.93±0.03)ab(0.89±0.02)b(0.89±0)b200(0.94±0.01)a(0.93±0)ab(0.9±0.02)ab(0.87±0.02)b(0.81±0.01)c300(0.93±0)a(0.92±0.02)ab(0.87±0)bc(0.78±0.05)c(0.75±0.01)cd400(0.93±0.01)a(0.93±0)ab(0.81±0.06)cd(0.74±0.04)c(0.70±0.04)d500(0.95±0.01)a(0.89±0.03)b(0.78±0.02)d(0.66±0.01)d(0.59±0.06)e
2.5 元宝枫耐盐性评价
2.5.1 相关性分析
对元宝枫盐碱胁迫下的18个生理指标的耐盐系数进行Person相关性分析,由表10可知,MDA质量摩尔浓度与Y(Ⅱ)和qP均呈显著负相关,与Fv/Fm呈极显著负相关;SOD活性与可溶性糖质量分数呈显著负相关,与叶绿素质量分数呈极显著正相关;POD活性与Pn和Tr均呈显著负相关;APX活性与脯氨酸质量分数呈显著正相关;Gs和Tr呈极显著正相关;Fv/Fm和Y(Ⅱ)、qP均呈极显著正相关;Y(Ⅱ)和qP呈显著正相关。由此可见,选取的生理指标之间存在一定的相关关系,对耐盐性进行评价时会产生信息的重叠,故可以用主成分分析法对评价指标进行简化。

表10 盐碱胁迫时元宝枫各生理指标间相关系数
2.5.2 主成分分析
表11列出了前4个主成分的分析结果,前3个主成分的累计贡献率为91.52%。主成分1贡献率为41.51%,其中叶绿素质量分数、SOD活性、APX活性、POD活性以及可溶性糖质量分数这5个指标绝对值均在0.8以上,主要反映了酶活性与元宝枫耐盐碱能力的关系;主成分2则主要包含相对电导率、MDA质量摩尔浓度、Gs、Ci、Fv/Fm、Y(Ⅱ)、qP这7个指标,反映了膜系统、叶绿素荧光参数和元宝枫耐盐碱能力的关系;主成分3中,叶片组织含水量是主要指标。
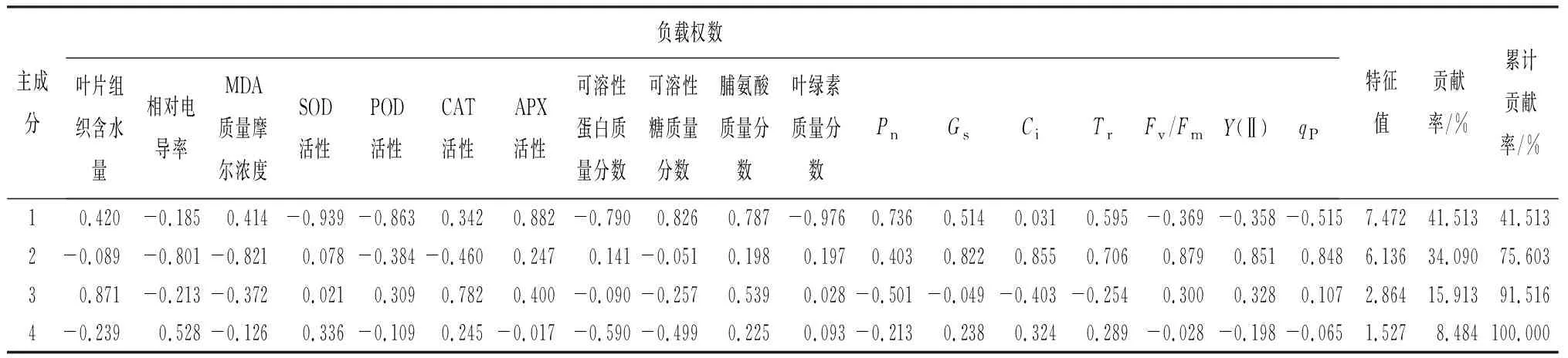
表11 盐碱胁迫时元宝枫各生理指标主成分分析结果
3 结论与讨论
植物对盐碱胁迫的响应过程涉及了复杂的生理生化反应,盐碱逆境对植物造成的危害表现为渗透胁迫、离子毒害、氧化胁迫、光合作用受阻、生长发育和形态建成的改变等[19-20]。植物外部形态和生长状况是反映其受盐碱伤害程度大小的最直观表现[21]。本研究中,在低盐浓度(100~200 mmol·L-1)下,元宝枫生长受到的抑制较小,各生长量相比对照无显著差异;盐浓度为300 mmol·L-1时,部分叶片枯死脱落,盐害率已达到100%,并且此时叶长生长量显著低于对照;而随着盐浓度增加,各生长量均显著下降,说明低浓度盐碱胁迫对元宝枫生长影响较小,中高浓度(300~500 mmol·L-1)盐碱胁迫则严重影响了元宝枫的生长发育,这与耐盐性较弱树种如复叶槭、茶条槭的研究结果相似[22]。含水量也可以反映盐碱胁迫对植物造成的伤害程度。元宝枫叶片组织含水量随盐浓度增加和胁迫时间延长呈“下降-上升-下降”趋势,胁迫40 d时在中低盐浓度(100~300 mmol·L-1)下与对照差异不显著,高盐浓度(400~500 mmol·L-1)下显著降低,说明在中低盐浓度下,元宝枫能维持正常生长所需水分,随着盐浓度增加,细胞严重失水,在表观上呈现出叶片枯萎脱落等现象。
盐碱胁迫下,植物最先受到伤害的是细胞膜的结构和功能,膜系统的受盐害程度可以用膜透性变化和膜脂过氧化反应的主要产物MDA质量摩尔浓度来反映[21]。本研究中,胁迫30 d时,低盐浓度下相对电导率与对照无显著差异,说明在短时间低浓度盐碱胁迫下元宝枫可通过自身调节对胁迫产生一定的适应,此时叶片细胞膜结构尚未被破坏,而随着盐浓度的增加和胁迫时间的延长,相对电导率大幅上升,元宝枫膜结构的稳定性受到破坏,大量电解质外渗。盐浓度为100 mmol·L-1时,MDA质量摩尔浓度在胁迫各时期与对照均无显著差异,说明低盐浓度下元宝枫细胞膜氧化程度较低;随着盐浓度增加和胁迫时间延长,MDA质量摩尔浓度显著上升,且与相对电导率变化趋势一致,说明盐浓度升高导致电解质外渗的同时,膜脂过氧化程度加剧导致大量MDA等毒害物质累积,细胞膜受损严重,与石元豹[23]、周艳威[24]等研究结果一致。
脯氨酸、可溶性糖和可溶性蛋白是植物在抗盐碱过程中合成的有机小分子物质,参与植物的渗透调节,使植物在胁迫环境下保持自身水分平衡[31]。本研究中,元宝枫可溶性蛋白质量分数在中低浓度盐碱胁迫下高于对照,在胁迫10 d时达到最大值,随盐浓度增加和胁迫时间延长而下降,说明在短时间内中低浓度盐碱胁迫促进了元宝枫可溶性蛋白的合成,作为渗透调节物质来缓解盐害,而随着盐浓度增加,可溶性蛋白质量分数下降,可能是高盐浓度抑制了可溶性蛋白的合成,与石元豹[23]、杨万鹏[32]等的研究结果一致。可溶性糖质量分数随盐浓度增加和胁迫时间延长呈上升趋势,在低盐胁迫前30 d均低于对照,高盐胁迫下均高于对照,说明元宝枫在高盐胁迫下可通过积累可溶性糖进行渗透调节,与垂丝海棠[33]、小果白刺[34]等研究结果一致。脯氨酸质量分数在胁迫30 d低盐浓度下显著高于对照,随盐浓度升高质量摩尔浓度显著降低;胁迫40 d时在盐浓度为100 mmol·L-1时显著高于对照,随盐浓度升高呈下降趋势,与小叶榄仁[35]、梅花[36]随盐浓度升高而升高的趋势不同,与大果白刺[28]、流苏[37]的结果一致,可能是因为碱胁迫中和了部分脯氨酸,导致高浓度盐碱胁迫下脯氨酸质量分数下降,也有可能是因为中生植物并不主要依靠脯氨酸来调节渗透势[38]。
光合作用为植物生长发育提供物质和能量,盐碱胁迫主要通过渗透胁迫、离子毒害和营养效应等影响光合作用器官以及其组分进而影响植物的光合作用[39]。本研究中,胁迫前30 d,元宝枫叶绿素质量分数在中低盐浓度下均高于对照且呈上升趋势,而随着盐浓度增加和胁迫时间延长,叶绿素质量分数降低且均低于对照。这可能是由于短时间内的低盐胁迫促使细胞积累渗透调节物质、提高了酶活性而加速了叶绿素的合成,以维持正常的光合作用;而随着盐碱胁迫的加剧,叶绿素质量分数降低,可能是由于植株吸收水分和矿质营养困难,引起生理干旱,造成营养不良[40],同时高盐碱胁迫累积的离子毒害使得叶绿体结构和功能受损,导致叶绿素质量分数降低[41]。Pn可以衡量植物光合系统的工作情况,气孔限制和非气孔限制是导致光合作用效率降低的两种主导因素[42]。胁迫30 d时,低盐浓度下Pn显著低于对照,而40 d时与对照无显著差异且略高于对照,说明随着胁迫时间延长,元宝枫逐渐适应了低盐胁迫,光合作用有所恢复,与范方[43]相似。随着盐浓度增加,元宝枫Pn、Gs、Tr呈下降趋势,三者的变化规律相似,说明Pn和Tr所受到的胁迫很有可能来源于气孔限制因素;而Ci呈现低盐浓度降低,高盐浓度升高的趋势,说明在低浓度盐碱胁迫下,气孔限制是导致元宝枫光合速率降低的主导因素,而在高浓度盐碱胁迫下,非气孔限制是影响光合速率的主要因素,与赵海燕[44]、刘莉娜[45]相似。叶绿素荧光参数与光合作用密切相关,可以反映光系统Ⅱ(PSⅡ)对光能的吸收和利用情况[39],本研究中,PSⅡ最大光化学量子产量(Fv/Fm)、PSⅡ实际光化学量子产量(Y(Ⅱ))和光化学淬灭系数(qP)随着盐碱浓度增加和胁迫时间延长均呈下降趋势,胁迫40 d后,除Fv/Fm在盐浓度为100 mmol·L-1时与对照无显著差异,Y(Ⅱ)和qP各处理组均显著低于对照,且三者在高浓度盐碱胁迫下均显著低于中低浓度盐碱胁迫,表明元宝枫在盐碱胁迫下受到光抑制,电子传递活性和速率减弱,捕获的光能用于光化学反应的比例降低,可能是由于盐碱胁迫对元宝枫PSⅡ反应中心、原初电子受体或PSⅡ氧化传递链造成了一定的损伤所导致[46]。
本研究发现,元宝枫在低浓度盐碱胁迫下,可通过提高SOD、POD、CAT、APX活性来清除体内活性氧自由基,减少膜脂过氧化作用对细胞的伤害,并累积可溶性蛋白、可溶性糖和脯氨酸等渗透调节物质来提高细胞的渗透调节能力,维持植物正常生长所需的水分,此时植物光合作用受到的影响较小,生长量无显著差异,表现出较强的适应能力。当盐浓度超过元宝枫的耐受范围时,其盐害指数和盐害率升高,植株受到光抑制,净光合速率下降,膜脂过氧化加剧,抗氧化酶系统受到损伤,生长发育受到抑制。元宝枫具有一定的耐盐碱能力,其在土壤中n(NaCl)∶n(NaHCO3)=1∶1的条件下胁迫40 d后的耐盐阈值为295.833 mmol·L-1;通过对元宝枫耐盐生理指标进行主成分分析,认为可将叶绿素质量分数、SOD活性、APX活性、POD活性以及可溶性糖质量分数作为元宝枫耐盐性评价的参考指标。
本研究可以在一定程度上反映出元宝枫的耐盐碱能力,但考虑到自然界中的盐碱土壤离子成分复杂,建议以后根据不同盐碱土地区的实际离子含量比模拟土壤盐碱复合胁迫环境进行研究。
