免疫抑制受体IGSF9单克隆抗体的制备以及功能验证
2022-09-08刘祎璠赵鑫钰栾惠雯刘晓丽李尊岭
刘祎璠 赵鑫钰 栾惠雯 刘晓丽 李尊岭
滨州医学院基础医学院生物化学与分子生物学教研室,山东省肿瘤免疫治疗研究创新团队 山东 烟台 264003
肿瘤免疫治疗是重新启动机体免疫系统识别并清除异常细胞,恢复机体正常免疫反应,进而控制肿瘤的一种治疗手段[1]。目前,肿瘤免疫治疗已经成为晚期肿瘤患者的首选治疗方式,其中靶向CTLA-4、PD-1和PD-L1的免疫检查点抑制剂是临床应用最多、适应症最广的肿瘤免疫治疗药物。只有20%的肿瘤患者能够从肿瘤免疫检查点抑制剂治疗中受益,这表明,大多数肿瘤患者有非依赖于PD-1/PD-L1的免疫逃避机制[2]。
迄今为止,从人类蛋白组中鉴定出109个跨膜蛋白的胞内区域含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)[3],与配体结合后,ITIMs基序募集磷酸酶SHP-1、SHP-2或者SHIP-1,抑制免疫细胞的活性,因此将这109个膜蛋白统称为免疫抑制受体[4]。本课题组前期应用生物信息学工具,筛选这109个免疫抑制受体在肿瘤组织中的表达,发现靶向免疫球蛋白超家族成员9(immunoglobulin superfamily member 9,IGSF9)几乎在所有肿瘤细胞中表达较高。2018年,IGSF9首次被报道与癌症有关。IGSF9与子宫肌层浸润和预后不良有关,可作为子宫内膜癌的新生标志物,在诊断、预后和治疗方面具有潜在的应用价值[5]。通过生物信息学分析,IGSF9可作为鼻咽癌的一种新的预后指标反映肿瘤异质性[6],但IGSF9作为一种免疫抑制受体未见报道。本研究旨在制备靶向IGSF9的特异阻断型单克隆抗体,并验证其功能,为肿瘤免疫治疗药物的研发提供理论基础和实验依据。
1 材料与方法
1.1 材料 THP-1细胞购自武汉普诺赛生命科技有限公司(STR验证细胞正确),健康供体T细胞购自All Cells。BALB/c小鼠购自北京维通利华实验动物技术有限公司。抗体纯化柱购自碧云天生物技术有限公司,抗体浓缩柱购自Merck公司。Anti-human CD3-APC(Cat# OKT3, 1∶200,Biolegend),anti-human CD8-PE(Cat# RPA-T8,1∶200,Invitrogen),anti-human CD4-PE(Cat# OKT4,1∶200,Biolegend),anti-Rabbit secondary antibody-Alexa Fluor 647(1∶1 000,Jackson Lab)购自Biolegend公司,anti-human IGSF9(Cat# orb1926,1∶200,Biorbyt)购自Biorbyt公司。
1.2 仪器 C6-Plus流式细胞仪购自美国BD公司,微量移液器购自Eppendorf公司,倒置显微镜购自日本Olympus公司,荧光显微镜购自Zeiss公司,高速低温离心机购自美国贝克曼库尔特公司。
1.3 IGSF9-ECD-His蛋白制备 将human-IGSF9基因合成,亚克隆至pcDNA3.1(-)表达载体。以构建好的human-IGSF9蛋白质粒为模板进行分子克隆获得human-IGSF9-ECD蛋白质粒。设计目标蛋白序列,通过分子克隆构建新的表达载体,质粒提取,进行表达鉴定。将质粒瞬时转染HEK293/CHO细胞,扩大培养。收集细胞上清,进行蛋白亲和层析纯化。纯化的蛋白通过SDS聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)和Western blotting验证。配置8%凝胶;电泳;考马斯亮蓝染色;脱色液脱色。 配置10%凝胶;电泳;转膜;封闭;一抗孵育(anti-His抗体 1∶2 000);洗膜;二抗孵育;洗膜;曝光。
IGSF9-ECD-His目标蛋白序列(信号肽,C-His标签)为:

1MVWCLGLAVLSLVISQGADGRGKPEVVSVVGRAGESVVLGCDLLPPAGRPPLHVIEWLRF61GFLLPIFIQFGLYSPRIDPDYVGRVRLQKGASLQIEGLRVEDQGWYECRVFFLDQHIPED121DFANGSWVHLTVNSPPQFQETPPAVL EVQELEPVTLRCVARGSPLPHVTWKLRGKDLGQG181QGQVQVQNGTLRIRRVERGSSGVYTCQASSTEGSATHATQLLVLGPPVIVVPPKNSTVNA241SQDVSLACHAEAYPANLTYSWFQDNINVFHISRLQPRVRILVDGSLRLLATQPDDAGCYT301CVPSNGLLHPPSASAYLTVLYPAQVTAMPPETPLPIGMPGVIRCPVRANPPLLFVSWTKD361GKALQLDKFPGWSQGTEGSLIIALGNEDALGEYSCTPYNSLGTAGPSPVTRVLLKAPPAF421IERPKEEYFQEVGRELLIPCSAQGDPPPVVSWTKVGRGLQGQAQVDSNSSLILRPLTKEA481HGHWECSASNAVARVATSTNVYVLGTSPHVVTNVSVVALPKGANVSWEPGFDGGYLQRFS541VWYTPLAKRPDRMHHDWVSLAVPVGAAHLLVPGLQPHTQYQFSVLAQNKLGSGPFSEIVL601SAPEGLPTTPAAPGLPPTEIPPPLSPPRGLVAVRTPRGVLLHWDPPELVPKRLDGYVLEG661RQGSQGWEVLDPAVAGTETELLVPGLIKDVLYEFRLVAFAGSFVSDPSNTANVSTSGLEV721YPSRTQLPGLHHHHHH
1.4 抗体的制备及筛选
1.4.1 免疫BALB/c小鼠 将Human-IGSF9-ECD-His蛋白与弗氏佐剂混合,皮下注射6周龄雌性BALB/c小鼠(50 μg/只),每2周免疫1次,免疫4次后,采血,分离血清。
1.4.2 ELISA检测小鼠血清效价 ELISA检测小鼠血清针对Human-IGSF9-ECD-His蛋白的效价。
1.4.3 流式细胞仪检测小鼠血清特异性 检测小鼠血清与THP-1-igsf9-WT细胞和THP-1-igsf9-KO细胞结合能力。
多式联运步伐加快。珠航局通过优化多式联运体系,推广珠江三角洲集装箱运输“陆改水”工程,实施大宗货物绿色运输北江示范项目,不断完善主要港区与干线铁路、高等级公路的连接,打通港口集疏运“最后一公里”,加快推进铁公水和江海联运等多式联运发展;研究建立西江航运干线船舶大气污染物排放控制区,开展船舶排放控制区船舶污染监测监管能力建设。
1.4.4 T细胞共培养筛选阻断型抗血清 常规培养THP-1细胞,计数后的细胞(2.5×104细胞/孔)用X-ray(28 Gy)进行照射。在10 % FBS的RPMI 1 640培养基中加入IL2和CD3/CD28 coated beads,重悬CFSE染色的正常人外周血CD3+T 细胞(5×104细胞/孔),加入U型96孔板。分为阴性对照组、阳性对照组以及实验组。在实验组孔中加入小鼠血清,5 d后显微镜下观察抗血清的阻断效应。
1.4.5 细胞融合 取小鼠脾脏,制备成单细胞悬液,与骨髓瘤细胞等比例混匀,在融合池中电融合,加入HAT DMEM培养基,将细胞均匀铺到96孔板中培养10 d后筛选检测。
1.4.6 ELISA筛选融合细胞 ELISA筛选效价高的融合细胞上清。
1.4.7 流式细胞仪检测融合细胞上清特异性 检测ELISA筛选后的融合细胞上清与THP-1-igsf9-WT细胞的结合能力。
1.4.8 T细胞共培养筛选融合细胞 用加入IL2、CD3/CD28 beads和10 % FBS的RPMI 1 640培养基重悬正常人外周血CD3+T细胞,加入到U型96孔板阳性对照组,将human-IGSF9-ECD-His蛋白和融合细胞上清加入到相应实验组孔,5 d后显微镜下观察融合细胞上清的阻断效应。
1.4.9 细胞亚克隆制备 4倍稀释融合细胞悬液,均匀加入到96孔板中,7~10 d后挑出阳性单克隆细胞,扩大培养定株。
1.4.10 细胞亚克隆筛选 同融合细胞筛选步骤一致。
1.5 抗体的获取、纯化及浓缩
1.5.1 抗体获取 将1×107筛选后的亚克隆细胞腹腔注射BALB/c小鼠,15 d左右取小鼠腹水,用0.2 μm滤器过滤,用结合缓冲液按照1∶1比例稀释腹水。
1.5.2 平衡纯化柱 用10倍柱体积的结合缓冲液平衡纯化柱。
1.5.3 样品结合 混匀稀释的样品,从纯化柱的上端加入,重复2遍上样。
1.5.4 洗涤 待样品结合后,用20倍柱体积的结合缓冲液洗涤纯化柱。
1.5.5 洗脱和中和 在收集管中加入中和缓冲液,按5倍柱体积的洗脱液洗脱结合的抗体。
1.5.6 纯化柱再生 用5倍柱体积的洗脱液洗涤纯化柱,用5倍柱体积的去离子水洗涤纯化柱,最后保存在等体积的保存液中,4 ℃保存。
1.5.7 纯化样品检测 将纯化的蛋白用SDS-PAGE进行检测。
1.5.8 抗体浓缩 将纯化的抗体加入浓缩柱中,以5 000 rpm/min的转速离心15 min,加入PBS置换。
1.6 ELISA检测TNF-α和IFN-γ
1.6.1 TNF-α检测 将所需试剂平衡到室温,按要求准备试剂、工作标准品、样品。将50 μL标准品和样品加入相应的孔,每孔加入50 μL Antibody Cocktail,室温孵育1 h,Wash Buffer PT 清洗每孔,加入TMB显影液,避光孵育10 min,加入100 μL终止液,反应1 min,酶标仪450 nm处读取OD值。
1.6.2 IFN-γ检测 实验前将所需试剂平衡到室温,配置所需试剂及样品。将100 μL标准品、样品、对照溶液加入对应的孔,每孔加入50 μL生物素化的anti-IFN-γ,室温孵育2 h。每孔加入Wash Buffer清洗,加入100 μL 1×Streptavidin-HRP,室温避光孵育30 min。加入TMB显色液,室温避光孵育15~20 min。加入100 μL终止液,酶标仪450 nm处读取OD值。
1.7 统计学方法 应用GraphPad Prism8进行统计学分析。定量资料采用t检验和方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 IGSF9-ECD-His蛋白的制备及鉴定 本研究制备了带有His标签的人IGSF9胞外区蛋白(human-IGSF9-ECD-His)。SDS-PAGE和Western blotting结果都表明:在100 KD有非常明显的单一条带,与预期蛋白分子量一致,总共获取5 mg IGSF9-ECD-His蛋白(图1A);接下来,本研究向T细胞培养体系中,加入1 μg IGSF9-ECD-His蛋白,发现IGSF9-ECD-His蛋白能够显著抑制CD3+T细胞增殖(图1B)。
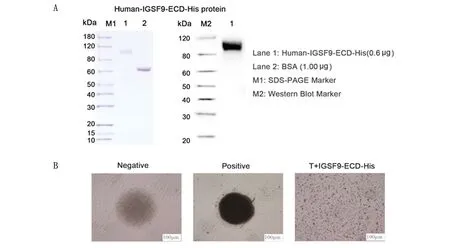
A. Human-IGSF9-ECD-His蛋白的SDS-PAGE和Western blotting验证结果;B. 活化的CD3+ T在含有10% FBS、IL-2和CD3/CD28 coated beads的1640培养基中与1 μg IGSF9-ECD-His蛋白孵育。Negative. 只有CD3+ T细胞;Positive. 加入IL-2和CD3/CD28 coated beads的CD3+ T细胞;T+IGSF9-ECD-His. 在加入IL-2和CD3/CD28 coated beads的CD3+ T细胞中加入Human-IGSF9-ECD-His蛋白。
2.2 小鼠抗血清效价筛选以及流式细胞仪检测抗血清特异性 本研究取免疫4次后的BALB/c小鼠血清,ELISA结果显示,抗血清效价为1∶364 500,这表明,5只小鼠都产生了高效价的抗体(表1)。

表1 鼠抗血清效价ELISA检测结果
流式细胞仪检测小鼠血清的特异性,结果显示:5只小鼠血清都可以和THP-1-igsf9-WT细胞结合,而不与THP-1-igsf9-KO细胞结合(图2A)。将抗血清加入T细胞和THP-1细胞的共培养体系中,结果显示:5只小鼠血清都可以逆转THP-1对T细胞的增殖抑制(图2B)。这表明,5只小鼠的血清都具有明显的阻断效应。
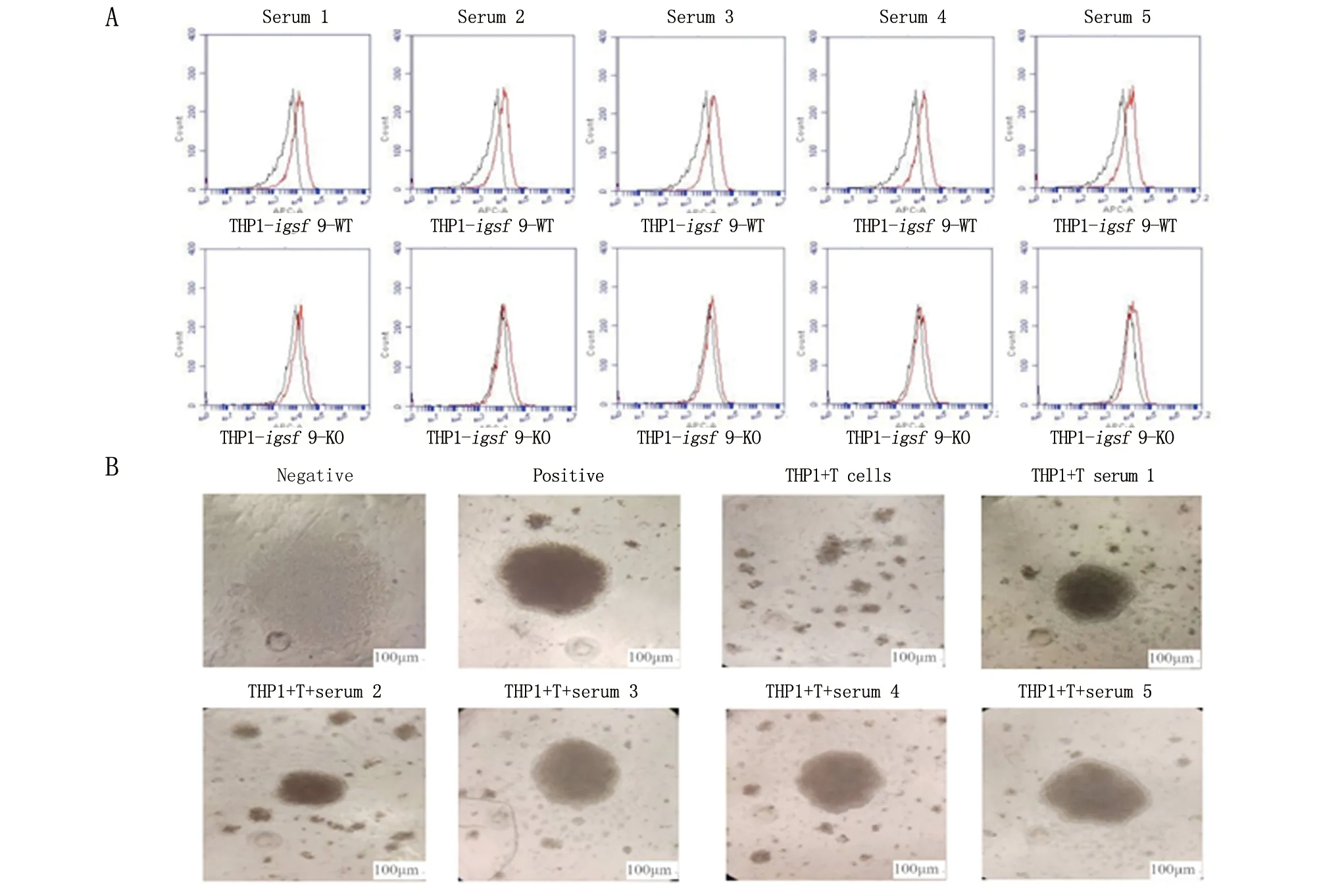
A. 流式细胞仪检测被免疫小鼠的血清与THP-1-igsf 9-WT和-igsf 9-KO细胞结合能力;B. 向加入IL-2和CD3/CD28 coated beads的CD3+ T细胞与辐照后的THP-1细胞共培养体系中加入小鼠的血清。Negative. 只有CD3+ T细胞;Positive. 加入IL-2和CD3/CD28 coated beads的CD3+ T细胞;THP-1+T cells. 在加入IL-2和CD3/CD28 coated beads的CD3+ T细胞与辐照后的THP-1细胞共培养;THP-1+T+serum. 在THP-1细胞和T细胞共培养体系中加入小鼠血清。
2.3 融合细胞上清的效价及特异性 本研究分离小鼠脾脏细胞,与多发性骨髓瘤细胞SP2/0进行融合,通过ELISA检测,获得了64株阳性细胞株。从64株ELISA检测阳性的上清中,筛选可以用于流式检测的上清,最终获取6株阳性融合细胞的上清能够用于流式细胞仪检测(图3A),并且这6株融合细胞上清都能逆转IGSF9-ECD对T细胞的增殖抑制(图3B)。
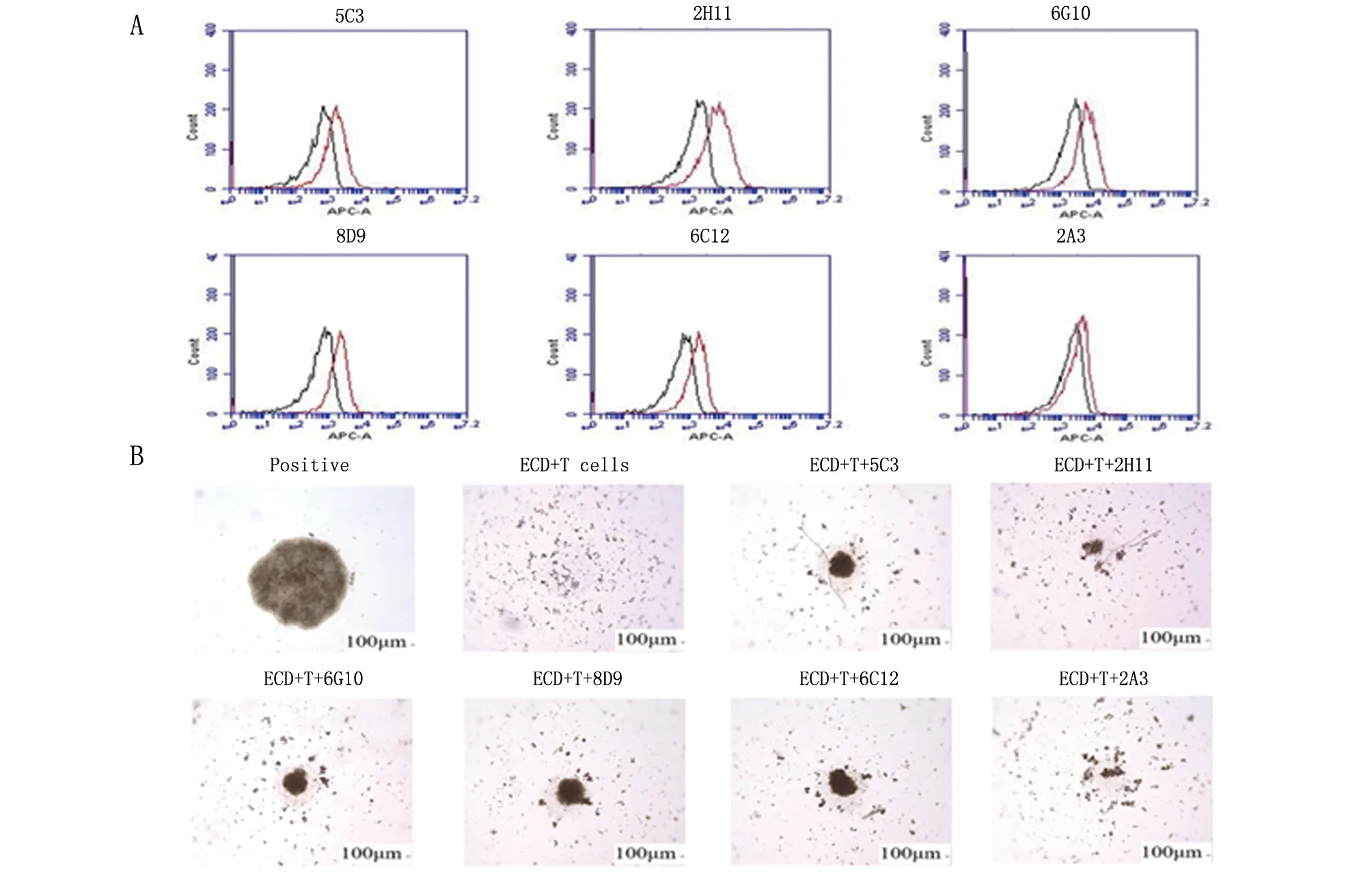
A. 从64组ELISA阳性的细胞上清中筛选出可以和THP-1-igsf 9-WT细胞结合的6组阳性融合细胞上清;B. 将融合细胞上清加入Human-IGSF9-ECD-His蛋白与T细胞共培养体系中,验证融合细胞上清阻断效果。
2.4 单克隆细胞上清阻断IGSF9介导的T细胞增殖抑制 本研究选择克隆号5C3融合细胞进一步亚克隆,最终获取5株亚克隆细胞的上清能够结合THP-1-igsf9-WT细胞,克隆号分别是5C3-1A4,5C3-1B2,5C3-1C12,5C3-2B2,5C3-2B8。T细胞共培养结果显示5株亚克隆细胞上清能够逆转IGSF9-ECD蛋白对T细胞的增殖抑制,其中5C3-1A4是阻断型效果最好的一株单克隆细胞(图4)。因此,本研究最终选择5C3-1A4细胞制备靶向IGSF9的单克隆抗体。
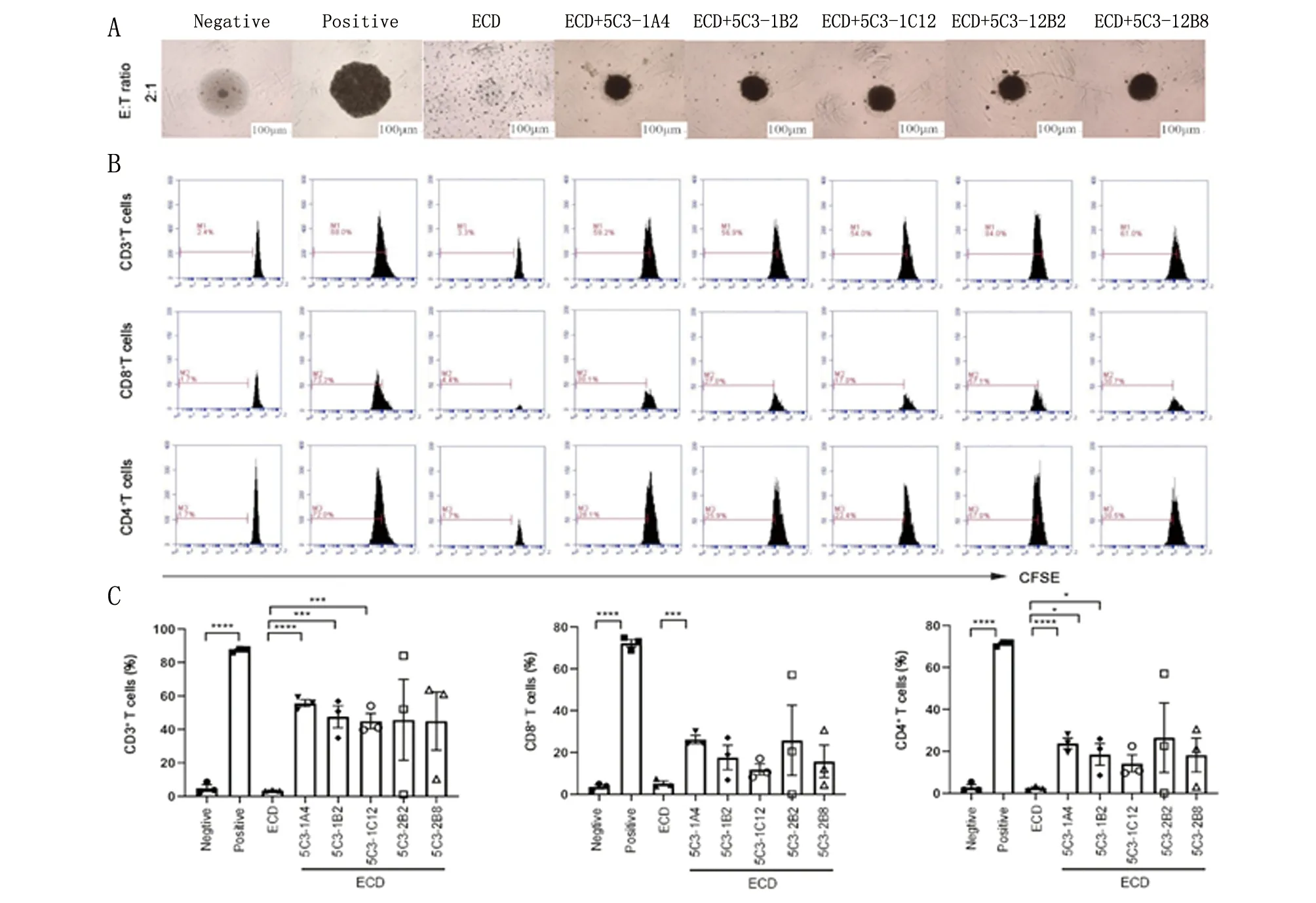
A. 从5C3亚克隆细胞中获得的单克隆抗体加入到Human-IGSF9-ECD-His蛋白与T细胞共培养体系中5 d后的显微镜下图像;B~C. 流式细胞仪检测CD3+ T细胞、CD8+ T细胞、CD4+ T细胞的增殖,CFSE的稀释代表T细胞的增殖。
2.5 单克隆细胞上清促进T细胞分泌IFN-γ和TNF-α 本研究将IGSF9抗体(5C3-1A4)加入到T细胞和THP-1细胞共培养体系中,检测上清中IFN-γ和TNF-α水平,结果显示:IGSF9抗体显著恢复了T细胞增殖,并且增加了IFN-γ和TNF-α水平(图5)。
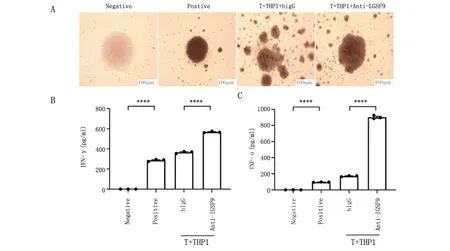
A. Anti-IGSF9和hIgG(human IgG)加入到T细胞和THP-1细胞共培养体系中5 d后的显微镜下图像;B. ELISA检测细胞上清中IFN-γ水平;C. ELISA检测细胞上清中TNF-α水平。****P<0.0001。
3 讨论
抗肿瘤免疫反应已成为癌症免疫治疗的基本策略。阻断PD-1/PD-L1信号通路为肿瘤免疫治疗从增强到正常化开启了新时期[7]。在这个过程中,由于肿瘤微环境的复杂性,许多障碍阻碍了免疫正常化的发展[8],因此发现新的肿瘤特异性免疫检查点并且揭示新的作用机制将是科研工作者和临床医师面临的巨大挑战。
IGSF9作为一种神经粘附分子,表达在胚胎神经系统,能够抑制神经突触的发育[9]。本课题组在前期研究中阐明了IGSF9在肿瘤以及肿瘤浸润的免疫细胞上的表达模式,发现了IGSF9在患者肿瘤标本中有表达,而在正常标本中没有检测到,本研究在荷瘤小鼠上观察到了同样的结果,所以本研究断定在肿瘤微环境中,IGSF9能够被未知的因子诱导,并且可以成为免疫治疗正常化策略中新的免疫检查靶点。IGSF9首次作为一个免疫抑制分子被报道,能够通过抑制T细胞增殖促进肿瘤免疫逃避。当肿瘤发生时,PD-L1可以被IFN-γ诱导,PD-L1和T细胞上的PD-1相互作用进而抑制T细胞增殖,同时,IGSF9也被未知因子诱导,和T细胞膜表面的未知蛋白结合进而抑制T细胞增殖。所以,本研究假设,IGSF9促进肿瘤逃避的机制是否与PD-L1和PD-1相互作用机制有相似之处。
在过去的十年里,癌症免疫治疗取得了前所未有的进展。免疫检查点抑制剂(ICIs)这一类新型药物是癌症免疫治疗领域研究的重点。到目前为止,最广泛使用的ICIs是靶向免疫抑制受体(如CTLA-4、PD-1和PD-L1)的阻断抗体,能够恢复患者免疫系统的抗肿瘤应答,延长患者生存期[10]。尽管一些患者经过ICIs治疗后,经历了显著的肿瘤消退,但大多数患者对这些治疗并无反应,甚至出现免疫相关的副作用[11]。在本研究中,anti-IGSF9作为一种新的免疫检查点抑制剂,显著恢复了T细胞增殖抑制,为肿瘤免疫治疗药物的研发以及临床上的应用奠定了基础。
随着临床试验证明,联合治疗具有较好的无进展生存期和总生存期。Anti-PD-1或anti-PD-L1单药疗法已被批准用于10多种癌症类型的治疗[12],客观有效率为15%~20%[13]。Anti-PD-1和anti-CTLA4联合应用用于晚期黑色素瘤、晚期非小细胞肺癌、肾细胞癌和结直肠癌的治疗[14],但肿瘤患者类型还存在一定的局限性,所以anti-IGSF9和anti-PD-1的联用可能考虑成为今后癌症免疫治疗一项新的策略。
综上所述,本研究制备了靶向IGSF9的单克隆抗体,并验证了其可以恢复IGSF9对T细胞的抑制,并且anti-IGSF9和anti-PD-1的联合应用可以考虑作为一种新的临床治疗策略。
