电化学溶铂制备氯铂酸工业应用研究
2022-09-07许浩洋
许浩洋,夏 鹏
(1. 中国石化催化剂有限公司 北京奥达分公司,北京 101111;2. 中国石化催化剂有限公司 长岭分公司,湖南 岳阳 414000)
铂是一种重要的铂族金属,被广泛应用于汽车、电子、电池、医药、石油化工等领域[1]。氯铂酸作为重要的铂基化合物之一,可用于制备催化剂[2-5]、化学电极[6-7]、分析化学试剂[8]等。铂溶解制备氯铂酸主要有化学溶解法[9-12]和电化学溶解法[13]。化学溶解法主要以盐酸为溶剂,加入氧化剂。常用的氧化剂有硝酸、H2O2[11]、Cl2[9]等,其中,以盐酸和硝酸形成体积比为3∶1 的王水溶解铂应用最广泛,在加热条件下,王水与铂反应生成氯铂酸,铂溶解后向溶液中分批次加入盐酸进行赶硝,除去硝酸根。王水溶解铂制备氯铂酸具有操作性强、溶解速率快等特点,但盐酸和硝酸消耗量大,且排放NOx多,对环境造成污染[14-15]。电化学溶解法是通过电解液使金属铂阳极发生溶出反应而溶解。铂溶解效果主要与电流密度、电解质、时间等因素有关。电化学溶铂制备氯铂酸具有反应稳定、安全性高、酸量消耗少等特点,但也存在溶解速率慢和溶解不彻底等问题。
本工作介绍了电化学溶铂制备氯铂酸工业试验装置的运行情况,考察了电流密度、盐酸浓度、硝酸浓度和溶解时间对铂溶解效果的影响,采用沉淀法分析了氯铂酸溶液中铂的含量,并将电化学溶铂与王水溶铂情况进行了对比。
1 实验部分
1.1 主要试剂和仪器
铂块:纯度99.99%(w),徐州浩通新材料科技股份有限公司;盐酸、硝酸:GR,长沙汇虹化玻仪器设备有限公司;无水乙醇:GR,西陇科学股份有限公司;氯化铵:AR,国药集团化学试剂公司。
ML204/02 型电子天平:梅特勒-托利多公司;SX2-4-10 型马弗炉:长沙市远东电炉有限责任公司;YB2-112M-2 型真空泵:江苏新大力电机公司。
1.2 工业试验装置及溶铂原理
交流电电化学溶解铂的电解工业试验装置流程见图1。首先在自制的以聚四氟乙烯为材质的电解槽内加入浓盐酸和少量的硝酸,然后在电解槽内竖直插上厚度均匀的铂片,再将交流电电源通过接触调变器由外围覆盖有绝缘层的石墨电极上部接入,进行电化学溶解。溶解过程中产生的气体经冷凝器冷凝,再经水环式真空泵抽出。

图1 电化学溶铂制备氯铂酸工业装置Fig.1 Industrial plant for the preparation of chloroplatinic acid by electrochemical dissolution of platinum.
交流电溶铂原理:以待溶解的铂为电极、盐酸为电解质溶液,当电流通过电解液时,金属阳电极上的铂发生溶出反应生成Pt4+,Pt4+与溶液中的阴离子Cl-形成络合离子,不在阴极上析出,形成的络合离子再与溶液中的H+形成H2PtCl6。
1.3 溶铂操作步骤
将铂块称重,压轧成厚度均匀的铂片,然后切割成片,并用净水和无水乙醇洗净。将洗净后的铂片插至格栅上,格栅放入电解槽中,在电解槽中加入适量的去离子水、盐酸和硝酸,接通电流,调节调变器达到设定的电压和电流后开始电解,电解过程产生的尾气通过真空泵抽走,电解一定时间后停止,将电解槽中的电解液抽入到储罐中,并用去离子水冲洗电解槽,洗液同样抽入到储罐中,对未电解完的铂片进行称重。
1.4 铂含量分析
采用氯化铵与氯铂酸反应生成沉淀物的分析方法对铂含量进行分析。首先用称量瓶从溶解好的氯铂酸溶液中称取氯铂酸溶液,并将溶液转入到坩埚中,再向溶液中加入过量的氯化铵,氯铂酸与氯化铵反应形成沉淀物氯铂酸铵,将盛反应液的坩埚放在红外灯下烘烤,用玻璃棒适当搅拌以提高烘烤速率,待挥发量较小且溶液基本烤干时停止烘烤。将坩埚移至马弗炉内,升温至350 ℃恒温1 h 后,再升温至700 ℃恒温1 h,冷却后从马弗炉取出,称取铂粉重量,并计算对应的氯铂酸溶液铂的含量。铂溶解速率是指铂通过电化学溶解,单位时间内溶解的铂量。铂溶解率为一定量的铂金溶解一定时间后,溶解铂的量与投入的总铂量的百分比。
2 结果与讨论
2.1 电流密度对铂溶解速率的影响
电流密度对铂溶解速率的影响见图2。
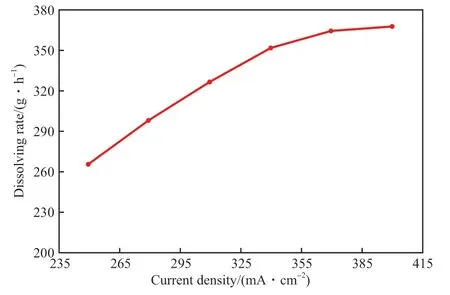
图2 电流密度对铂溶解速率的影响Fig.2 Influence of current density on platinum dissolving rate.
从图2 可看出,随着电流密度的增加,铂溶解速率增加,但当电流密度大于355 mA/cm2时,铂溶解速率增幅减缓,这是因为电解液的电导率和电极的接触面积是一定的,电流密度增加会导致电解槽电压增高,当超过一定值后,电解槽中水的电解导致电极上电解出大量气体,从而影响了铂的电解溶出。
2.2 盐酸浓度对溶解效率的影响
盐酸浓度对铂溶解效率的影响见图3。从图3可看出,随盐酸浓度的增加,铂溶解速率先增加后降低,在盐酸浓度为8 mol/L 时,铂溶解速率最大。随着盐酸浓度的增加,溶液中氯离子浓度增加,氯离子可以与溶解的铂形成稳定的氯铂配合物PtCl62-。铂溶解率随着盐酸浓度的增加而降低,这可能是因为盐酸浓度增大,电解质溶液导电率提高,促进了进入溶液的含铂离子在阴极的还原析出,从而影响铂的溶解率。由此可知,盐酸浓度在7 ~8 mol/L 时,可以获得较理想的铂溶解速率和溶解率。

图3 盐酸浓度对铂溶解效率的影响Fig.3 Influence of HCl concentration on dissolution efficiency of platinum.
2.3 硝酸浓度对铂溶解效率的影响
定期向电解槽中添加适量的硝酸,可以有效加快铂的溶解速率和溶解率,硝酸浓度对铂溶解效率的影响见图4。从图4 可知,随着硝酸浓度的增加铂溶解速率增加,但当硝酸浓度大于1.5 mol/L 时,铂溶解速率的增加并不明显,这可能是因为NO3-与Cl-均为阴离子,随硝酸浓度的增加,NO3-与Cl-浓度比增大,不利于铂离子与Cl-络合形成PtCl62-,同时硝酸浓度增加,过量硝酸产生大量NOx气体,给铂的溶解带来消极影响。
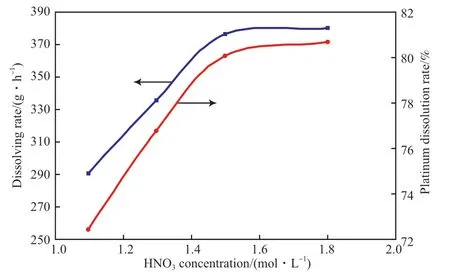
图4 硝酸浓度对铂溶解效率的影响Fig.4 Influence of HNO3 concentration on dissolution efficiency of platinum.
2.4 溶解时间对铂溶解效率的影响
溶解时间对铂溶解效率的影响见表1。从表1可知,随着溶解时间的延长,铂溶解速率先增加后降低,当溶解时间大于15.5 h 时,铂溶解速率降幅较大,铂溶解率增幅较小。这可能是因为:一方面随着电解时间的延长,电极附近积累的氯铂酸浓度增加,而有效的氯离子浓度在电解消耗及挥发的双重作用下降低,于是电解槽中铂的放电倾向性减弱,电解速率也逐渐降低;另一方面,电解时间延长,阳极钝化现象表现较突出,影响了铂的电解。当溶解时间为15.5 h,铂溶解速率较快,氯铂酸制备效率较高。
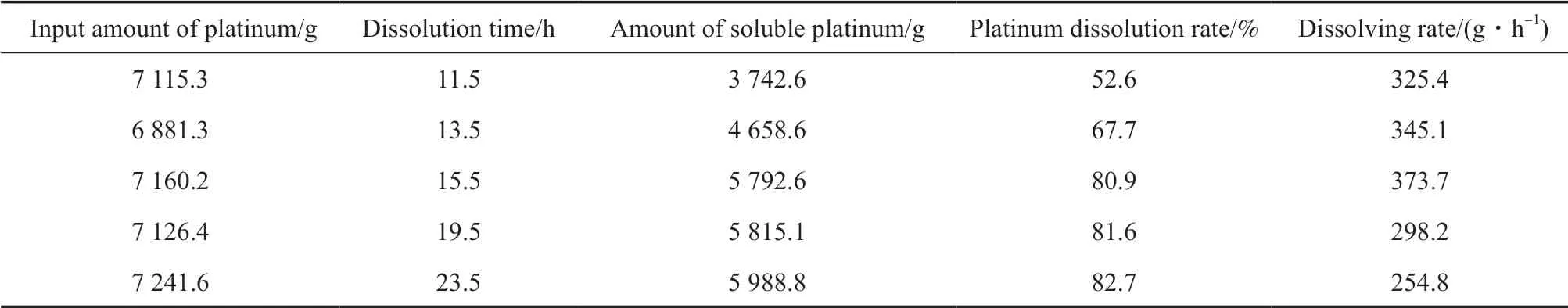
表1 溶解时间对铂溶解效率的影响 Table 1 Effect of dissolution time on dissolution efficiency of platinum
2.5 铂含量分析
尽管电化学溶铂效率较高,但不能完全溶解,特别是工业生产中溶解铂的量大,导致剩余几千克的铂,而这些剩余铂已变成粉粒,不易回收,由此需准确分析氯铂酸溶液铂的含量,从而将溶解的氯铂酸进行工业应用。氯铂酸溶液铂含量分析结果见表2。标准浓度氯铂酸溶液由王水与铂在加热的状态下将铂完全溶解制备。从表2 可知,氯铂酸溶液中的铂含量与标准溶液中铂的含量相比,分析偏差小于0.04%,说明分析方法可靠、准确,采用沉淀法完全可以分析氯铂酸溶液中铂的含量。
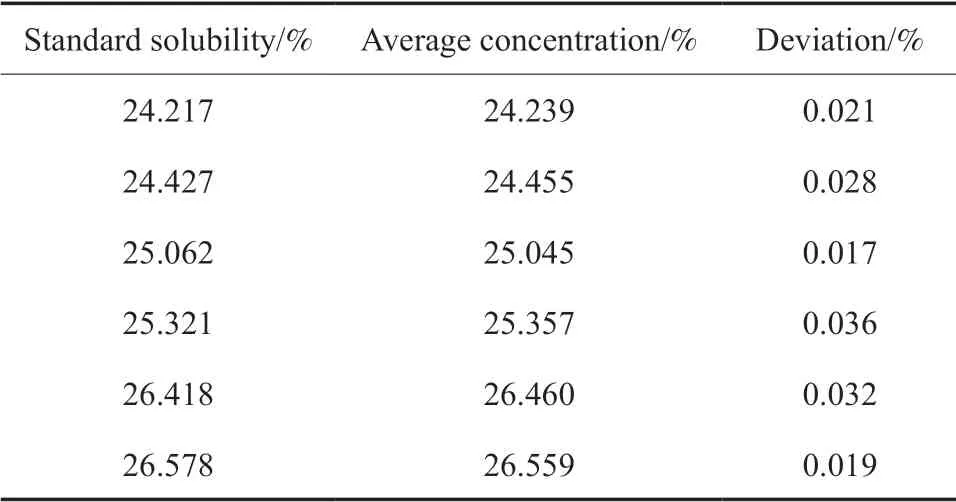
表2 氯铂酸溶液的铂含量分析结果Table 2 Analysis results of platinum content in chloroplatinic acid solution
2.6 电化学溶铂所得氯铂酸的应用及评价
以本装置所制得的氯铂酸为前体制备连续重整催化剂,在微型反应装置上,以石脑油为原料,填装3 mL 催化剂,对催化剂进行活性评价,结果见表3。从表3 可知,制备的催化剂的催化性能与标准催化剂的催化性能基本相当。

表3 催化剂活性评价结果Table 3 Evaluation results of catalytic activity of catalyst
2.7 电化学溶铂与王水溶铂对比
将最优条件(电流密度355 mA/cm2、盐酸浓度为7 ~8 mol/L、硝酸浓度为1.5 mol/L)下的电化学溶铂情况与王水溶铂情况进行对比,结果见表4。从表4 可看出,与王水溶铂相比,电化学溶铂速率降低了约14%,铂溶解不完全,但电化学溶铂的盐酸和硝酸消耗量少,其中,盐酸消耗量减少约11%,硝酸消耗量减少64%。由此可见,采用电化学溶铂消耗的盐酸和硝酸降低了,相应产生的尾气量也减少了,具有较好的经济效益和社会效益。

表4 电化学溶铂与王水溶铂的对比Table 4 Comparison of electrochemically dissolution of platinum and dissolution of platinum with aqua regia
3 结论
1)工业交流电电化学溶铂制备氯铂酸的最优条件为:电流密度为355 mA/cm2、盐酸浓度为7 ~8 mol/L、硝酸浓度为1.5 mol/L、溶解时间为15.5 h。
2)采用沉淀法对氯铂酸溶液中的铂含量进行分析,与标准氯铂酸溶液进行对比,分析结果的偏差小于0.04%,可以用于氯铂酸铂含量的快速分析。
3)以石脑油为原料,电化学溶铂制备的氯铂酸为前体制备的连续重整催化剂与标准催化剂相比,催化性能相当。
4)与王水法溶铂相比,电化学溶铂制备氯铂酸降低了盐酸和硝酸用量,减少了尾气量,具有较好的经济效益和社会效益。
