敲降同源异型盒C8对7因子诱导的体细胞重编程的抑制作用
2022-09-07黄依方仕才王波明金李陈裴端卿
黄依,方仕才,王波,明金,李陈,裴端卿*
(1.广州医科大学-中国科学院广州生物医药与健康研究院联合生命科学学院,广州 511436;2.中国科学院广州生物医药与健康研究院,广州 510530;3.生物岛实验室(广州再生医学与健康广东省实验室),广州 510530)
2006 年,日本科学家山中伸弥研究发现,在小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)中过表达4个转录因子OCT4、SOX2、KLF4、C-MYC(OSKM),可将该成纤维细胞诱导为多能干细胞(induced pluripotent stem cells,iPSCs)[1]。随着研究深入和技术迭代,出现了非OSKM因子诱导[2]、小分子化合物诱导[3]、小分子化合物结合转录因子诱导[4]等方法。这些诱导方法不仅为细胞命运转变提供了更多研究模型,也有助于通过比较系统之间的差异来全面认识细胞命运转变的本质规律。2019 年,本实验室报道了7 因子(Jdp2-Jhdm1b-Mkk6-Glis1-Nanog-Esrrb-Sall4)重编程体系,并发现同源异型盒(homeobox,Hox)基因家族在7 因子重编程中表达上调[5]。但该家族基因在7 因子重编程中的具体作用仍然未知。
在小鼠胚胎发育过程中,Hox基因家族对足趾形成及其附件形态发生具有重要调控作用[6-8]。Hox-9、Hox-10和Hox-11直系或旁系同源物的表达可定义轴向受限的脊髓小脑束神经元的位置[9]。Hoxc8突变可导致小鼠胚胎后足骨骼发育畸形[10]。在癌症发展过程中,Hox基因家族同样扮演重要角色,既可充当转录激活因子,也可充当转录抑制因子[11]。在多种肿瘤细胞中,Hoxc8异常高表达,且可促进肿瘤细胞侵袭和迁移,产生较差的预后[12-14]。同时,Hoxc8在此过程中极大地促进了肿瘤细胞的增殖[15-16]。在神经胶质瘤细胞中,敲降Hoxc8可显著抑制U251 与LN229 细胞系的增殖,同时降低上皮-间质转化(epithelial-mesenchymal transition,EMT)过程中相关基因的蛋白水平和肿瘤细胞的迁移能力[17]。总之,Hox基因家族在胚胎发育与肿瘤发生发展中扮演着重要角色,其中Hoxc8对细胞的增殖促进尤为显著,但它在多能性网络重建等细胞命运转变过程中的作用尚未见报道。本研究通过短发夹RNA(short hairpin RNA,shRNA)抑制Hoxc8的表达可显著抑制7 因子诱导的体细胞重编程,表明Hoxc8在体细胞重编程中具有重要的作用,并且初步探索了与其相关的机制,旨在为深入揭示Hoxc8调控细胞命运转变的机制提供参考。
1 材料与方法
1.1 细胞株及培养基
Plat-E、OG2-MEF、293T 细胞株均来源于笔者所在实验室,其中OG2-MEF 由携带Oct4-GFP等位基因的CBA/CaJ×C57BL/6J 雄鼠与129S4/SvJaeJ雌鼠杂交后从怀孕13.5 d 小鼠的胚胎中分离得到。10%胎牛血清(fetal bovine serum, FBS)培养基:由DMEM(Dulbecco’s modified Eagle medium)高糖基础培养基(美国HyClone 公司,货号SH30022.01)、10%胎牛血清(阿根廷Natocor公司,货号SFBE)、1/100非必需氨基酸(美国Gibco 公司,货号11140076)、1/100 Glutmax(美国Gibco 公司,货号35050079)组成。iPSCs 合成培养基1(iPSCs chemically defined medium 1,iCD1):笔者所在实验室专利,详细配方参见文献[4]。
1.2 实验材料及试剂
pMX-Jdp2、pMX-Glis1、pMX-Esrrb、pMX-Sall4、pMX-Jhdm1b、pMX-Nanog、pMX-Mkk6、pMX-Hoxc8、pMX-Smad6、pGL3-basic、pTK-Renilla,以 及 含DsRed、shLuciferase的质粒(由笔者所在实验室提供);CaCl2溶液和2×HBS 试剂(实验室内配制);质粒小提试剂盒[天根生化科技(北京)有限公司,货号DP103-03];质粒大提试剂盒[天根生化科技(北京)有限公司,货号P1156-03];SYBR Green荧光染料(ChamQ SYBR qPCR Master Mix,南京诺唯赞生物科技股份有限公司,货号Q311-02);双萤光素酶报告基因系统(Dual-Luciferase ReporterAssay System,美国Promega公司,货号E1910)。
1.3 pSuper-shRNA 的构建
通过Sigma-Aldrich网站(https://www.sigmaaldrich.cn)挑选已验证过的shRNA 序列,针对Hoxc8和Smad6同时设计2 条shRNA,送至广州艾基生物技术有限公司合成,对合成的shRNA 引物退火后,使用BglⅡ和HindⅢ对反转录病毒载体pSuper进行双酶切,然后将退火后的引物与酶切后的pSuper载体进行酶连,并转化至大肠埃希菌DH5α中,挑单菌落进行测序,经检测正确后提取质粒,命名为pSupershRNA。实验中使用的引物序列如下:shHoxc8-610,CGAAGGACAAGGCCACTTAAA;shHoxc8-698,CGACAAACTTACAGCCGGTAT;shSmad6-526,CCGATTCTACATTGTCTTACA;shSmad6-527,GCTGGAGATCCTACTCAACAA。
1.4 细胞培养和shRNA 敲降效率检测
Plat-E、OG2-MEF 细胞株均使用10% FBS 培养基,在5%CO2、37 ℃培养箱中培养。使用Plat-E细胞包装pSuper-shRNA 反转录病毒,分别在转染后36、48 h 收样,感染OG2-MEFs。在感染48 h 后加入嘌呤霉素(puromycin,Puro)进行抗性筛选,以未感染的OG2-MEFs 全部死亡为标准,收样,提取RNA,并检测Hoxc8和Smad6的表达水平。
1.5 细胞转染
转染前一天将8×106个Plat-E 细胞接种至含10%FBS培养基的培养皿(直径100 mm)中,保证第2 天转染时其密度约为80%。对7 因子正式开始转染前先更换7.5 mL 新鲜的10% FBS 培养基,并在15 mL离心管中配制转染试剂[7 因子质粒使用量25 µg,依次加入2 mol/L CaCl2156.25µL(工作浓度为125 mmol/L)、2×HBS 1 250µL,最后加蒸馏水补足至2 500µL],将配制的转染试剂吹打混匀后逐滴加至培养皿中,微微摇晃混匀,在5%CO2、37 ℃培养箱中培养。转染后12~16 h 再次更换新鲜的10%FBS培养基,放入培养箱继续培养。
1.6 反转录病毒感染OG2-MEF和诱导多能干细胞
提 前12~16 h 将OG2-MEFs 以1.5×104个/孔接种到24 孔板中,使其完全贴壁。分别在36、48 h收集含Jdp2、Glis1、Esrrb、Sall4、Jhdm1b、Nanog、Mkk6基因的反转录病毒,并按1∶0.5∶1∶1∶1∶1∶1 混合,每孔加入0.25 mL 10%FBS 培养基及1.625 mL病毒混合液,再加入终质量浓度为4~8µg/mL的聚凝胺(polybrene),感染OG2-MEF 细胞。继续感染24 h 后,将病毒液吸尽,向每孔添加0.5 mL 新鲜配制的iCD1诱导培养基。以后每天定时更换iCD1诱导培养基,诱导7 d 后使用BioStation CT 4 倍物镜(日本尼康株式会社)对24孔板进行图像扫描,然后导出图像至计算机,使用Image J 软件(设定阈值65~255)对获得的图像中绿色荧光蛋白(green fluorescent protein, GFP)阳性克隆(Oct4-GFP+)进行计数,并与显微镜下人工计数进行匹配。
1.7 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)
弃去上述24 孔板中的培养基,在每孔中加入0.5 mL TRIzol 试 剂(美 国Invitrogen 公 司,货 号15596026),反复吹打至细胞完全裂解,然后将样品收集至1.5 mL离心管中,加入100µL三氯甲烷,漩涡混匀10 s 后于室温条件下放置5 min,然后以4 ℃、1.4×104r/min离心15 min。吸取上层水相至提前分装好并预冷的含400µL异丙醇的1.5 mL离心管中,混匀,在冰上放置10 min 后,以4 ℃、1.4×104r/min离心10 min,弃上清液,再用75%无水乙醇清洗沉淀,离心,弃上清液,在空气中晾干,加入适量的无RNA酶水溶解。测浓度后,取1µg RNA反转录成cDNA,使用SYBR Green荧光染料掺入法进行qRT-PCR扩增,检测在转录组水平上Hoxc8和Smad6的表达。
1.8 双萤光素酶报告基因系统的构建
选取SMAD家族成员6(SMAD family member 6,Smad6)转录起始位点前的2 kb 构建pGL3 质粒,引物序列为5'-GGTACCGAGCTCTTACGCGTCATC ACATAGTTACATGCCTCTCC-3'(上游),5'-AGTA CCGGAATGCCAAGCTTAGACACTTTGGCGGCT CC-3'(下游)。首先在24孔板中每孔加入1.0×106个293T 细胞、100 ng pGL3-Smad6启动子、1 ng pTKRenilla 和200 ng pMX-Hoxc8,在5% CO2、37 ℃培养箱中培养。接着在转染8~10 h 后更换新鲜的10% FBS 培养基,72 h 后加入100 µL 1×被动裂解缓冲液(passive lysis buffer,PLB),于室温条件下在摇床上振荡15 min,然后收集至1.5 mL 离心管中,以1.2×104r/min离心30 s。最后转到96孔板中,每孔加入20µL 裂解上清液和100µL 萤光素酶检测试剂Ⅱ(Luciferase Assay Reagent Ⅱ),上机检测其萤光素酶活性,读数值为L,再加入100 µL Stop&Glo试剂,读数值为R。萤光素酶活性改变趋势用L/R表示。
1.9 数据统计和分析
各组实验独立重复3次,结果以平均值±标准差表示,并采用GraphPad Prism 6.0软件对结果进行统计学差异分析。
2 结果与分析
2.1 敲降Hoxc8 抑制7 因子诱导的体细胞重编程
对敲降Hoxc8的shRNA效率进行检测,结果显示,与对照shLuciferase相比,2条shRNA即shHoxc8-610、shHoxc8-698 均具有显著的敲降效率(图1A)。整孔扫描结果显示,在7 因子诱导的体细胞重编程中敲降Hoxc8降低了Oct4-GFP 阳性克隆(Oct4-GFP+)数目(图1B~C)。
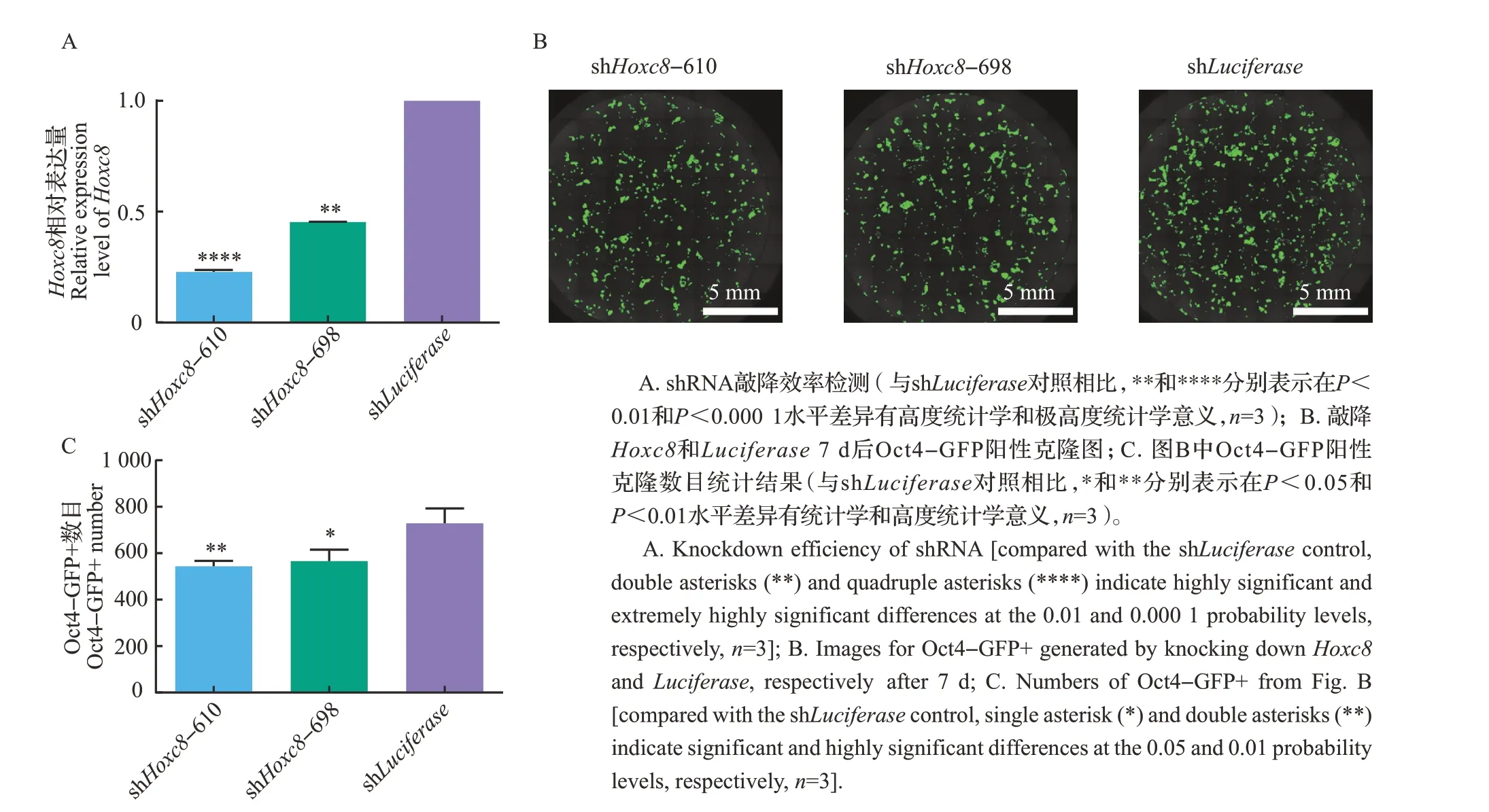
图1 敲降Hoxc8的结果Fig.1 Results of knocking down Hoxc8
2.2 过表达Hoxc8 对7 因子诱导的体细胞重编程无影响
从图2A~B 中可见,与对照DsRed相比,过表达Hoxc8对7 因子诱导的体细胞重编程无影响(P>0.05)。
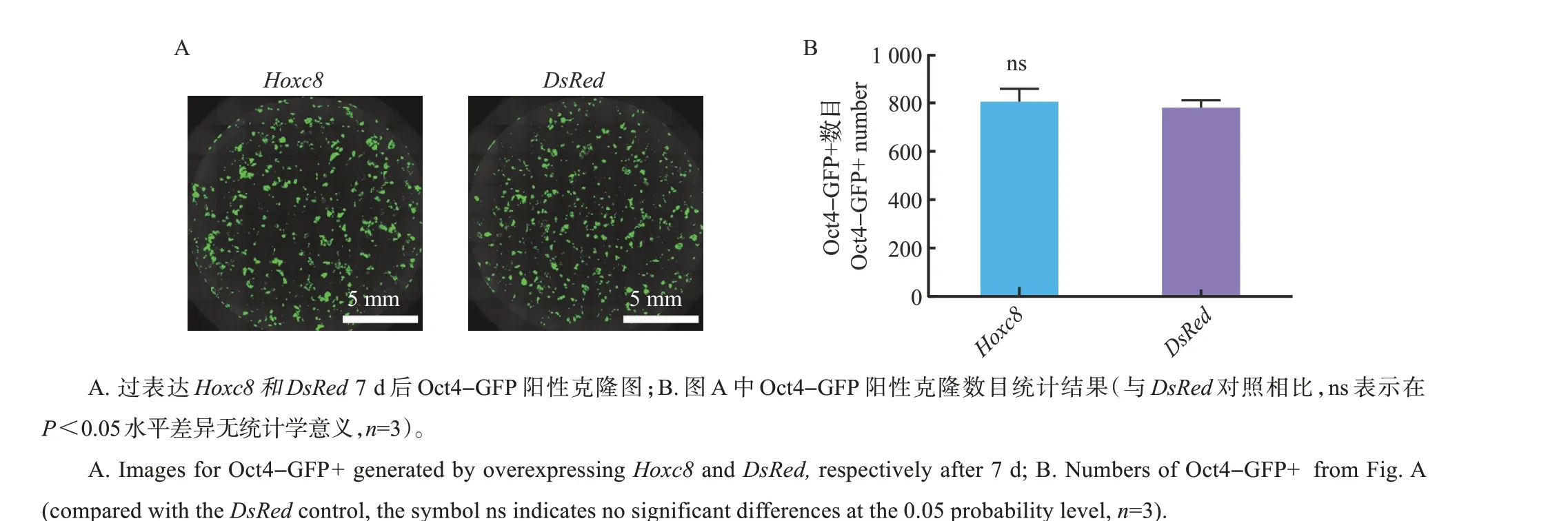
图2 过表达Hoxc8的结果Fig.2 Results of overexpressing Hoxc8
2.3 敲降Hoxc8 对经典的体细胞重编程分子事件无影响
为了进一步探究Hoxc8参与调控7因子诱导的体细胞重编程的分子机制,收集重编程过程中敲降Hoxc8第0、1、3、5、7天的细胞样品,利用qRT-PCR对已报道的体细胞重编程中关键分子事件进行检测。结果表明:首先,敲降Hoxc8不影响多能性标记基因Oct4、Dppa5a、Sox2、Rex1、Dnmt3l的上调(图3A);其次,间质细胞标记基因Snail、Twist2、Cdh2和上皮细胞标记基因Cdh1、Cldn3、Epcam的表达在敲降Hoxc8后并无显著性差异(图3B);再次,敲降Hoxc8也不影响体细胞标记基因Jun-B、Runx1的下调(图3C);最后,敲降Hoxc8对细胞增殖标记基因Trp53、Cdkn1a的表达也无影响(图3D)。综上所述,在7因子诱导的体细胞重编程中敲降Hoxc8对必然发生的重编程分子事件无影响。
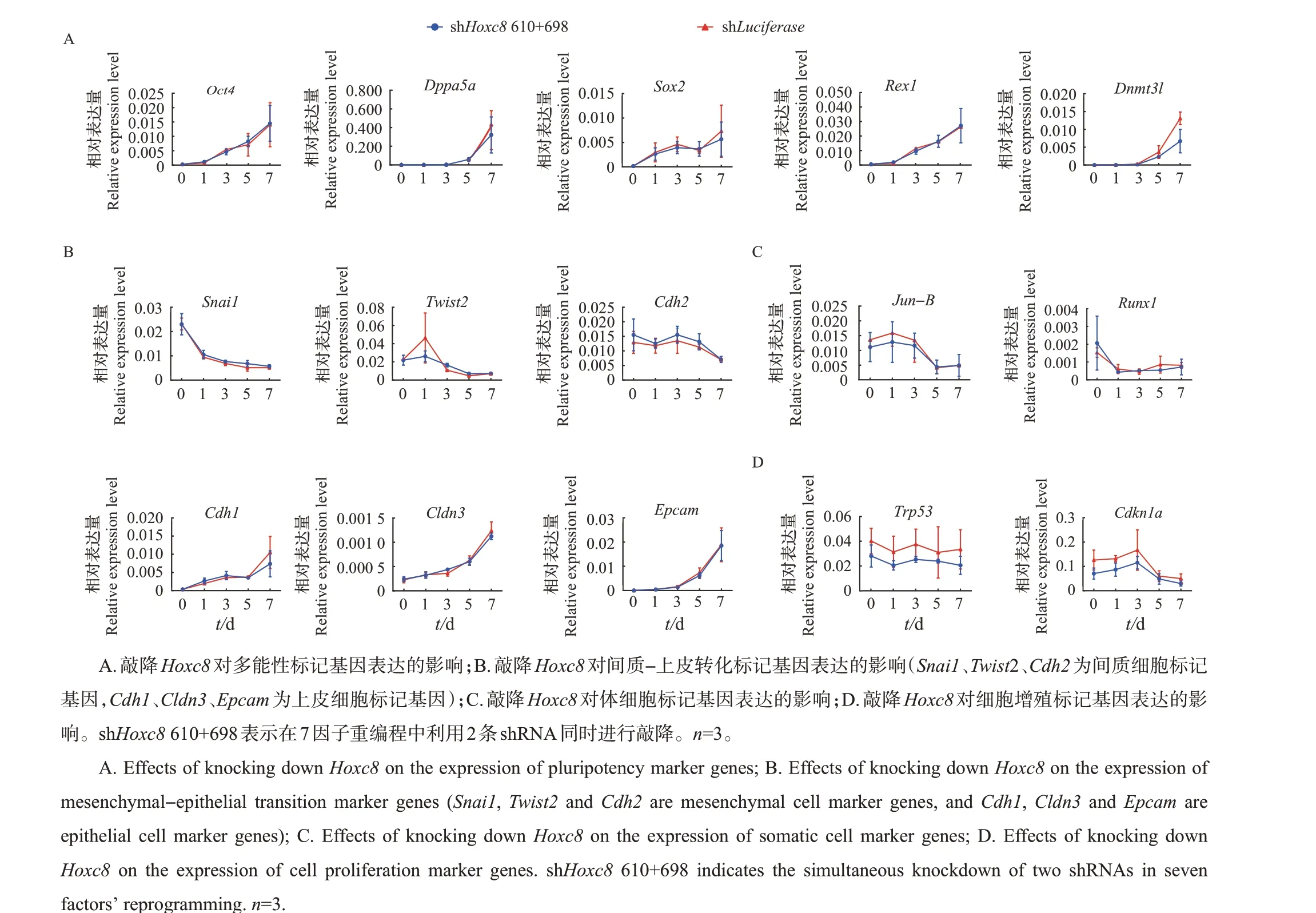
图3 基因表达结果的qRT-PCR检测Fig.3 Gene expression results detected by qRT-PCR
2.4 敲降Smad6 可挽救由敲降Hoxc8 引起的重编程效率下降
因Smad6和Hoxc8在转录水平具有相互调控关系,故进一步探讨是否可通过调节Smad6恢复由敲降Hoxc8引起的抑制情况。结果表明:构建的2 条Smad6基因的shRNA(shSmad6-526和shSmad6-527)表达量明显降低,具有显著的敲降效率(图4A)。单独敲降Smad6对7因子诱导的体细胞重编程无显著影响(图4B)。但同时敲降Smad6与Hoxc8可使敲降Hoxc8导致的重编程效率下降情况得到恢复(图4C)。该结果暗示Samd6有可能是受Hoxc8调控的下游靶基因。对此,我们设计了针对Smad6启动子(转录起始位点前2 kb)的双萤光素酶报告系统。结果表明,与对照pGL3-basic相比,当在293T细胞中将过表达的Hoxc8、pGL3-Smad6启动子和pTK-Renilla 共转染时,萤光素酶活性提高了1 030倍(图4D)。
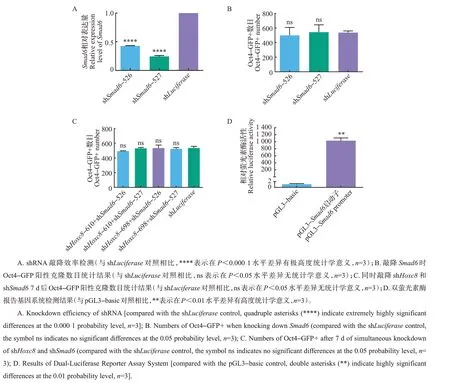
图4 同时敲降Smad6和Hoxc8的结果Fig.4 Results of simultaneous knockdown of Smad6 and Hoxc8
3 讨论和结论
在体细胞重编程过程中转录因子之间相互协调,并结合相关表观修饰复合物参与靶向基因沉默与激活,从而诱导细胞命运发生转变。本研究中,我们发现Hox基因家族成员Hoxc8在7因子诱导的体细胞重编程中具有重要作用。通过shRNA 敲降Hoxc8阻碍了体细胞重编程,而敲降Smad6则可挽救由敲降Hoxc8引起的重编程效率下降,表明Hoxc8与Smad6之间可能存在相互调控关系。首先,Hoxc8属于同源异型盒家族,具有DNA 结合结构域,可以结合到特定的DNA 区域来调控基因表达(例如Smad6),从而影响体细胞重编程[10]。LEI 等[18]通过染色质免疫共沉淀技术(chromatin immunoprecipitation assay,ChIP)发现,Hoxc8可通过调控其下游靶基因细胞凋亡锌指蛋白调节因子(zinc finger protein regulator of apoptosis,Zac1)的表达,改变早期胚胎发育的进程。Hoxc8在胚胎发育过程中还参与了骨形态发生蛋白(bone morphogenetic protein, BMP)信号的调控。Hoxc8充当BMP 信号传导的转录抑制因子,该信号通路对于重编程不是必要的[19];而Smad6同样是BMP信号的负反馈调节因子,可抑制BMP 信号的过度激活。因此,这有可能是同时敲降Smad6与Hoxc8可以使单独敲降Hoxc8导致的重编程效率降低情况得到恢复的原因。其次,Hoxc8在从正常细胞演变为肿瘤细胞过程中扮演了重要的角色,其在多种肿瘤细胞中极大地促进了细胞增殖[11,20-21]。小鼠体细胞重编程依赖于细胞的增殖,其中超快分裂细胞亚群占总重编程细胞的99%以上[22]。另有研究表明,通过分选高速增殖的细胞,也可以提高重编程的效率[23]。Hoxc8可直接增强KDM1A 转录,而KDM1A 活性较低时可导致细胞周期停滞在G0/G1期,影响细胞生长[24-25]。在本研究中,敲降Hoxc8之后并不影响重编程中增殖基因的表达,造成该差异的原因可能是不同实验室所使用的细胞类型不一致。最后,已有的研究表明,间质-上皮转化(mesenchymalepithelial transition,MET)是成纤维细胞重编程早期的重要过程,而在正常的MET 之前引入短暂的EMT可以有效提高重编程效率[26]。Hox家族在肿瘤发生发展中可促进EMT的进程。分析显示,癌组织中的间质细胞标记基因Snail和β-catenin的表达水平显著上升。而与癌旁组织相比,癌组织中的上皮细胞标记基因E-cadherinmRNA 和蛋白表达水平较低[27]。由此推测,在7 因子诱导的体细胞重编程中敲降Hoxc8可能不利于EMT进程,从而阻碍了细胞命运转变。综上所述,Hoxc8在介导7 因子诱导的体细胞重编程中发挥了重要的作用,但是其具体的调控机制仍然需要更深入的研究。
