饲喂高精料日粮的奶牛瘤胃液对瘤胃上皮细胞炎症因子表达量的影响
2022-09-07马晓宇杨天宇姜茂成赵国琦
严 康, 马晓宇, 杨天宇, 姜茂成, 詹 康, 赵国琦
(1.扬州大学动物科学与技术学院,江苏 扬州 225009; 2.江苏省畜牧总站,江苏 南京 210017)
瘤胃上皮是重要的免疫屏障器官,对抵御瘤胃内微生物崩解产生的抗原具有重要的生理意义[1]。高精料日粮饲喂下瘤胃液中抗原肽以及有害物质会损害瘤胃上皮屏障功能[2-3],引发系统性炎症反应,影响奶牛的健康和生产性能[4]。然而,关于饲喂高精料日粮的奶牛瘤胃液是如何引发牛瘤胃上皮细胞(BRECs)炎症反应的研究较少。因此,在高精料日粮饲喂条件下,阐明饲喂高精料日粮的奶牛瘤胃液诱导瘤胃上皮细胞炎症反应的分子机制,可为缓解奶牛瘤胃上皮炎症等代谢性障碍提供理论依据。
在奶牛生产中,为提高产奶量,一般会在日粮中添加高精料日粮,但长时间饲喂高精料日粮会诱发瘤胃内革兰氏阴性菌大量死亡和崩解[5],导致瘤胃内产生大量脂多糖(LPS)[6],引发系统性促炎症反应,导致产奶量下降[7-8],给奶牛养殖业造成巨大的经济损失[9]。当LPS与BRECs共培养时,LPS能上调炎症因子基因IL-1β、TNF-α以及趋化因子基因CXCL2、CXCL8的mRNA表达量[10]。LPS与Toll样受体4(TLR4)结合,可识别和启动LPS触发的炎症反应[11-12]。LPS激活TLR4后,TLR4与细胞质内TIR结构域的接头蛋白相互作用[13],接头蛋白包括髓样分化因子(MyD88)和Toll受体相关的分子[14-15]。TLR4与接头蛋白相互作用后,诱导IRAK1、IRAK4的招募和激活[16],并与TRAF6形成复合体,激活下游蛋白激酶TAK1、IKK[17-18],最终使NF-κB转录因子从细胞质移位至细胞核,进而引起炎症反应[15]。
饲喂高精料日粮后,奶牛瘤胃液中不仅含有LPS,还含有细菌二肽和细菌三肽[19]。营养代谢异常会破坏消化道天然免疫屏障,如小肠上皮屏障,使细菌小肽通过细胞旁路方式进入小肠固有层或直接进入小肠上皮细胞内,引发小肠上皮炎症反应[20]。细菌小肽诱发胃肠道炎症反应,严重影响奶牛健康、鲜奶质量和饲料利用率。有学者指出,大肠杆菌崩解产生的细菌三肽,如甲酰三肽(fMLP)进入小肠内腔,引发小肠上皮的免疫应答反应[21]。通过fMLP处理小肠上皮细胞,能够上调肠上皮细胞转录因子基因NF-κBmRNA表达,并诱发促炎症反应[22]。此外,细菌胞壁酰二肽(MDP)和Tri-DAP三肽也能激活转录因子基因NF-κB。小肽转运蛋白1(PEPT1)转运细菌胞壁酰二肽MDP进入细胞内,刺激人结直肠腺癌细胞Caco-2上皮细胞中IL-8mRNA上调[23]。MDP能够识别NOD2受体,引发一系列炎症反应,但不是通过Toll样受体信号通路[24-25]。Tri-DAP识别NOD1受体,激活RIPK2激酶,与IKK激酶相互作用,激活NF-κB信号通路,上调TNF-α、IL-6的表达[26]。Tri-DAP激活Caco-2丝裂原活化蛋白激酶(MAPK),引发IL-8的mRNA表达[20]。
本研究拟探究饲喂高精料日粮的奶牛瘤胃液对BRECs炎症因子、趋化因子和抗氧化指标的影响,以期解析高精料日粮饲喂条件下奶牛瘤胃上皮细胞的炎症反应机制。
1 材料与方法
1.1 试验材料
DMEM/F12培养基、胎牛血清和胰蛋白酶由Gibco公司提供;青霉素、链霉素、L-谷氨酰胺溶液、乙二胺四乙酸(EDTA)、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸由Sigma公司提供;PrimeScriptTM RT Master Mix和SYBR© Premix Ex TaqTMⅡ由TaKaRa公司提供;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、过氧化氢(H2O2)、总抗氧化物质(T-AOC)的检测试剂盒由南京建成生物工程研究所提供。
1.2 试验方法
1.2.1 奶牛瘤胃上皮细胞培养 奶牛瘤胃上皮细胞来自扬州大学[27]。用DMEM/F12完全培养基培养奶牛瘤胃上皮细胞,待细胞密度达到培养瓶70%生长面积时,用0.05%胰蛋白酶-0.02% EDTA消化奶牛瘤胃上皮细胞,放置于37 ℃细胞培养箱中温育3 min,培养瓶中的细胞开始发亮并从瓶底脱落,拍打细胞培养瓶数次,直至奶牛瘤胃上皮细胞全部从培养瓶底部脱落,用5 ml含10.00%胎牛血清(FBS)的DMEM/F12完全培养基终止消化,转移至3个瓶底面积为25 cm2培养瓶中继续培养。
1.2.2 瘤胃液样品采集 试验分为2组,分别为对照组(正常饲喂)和高精料组(饲喂高精料日粮),每组6头荷斯坦奶牛。试验奶牛处于泌乳中期且无临床疾病,100%全混合日粮TMR饲喂且满足美国国家科学研究委员会修订的奶牛营养需要(NRC)要求,每天于8∶00、14∶00和21∶00分别挤奶。饲粮组成、营养成分见表1和表2。每组奶牛饲喂相应日粮28 d,诱导高精料组奶牛发生亚急性酸中毒(SARA)。当高精料组奶牛瘤胃液pH值为5.5~5.8时,对奶牛瘤胃液进行采集。采集时间为晨饲3 h后,用瘤胃液口腔采集器从瘤胃中采集约50 ml瘤胃食糜,并用4层纱布过滤后,转移至50 ml无菌离心管中,立即用便携式pH计测定瘤胃液pH值,并立即放置于液氮中暂存,然后带回实验室保存在-80 ℃超低温冰箱中。
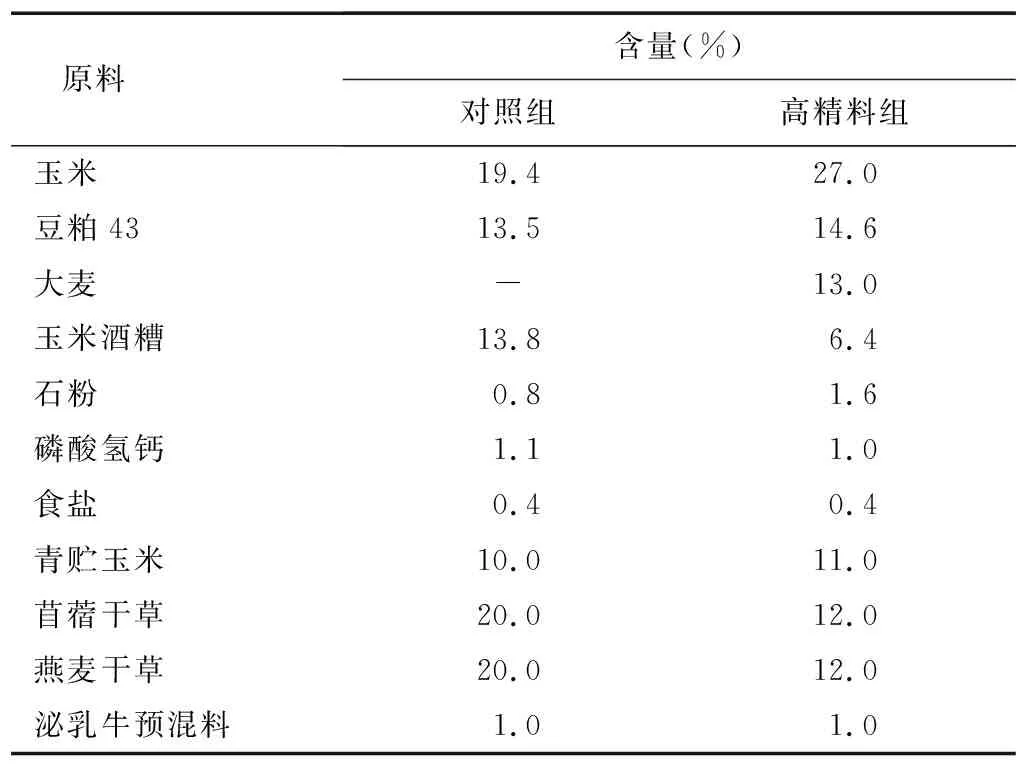
表1 饲粮组成

表2 饲粮营养成分含量
1.2.3 瘤胃液中挥发性脂肪酸浓度测定 瘤胃液中挥发性脂肪酸(VFA)浓度使用气相色谱法进行测定。取2.0~3.0 ml瘤胃液经12 000g离心10 min后取1.0 ml上清液于1.5 ml离心管中,加0.2 ml 20%含60 mmol/L巴豆酸的偏磷酸,混匀后在-20 ℃冰箱中过夜。第2 d将样品进行12 000g离心10 min后,取上清液于0.22 μm水相滤膜过滤后,取1.0 μl进样进行VFA浓度测定。
1.2.4 瘤胃上皮细胞炎症因子基因mRNA相对表达量测定 选取试验组奶牛瘤胃液置于50 ml离心管中,4 ℃ 12 000g离心90 min,小心吸取上清液并转移至50 ml离心管中,再进行4 ℃ 12 000g离心90 min,吸取上清,并用无菌0.22 μm滤膜进行过滤、除菌。试验分为2个组,分别为对照组(CK)和高精料组(HCRF)。6孔板每孔接2×105个BRECs,CK组在培养基中添加10%正常饲喂奶牛的瘤胃液,HCRF组在培养基中添加10%饲喂高精料日粮奶牛的瘤胃液,分别孵育BRECs 6 h。然后,使用TRIzol试剂盒提取总RNA。根据TaKaRa反转录试剂盒说明书将RNA反转录成cDNA,其中反转录反应混合物含有1 μg总RNA和1×PrimeScript RT Master Mix,最终体积为20 μl,反应在37 ℃条件下进行15 min。使用SYBR® Premix Ex TaqTM II试剂盒进行qRT-PCR试验。qRT-PCR反应混合物包含1×SYBR® Premix Ex TaqTM Ⅱ,0.4 μmol/L的上游、下游引物,以及100 ng cDNA模板,最终体积为20 μl,反应过程:95 ℃初始变性30 s;然后在95 ℃ 5 s,60 ℃ 30 s,进行40个循环。本研究所用引物由苏州金唯智生物科技有限公司合成(表3)。试验设3个重复,GAPDH为内参基因,基因相对表达量用2-△△Ct法计算。

表3 荧光定量PCR引物信息表
1.2.5 奶牛瘤胃上皮细胞抗氧化指标测定 试验分为2个组,分别为对照组(CK)和高精料组(HCRF)。6孔板每孔接2×105个BRECs,CK组在F12基础培养基中添加10%饲喂正常日粮奶牛的瘤胃液,HCRF组在F12基础培养基中添加10%饲喂高精料日粮奶牛的瘤胃液,分别孵育BRECs 6 h。然后,用含有蛋白酶抑制剂裂解液裂解细胞,提取细胞总蛋白质。通过试剂盒检测细胞内SOD、GSH-Px、MDA、H2O2、T-AOC的含量。
1.2.6 统计分析 利用SPSS16.0统计软件中的One-Way ANOVA模块进行单因素方差分析,显著性检验应用多重比较法。
2 结果与分析
2.1 饲喂高精料日粮对奶牛瘤胃发酵反应的影响
表4显示,与对照组相比,高精料组的奶牛瘤胃液中总挥发性脂肪酸浓度以及乙酸、丙酸、丁酸含量极显著提高(P<0.010),戊酸含量提高(P=0.070)。与对照组相比,高精料组的奶牛瘤胃液的pH值极显著下降(P=0.005),说明饲喂高精料日粮可以诱导奶牛发生亚急性酸中毒(SARA)。

表4 饲喂高精料日粮对奶牛瘤胃发酵参数的影响
2.2 饲喂高精料日粮的奶牛瘤胃液对奶牛瘤胃上皮细胞炎症因子基因表达的影响
通过qRT-PCR检测IL-1β、IL-6、TNF-α、IL-12、IL-32、p38β、TGF-β的mRNA表达量,GAPDH作为内参基因。表5显示,与对照组相比,高精料组BRECs炎症因子基因IL-1β、TNF-α的mRNA表达量极显著上调,IL-6的mRNA表达量也极显著上调,然而,炎症因子IL-12、IL-32的mRNA表达量并没有显著改变。与对照组相比,高精料组p38β和TGF-β的mRNA表达量也没有显著变化。说明,饲喂高精料日粮的奶牛瘤胃液可以促进BRECs的炎症反应。
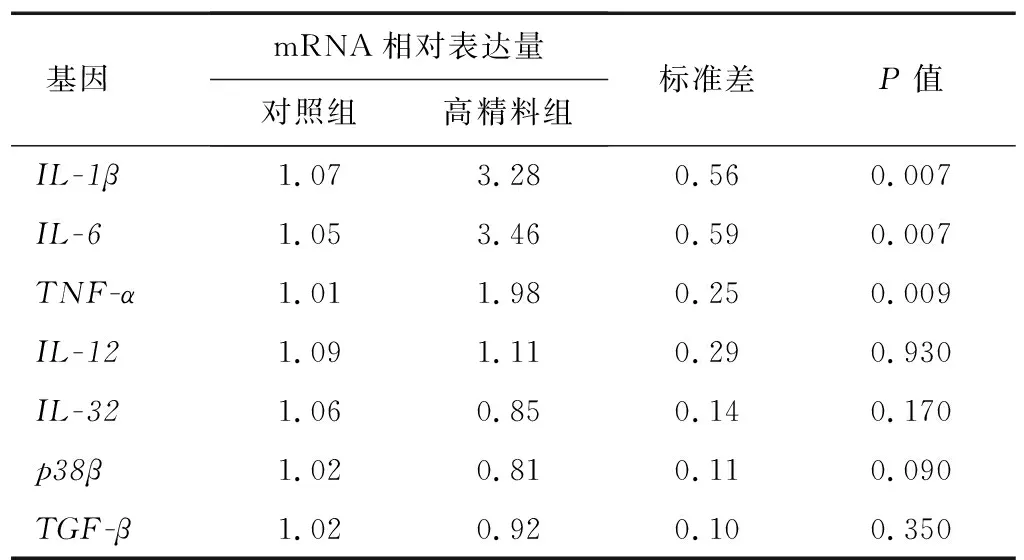
表5 饲喂高精料日粮的奶牛瘤胃液对BRECs炎症因子基因mRNA相对表达量的影响
2.3 饲喂高精料日粮的奶牛瘤胃液对奶牛瘤胃上皮细胞趋化因子基因表达的影响
当受到外来抗原刺激时,机体会启动先天免疫反应来积极响应感染。由于饲喂高精料日粮的奶牛瘤胃液中含有细菌死亡崩解产生的细菌小肽,本研究假设饲喂高精料日粮后,奶牛瘤胃上皮能够积极响应瘤胃液中细菌小肽对BRECs的感染,因此,通过qRT-PCR来检测BRECs初始炎症反应相关趋化因子基因的mRNA表达量。表6显示,饲喂高精料日粮奶牛的瘤胃液能够显著上调BRECs中CCL型的CCL2、CCL20的mRNA表达量,但CCL28的mRNA表达量并未显著上调(P>0.05)。此外,与对照组相比,高精料组的BRECs中CXCL型的CXCL8、CXCL9的mRNA表达量极显著上调(P<0.01),CXCL2的mRNA表达量显著上调(P<0.05),CXCL14的mRNA表达量未显著上调(P=0.09)。说明,饲喂高精料日粮奶牛的瘤胃液能够增加大部分CCL型和CXCL型趋化因子基因的mRNA表达量,进而积极响应饲喂高精料日粮奶牛的瘤胃液中细菌抗原的感染。
2.4 饲喂高精料日粮的奶牛瘤胃液对奶牛瘤胃上皮细胞Toll信号通路的影响
模式识别受体主要包括2种,即细胞膜表面的Toll样受体(TLR)和胞浆内NOD受体。Toll样受体信号通路的激活在炎症反应中发挥重要作用。TLR能够识别各种病原体中的保守基序,迅速激活细胞内信号传导的级联反应,促使机体生成炎症因子和趋化因子。与对照组相比,高精料组TLR2、TLR4基因的mRNA表达量显著降低。TLR4与许多细胞质内的接头蛋白(包括CD14、MD2、MyD88)相互作用。TLR4与接头蛋白的相互作用,会引起、导致白介素-1 受体相关激酶的募集和激活,并与TRAF6形成复合体。结果(表7)表明,饲喂高精料日粮奶牛的瘤胃液并未显著改变CD14、MD2、MyD88以及下游信号通路IRAK1激酶、TRAF6连接酶基因的mRNA表达量,说明饲喂高精料日粮奶牛的瘤胃液促进BRECs炎症反应可能不是通过Toll样受体信号通路,而是通过其他信号通路实现的。
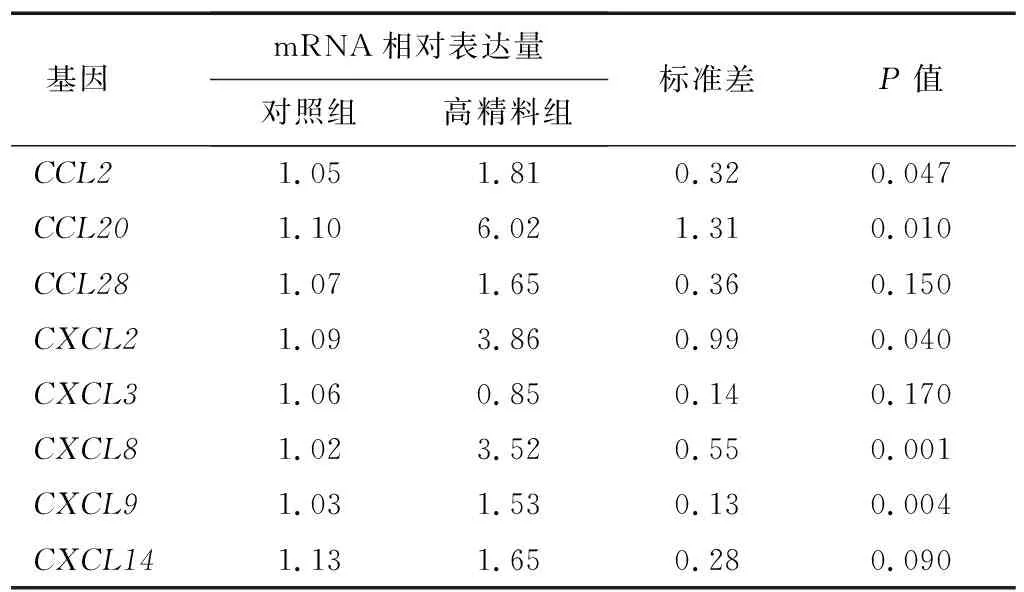
表6 饲喂高精料日粮的奶牛瘤胃液对BRECs趋化因子基因mRNA表达量的影响
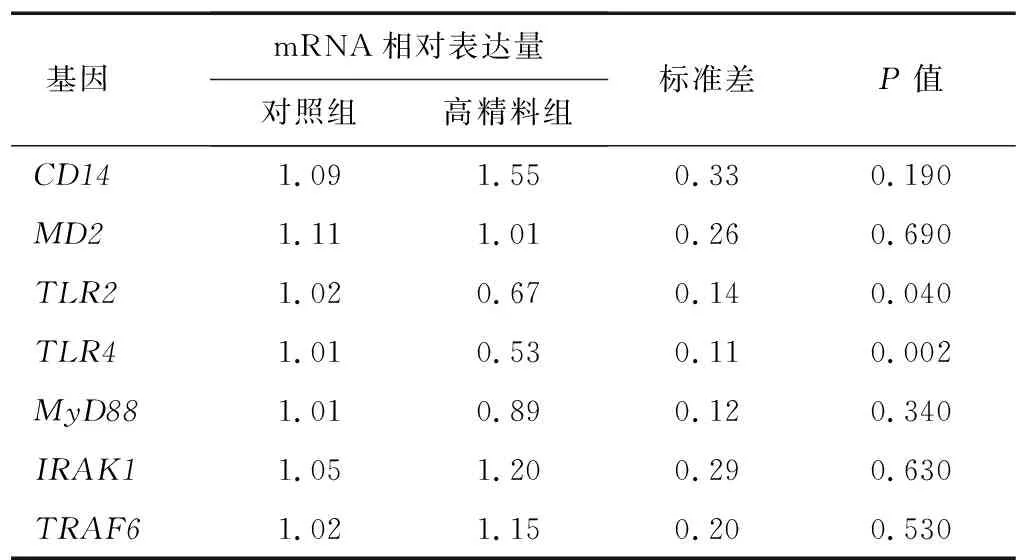
表7 饲喂高精料日粮的奶牛瘤胃液对BRECs Toll样受体信号通路的影响
2.5 饲喂高精料日粮的奶牛瘤胃液对奶牛瘤胃上皮细胞NOD/RIPK2信号通路的影响
PEPT1可以将细菌小肽转运至细胞内,细菌小肽引起核苷酸寡聚化结构域NOD受体与RIPK2相互作用,进而引起奶牛瘤胃上皮细胞炎症反应。NOD受体可以识别细菌小肽,激活NF-κB转录因子并诱导炎症反应。NOD1和NOD2是先天免疫受体,能够识别革兰氏阳性菌和革兰氏阴性菌崩解的细菌小肽。NOD1主要识别革兰氏阴性菌崩解产生的细菌小肽,而NOD2既能识别革兰氏阴性菌崩解产生的细菌小肽也能识别革兰氏阳性菌崩解产生的细菌小肽。表8显示,与对照组相比,高精料组BRECs中PEPT1的mRNA表达量显著提高(P<0.05),但NHE1、NOD1、NOD2、RIPK2的mRNA表达量并无显著变化。说明,PEPT1可能转运饲喂高精料日粮的奶牛瘤胃液中的细菌小肽进入细胞,引起炎症反应,但还需要进一步证明。
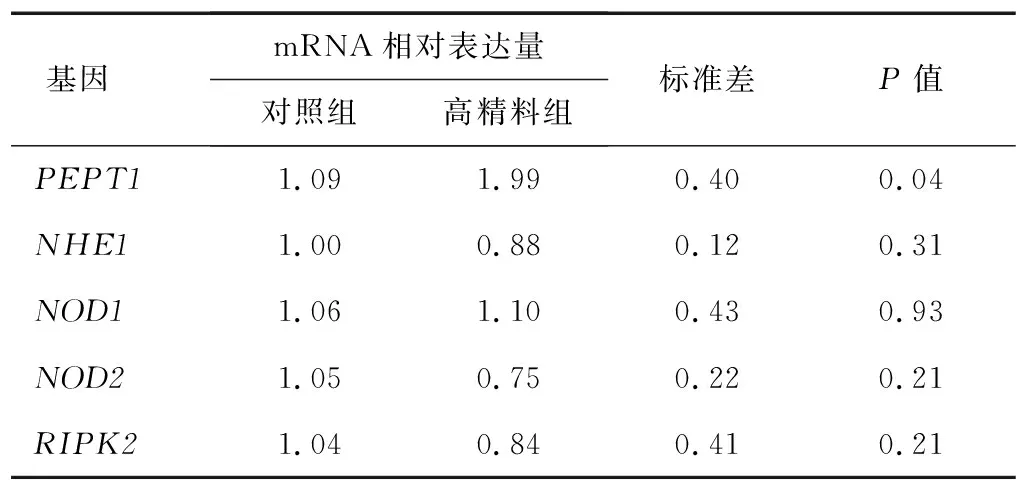
表8 饲喂高精料日粮的奶牛瘤胃液对BRECs NOD样受体和RIPK2信号通路的影响
2.6 饲喂高精料日粮的奶牛瘤胃液对奶牛瘤胃上皮细胞抗氧化性的影响
表9显示,饲喂高精料日粮的奶牛瘤胃液可以极显著增加BRECs中MDA、H2O2含量,然而,SOD、GSH-Px、T-AOC含量极显著降低。表明饲喂高精料日粮会对奶牛瘤胃上皮产生损伤作用。
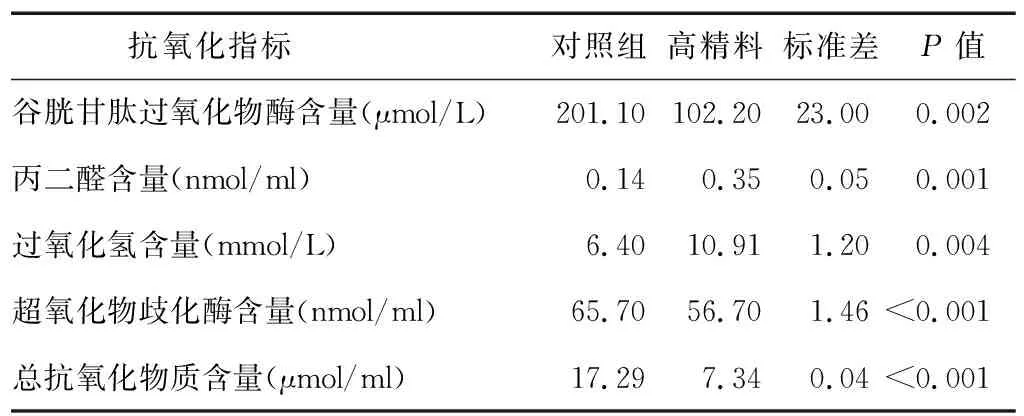
表9 饲喂高精料日粮的奶牛瘤胃液对奶牛瘤胃上皮细胞抗氧化指标的影响
3 讨 论
为了提高产奶量,经常以高精料日粮饲喂奶牛。然而,长期饲喂高精料日粮会改变奶牛瘤胃微生物的组成和代谢,导致挥发性脂肪酸大量积累,降低瘤胃液pH值[28-29]。瘤胃液pH值的急剧下降是目前奶牛养殖业主要关注的健康问题之一,会导致奶牛出现消化紊乱,引发生产损失。有报道指出,SARA与低纤维、高能量的日粮和pH值有关[9]。SARA会导致瘤胃内LPS产生,甚至从瘤胃转移到血液内循环[30]。有研究发现,饲喂高精料日粮的奶牛瘤胃液pH值低于5.8,且持续时间为1 d约5.1 h,成功诱导奶牛出现SARA[31]。在本研究中,与对照组相比,高精料组的瘤胃液pH值显著降低,说明SARA被成功诱导。通常情况下,高精料会促进乳酸产生菌的增加,减少瘤胃内纤维降解菌的数量,导致瘤胃液pH值急剧下降[32]。因此,瘤胃液pH值的改变可能是由于饲料从干草到高精料过渡过程中,非结构性碳水化合物的快速发酵和瘤胃内挥发性脂肪酸的积累引起的[33]。pH值的降低也可能是由于瘤胃内乳酸积累导致的。此外,在本研究中,饲喂高精料日粮的奶牛瘤胃液中乙酸、丙酸、丁酸含量和总挥发性脂肪酸浓度显著升高。有研究发现,饲喂高精料日粮会引起瘤胃内丙酸、丁酸含量的升高[34-35],这与本研究结果一致。有学者指出,高精料日粮会激活瘤胃上皮钙信号通路,可能是由于挥发性脂肪酸在瘤胃内大量积累引起的[36-37]。低pH值会降低瘤胃内细菌的丰富度和多样性,在饲喂高精料日粮引起奶牛SARA时,低pH瘤胃环境会导致细菌死亡和崩解,使其相对丰度降低[38]。因此,饲喂高精料日粮会影响奶牛瘤胃发酵,导致瘤胃内环境紊乱。
饲喂高谷物日粮引起的SARA会损害奶牛健康,如产生瘤胃炎、代谢性酸中毒、跛行和肝脓肿等[38-40]。此外,谷物诱导的SARA会增加急性时相反应蛋白和血清淀粉样蛋白A的水平,引起全身炎症反应[41-42]。这种全身性炎症反应与日粮引起的瘤胃上皮屏障功能的破坏有关[5]。因此,本研究采集饲喂高精料日粮奶牛的瘤胃液进行体外试验,进一步探索其是否会引起BRECs的炎症反应,结果表明,与对照组相比,高精料组促炎因子基因IL-1β、TNF-α、IL-6的mRNA表达量显著上升。有研究发现,LPS的释放以及pH值的降低可能通过协同作用破坏瘤胃上皮屏障[43]。上皮屏障被破坏后,促使炎症因子大量释放,引起瘤胃上皮局部炎症反应[44-45]。IL-6作为一种多功能细胞因子,参与调节免疫反应、急性时相反应和炎症[46-47]。前人的研究结果表明,IL-6可以参与肠道组织修复,阻止IL-6的产生有利于创伤面的愈合[48-49]。因此,BRECs炎症因子基因的高表达,说明长时间饲喂高精料日粮能引起奶牛瘤胃上皮发生炎症反应。有研究发现,SARA引发的炎症因子基因mRNA表达量增加主要与淀粉类细菌有关,高精料日粮有利于这类细菌增长,进而增加瘤胃内毒素和其他细菌崩解产物在胃肠道的易位,这可能是诱发反刍动物炎症的原因[42]。
趋化因子是能诱导免疫细胞发生定向趋化的细胞因子的总称,是一类结构、功能相似的小分子蛋白质,在细胞迁移、免疫、炎症等反应中发挥重要作用。趋化因子可参与调节白细胞、淋巴细胞等免疫细胞的募集[50]。根据半胱氨酸的序列位置将趋化因子分为CXCL、CCL、C和CX3C(C为半胱氨酸,X为任意氨基酸)4大类。CCL型趋化因子主要趋化单核细胞,CXCL型趋化因子主要趋化中性粒细胞。本研究选取趋化因子家族中种类较多的2种亚家族(CCL型趋化因子和CXCL型趋化因子)进行测定。趋化因子在免疫细胞迁移中的作用主要是通过与免疫细胞受体结合完成的。一种趋化因子可结合多种趋化因子受体,一种趋化因子受体也能与多种趋化因子相结合[51]。CCL2是在人体内最早被发现及研究最多的CCL类趋化因子,可通过受体CCR2介导,将免疫细胞迁移至损伤部位引发免疫应答反应[52]。有研究发现,CXCL14可以通过调节其他趋化因子受体,在介导免疫及炎症反应等过程中发挥作用[53]。CXCL14可由B淋巴细胞、单核细胞、巨噬细胞、单核细胞衍生的未成熟的树突状细胞等多种细胞分泌产生,并能聚集、激活免疫细胞至炎症部位杀死靶细胞,发挥免疫监视及免疫防御作用[54]。在本研究中,饲喂高精料日粮的奶牛瘤胃液可显著提高BRECs中CCL型CCL2、CCL20基因以及CXCL型CXCL2、CXCL8、CXCL9基因的表达。另有研究发现,饲喂高精料日粮奶牛的瘤胃上皮趋化因子基因表达上调[34],这与本研究结果一致,表明饲喂高精料日粮触发了奶牛瘤胃上皮免疫应答反应,这可能是在饲喂高精料日粮条件下机体对自身的免疫保护。
反刍动物PEPT1主要分布于胃上皮组织和小肠黏膜[55]。有研究报道,PEPT1介导细菌小肽转运,进入结肠上皮细胞,通过调节IFN-γ活性,激活NF-κB通路,诱导肠道炎症反应[22]。有研究发现,饲喂高精料日粮能促进马肠道中PEPT1mRNA的表达[22]。由此可知,PEPT1可以介导细菌小肽的转运和吸收,激活肠道免疫细胞,促进肠上皮细胞与免疫细胞相互作用,最终导致小肠上皮细胞的炎症反应。此外,有研究发现,饲喂高精料日粮会导致奶牛瘤胃内有机酸大量累积和瘤胃液pH值急剧下降,改变瘤胃内环境的酸碱平衡,影响瘤胃微生物区系多样性,并诱发微生物崩解释放大量细菌小肽和促炎因子[31]。在本研究中,饲喂高精料日粮的奶牛瘤胃液显著上调BRECs中PEPT1的mRNA表达量,这可能是由于瘤胃液中携带大量细菌分解产生的细菌小肽,通过PEPT1可以将这些细菌小肽运输到细胞中,细菌小肽的运输也可能导致瘤胃上皮细胞内的细菌产物抗原增加,诱导PEPT1在瘤胃上皮细胞中的表达,进而导致细胞对细菌小肽转运的增加,使细胞内的细菌小肽大量积累,激活炎症信号通路,从而引发下游的促炎症反应。
细菌小肽可激活细胞内的NOD1、NOD2样受体,并使其结构发生改变,进而激活丝氨酸/苏氨酸激酶2(RIPK2)并引起泛素化[56]。RIPK2是NOD1和NOD2的下游信号分子。RIPK2在树突状细胞和巨噬细胞等细胞中表达,NOD1和NOD2对微生物相关分子模式的识别导致RIPK2与这些天然免疫受体相互作用,进而通过激活MAPK信号通路中关键激酶和NF-κB转录因子表达,释放TNF-α、IL-6、IL-12等促炎细胞因子[57]。有研究证实,RIPK2依赖NOD受体诱导促炎细胞因子的产生[25]。此外,有研究发现,与受刺激的RIPK2完整小鼠的巨噬细胞相比,缺乏RIPK2的小鼠中,IL-6、TNF-α炎症因子基因的mRNA表达量明显降低[58]。因此,这些研究结果表明RIPK2是通过NOD1/NOD2介导产生促炎因子的重要信号分子,RIPK2的激活在宿主防御微生物感染中起着至关重要的作用。
有学者指出,日粮的改变会影响动物机体瘤胃组织的抗氧化能力[59]。饲喂高精料日粮的奶牛瘤胃液可以极显著增加BRECs中MDA、H2O2含量,然而,SOD、GSH-Px、T-AOC含量极显著降低,说明饲喂高精料日粮奶牛的瘤胃液可能影响瘤胃上皮细胞的抗氧化能力,与前人的研究结果一致。组织中的SOD、GSH-Px、MDA和T-AOC等指标的变化是反应机体氧化/抗氧化状态的重要指标,其中超氧化物歧化酶是消除动物体内自由基损伤的主要防御酶[60-62],具有清除自由基、提高细胞活力、保持生物膜稳态等功能;MDA是脂质过氧化反应的终产物,其含量可直接反映细胞膜脂质过氧化的程度[63]。通过本研究结果证明,饲喂高精料日粮的奶牛瘤胃液会对细胞活力和生物膜稳态造成损伤,并且会加剧细胞膜脂质过氧化程度。饲喂高精料日粮的奶牛瘤胃液会影响瘤胃上皮细胞的稳态,致使瘤胃上皮细胞对营养物质的代谢受阻,从而造成代谢紊乱,引起机体的氧化应激反应,导致炎症反应。
