防治水稻恶苗病拮抗细菌的筛选、鉴定和评价
2022-09-07李风顺乔俊卿张荣胜刘邮洲刘永锋
李风顺, 乔俊卿, 张荣胜, 刘邮洲, 刘永锋
(1.南京农业大学植物保护学院,江苏 南京 210095; 2.江苏省农业科学院植物保护研究所,江苏 南京 210014)
水稻恶苗病是常见种传病害,自1828年日本首次报道后,几乎在世界各水稻种植区均有发生,在中国稻区分布广泛,造成不同程度的危害,一般减产10%~20%,严重时达50%[1-2]。水稻恶苗病由藤仓镰刀菌复合菌群引起,已报道的病原菌种属包括藤仓镰刀菌(Fusariumfujikuroi)、层出镰刀菌(Fusariumproliferatum)、拟轮枝镰刀菌(Fusariumverticilliodes)、Fusariumandiyazi、Fusariumasiaticum和禾谷镰刀菌(Fusariumgraminearum),其中藤仓镰刀菌和层出镰刀菌分布最广,致病力最强,是引起水稻恶苗病的主要致病菌,其他种属的镰刀菌有混合侵染的现象[3-4]。水稻恶苗病症状主要表现为:苗期徒长、叶片细长呈淡绿色、矮化、死苗;成株期出现根部和茎基部腐烂,严重时整株枯死或徒长,长倒生根;水稻灌浆后,发病严重的植株籽粒带菌(粉红色霉层)[5-6]。
目前水稻生产上,采用化学药剂拌种、浸种或包衣防治水稻恶苗病。截至2020年,中国农药信息网数据显示,中国登记防治水稻恶苗病的种衣剂有68种(包括单剂和复配剂),产品有效成分均为化学药剂,其中约80%的产品有效成分含有咪鲜胺、精甲霜灵、咯菌腈或多菌灵。随着水稻恶苗病病菌对多菌灵、咪鲜胺产生抗药性[7-9],咯菌腈、精甲霜灵和氰烯菌酯成为市场上防治水稻恶苗病的主要制剂[10]。由于水稻恶苗病病菌对化学药剂产生的抗药性逐年上升,过量使用化学农药造成生态环境严重污染,农药残留增加,严重危害人类健康。随着中国植保绿色防控的推广,生物防治成为绿色综合防控技术中的重要措施。生物农药源于自然,对环境友好,在病虫害综合治理中,是一类理想的可替代或部分替代化学农药的产品,大力发展生物农药,符合当前中国农业和环境可持续发展的要求[11]。
中国在20世纪90年代即有关于防治水稻恶苗病的生防微生物筛选的相关研究,如陈志谊等[12]报道了利用拮抗芽孢杆菌防治水稻纹枯病和恶苗病;2006年,李斌等[13]报道了枯草芽孢杆菌和巨大芽孢杆菌对水稻恶苗病病菌具有较好拮抗效果。已有研究主要是以水稻恶苗病病菌(Fusariummoniliforme)为指示菌筛选拮抗菌株,由于水稻恶苗病是多种菌群复合侵染,因此利用致病菌复合菌群为指示菌筛选拮抗菌株,更符合生产实际。本研究以不同种属的恶苗病致病菌为指示菌筛选拮抗菌,通过温室盆栽试验,最终获得优良生防促生菌株,以期为创制防治水稻恶苗病的种子处理剂提供具有潜力的菌株资源。
1 材料与方法
1.1 试验材料
土壤样品采集于江苏省南京市溧水区和常州市金坛区的水稻、西瓜、青菜、辣椒和安徽淮南的樟树、紫荆、鹅掌楸、桂花和朴树等植物根围土壤,共16份。
供试菌株为实验室保存的水稻恶苗病病菌:Fusariumfujikuroi50-1、Fusariumasiaticum25-2、FusariumproliferatumE-Q、FusariumgraminearumDG-9、FusariumgraminearumDG-11、Fusariumproliferatum63-2。水稻品种:金刚30。
水稻恶苗病病菌活化、培养所用的培养基为马铃薯葡萄糖琼脂(PDA)培养基。拮抗细菌的分离、纯化及发酵培养等所用的培养基为1/2 TSB、M715、LB、YPGA培养基,生物膜形成所用培养基为Msgg培养基,芽孢杆菌产孢所用的培养基为SSM培养基。各培养基配方见表1。
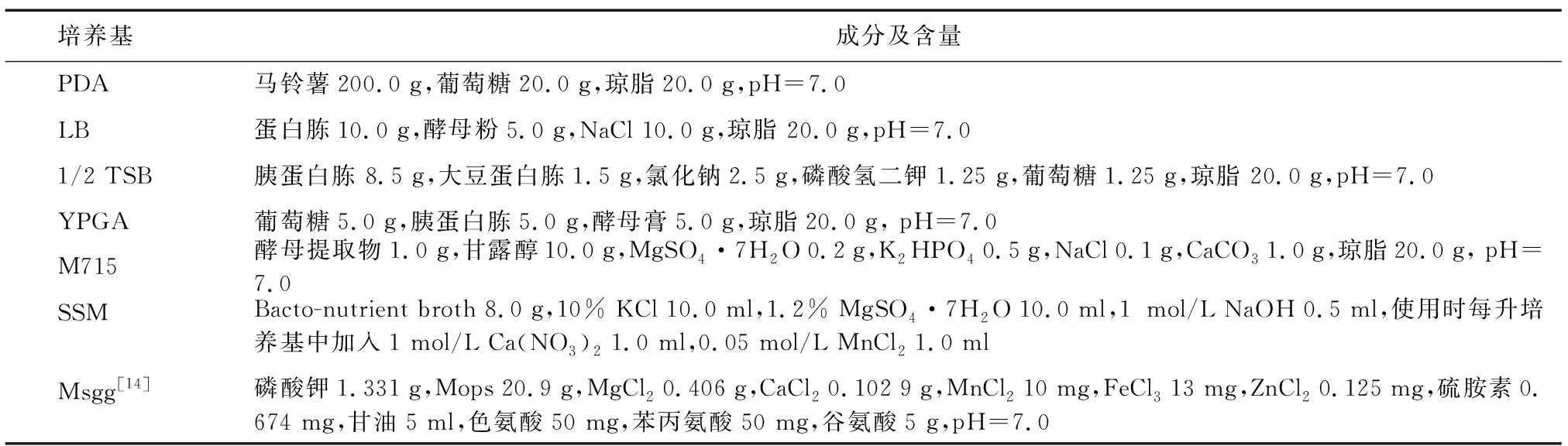
表1 本研究所用培养基
1.2 拮抗细菌的分离和纯化
采用稀释涂板法进行拮抗细菌的分离。称取10 g土壤于90 ml无菌水中,25 ℃ 150 r/min振荡1 h后,即得到所需的土壤悬浮液,将土壤悬浮液进行10倍梯度稀释,稀释液分别涂布分离平板(分离培养基为LB、YPGA、1/2TSB、M715)。平板于28 ℃生长2~5 d,依据菌落形态、大小、色泽等挑选不同分离物,转接至相应培养平板,通过划线法进行单胞纯化,直至有单菌落为止。本研究共分离获得432株细菌,并进行后续试验。
1.3 拮抗细菌的筛选
采用孢子萌发抑制法进行拮抗细菌初步筛选。6株水稻恶苗病病菌在PDA平板上活化,生长4~5 d后,用无菌水洗涤孢子,分别将孢子液调整为1 ml 1×106个孢子,随后,将6种孢子液等体积混合,并调整混合孢子液浓度为1 ml 1×105个孢子,吸取100 μl均匀涂布于PDA平板,晾干备用。将单胞纯化后的细菌用无菌牙签接入PDA平板培养,28 ℃培养3~4 d,调查细菌抑制孢子萌发的情况,3次重复。
采用平板对峙试验法进行拮抗细菌复筛。6株水稻恶苗病病菌在PDA平板上活化,生长2~3 d后,沿生长茂盛的菌落边缘打孔(直径5 mm)制备菌饼,将菌饼置于PDA平板中央,先将其放入28 ℃培养箱培养24 h,备用。以菌饼为中心,按“十”字方位将单胞纯化后的细菌接入已培养24 h的PDA平板,每菌株重复3次,28 ℃恒温培养直到对照平板长满真菌时,调查拮抗菌抑菌带宽。
1.4 拮抗菌生物学相关特性的测定
1.4.1 拮抗细菌的生物膜形成能力和群集游动能力(Swarming)检测 将拮抗菌株平板活化,单胞接入LB培养液中过夜培养,再次转接入新鲜LB培养液中,待对数生长期OD600为1.0时,取菌液1 μl滴于Msgg培养基[14]中,28 ℃培养,分别于24 h、36 h和48 h观察菌株生物膜情况,3次重复。同时,将上述菌液取1 μl滴于0.7% LB平板中心,28 ℃培养,分别于24 h和48 h观察菌株群集游动情况,测量菌落直径,3次重复。
1.4.2 拮抗细菌产生脂肽类物质的检测 将拮抗菌株平板活化,单胞接入LB培养液中30 ℃180 r/min培养12~16 h;随后,将培养液按照1%接种体积接入新鲜LB培养液中,30 ℃ 180 r/min培养48 h,利用盐酸沉淀法提取脂肽类抗生素。脂肽类物质粗提物经0.22 μm无菌滤膜过滤,进行高效液相色谱(HPLC)检测。具体检测方法如下:HPLC分析采用C18柱(Sephasil Peptide C18 5 μm ST 4.6/250);流动相为乙腈(A)、水(B)和0.1%三氟乙酸;采用梯度检测方法(0~25 min,60% A和40% B; 25~35 min, 70% A和30% B; 35~60 min, 93% A和7% B);流速为0.8 ml/min,进样量为10 μl,检测波长为210 nm,柱温为30 ℃[15]。
1.5 拮抗细菌种属分子鉴定
离心收集拮抗细菌LB过夜培养的菌体,按照常规SDS(十二烷基硫酸钠)碱裂解法小量提取基因组DNA。以细菌基因组为模板扩增16S rRNA 部分序列。16S rRNA序列扩增引物:16S F(27f),5′-AGAGTTTGATCCTGGCTCAG-3′;16S R (1492r),5′-GGTTACCTTACGACTT-3′。测序由北京擎科生物技术有限公司完成,通过NCBI 网站的BLAST 程序进行同源性比对,采用Mega软件建立系统发育树。
1.6 拮抗细菌对水稻的促生作用评价
将水稻健康种子在体积分数为75%的乙醇溶液中浸泡2 min,用无菌水冲洗2~3次,再用75%乙醇浸泡1 min,用无菌水冲洗至无乙醇残留后在无菌滤纸上晾干,每30粒分装于灭菌离心管。分别选用OD600=1.00、OD600=0.10和OD600=0.01的拮抗菌孢子液(利用芽孢杆菌产芽孢培养基培养至90%产芽孢,芽孢离心收集后用无菌水稀释到相应浓度)浸种24 h,以无菌水作为对照。将种子取出,保持湿润状态,室温催芽72 h记录萌发情况,每处理测量10粒正常萌发种子的根长,比较不同浓度拮抗菌孢子液对种子根长的促生作用。用OD600=0.10的各拮抗菌的孢子液(无菌水稀释)浸种已消毒的水稻种子24 h后,室温催芽,待露白后将种子播种于一次性水杯中,置于温室(16~25 ℃)中生长,每杯10粒,每处理重复3次。30 d后调查所有植株的株高和鲜质量,评估拮抗菌的促生效果。
1.7 拮抗细菌对水稻苗期恶苗病的防效评价
拮抗细菌平板活化后,单胞接入LB培养基, 30 ℃ 180 r/min培养12~16 h,按照1%接种体积接入YPGA培养液中,30 ℃ 180 r/min培养48~72 h,待拮抗细菌细胞80%以上成为芽孢后,收集发酵菌液备用。将健康种子与试验田留存的自然发病的恶苗病水稻种子混合(健康种子∶恶苗病种子=4∶1),分装50粒到15 ml灭菌离心管中,分别用OD600=1.0和OD600=0.1的拮抗细菌发酵菌液浸种24 h,用无菌水和25%咪鲜胺乳油(4 000倍稀释液)作为空白和化学药剂对照,重复3次。种子催芽后播种于盆钵中,30 d后调查发病情况,计算发病率和防治效果。
发病率=发病株数/总株数×100%。
防治效果=[(对照发病率-处理发病率)/对照发病率]×100%。
1.8 数据分析方法
数据处理和统计分析采用Excel和DPS软件进行。
2 结果与分析
2.1 拮抗细菌的分离、纯化和筛选
将16份土壤样品稀释悬浮液涂布于不同的分离培养基平板上,共分离获得不同菌落形态的细菌分离株432株,利用6株水稻恶苗病病菌孢子混合液初步筛选获得17株对孢子萌发有抑制作用的菌株。随后,通过平板对峙试验评价17株菌株对6株指示菌菌丝生长的抑制效果,结果(表2)显示,6株拮抗菌对不同的水稻恶苗病病菌都具有较为显著的抑制效果,这6株菌株分别是LSRS26、JTRSM1、JTGSL12、JTGSM22、JTLM2和AHGHL2。

表2 拮抗菌对水稻恶苗病病菌的平板抑制作用
2.2 拮抗细菌的生防相关特征评价
本研究对筛选获得的6株拮抗菌进行了生物膜形成能力、群集游动能力(Swarming)和芽孢杆菌脂肽类物质产生情况的分析。
生物膜形成试验结果(图1)显示,在生物膜形成培养基Msgg中,拮抗菌培养24 h时,只有菌株JTRSM1形成了较为致密的菌膜,而菌株LSRS26、JTGSL12和AHGHL2仅仅在培养基表面看到非常单薄的菌膜;随着培养时间的增加,在36 h时,菌株LSRS26、JTRSM1、JTGSL12和AHGHL2都可以形成致密褶皱的生物膜,在培养48 h时,4株菌的生物膜更加致密、褶皱更多(图1A);但是菌株JTGSM22和JTLM2培养48 h后,仍然不能形成明显的生物膜。4株菌株在培养48 h形成生物膜的干质量分析结果(图1B)显示,菌株LSRS26、JTRSM1和AHGHL2形成的生物膜干质量基本相当,为4.40~4.65 mg,菌株JTGSL12形成生物膜的干质量略低,为3.37 mg。

A:拮抗菌形成的生物膜表形;B:拮抗菌培养48 h形成的生物膜干质量。图1 拮抗菌在Msgg培养基中形成生物膜的情况Fig.1 Biofilm formation of antagonistic bacteria in Msgg culture
群集游动能力试验结果(图2A)显示,随着培养时间的增加,5株拮抗菌的Swarming菌落直径逐渐增加,但菌株JTLM2的群集游动能力较差,基本未发生游动现象。此外,在培养48 h时,菌株JTGSM22游动能力最强,直径达7 cm;游动菌落直径比较结果(图2B)表明,各菌株游动能力强弱:JTGSM22>JTGSL12>LSRS26>AHGHL2>JTRSM1>JTLM2。

A:拮抗菌群集游动平板表形;B:拮抗菌群集游动扩散直径。图2 拮抗菌在0.7% LB平板的群集游动能力Fig.2 Swarming ability of antagonistic bacteria in 0.7% LB plate
采用盐酸(HCl)沉淀法提取芽孢杆菌脂肽类物质粗提物,其中菌株JTGSM22 和JTLM2发酵液加HCl后未产生沉淀,其余4株菌株均产生沉淀并提取到脂肽类物质,随后通过高效液相色谱检测发酵产生脂肽类抗生素的情况,结果如图3所示,菌株LSRS26、JTGSL12、JTRSM1、AHGHL2 均可产生表面活性素(Surfactin)、伊枯草菌素(Iturin)和范革素(Fengycin)。
Surfactin:表面活性素;Fengycin:范革素;Iturin:伊枯草菌素。图3 高效液相色谱检测拮抗细菌产生脂肽类物质情况Fig.3 High performance liquid chromatography (HPLC) detection of lipopeptides produced by antagonistic bacteria
2.3 拮抗细菌种属的鉴定
利用16S rDNA基因部分序列,对6株拮抗菌进行种属鉴定。PCR产物经回收后测序,测序结果在NCBI进行同源性比对,并构建系统发育树(图4)。序列比对结果表明,菌株LSRS26、JTRSM1、JTGSL12和AHGHL2是Bacillusamyloliquefaciens(解淀粉芽孢杆菌),菌株JTGSM22和JTLM2是Paenibacillusjamilae(杰米拉类芽孢杆菌)。

Bacillus amyloliquefaciens:解淀粉芽孢杆菌;Paenibacillus jamilae:杰米拉类芽孢杆菌。图4 拮抗菌16S rDNA部分序列构建的系统发育树Fig.4 Phyligenetic tree constructed by part region of the 16S rDNA of antagonistic bacteria
2.4 拮抗细菌对水稻的促生作用
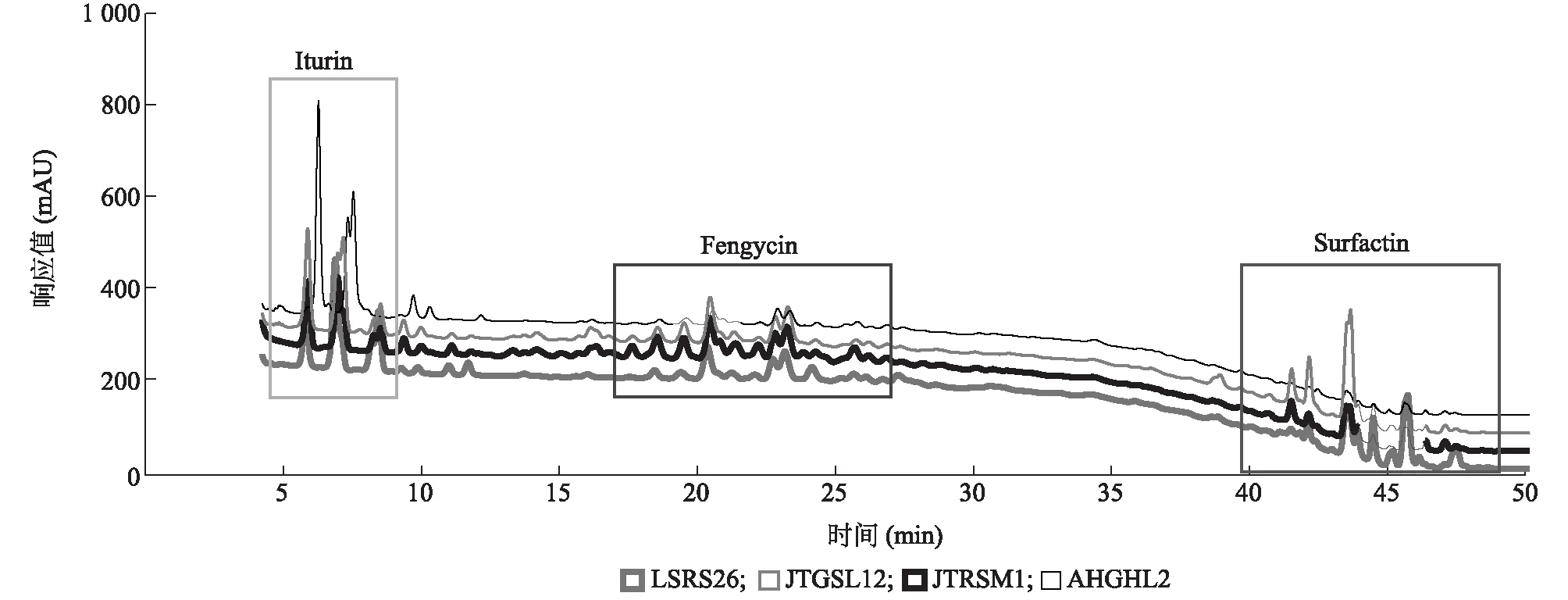
综合拮抗细菌的抑菌活性、生防相关特征、种属鉴定以及后期发酵生产的难易等因素,本研究选择拮抗菌LSRS26、JTRSM1和JTGSL12进行水稻促生作用评价。利用拮抗菌不同浓度的孢子液对水稻种子进行浸种处理,评价其对种子发芽和胚根伸长的促进作用。试验结果(图5)显示,当用OD600=0.01和1.00的拮抗菌芽孢菌液浸种后,LSRS26、JTRSM1和JTGSL12菌株对水稻种子发芽都没有促进作用;当用OD600=0.10的菌液浸种后,菌株LSRS26和JTRSM1对水稻发芽和胚根伸长都具有促进作用,JTGSL12处理与对照无显著差异。盆栽苗期株高和植株鲜质量数据分析结果(图6)表明,用OD600=0.10的菌液浸种后,3株芽孢杆菌对水稻植株鲜质量和株高都具有不同程度的促进作用,其中JTGSL12对水稻植株鲜质量增加的促进效果最为显著。用菌株JTGSL12处理后,水稻株高平均达23.57 cm,植株鲜质量平均为0.372 g;用菌株JTGSM1处理后,水稻植株鲜质量平均为0.325 g。

图5 拮抗细菌对水稻种子发芽和胚根伸长的促进作用Fig.5 Promotion effects of antagonistic bacteria on rice germination and radicula elongation
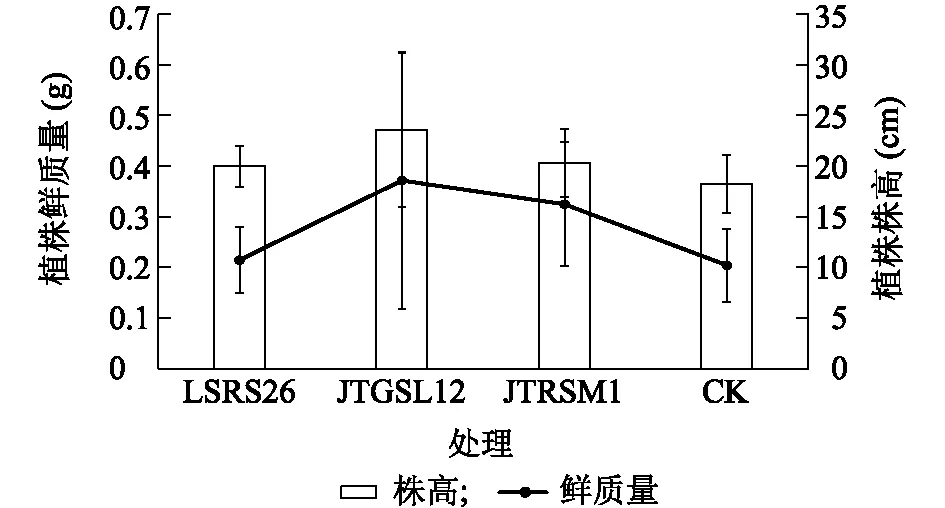
图6 拮抗细菌(OD600=0.10)对水稻株高和鲜质量的促生作用Fig.6 Promotion effects of antagonistic bacteria on rice plant height and fresh weight
2.5 拮抗细菌对水稻苗期恶苗病的盆栽防治效果
利用不同浓度(OD600=1.0和OD600=0.1)菌液对带病稻种浸种24 h后,进行催芽播种,并在30 d时调查水稻植株恶苗病发病情况,结果(图7)显示,在菌液OD600=1.0时浸种,3株芽孢杆菌对水稻恶苗病都表现出不同程度的防治作用,防效为58.00%~72.00%,其中JTGSL12的防效最高,为71.62%。在菌液OD600=0.1时浸种,3株芽孢杆菌对水稻恶苗病的防效均比菌液OD600=1.0时显著下降,防效为32%~50%,其中LSRS26的防效较好。
不同处理间标有不同小写字母表示差异显著(P<0.05)。图7 拮抗菌发酵菌液对水稻恶苗病苗期防效评价Fig.7 Control effects of antagonistic bacteria on rice bakanae disease in seedling stage
3 结论与讨论
由藤仓镰刀菌复合菌群引起的水稻恶苗病近年来在中国稻区时有发生,造成不同程度的危害,其中藤仓镰刀菌、层出镰刀菌分布最广,致病力最强,也是引起江苏省水稻恶苗病的主要病原菌种类[16]。由于恶苗病病菌对常用化学药剂咪鲜胺、氰烯菌酯等的抗药性增强和植保绿色防控技术的推广,使用生物防治技术防治水稻恶苗病的相关研究逐渐增多。有研究报道,枯草芽孢杆菌、解淀粉芽孢杆菌、多黏芽孢杆菌和放线菌等可用于防治水稻恶苗病[17-21]。本研究从植物根际土壤中分离获得不同形态的细菌432株,以不同水稻恶苗病致病菌F.fujikuroi、F.proliferatum、F.asiaticum、F.graminearum为指示菌,筛选获得6株对不同水稻恶苗病病菌均有较好抑制效果的拮抗菌,其中4株鉴定为解淀粉芽孢杆菌,2株鉴定为杰米拉类芽孢杆菌。本研究获得的拮抗菌是以恶苗病致病菌复合菌群为指示菌进行筛选,区别于以往报道的以单一病原菌为指示菌的筛选;这些拮抗菌更适用于防治复合菌群引起的水稻恶苗病,可为开发适用范围更广的生防制剂积累菌株资源。
芽孢杆菌活体微生物制剂效价的稳定性和货架期主要受其抑菌活性物质、定殖能力和芽孢形成能力的影响。拮抗菌的生物膜形成能力与其在生境中的定殖能力密切相关,游动能力决定了生防菌在根围的营养摄取能力,脂肽类抗生素的产生直接与生防芽孢杆菌的抑菌效果密切相关[22-25]。本研究在筛选获得6株拮抗菌后,进一步评估了菌株的生物膜形成能力、群集游动能力和芽孢杆菌产脂肽类物质的情况。解淀粉芽孢杆菌LSRS26、JTGSL12和JTGSM1在对恶苗病病菌的抑菌效果、生物膜形成能力、群集游动能力和产抑菌物质方面表现较为优秀,且易于生产、发酵形成芽孢;而菌株JTLM2和JTGSM22为杰米拉类芽孢杆菌,与多黏芽孢杆菌同源,虽有较强的抑菌活性,但JTLM2的游动能力最差,JTGSM22在培养基中产生的多糖较多,不利于定殖和液体生产、发酵。综合以上分析,本研究最终选择芽孢杆菌LSRS26、JTGSL12和JTGSM1进一步开展对水稻的促生作用和对恶苗病的防治效果研究。
随着测序技术的发展,早期枯草芽孢杆菌菌群中的解淀粉芽孢杆菌被进一步划分为单一的新种[26]。基因组序列分析发现,解淀粉芽孢杆菌比枯草芽孢杆菌含有更多的次生代谢产物合成基因簇,且可产生种类更多的抑菌物质,如解淀粉芽孢杆菌FZB42可以产生Surfactin、 Fengycin、Bacillomycin D等,而枯草芽孢杆菌模式株Bs168虽然含有部分脂肽类抗生素的合成基因簇,但不能正常合成相应物质[27]。本研究中,高效液相色谱检测结果表明,菌株LSRS26、JTGSL12和JTGSM1产生的Iturin和Fengycin相对较多,而这些物质是抑制真菌的主要活性物质。本研究按照平板抑菌效果、定殖能力、游动能力和产抑菌物质能力,并结合后期菌株发酵难易程度等多个标准筛选和评价生防菌,与郭坚华等[28]的研究思路类似,并进行了必要的扩展,这更有利于精准获得在田间具有潜在应用价值的菌株资源。
水稻种植大户主要采用化学种子处理剂进行水稻恶苗病的防治,随着国家农药、化肥双减工作的推进,绿色防控势在必行[29-30],而微生物农药使用是其中的重要部分,因此,生防菌筛选确定后,继续研发生物农药制剂是推进市场应用的必然过程。本研究团队后续将以筛选获得的生防菌株作为材料,进一步研发防治水稻恶苗病的种子处理剂。虽然,生物防治越来越多地应用于病害防治领域,但与化学药剂防治相比,生物防治效果相对较差,且不稳定。因此,可以在种子处理剂研发过程中,加强助剂的筛选、生防菌与现有化学农药的兼容性等方面的研究,筛选可以增效的助剂和具有兼容性的化学药剂,后期田间生产中可以考虑将生物农药与化学农药混用,既降低化学农药用量,又可以保证防治效果。
