邻甲氧基肉桂酸抗衰老活性及机制研究△
2022-09-07王析瑞刘永建刘岑杜裕杨洪柳刘永刚
王析瑞,刘永建,刘岑,杜裕,杨洪柳,刘永刚
北京中医药大学 中药学院,北京 102488
衰老是一个复杂的过程,受体内外多种因素共同影响,并会导致各种其他疾病的发生。如何延缓衰老及减少其相关疾病的发生是人类社会面临的主要挑战之一。衰老与氧化应激的关系密不可分。衰老的相关学说之一氧化应激学说认为,氧化性损伤是导致衰老的根本原因,可以通过抗氧化药物降低体内自由基水平,进而延缓机体衰老[1]。
邻甲氧基肉桂酸(OMA)是一种合成香料,具有特有的脂香气及花香,主要用于日化香精,还可用于肥皂、化妆品和洗涤剂等用品的加香[2]。邻甲氧基肉桂酸酯类是日化护肤品配方中的抗紫外线剂[3],而其合成的重要原料正是OMA。经过初步筛选,OMA 具有一定的抗氧化活性,且其合成工艺简单、反应温和、合成原料与试剂廉价易得、总收率高、具有较高的安全性[4]。OMA 还存在于桂枝中,现代药理研究表明,桂枝具有良好的抗衰老活性[5-6]。目前国内外学者主要关注桂枝的挥发油部位及复方功效,较少涉及抗衰老活性成分的研究,其活性成分尚不明确。因此,寻找桂枝抗衰老的活性成分对其物质基础研究具有重要意义。
秀丽隐杆线虫(Caenorhabditis elegans,以下简称线虫)与传统动物模型相比具有许多优点,如体形小、寿命短、易操作、成本低、遗传背景清晰、透明度高、具有完全测序的基因组及超过65%与人类相关的基因等[7]。线虫和哺乳动物之间的一些衰老现象很相似,如脂褐素浓度增加、运动减慢和神经系统退化[8]。而且,由于线虫身体透明,通过荧光标记可以直接在体内观察其神经元及亚细胞结构,这些优势使线虫广泛应用于抗衰老疾病的研究中[9-11]。线虫作为一种模式生物,在鉴定可能有益于延缓衰老的中药和天然药物并研究其作用机制方面具有很高的价值[12-13]。
本研究采用线虫模型,探索OMA 对线虫体长、脂褐素含量等的影响,并进一步利用线虫转基因株系探究OMA抗衰老的潜在作用机制,为其治疗衰老等相关疾病的研究提供参考。
1 材料
1.1 试药
OMA(批号:091128,纯度≥98%,武汉远城科技发展有限公司);1-苯氧基-2-丙醇、胰蛋白胨、酵母提取物、琼脂、蛋白胨、胆固醇、无水乙醇、次氯酸钠、二甲基亚砜(DMSO)均购自北京虹湖化工有限公司;碳酸钠、氯化钠、氯化钙、磷酸二氢钾、氢氧化钾、硫酸镁、磷酸二氢钠、氯化铵、氢氧化钠等试剂均购自兰博利德生物科技有限公司。
1.2 菌株及线虫
菌株和线虫均由中国科学院遗传与发育生物学研究所惠赠;缺陷型大肠埃希氏菌(Escherichia coliOP50);野生型线虫株N2;线虫株TJ356,基因型:zls356 [daf-16p::daf-16a/b::GFP+rol-6 (su1006)],绿色荧光蛋白(GFP)融合衰变加速因子-16(DAF-16)蛋白;线虫株CF1553,基因型:muls84 [(pAD76)sod-3p::GFP+rol-6 (su1006)],GFP 融合超氧化物歧化酶-3(SOD-3)蛋白。
1.3 仪器
Revco PLUS 型-80 ℃低温冰箱(美国Thermo公司);SW-CJ-2FD标准型双人单面净化工作台(苏州博莱尔净化设备有限公司);SPX-250 型生化培养箱(北京科伟永兴仪器有限公司);SMZ745 型体式显微镜、D-LH/LC 型荧光倒置显微镜(日本Nikon公司);SP8 型激光共聚焦显微镜(德国Leica 公司);YXQ-LS-100SⅡ型高温高压灭菌锅(上海博迅医疗生物仪器股份有限公司);KQ100VDB 型双频数控超声波清洗器(昆山禾创超声仪器有限公司);BSA124S-CW 型万分之一电子分析天平(德国赛多利斯公司);SYG-A2-6 型电热恒温水浴锅(天津市泰斯特仪器有限公司);LX-300 型迷你离心机、VORTEX-7 型迷你混合仪(海门市其林贝尔仪器制造有限公司)。
2 方法
2.1 加药培养基及加药E.coli OP50的配制
为保证线虫能够充分暴露于药物中,培养基及E.coliOP50 中都补充了对应浓度的OMA。用DMSO溶解OMA,配制成100 mmol·L-1母液。将配制好的药物母液与培养基混合,制成含OMA 63、125、250 μmol·L-1的培养液,倒入培养板中。培养板在室温下保存,直到琼脂凝固,然后在4 ℃下保存。用E.coliOP50 溶液对配制好的药物母液进行稀释,充分混匀后配制成含OMA不同浓度(63、125、250 μmol·L-1)的食物添加到培养基中。
2.2 线虫的培养
无菌环境下,在培养基中接种E.coliOP50 50 μL后,放置于生化培养箱中1 d后可用于培养线虫。线虫在培养基上生长发育,培养于22 ℃恒温培养箱。根据实验需要,3~4 d 转1 次板,避免线虫过于拥挤或处于饥饿状态而进入dauer时期,同时还需要保证线虫的干净,防止霉菌、细菌及螨虫等污染。
2.3 OMA抗衰老活性研究
2.3.1 线虫体长测定 将经过同步化生长至L4期的线虫分为对照组和OMA 不同浓度组,分别置于含OMA 0、63、125、250 μmol·L-1的培养板中,给药处理24 h后,将线虫挑至滴加1滴M9溶液(磷酸二氢钾+磷酸二氢钠)的载玻片上,再滴加1滴0.5%1-苯氧基-2-丙醇溶液麻醉,待虫体变直,将玻片放置于倒置显微镜上,对至少60条线虫进行拍照,利用倒置显微镜自带软件测量线虫体长。
2.3.2 线虫头部摆动能力测定 线虫分组及处理同2.3.1项下,给药处理3 d 后,将线虫转移到不含E.coliOP50 的培养基上。线虫头部摆动方向改变,其转向必须转过其身体朝向方向,记为1 次数据。在体视显微镜下观察并记录线虫在20 s 内的头部摆动次数。每组实验计数20条线虫。
2.3.3 线虫脂褐素含量测定 线虫分组及处理同2.3.1项下,给药处理5 d 后,将线虫挑至滴加1 滴M9溶液的载玻片上,再滴加1滴0.5%1-苯氧基-2-丙醇溶液麻醉,待虫体变直,在荧光显微镜下观察线虫,固定曝光时间和强度,设置激发波长为380 nm,发射波长为420 nm,拍摄不同组的荧光图片。之后使用Image J软件处理图片,统计不同组线虫体内脂褐素的荧光强度,每组实验至少计数60条线虫。
2.3.4 线虫氧化应激实验 将经过同步化生长至L4 期的线虫分为对照组和OMA 63 μmol·L-1组,分别置于含OMA 0、63 μmol·L-1的培养板中,给药处理3 d后,将各组线虫转移至含有0.1%双氧水(H2O2)的线虫培养板中,于体视显微镜下进行观察,记录每小时死亡线虫的数量,直到所有线虫死亡。每组实验至少计数60条线虫。
2.3.5 线虫热应激实验 线虫分组及处理同2.3.4项下,给药处理3 d 后,将线虫转移到37 ℃培养箱中进行观察,记录每小时死亡线虫的数量,直到所有线虫死亡。每组实验至少计数60条线虫。
2.4 OMA抗衰老作用机制研究
2.4.1 TJ356 线虫DAF-16 蛋白核转位实验 TJ356线虫是GFP 融合DAF-16 蛋白的线虫。在荧光显微镜下观察绿色荧光即可统计DAF-16 蛋白分布情况。将同步化后的TJ356线虫卵分为对照组和OMA不同浓度组,分别置于含OMA 0、63、125、250 μmol·L-1的培养板中。给药处理3 d 后,将线虫挑至滴加1 滴M9 溶液的载玻片上,再滴加1 滴0.5% 1-苯氧基-2-丙醇溶液麻醉,待虫体变直,在激光共聚焦显微镜下观察线虫并拍摄荧光图片。统计各组的线虫总数及线虫发生核转位占线虫总数的比例。每组实验至少计数30条线虫。
2.4.2 CF1553 线虫SOD-3 蛋白表达实验 CF1553线虫是一种GFP 标记SOD-3 蛋白的线虫,在荧光显微镜下观察其绿色荧光强度即可直接反映出SOD-3蛋白的表达情况。将同步化后的CF1553线虫卵分为对照组和OMA 不同浓度组,分别置于含OMA 0、63、125、250 μmol·L-1的培养板中。给药处理3 d后,将线虫挑至滴加1滴M9溶液的载玻片上,再滴加1滴0.5%1-苯氧基-2-丙醇溶液麻醉,待虫体变直,在激光共聚焦显微镜下观察线虫并拍摄荧光图片。然后使用Image J软件处理图片,统计不同组线虫全身的荧光强度。每组实验至少计数30条线虫。
2.5 统计学处理
使用SAS 9.4 统计软件进行统计分析,通过单因素方差分析对观察到的差异进行统计显著性评估,P<0.05为差异有统计学意义。
3 结果
3.1 OMA抗衰老活性研究
3.1.1 线虫体长测定 利用倒置显微镜自带软件进行线虫体长的测定(图1)。不同浓度的OMA 对线虫体长的影响见表1。实验结果表明,OMA 可以抑制线虫的体长。与对照组相比,随着浓度的增加,线虫体长不断减少,差异有统计学意义(P<0.001)。

图1 测量线虫体长代表性图(×40)
表1 OMA对线虫体长的影响(±s, n=60)

表1 OMA对线虫体长的影响(±s, n=60)
注:与对照组比较,***P<0.001;表4同。
3.1.2 线虫头部摆动能力测定 不同浓度的OMA对线虫头部摆动频率的影响见表2。实验结果表明,与对照组相比,不同浓度OMA 组线虫20 s头部摆动频率都有所减少,但差异无统计学意义。
表2 OMA对线虫头部摆动频率的影响(±s, n=20)

表2 OMA对线虫头部摆动频率的影响(±s, n=20)
3.1.3 线虫脂褐素含量测定 不同浓度的OMA 对线虫脂褐素沉积的影响见图2 和表3。实验结果表明,与对照组相比,不同浓度OMA 组线虫体内脂褐素含量均显著降低(P<0.001)。与OMA 63 μmol·L-1组相比,OMA 125、250 μmol·L-1组线虫体内脂褐素含量显著升高(P<0.001)。OMA 63 μmol·L-1组线虫体内脂褐素含量最低,对线虫体内脂褐素沉积的减缓作用最强,因此后续氧化应激及热应激实验选择OMA 给药浓度为63 μmol·L-1。
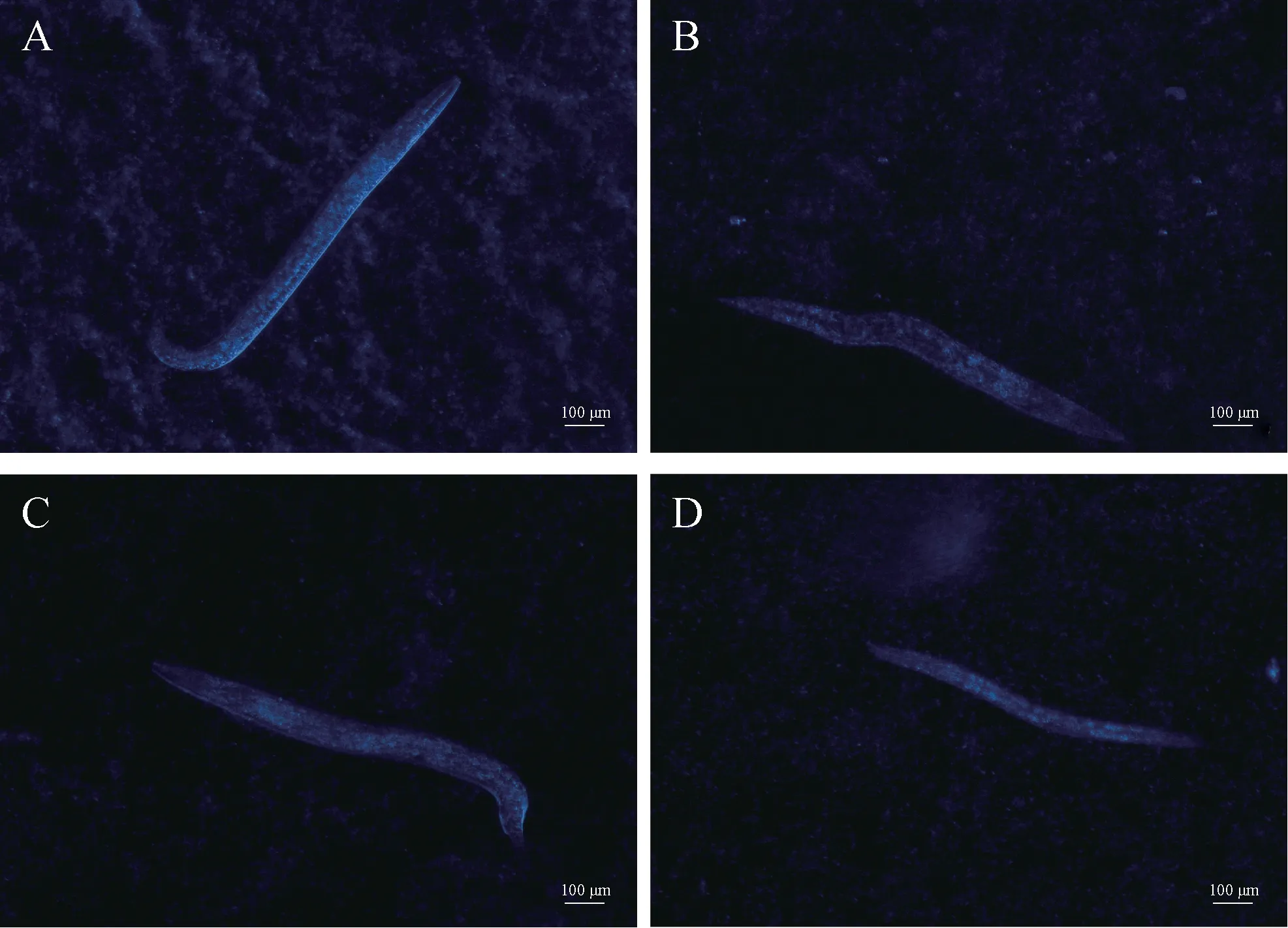
图2 OMA各浓度组线虫体内脂褐素荧光图(×40)
表3 OMA对线虫脂褐素沉积的影响(±s, n=20)

表3 OMA对线虫脂褐素沉积的影响(±s, n=20)
注:与对照组比较,***P<0.001;与OMA 63 μmol·L-1组比较,###P<0.001。
3.1.4 线虫氧化应激实验 线虫在H2O2应激环境中培养的生存曲线见图3。OMA 组线虫生存曲线与对照组相比有一定程度的右移,且差异有统计学意义(P<0.05)。

图3 氧化应激下OMA对线虫寿命的影响
3.1.5 线虫热应激实验 线虫在37 ℃环境中培养的生存曲线见图4。与对照组相比,在热应激条件下,OMA 组线虫在4~6 h 生存率提高,但差异无统计学意义。

图4 热应激下OMA对线虫寿命的影响
3.2 OMA抗衰老作用机制研究
3.2.1 TJ356线虫DAF-16蛋白核转位实验 DAF-16蛋白可调节线虫的抗逆性和持久性,其核定位对激活下游基因至关重要。OMA 对线虫DAF-16 核定位的影响见图5。DAF-16::GFP 的荧光在TJ356 线虫细胞内的定位主要分为细胞质定位、中间定位及细胞核定位。结果表明,对照组中,DAF-16::GFP 荧光细胞质定位占比为51.75%,中间定位占比为46.49%,细胞核定位占比为1.75%;OMA处理后,63 μmol·L-1浓度组中DAF-16::GFP 荧光细胞质定位占比为26.74%,中间定位占比为51.16%,细胞核定位占比为22.09%;125 μmol·L-1浓度组中DAF-16::GFP荧光细胞质定位占比为13.16%,中间定位占比为60.53%,细胞核定位占比为26.32%;250 μmol·L-1浓度组中DAF-16::GFP 荧光细胞质定位占比为22.22%,中间定位占比为47.22%,细胞核定位占比为30.56%。结果表明OMA 能显著促进DAF-16向细胞核的迁移。
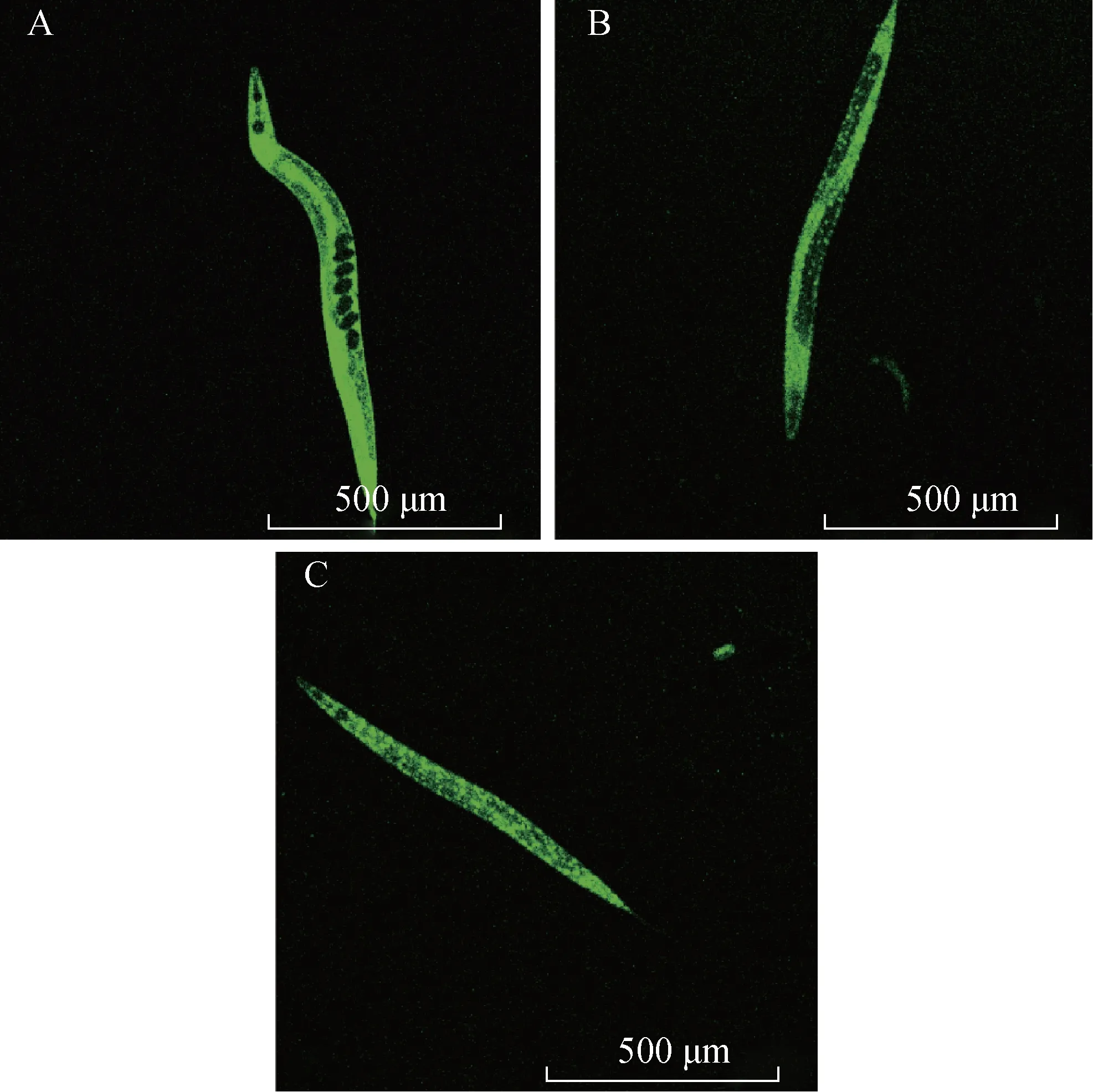
图5 OMA各浓度组TJ356线虫体内GFP荧光图(×40)
3.2.2 CF1553 线虫SOD-3 蛋白表达 为了进一步确认OMA 是否会影响DAF-16 的转录活性,利用SOD-3::GFP 的转基因线虫CF1553 观察SOD-3 蛋白的表达情况。结果如图6 及表4 所示,给药3 d 后,与对照组相比,OMA 各浓度给药组线虫的荧光强度均有所增高,250 μmol·L-1浓度组线虫的荧光强度最高,且差异有统计学意义(P<0.001)。进一步说明样品能激活DAF-16 转录因子,促进线虫DAF-16转录入核,从而促进SOD-3蛋白表达。
表4 OMA对CF1553线虫SOD-3蛋白表达的影响(±s, n=30~60)

表4 OMA对CF1553线虫SOD-3蛋白表达的影响(±s, n=30~60)
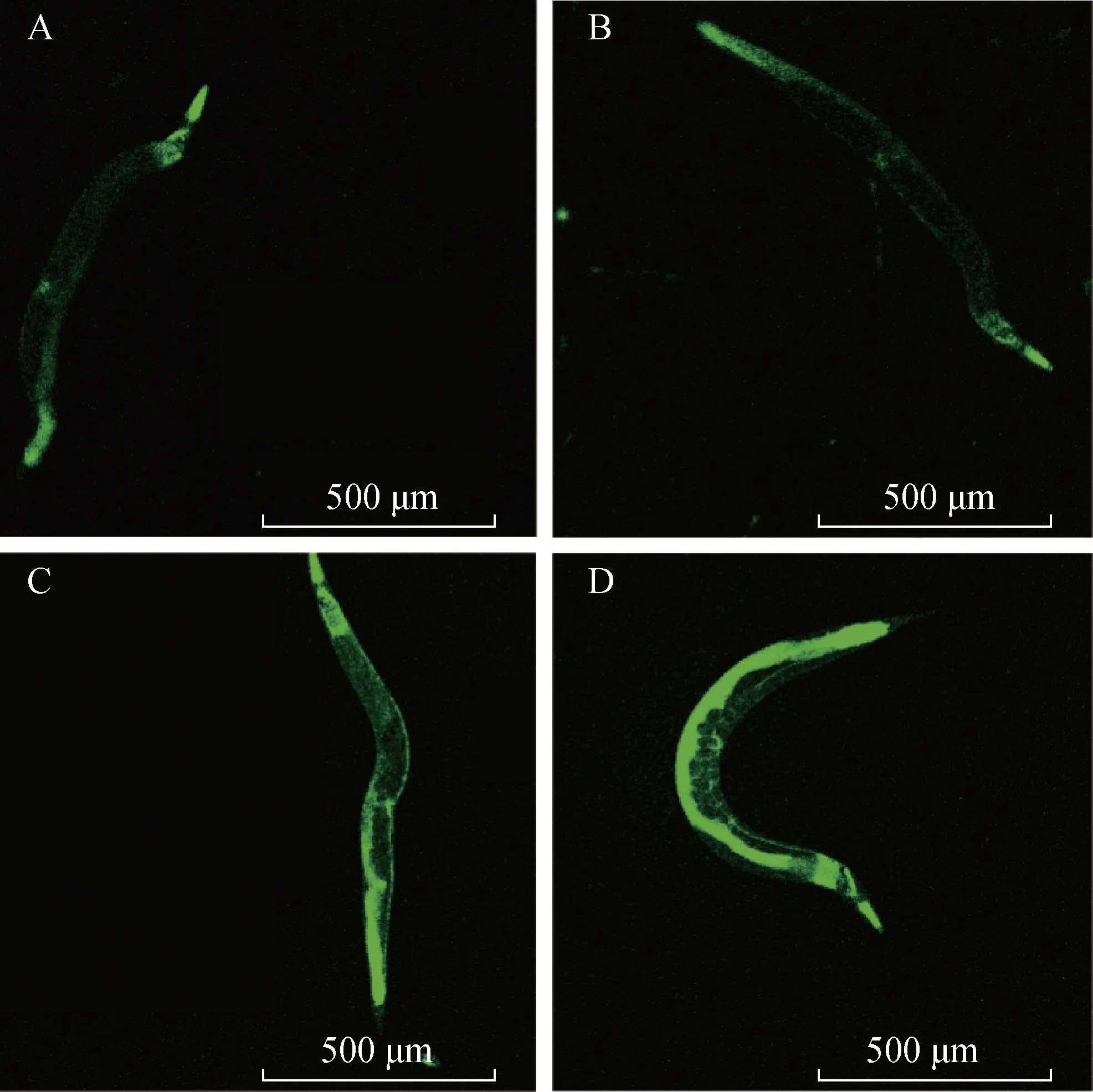
图6 OMA各浓度组CF1553线虫体内GFP荧光图(×40)
4 讨论
本研究探讨了OMA抗衰老的活性作用及其分子机制。与其他生物体一样,线虫表现出许多与年龄相关的变化。随着年龄的增长,线虫的活跃性降低,表现出一些不协调的运动,可通过测量其身体弯曲频率、头部摆动频率等检测这种变化。还有研究发现,线虫抗氧化能力的提高及寿命的延长往往伴随着线虫体长的减小[14-15]。本研究结果表明,OMA 可以抑制线虫的体长并降低其头部摆动频率,其可能会提高线虫抗氧化的能力并延长线虫的寿命。其他与年龄相关的变化还包括脂褐素积累增加[16]。脂褐素是一种自身荧光色素,在线虫体内积累,可以通过荧光显微镜检测。本研究通过检测给药5 d后线虫体内脂褐素荧光强度发现,与对照组比较,OMA 组线虫体内脂褐素荧光强度均明显降低,对线虫体内脂褐素沉积减缓有一定作用。说明OMA可以有效减少衰老引起的有害物质脂褐素的沉积,减少对机体的损伤,具有显著的延缓衰老的活性。
与衰老相关的信号通路中,胰岛素/胰岛素样生长因子-1(IIS)信号通路的研究最为广泛。DAF-16是作用于IIS信号通路的一种主要的转录因子,可调节线虫的抗逆性和持久性,DAF-16的核定位对激活下游基因至关重要。激活线虫DAF-16转录因子能上调一系列抗胁迫基因的表达,抑制线虫体内异常的蛋白沉积与错误折叠,提高机体的抗胁迫能力,延长线虫寿命。有研究报道,DAF-16 不仅受IIS 信号通路的调控,还受到许多其他信号通路和调控蛋白的调控。这些调控可以影响DAF-16的表达水平、核定位及转录活性,进而影响DAF-16对下游抗胁迫基因如sod-3的调控,调节线虫的生理活动。
本研究采用线虫转基因株系作为动物模型,通过DAF-16 核转位实验和SOD-3 融合GFP 荧光检测实验探究OMA 抗衰老活性是否依赖IIS 分子信号通路。TJ356株系线虫携带DAF-16::GFP融合蛋白,在正常生长发育条件下,TJ356 株系线虫周身呈现均匀弥散的绿色荧光,当DAF-16 转录因子被激活时,将发生核转位,绿色荧光细胞质定位转移为细胞核定位,在荧光显微镜下可以观察到明显的点状绿色荧光[17]。给药作用3 d 后,OMA 各浓度给药组线虫在荧光显微镜下能明显观察到荧光点,说明OMA能激活DAF-16 转录因子,促进线虫DAF-16 发生核转位。研究发现,SOD 对过量氧自由基具有清除作用,能减轻氧化应激对机体的损伤[18],且sod-3是daf-16的直接下游靶基因之一,由daf-16直接调控其转录。DAF-16 转录活性通过其下游基因sod-3的表达加以验证。转基因线虫CF1553 携带SOD-3::GFP融合蛋白,当CF1553 线虫sod-3基因被激活时,线虫体内将会大量表达GFP。本研究通过CF1553线虫SOD-3::GFP 实验发现OMA 能显著增强CF1553 线虫荧光强度,增加SOD-3蛋白表达量。
综上所述,OMA 具有良好的抗衰老活性,其作用机制可能是通过IIS 途径激活DAF-16 转录因子,促进线虫体内DAF-16 核转位,上调SOD-3 表达水平,提高机体抗氧化应激能力延缓线虫衰老。本研究初步阐释了OMA抗衰老的作用机制,为其在抗氧化、抗衰老方面的进一步研究提供了一定的理论依据,为后续实验验证提供了思路。
