风轮菜地上部分2个新的齐墩果烷型三萜皂苷△
2022-09-07徐明杰伍一炜赵迪徐玉岩潘巧岭赵田甜周伟松袁银银徐暾海朱寅荻
徐明杰,伍一炜,赵迪,徐玉岩,潘巧岭,赵田甜,周伟松,袁银银,徐暾海*,朱寅荻*
1.北京中医药大学 中药学院,北京 100029;2.温州医科大学 药学院,浙江 温州 325035
风轮菜Clinopodium chinense(Benth.)O.Kuntze为唇形科风轮菜属多年生草本植物,其地上干燥部分已收载于《中华人民共和国药典》2020 年版,作为断血流药用,味微苦、涩,性凉,归肝经,具有收敛止血之功,可用于崩漏、尿血、鼻衄、牙龈出血、创伤出血[1]。风轮菜中含有的丰富的三萜皂苷和黄酮类化合物具有抗炎、抗肿瘤、抗心肌缺血等活性[2-6],是其主要活性成分。为进一步寻找结构新颖、活性良好的化学成分,本研究对风轮菜地上部分进行提取分离,经硅胶、十八烷基硅烷键合硅胶(ODS)、Sephadex LH-20 柱色谱及制备高效液相色谱法(HPLC)等从其70%乙醇提取物的正丁醇萃取部位中分离得到11 个化合物,分别鉴定为3β,16β,23,28-四羟基-齐墩果烷-11(12),13(18)-二烯-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷(1)、3β,16β,23,28-四羟基-齐墩果烷-11(12),13(18)-二烯-3-O-[β-D-吡喃葡萄糖基-(1→2)]-[β-D-吡喃葡萄糖基-(1→3)]-β-D-吡喃葡萄糖苷(2)、柴胡皂苷a(3)、异落叶松脂素(4)、梣树脂酚(5)、8-羟基-7′-表松脂醇(6)、三角叶凤毛菊木脂素A(7)、柳叶柴胡酚(8)、异秦皮啶(9)、4-羟基-3-甲氧基苯基-1-丙烷-1,2-二醇(10)和布卢竹柏醇A(11),结构见图1。其中化合物1、2 为新化合物,分别命名为风轮菜皂苷F(clinoposaponin F,1)、风轮菜皂苷G(clinoposaponin G,2)。
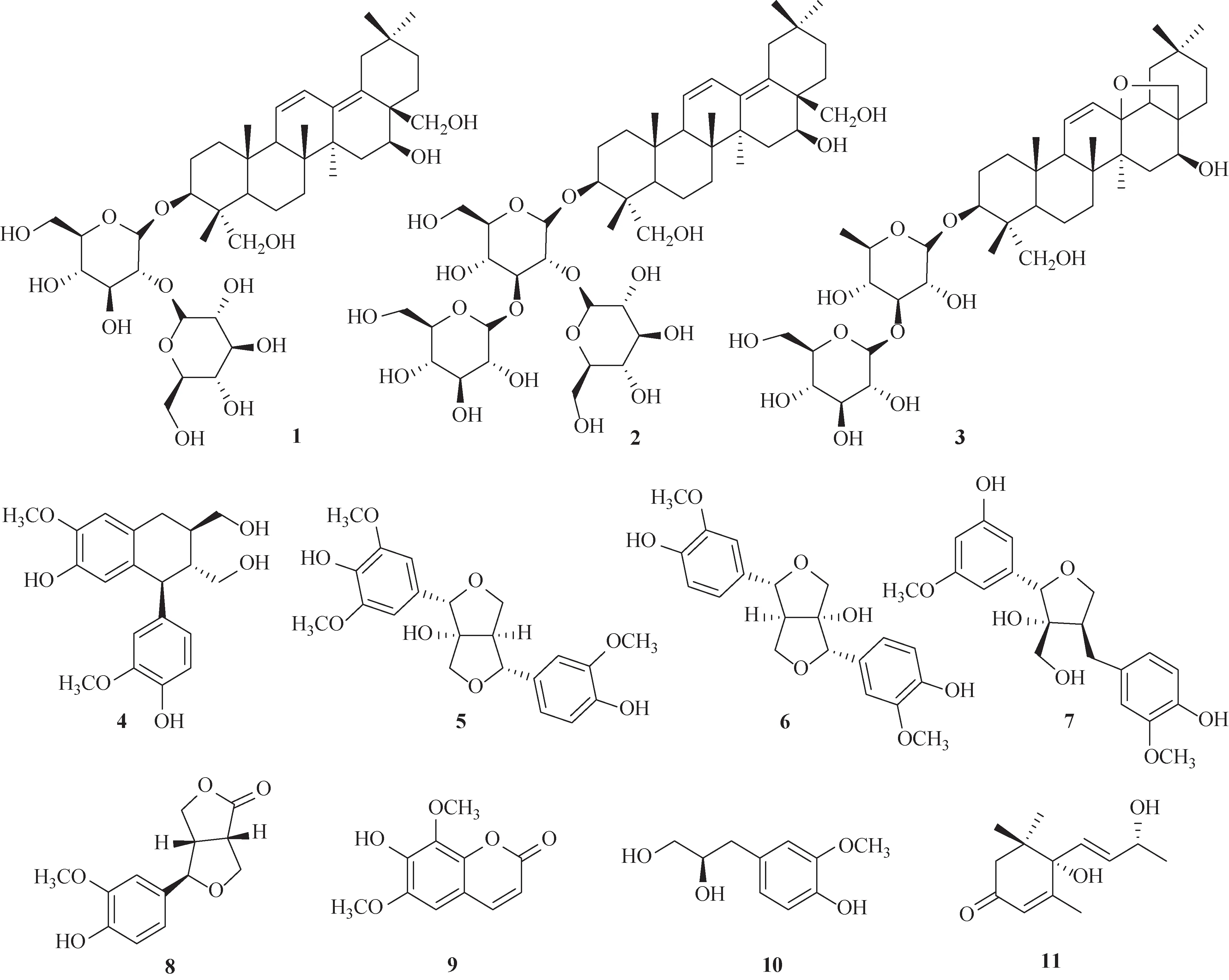
图1 风轮菜中分离得到的化合物1~11的化学结构式
1 材料
Avance Ⅲ600 型核磁共振仪(德国Bruker 公司);LTQ-Obit rap XL 型质谱仪(美国Thermo Fisher 公司);Triple TOF 6600 System 型高分辨率质谱仪(美国SCIEX 公司);1100 型高效液相色谱仪、6890 型气相系统配置火焰离子化检测器(FID)(美国Agilent公司);TU19型双光束紫外-可见光分光度计(北京普析通用仪器有限公司);FTIR-850 型傅里叶变换红外光谱仪(天津港东科技发展股份有限公司);MiFly-6 微型离心机(合肥艾本森科学仪器有限公司);YMC Pack ODS-A 型半制备色谱柱(250 mm×10 mm,5 μm)、C18反相填料均购于日本YMC 公司;柱色谱和薄层色谱硅胶(青岛海洋化工厂);D101 型大孔吸附树脂(南开大学);Sephadex LH-20(瑞典Amersham Biosciences公司)。
对照品D-吡喃葡萄糖(批号:110833-201205,纯度>99.5%,国药集团化学试剂有限公司);石油醚、乙酸乙酯、正丁醇、甲醇和乙醇等试剂为分析纯(国药集团化学试剂有限公司)或色谱纯(美国Tedia公司);水为实验室仪器自制超纯水。
风轮菜购于安徽省亳州市中药材市场,经安徽中医药大学药学院余世春教授鉴定为唇形科风轮菜属植物风轮菜Clinopodium chinense(Benth.)O.Kuntze。样品标本(20170820)现存于温州医科大学药学院。
2 提取与分离
风轮菜干燥地上部分60 kg粉碎后,经70%乙醇提取2 次,回收溶剂得到浸膏。浸膏加水分散后,依次用石油醚、乙酸乙酯和正丁醇萃取,回收溶剂得到各部分萃取物;将正丁醇萃取物加水混悬上D101 大孔吸附树脂柱,以30%、50%、75%、95%乙醇梯度洗脱,依次得到组分Fr.A、Fr.B、Fr.C 及Fr.D。
Fr.C 经硅胶柱色谱(100~200 目),以二氯甲烷-甲醇(100∶0→0∶100)梯度洗脱,经薄层色谱检识,合并共得16个组分(Fr.C.1~16);Fr.C.5经C18中压柱色谱,以甲醇-水(30∶70→100∶0)梯度洗脱,经薄层色谱检识,合并得到9 个组分(Fr.C.5.1~5.9);Fr.C.5.2 经多次Sephadex LH-20 柱色谱(甲醇)分离得到6 个组分(Fr.C.5.2.1~5.2.6),Fr.C.5.2.2 经半制备高效液相色谱(甲醇-水,74∶26)分离纯化,得到化合物1(5 mg,tR=27 min)和2(7 mg,tR=32 min);Fr.C.5.2.3 经半制备高效液相色谱(甲醇-水,76∶24)分离纯化,得到化合物3(6 mg,tR=30 min)。
Fr.A经硅胶柱色谱(100~200目),以二氯甲烷-甲醇(100∶0→0∶100)梯度洗脱,经薄层色谱检识,合并共得22个组分(Fr.A.1~22);Fr.A.2经C18中压柱色谱,以甲醇-水(30∶70→100∶0)梯度洗脱,经薄层色谱检识,合并得到7个组分(Fr.A.2.1~2.7),Fr.A.2.2再经硅胶柱色谱(100~200目),以石油醚-乙酸乙酯(100∶5→100∶50)梯度洗脱,经薄层色谱检识,合并共得12个组分(Fr.A.2.2.1~2.2.12),Fr.A.2.2.3 经Sephadex LH-20 柱色谱(甲醇为洗脱剂)及半制备高效液相色谱(甲醇-水,45∶55)分离纯化,得到化合物11(12 mg,tR=20 min);Fr.A.2.2.5 经Sephadex LH-20 柱色谱(甲醇为洗脱剂)及半制备高效液相色谱(甲醇-水,40∶60)分离纯化,得到化合物8(5 mg,tR=13 min)和9(4 mg,tR=20 min);Fr.A.2.2.8 经Sephadex LH-20柱色谱(甲醇为洗脱剂)及半制备高效液相色谱(甲醇-水,39∶61)分离纯化,得到化合物6(7 mg,tR=30 min);Fr.A.2.2.9 经Sephadex LH-20 柱色谱(甲醇为洗脱剂)及半制备高效液相色谱(甲醇-水,30∶70)分离纯化,得到化合物10(6 mg,tR=14 min);Fr.A.2.2.10 经Sephadex LH-20 柱色谱(甲醇为洗脱剂)及半制备高效液相色谱(甲醇-水,42∶58)分离纯化,得到化合物4(9 mg,tR=18 min)、7(5 mg,tR=22 min)和5(7 mg,tR=43 min)。
3 酸水解和糖构型的确定
取分离得到的新化合物各1 mg 于三氟乙酸-水(2∶1)1 mL 中溶解,95 ℃水浴回流2 h,冷却至室温,再用二氯甲烷1 mL 萃取3 次。水层减压浓缩干燥后旋蒸,并反复多次加入无水乙醇以除去三氟乙酸。薄层色谱检测(三氯甲烷-甲醇-水,8∶5∶1,下层),通过与单糖对照品的比移值(Rf)对比,确定水解得到的单糖种类。用无水吡啶2 mL 溶解水层样品,再加入L-半胱氨酸甲酯盐酸盐1.5 mg,密封,60 ℃加热1 h。冷却至室温,再加入三甲基氯硅烷-六甲基二硅胺烷(1∶2)0.5 mL,密封,60 ℃加热30 min。取单糖对照品D-吡喃葡萄糖1 mg,加入L-半胱氨酸甲酯盐酸盐1.5 mg、无水吡啶2 mL,溶解,密封,60 ℃加热1 h。再加三甲基氯硅烷-六甲基二硅胺烷(1∶2)0.5 mL,密封,60 ℃加热30 min。样品离心(4 ℃,10 min,3000 r·min-1,离心半径为5 cm),取上层进行气相色谱分析[7]。
气相色谱条件:Agilent 6890 型气相色谱系统;FID;HP-5 毛细管柱(30 m×0.25 mm,0.25 μm);柱温为150 ℃(2 min);程序升温(5 ℃·min-1到210 ℃);载气为N2,流速为1 mL·min-1;进样量为3.0 μL;进样口温度为250 ℃;检测器温度为250 ℃;分流比为1∶50。D-吡喃葡萄糖对照品衍生物tR为12.17、13.83 min;化合物1 的tR为12.14、13.76 min;化合物2的tR为12.16、13.81 min。
4 结构鉴定
化合物1:白色无定形粉末,易溶于甲醇;HRESI-MSm/z:819.450 9[M+Na]+(理论值为819.450 7),推断该化合物分子式为C42H68O14,不饱和度为9。紫外(UV)光谱(甲醇)显示在243、251、259 nm处有最大吸收,红外(IR)光谱(溴化钾压片)显示存在羟基(3291 cm-1)和双键(1621 cm-1)等官能团。
在核磁共振氢谱(1H-NMR)中显示,有6 个甲基单峰δH0.84、0.85、0.92、0.94、1.05、1.09;2 个次甲基烯烃信号δH5.65 (1H,d,J=10.8 Hz) 和6.51(1H,dd,J=10.8,3.0 Hz);2 对连氧的亚甲基信号δH3.78(1H,d,J=10.8 Hz)、4.45(1H,d,J=10.8 Hz)和4.20(2H,m);2 个连氧的次甲基质子信号δH4.22(1H,m)和4.22(1H,m)。在核磁共振碳谱(13C-NMR)中可以观察到42个碳信号,其中12个来自糖取代基(2 个端基碳信号δC104.4、106.5;2 个连羟基的亚甲基信号δC63.0、63.1;8 个连羟基的次甲基信号δC71.6~84.6)。此外,含有6个甲基碳信号δC13.4、17.4、19.2、22.4、25.2、32.7;2 个羟甲基碳信号δC65.1 (C-23) 和64.4 (C-28);2 个连氧次甲基碳信号δC82.7 (C-3) 和77.0 (C-16);4 个烯碳信号δC126.1 (C-11)、127.5 (C-12)、136.8 (C-13)、133.7 (C-18)。以上数据与文献[8]中风轮菜皂苷E(clinoposaponin E)的苷元数据基本一致,两者具有相同的苷元结构,即齐墩果烷-11(12),13(18)-二烯型三萜皂苷。
化合物1的苷元结构中共有9个不对称碳,分别为C-3、C-4、C-5、C-8、C-9、C-10、C-14、C-16和C-17。在ROESY 谱中,H-3 与H-5 相关,H-9 与H-5、H-27相关,H-27与H-16相关,上述已确定H-3为α构型,则H-5、H-9、H-16、H-24 和H-27 均为α构型。H-25 与H-24、H-26 相关且与H-27 无相关,H-27 与H-28 无相关,可以确定H-24、H-25、H-26和H-28 为β构型。另外,C-23 向高场位移,C-24 向低场位移,同样提示23-CH2OH为α构型,24-CH3为β构型[9-10];H-28与H-22远程相关,可知C-17位连有1 个羟甲基(图2~3)。通过HMBC 和HSQC 可知C-16 的化学位移为77.0,连有1 个羟基,C-16 的化学位移与C-α-OH 相比向低场位移[9,11],提示C-16-OH 为β构型。化合物1 中9 个不对称碳的构型与风轮菜皂苷E 相应碳的构型一致,以上数据可以确定化合物1 的苷元为3β,16β,23,28-四羟基-齐墩果烷-11(12),13(18)-二烯型三萜皂苷。

图2 化合物1和2的主要1H-1H COSY和HMBC相关
1H-NMR 谱中显示有2 个糖的端基质子信号δH5.13 (1H,d,J=7.8 Hz),5.41 (1H,d,J=7.8 Hz),根据其耦合常数可知其结构中糖苷键均为β构型。通过酸水解和气相色谱检测2 个糖均为D-葡萄糖基。在HMBC 谱中,δH5.13(H-1′)与δC82.7(C-3)有远程相关,δH5.41 (H-1ʺ) 与δC84.6 (C-2′) 有远程相关,且C-3 的化学位移向低场位移至δC82.7,由此可确定2个葡萄糖基以β(1→2)苷键相连,且与苷元3β-羟基成苷[10,12]。

图3 化合物1的主要ROESY相关
综上所述,化合物1 确定为3β,16β,23,28-四羟基-齐墩果烷-11(12),13(18)-二烯-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷,经SciFinder查询为新化合物,命名为风轮菜皂苷F。
化合物2:白色无定型粉末,易溶于甲醇;HRESI-MSm/z:981.503 9[M+Na]+(理论值为981.503 5),推断该化合物分子式为C48H78O19,不饱和度为10。UV光谱(甲醇)显示在242、252、260 nm处有最大吸收,IR光谱(溴化钾压片)显示存在羟基(3411 cm-1)和双键(1596 cm-1)等官能团。
分析化合物2和1的核磁共振波谱数据得出两者结构相似,具有相同的苷元,但化合物2比化合物1多了1 个葡萄糖基。通过酸水解和气相色谱检测,可确定化合物1 中的3 个糖基均为D-葡萄糖基,在1H-NMR(表1)中显示3 个糖的端基质子δH5.05(1H,d,J=7.8 Hz),5.74 (1H,d,J=7.8 Hz),5.34 (1H,d,J=7.8 Hz),由HSQC 谱可判断出其分别对应3 个糖基的端基碳信号δC104.6 (C-1′),104.3 (C-1ʺ),105.1(C-1‴),结合其耦合常数可知3 个糖基均为β-D-葡萄糖基。由C-3 与H-1′有HMBC 相关及C-3 的化学位移向低场位移至δC83.0,可知1 个葡萄糖基与3-β-OH成糖苷键;H-1′与H-2′有COSY相关,C-2′与H-1ʺ有HMBC 相关,可知第2 个糖基连接在C-2′-OH 上;H-2′与H-3′有COSY 相关,C-3′/C-3‴与H-1‴有HMBC相关,提示第3个糖基连接在C-3′-OH上。通过1H-1H-COSY、HSQC、HMBC 和NOESY 对该化合物的所有氢碳信号进行了归属,见表1。

表1 化合物1和2的1H-NMR和13C-NMR数据(600/150 MHz,吡啶-d5)

续表1
综上所述,化合物2 确定为3β,16β,23,28-四羟基-齐墩果烷-11(12),13(18)-二烯-3-O-[β-D-吡喃葡萄糖基-(1→2)]-[β-D-吡喃葡萄糖基-(1→3)]-β-D-吡喃葡萄糖苷,经SciFinder 查询为新化合物,命名为风轮菜皂苷G。
化合物3:黄色无定形粉末;1H-NMR(600 MHz,pyridine-d5)δ: 0.87 (3H,s,H-30),0.91 (3H,s,H-29),0.91(3H,s,H-24),0.97(3H,s,H-25),1.09(3H,s,H-27),1.39(3H,s,H-26),1.42(3H,d,J=6.6 Hz,H-6′),4.98 (1H,d,J=7.8 Hz,H-1′),5.36 (1H,d,J=7.8 Hz,H-1″),5.99(1H,brd,J=10.8 Hz,H-12),5.65(1H,dd,J=10.8,2.4 Hz,H-11);13C-NMR (150 MHz,CD3OD)δ: 38.4 (C-1),25.9 (C-2),81.3 (C-3),43.5 (C-4),47.0 (C-5),17.3 (C-6),31.4 (C-7),41.9 (C-8),52.8(C-9),36.0 (C-10),132.0 (C-11),130.9 (C-12),83.7(C-13),45.4 (C-14),35.9 (C-15),63.8 (C-16),46.8(C-17),51.9 (C-18),37.4 (C-19),31.3 (C-20),34.4(C-21),25.5 (C-22),63.6 (C-23),12.8 (C-24),18.5(C-25),19.8 (C-26),20.6 (C-27),72.8 (C-28),33.4(C-29),23.6 (C-30),105.8 (C-1′),71.6 (C-2′),85.0(C-3′),71.9 (C-4′),70.8 (C-5′),17.0 (C-6′),106.6(C-1″),75.6 (C-2″),78.6 (C-3″),72.3 (C-4″),78.2(C-1″),62.5(C-6″),以上波谱数据与文献报道的数据基本一致[13],故鉴定化合物3为柴胡皂苷a。
化合物4:白色无定型粉末;1H-NMR(600 MHz,CD3OD)δ:6.73(1H,d,J=7.8 Hz,H-5′),6.67(1H,d,J=1.8 Hz,H-2′),6.65 (1H,s,H-2),6.61 (1H,dd,J=7.8,1.9 Hz,H-6′),6.17 (1H,s,H-5),3.80 (3H,s,H-8′),3.77 (3H,s,3-OCH3),3.68 (3H,m,H-9b,9a,9′a),3.80 (1H,m,H-8′),3.39 (1H,m,H-9′b),2.77(2H,m,H-7),2.00 (1H,m,H-8),1.76 (2H,m,H-7′);13C-NMR (150 MHz,CD3OD)δ: 129.1 (C-1),113.8(C-2),149.2 (C-3),146.1 (C-4),117.5 (C-5),134.3(C-6),33.8 (C-7),40.0 (C-8),66.0 (C-9),138.8 (C-1′),112.4 (C-2′),147.4 (C-3′),145.4 (C-4′),116.1(C-5′),123.4 (C-6′),48.2 (C-7′),48.1 (C-8′),62.2(C-9′),56.4(3-OCH3),56.5(3′-OCH3)。以上波谱数据与文献报道的数据基本一致[14],故鉴定化合物4为异落叶松脂素。
化合物5:黄色油状物;1H-NMR (600 MHz,CD3OD)δ: 7.05 (1H,d,J=1.8 Hz,H-2′),6.87 (1H,dd,J=7.8,1.8 Hz,H-6′),6.77 (1H,d,J=7.8 Hz,H-5′),6.72 (2H,s,H-2,6),4.85 (1H,d,J=4.8 Hz,H-7′),4.67 (1H,s,H-7),4.46 (1H,t,J=8.4 Hz,H-9′a),4.07 (1H,d,J=9.0 Hz,H-9a),3.86 (1H,m,H-9b),3.85 (9H,s,3,3′,5-OCH3),3.76 (1H,dd,J=9.0,6.0 Hz,H-9′b),3.04 (1H,ddd,J=7.8,6.0,6.0 Hz,H-8′);13C-NMR (150 MHz,CD3OD)δ:149.3(C-3′),149.1 (C-3,5),147.6 (C-4′),136.5 (C-4),133.8 (C-1′),128.4 (C-1),120.7 (C-6′),116.2 (C-5′),111.4(C-2′),106.3 (C-2,6),93.1 (C-8),89.6 (C-7),87.9(C-7′),76.2 (C-9),72.2 (C-9′),62.6 (C-8′),56.9 (3,5-OCH3),56.5 (3′-OCH3)。以上波谱数据与文献报道的数据基本一致[15],故鉴定化合物5为梣树脂酚。
化合物6:黄色油状物;1H-NMR (600 MHz,CD3OD)δ: 7.03 (1H,d,J=1.8 Hz,H-2),6.94 (1H,brs,H-2′),6.84 (1H,dd,J=7.8,1.8 Hz,H-6′),6.78(3H,overlap,H-5,5′,6′),5.17(1H,d,J=6.4 Hz,H-7′),4.37 (1H,s,H-7),4.19 (1H,d,J=9.0 Hz,H-9a),3.90 (1H,d,J=9.0 Hz,H-9′a),3.86 (3H,s,3-OCH3),3.86 (3H,s,3′-OCH3),3.60 (1H,d,J=9.0 Hz,H-9b),3.22 (1H,t,J=9.0 Hz,H-9′b),3.09 (1H,m,H-8′);13C-NMR (150 MHz,CD3OD)δ: 149.1 (C-3′),148.8(C-3),147.7(C-4),146.9(C-4′),131.2(C-1′),129.1(C-1),121.8(C-6),119.4(C-6′),116.2(C-5′),115.8(C-5),112.9 (C-2),110.5 (C-2′),91.8 (C-8),91.0(C-7),82.9 (C-7′),76.9 (C-9),69.3 (C-9′),58.9 (C-8′),56.6 (3-OCH3),56.5 (3′-OCH3)。以上波谱数据与文献报道的数据基本一致[15],故鉴定化合物6为8-羟基-7′-表松脂醇。
化合物7:无色油状物;1H-NMR (600 MHz,CD3OD)δ: 6.95 (1H,s,H-6′),6.81 (1H,d,J=1.8 Hz,H-2),6.75 (1H,s,H-2),6.75 (1H,s,H-2′),6.72 (1H,d,J=7.8 Hz,H-5),6.65 (1H,dd,J=9.0,1.8 Hz,H-6),4.82 (1H,s,H-7′),4.06 (dd,J=6.4,8.4 Hz,H-9α),3.85 (3H,s,3′-OCH3),3.84 (3H,s,3-OCH3),3.79 (1H,d,J=11.4 Hz,H-9a),3.66 (1H,dd,J=5.4,8.4 Hz,H-9β),3.60 (1H,d,J=11.4 Hz,H-9b),3.09(1H,dd,J=13.2,3.0 Hz,H-7a),2.58 (1H,m,H-8),2.48 (1H,t,J=12.9 Hz,H-7b);13C-NMR (150 MHz,CD3OD)δ: 133.4 (C-1),113.5 (C-2),149.2 (C-3),146.9 (C-4),115.7 (C-5),122.4 (C-6),35.3 (C-7),52.1 (C-8),72.1 (C-9),130.9 (C-1′),121.7 (C-2′),147.4 (C-3′),116.3 (C-4′),148.8 (C-5′),112.8 (C-6′),85.7 (C-7′),83.4 (C-8′),64.6 (C-9′),56.5 (3-OCH3),56.5 (3′-OCH3)。以上波谱数据与文献报道的数据基本一致[16],故鉴定化合物7为三角叶凤毛菊木脂素A。
化合物8:白色粉末;1H-NMR (600 MHz,CD3OD)δ:6.96(1H,d,J=1.8 Hz,H-5),6.83(1H,dd,J=7.8,1.8 Hz,H-9),6.77(1H,d,J=8.1 Hz,H-8),4.66 (1H,d,J=6.6 Hz,H-3),4.53 (1H,dd,J=9.6,6.6 Hz,H-1α),4.36 (1H,dd,J=9.6,1.8 Hz,H-1β),4.30 (1H,t,J=8.4 Hz,H-1ʹα),4.09 (1H,dd,J=9.0,3.0 Hz,H-1ʹβ),3.86 (1H,s,6-CH3),3.55 (1H,td,J=8.4,3.0 Hz,H-2ʹ),3.20~3.24(1H,m,H-2);13C-NMR(150 MHz,CD3OD)δ: 71.1 (C-1),49.5 (C-2),87.9(C-3),132.4 (C-4),111.0 (C-5),149.4 (C-6),147.9(C-7),116.3 (C-8),120.4 (C-9),72.0 (C-1ʹ),47.7 (C-2ʹ),181.3(C-3ʹ),56.5(6-OCH3)。以上波谱数据与文献报道的数据基本一致[17],故鉴定化合物8为柳叶柴胡酚。
化合物9:黄色无定形粉末;1H-NMR(600 MHz,CD3OD)δ: 7.86 (1H,d,J=9.4 Hz,H-4),6.93 (1H,s,H-5),6.23 (1H,d,J=9.4 Hz,H-3),3.95 (3H,s,8-OCH3),3.90 (3H,s,6-OCH3);13C-NMR (150 MHz,CD3OD)δ: 163.7 (C-2),147.7 (C-6),146.8 (C-4),146.2 (C-9),144.9 (C-7),136.4 (C-8),112.9 (C-3),112.3 (C-10),105.2 (C-5),61.9 (8-OCH3),57.0 (6-OCH3)。以上波谱数据与文献报道的数据基本一致[18],故鉴定化合物9为异秦皮啶。
化合物10:无色针状晶体(甲醇);1H-NMR(600 MHz,CD3OD)δ: 6.82 (1H,d,J=1.5 Hz,H-6),6.65 (1H,d,J=7.8 Hz,H-3),6.66 (1H,dd,J=7.8,1.8 Hz,H-4),3.83 (3H,s,1-OCH3),3.76 (1H,m,H-8),3.49 (1H,dd,J=11.4,6.6 Hz,H-9a),3.42 (1H,dd,J=11.4,6.6 Hz,H-9b),2.73 (1H,dd,J=13.2,5.7 Hz,H-7a),2.59 (1H,dd,J=13.2,5.7 Hz,H-7b);13C-NMR (150 MHz,CD3OD)δ: 149.0 (C-1),146.1(C-2),116.2 (C-3),123.1 (C-4),131.7 (C-5),114.2(C-6),40.7 (C-7),74.9 (C-8),66.7 (C-9),56.5 (1-OCH3)。以上波谱数据与文献报道的数据基本一致[19],故鉴定化合物10 为4-羟基-3-甲氧基苯基-1-丙烷-1,2-二醇。
化合物11:黄色无定形粉末;1H-NMR(600 MHz,CD3OD)δ: 1.00,1.03 (各3H,s,11,12-CH3),1.24(3H,d,J=6.5 Hz,10-CH3),1.92(3H,d,J=1.0 Hz,13-CH3),2.15,2.52 (各1H,d,J=16.8 Hz,H-2),4.32(1H,m,H-9),5.78 (2H,m,H-7,8),5.87 (1H,brs,H-5);13C-NMR (150 MHz,CD3OD)δ: 42.6 (C-1),50.9(C-2),201.5(C-3),127.3(C-4),167.7(C-5),80.2(C-6),130.3 (C-7),137.1 (C-8),68.9 (C-9),24.0 (C-10),23.7 (C-11),24.7 (C-12),19.8 (C-13)。以上波谱数据与文献报道的数据基本一致[20],故鉴定化合物11为布卢竹柏醇A。
5 讨论
本研究运用多种色谱技术从风轮菜的70%乙醇提取物的正丁醇萃取部位中分离得到11 个化合物,其中化合物1 和2 为未见报道的新化合物,化合物4~11 为首次从该植物中分离得到。化合物1 和2 为齐墩果烷型三萜皂苷,化合物4~8 为木脂素类化合物,化合物9为香豆素,还有2个其他类型的结构。
风轮菜有止血之功,临床上主要应用于各种出血性疾病[5],现代研究发现其具有抗炎、抗肿瘤、抗心肌缺血再灌注损伤的活性。柴胡皂苷a 具有抗肿瘤、抗炎、抗癫痫、保肝护肝等作用[21];木脂素具有多种对人体健康有益的特性,而这种特性与其抗氧化能力密切相关[22];异落叶松脂素具有较强的1,1-二苯基-2-三硝基苯肼(DPPH)自由基、超氧阴离子自由基清除和还原能力[23];异秦皮啶具有抗炎[24]和抗癌[25]等活性,并且以Toll 样受体4(TLR4)/髓样分化蛋白2(MD-2)轴为靶点阻止骨关节炎发展[26];布卢竹柏醇A 对人体肿瘤细胞具有细胞毒性,但作用不显著[27],其他方面的研究较少。综上所述,本研究丰富了风轮菜的化学成分多样性,为寻找风轮菜属植物中新的、高效的生物活性成分提供了参考。
