大黄素-大黄素甲醚型二蒽酮化合物安全性研究△
2022-09-07汪祺杨建波文海若马双成
汪祺,杨建波,文海若,马双成
中国食品药品检定研究院,北京 100050
蛋白质酪氨酸磷酸酶1B(PTP1B)是一种在体内广泛表达于细胞内的蛋白质酪氨酸磷酸酶,为胰岛素的负调节剂,在调节胰岛素敏感性和能量代谢的过程中起着重要作用,PTP1B 可通过去磷酸化激活胰岛素受体或其底物上的酪氨酸残基,其抑制剂可以改善或延长胰岛素的作用,起到降血糖效果。大黄素-大黄素甲醚-二蒽酮(emodin physcion dianthrone,EPD)为有效的PTP1B 抑制剂,反式-EPD(trans-EPD)和顺式-EPD(cis-EPD)对PTP1B的半数抑制浓度(IC50)值分别为(2.77±1.23)、(7.29±2.32)μmol·L-1,是治疗2 型糖尿病的潜在有效成分[1]。本课题组前期已从传统中药何首乌中分离出trans-EPD 和cis-EPD,同时推测该类成分可能是何首乌发挥降糖作用的物质基础[2]。此外,已有研究表明,EPD 类具有高度共轭二聚体结构的双炔酮作为次生代谢产物广泛存在于陆地和海洋植物、动物和真菌中[3]。因此针对这类成分进行研究,可为相关新药开发和临床应用提供参考。
研究发现,尿苷二磷酸(UDP)-葡萄糖醛酸转移酶1A1(UGT1A1)为人体内源性物质胆红素的唯一代谢酶,当其被抑制时可引发胆红素代谢异常,造成肝内堆积引发肝损伤[4-8]。本课题组前期研究表明,何首乌中的大黄素-大黄素二蒽酮具有抑制UGT1A1的作用[9]。由于trans-EPD和cis-EPD与大黄素-大黄素二蒽酮结构特征极为相似,因此可能同为UGT1A1酶的底物并对其产生影响。
本研究以trans-EPD 和cis-EPD 为研究对象、UGT1A1 为研究切入点,结合分子对接、体外酶动力学实验及UGT1A1 蛋白和基因变化等结果,探究trans-EPD 和cis-EPD 是否具有潜在肝毒性风险,并从化合物构效关系的角度对这类单体成分进行安全性评价。
1 材料
1.1 仪器
ACQUITY™Ultra Performance LC 型超高效液相色谱仪(Waters 公司);VICTOR X5 型多功能酶标仪(PerkinElmer 公司);FQD-96A 型荧光定量聚合酶链式反应(qRT-PCR)仪(杭州博日科技股份有限公司);Nano-100 型分光光度计(杭州奥盛仪器有限公司);17R型高速低温离心机(Thermo公司);Vortex-Genie 2 型涡旋振荡器(Scientific Industries公 司);悬滴GravityPlus ™板及GravityTRAP ™板(Insphero公司);SDC-6节能型智能恒温槽(宁波新芝生物科技股份有限公司)。
1.2 肝微粒体、细胞及试药
人源肝细胞HepaRG(美国菌种保藏中心);大鼠肝微粒体(RLM,BD Gentest 公司);trans-EPD及cis-EPD均由中国食品药品检定研究院杨建波博士分离,纯度均大于98%;胆红素(批号100077-201206,纯度:99.3%,购自中国食品药品检定研究院);磷酸钾(纯度≥98%)、氯化镁(纯度≥98%)、抗坏血酸(纯度≥98%)、三羟甲基氨基甲烷(Tris,纯度≥98%)、还原型辅酶Ⅱ(NADPH,纯度≥98%)、氧化型辅酶Ⅱ(NADPNa2,纯度≥98%)、葡萄糖-6-磷酸脱氢酶(G-6-PDH,纯度≥98%)及D-葡萄糖-6-磷酸二钠(G-6-P,纯度≥98%)均购自北京百灵威科技有限公司;丙甲菌素(纯度≥98%)、尿苷二磷酸葡萄糖醛酸(UDPGA,纯度≥98%)、葡萄糖二酸单内酯(纯度≥98%)、二甲基亚砜(DMSO,纯度≥98%)均购自Sigma Aldrich公司;乙腈、甲醇均为色谱纯(默克公司);其他试剂均为分析纯(北京化学试剂厂);0.25%胰蛋白酶-乙二胺四乙酸(trypsin-EDTA)及胎牛血清(FBS)均购自Gibco 公司;琼脂糖(Spain Biowest公司);10 000×DuRed核酸染料(北京富百科生物技术有限公司);总RNA提取试剂盒、cDNA 第一链合成试剂盒、D2000 DNA Marker、Real SYBR Mixture及2×TaqPCR Mastermix均购于北京厚生博泰生物技术有限公司;引物由生工生物工程(上海)股份有限公司提供。
2 方法
2.1 分子对接
本课题组前期研究中采用Discovery Studio 2.5软件BLAST Search 模块,通过同源模建的方法成功构建了UGT1A1 蛋白结构,并同时识别出UGT1A1上的9 个活性口袋区(site A~I)[10]。本研究在此基础上应用该软件From Receptor Cavities 模块将trans-EPD 和cis-EPD 单体与UGT1A1 蛋白进行分子对接。由于UGT1A1 为胆红素唯一代谢酶,因此以胆红素为阳性对照,以胆红素对接打分值的80%作为最低标准,将打分高于阈值且相互作用模式与原配体相似的化合物定义为UGT1A1底物[11]。
2.2 UGT1A1体外抑制实验
应用本课题组前期已建立的RLM 孵育体系[4-6],研究trans-EPD 和cis-EPD 对UGT1A1 的作用及作用强度,同时启动Ⅰ、Ⅱ相代谢反应,以表观抑制常数(Ki)为最终评价指标。取蛋白质量浓度为0.5 mg·L-1的RLM 30 μL,加入系列浓度的胆红素对照品溶液(0.36~3.35 μmol·L-1)及EPD 单体溶液(trans-EPD 0.05~2.00 μmol·L-1,cis-EPD 0.05~1.50 μmol·L-1),置于37 ℃恒温水浴预孵育3 min,同时加入NADPH和UDPGA再生系统(UDPGA终浓度为5 mmol·L-1)。反应启动15 min 后加入含维生素C 200 μmol·L-1的冰乙腈-甲醇(2∶1)600 μL,沉淀蛋白,涡旋1 min 后13 000 r·min-1(离心半径为5 cm)离心25 min,取上清液1 μL 进行测定,测定方法见文献[12-13]。每个样本重复3次。
以胆红素及其代谢产物生成总量对应其底物浓度作图,纵坐标为加入EPD 后胆红素代谢速率的倒数(1/v),横坐标为胆红素浓度的倒数(1/S),采用米氏方程双倒数法作图;加入不同浓度EPD 对应不同曲线,以不同曲线斜率对胆红素浓度绘制slop图,求得Ki[9]。
2.3 HepaRG细胞毒性考察
取对数生长期的HepaRG 细胞,消化后调整密度为5×104个/mL接种于96孔板,每孔接种细胞约为5000 个,孵育24 h 后加入trans-EPD 和cis-EPD。设置空白对照组(不含HepaRG 细胞)、对照组(0.5% DMSO)、trans-EPD(0.1、0.3、1.0、3.0、6.0 nmol·L-1)组和cis-EPD(0.1、0.3、1.0、3.0、6.0 nmol·L-1)组。细胞孵育24 h(5%CO2,37 ℃),每孔加CCK-8 细胞活力检测试液10 μL,37 ℃避光孵育2 h,采用酶标仪于450 nm 处检测各孔吸光度(A),按公式(1)计算细胞存活率[14],并计算trans-EPD和cis-EPD对细胞的IC50。

2.4 qRT-PCR实验
细胞培养及给药同2.3 项下操作,设对照组、cis-EPD 组和trans-EPD 组,给药组浓度均为0.1、1.0、10.0 nmol·L-1。细胞经EPD 单体处理24 h 后用磷酸盐缓冲液(PBS)洗涤2次,加入0.25%胰蛋白酶-EDTA消化,离心收集细胞。
以β-肌动蛋白(β-actin)作为内参,正向引物:5′-AGCCATGTACGTAGCCATCC-3′,反向引物:5′-ACCCTCATAGATGGGCACAG-3′;UGT1A1 基因正向引物:5′-CTCCCCTGGATTCTCAGACC-3′,反向引物:5′-CCGTGCCACCCACAAAAC-3′;提取RNA后,经Nano-100型分光光度计测定浓度和纯度。采用cDNA第一链合成试剂盒反转录cDNA,进行qRT-PCR检测[15]。反应程序为95 ℃预变性10 min;95 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,40个循环。
2.5 统计学分析
实验数据均采用SPSS 13.0 软件处理分析,多组间比较采用单因素方差分析,数据以(±s)表示,以P<0.05为差异有统计学意义。
3 结果
3.1 UGT1A1蛋白分子对接
采用Discovery Studio 2.5 软件中的LibDock 功能,在确定trans-EPD 和cis-EPD 的对接口袋区后,对其与UGT1A1 蛋白的对接结果进行LibDock score值测定,由结果可知,trans-EPD 和cis-EPD 对接口袋为site F,与胆红素对接活性区相同。胆红素LibDock score 值为108.623(80% 打分阈值为86.898),trans-EPD为101.469,cis-EPD为103.15,均远高于阈值,因此提示trans-EPD 和cis-EPD 与UGT1A1 的亲和能力与胆红素底物相当。此外,由于trans-EPD 和cis-EPD 与胆红素结合位点为同一位点site F,存在竞争结合的可能,因此提示trans-EPD 和cis-EPD 对于UGT1A1 结合底物胆红素均可产生影响,使胆红素代谢受阻,存在引发肝损伤的风险。
trans-EPD 和cis-EPD 分子体积大,刚性强,存在较大的共轭体系(图1)。分析对接模式发现,trans-EPD 和cis-EPD 均与UGT1A1 中的氨基酸残基GLY332 形成了碳氢键,与ILE343、VAL345 形成了多个Pi-Alkyl 键,同时和PHE283 形成了更为稳定的Pi-Pi T shape键,增大了化合物与UGT1A1的疏水结合作用。从相互作用方式看,trans-EPD 和cis-EPD与UGT1A1蛋白对接模式基本一致(图2)。
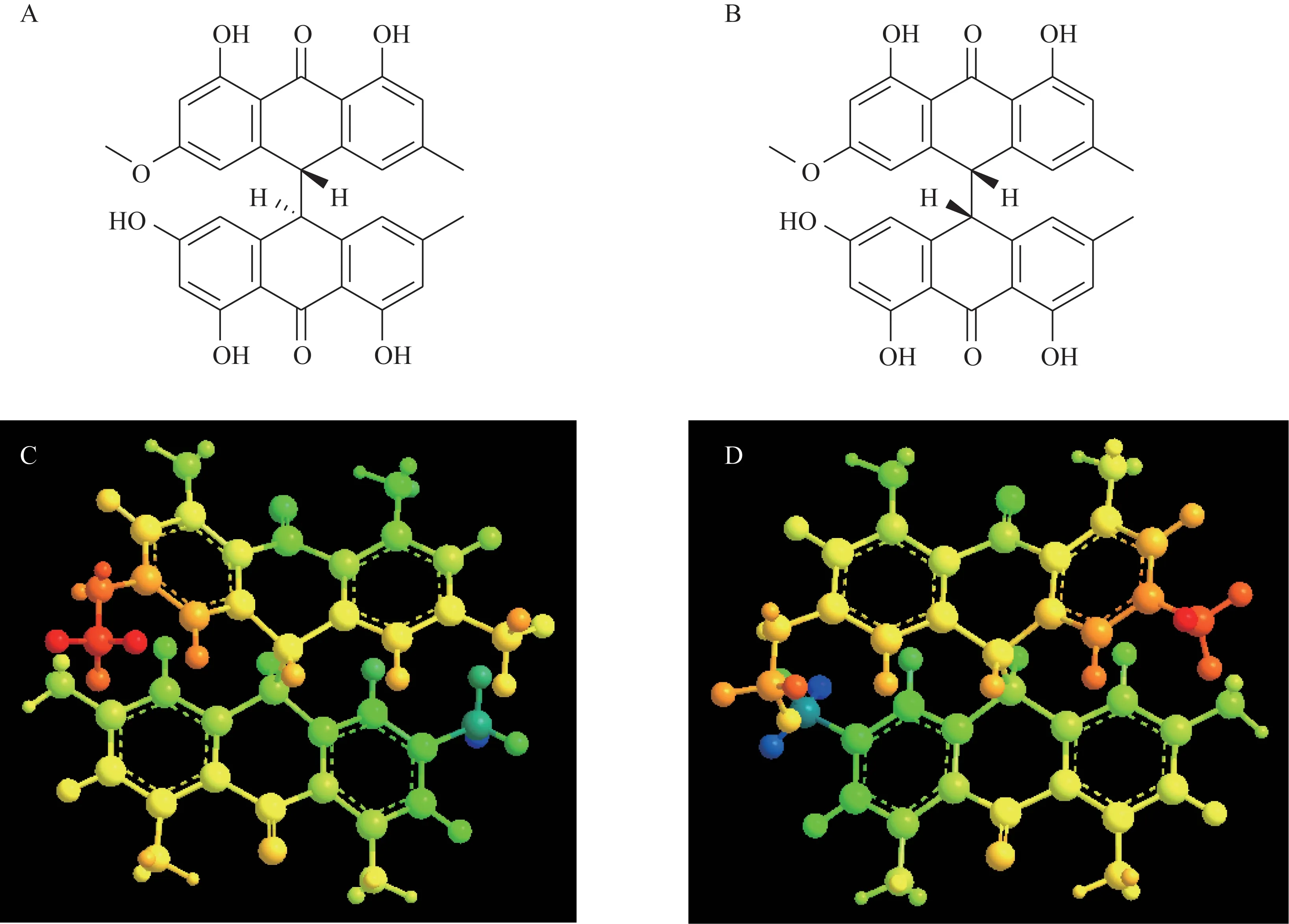
图1 trans-EPD和cis-EPD结构
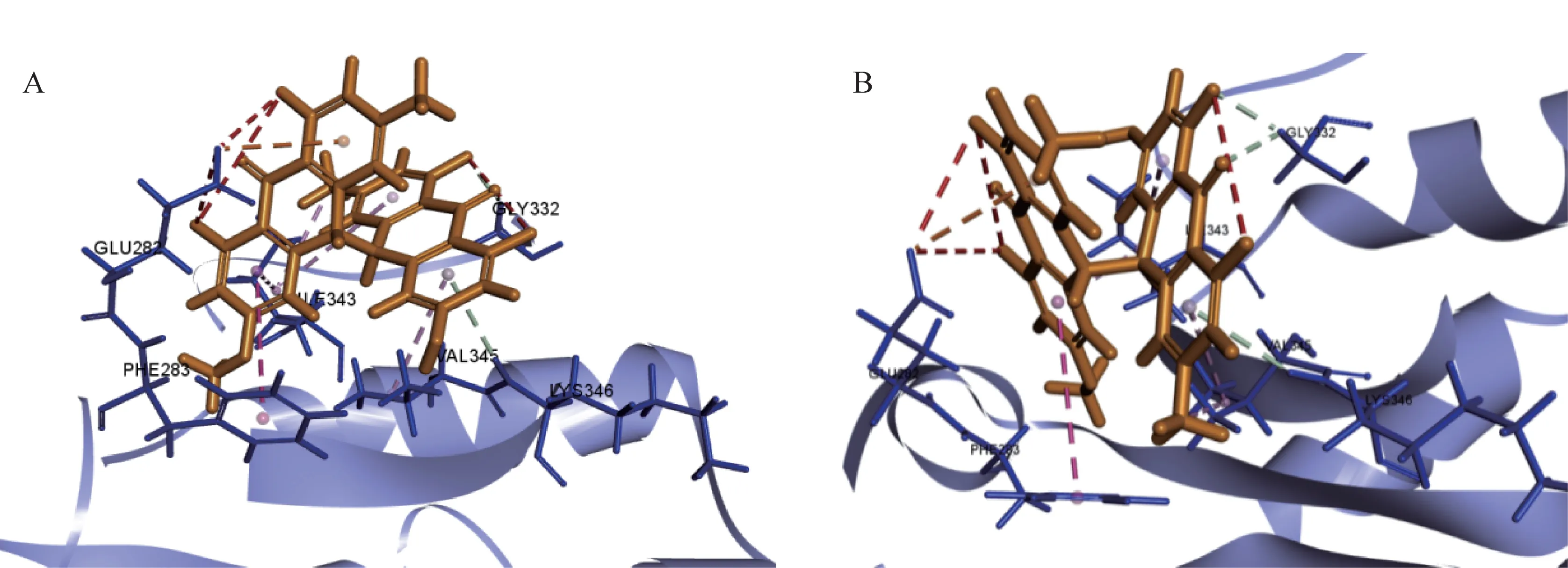
图2 trans-EPD和cis-EPD与UGT1A1蛋白对接模式
3.2 UGT1A1体外抑制实验
trans-EPD 和cis-EPD 在RLM 中对UGT1A1 酶的抑制情况见图3。由实验结果可知,trans-EPD 和cis-EPD 对UGT1A1 均表现出竞争型抑制作用,Ki值分别为5.22、11.45 μmol·L-1,抑制作用较强(Ki<1 μmol·L-1,强抑制;Ki>50 μmol·L-1,弱抑制[16]),与分子对接结果一致。
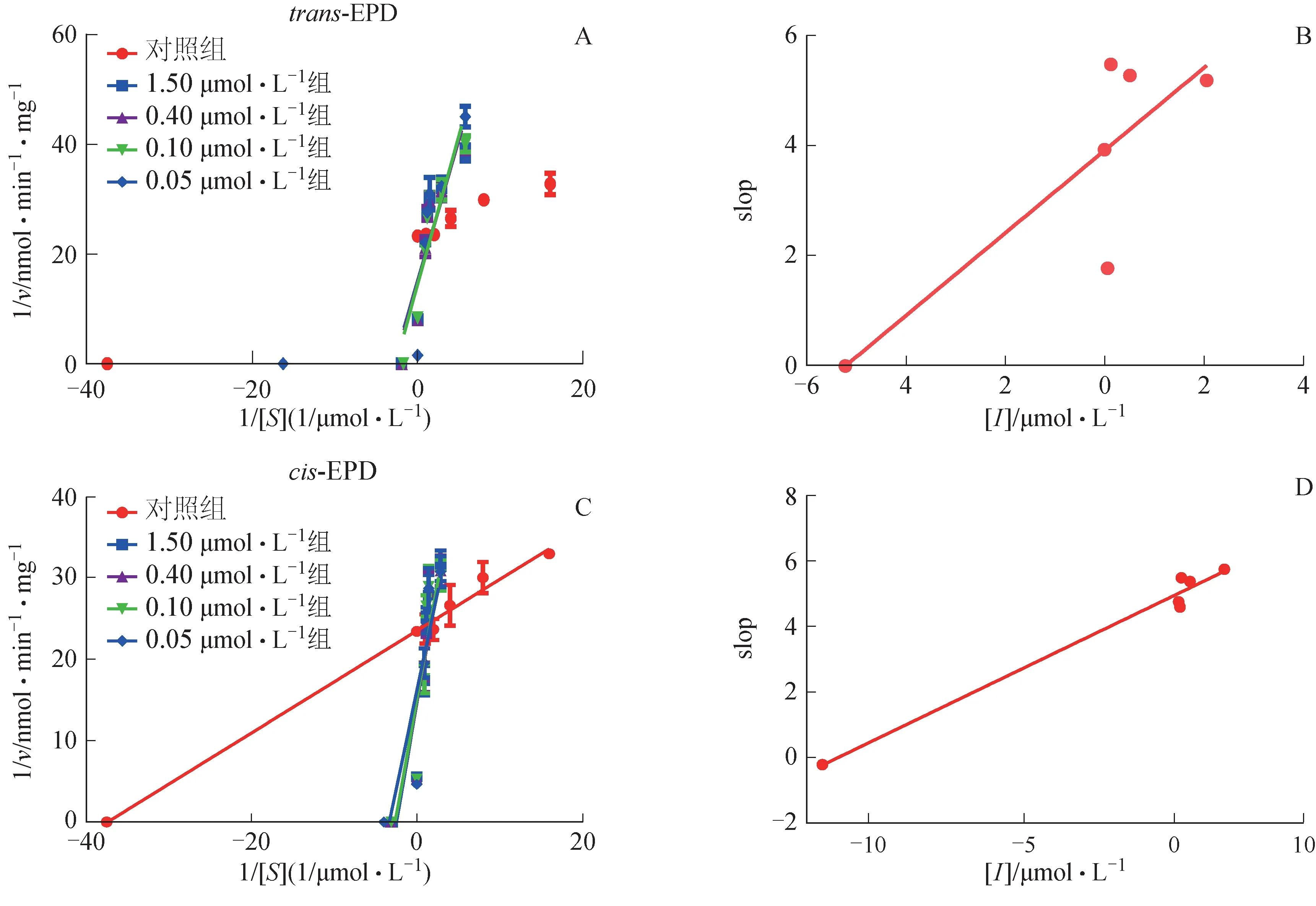
图3 trans-EPD和cis-EPD对UGT1A1的影响
3.3 HepaRG细胞毒性结果
由HepaRG 细胞毒性结果(图4)可知,trans-EPD(IC50为3.248 nmol·L-1)和cis-EPD(IC50为3.984 nmol·L-1)IC50值较小,提示具有肝细胞毒性风险。体外毒性实验数据与对接筛选结果相一致。
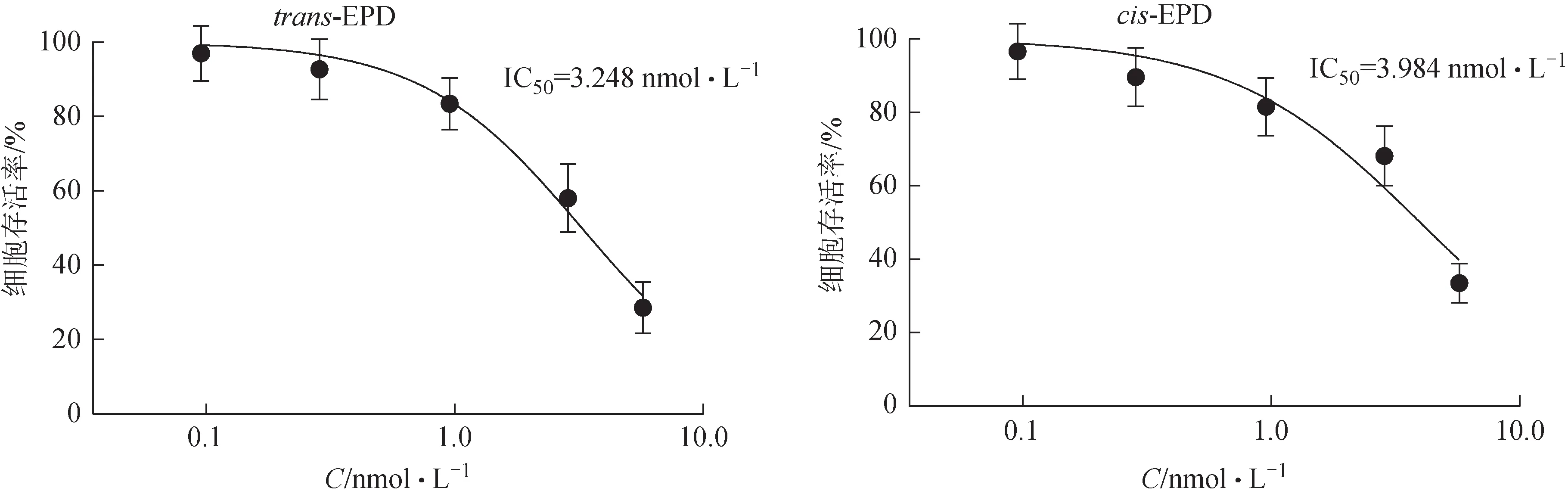
图4 trans-EPD和cis-EPD对HepaRG细胞活性的影响(±s, n=3)
3.4 UGT1A1 mRNA表达变化
由结果可知(图5),与对照组比较,trans-EPD和cis-EPD 低、中、高浓度下均可下调UGT1A1 mRNA 表达水平(P<0.05),且作用存在剂量效应相关性。结合体外UGT1A 抑制实验和细胞毒性数据,初步推测trans-EPD 和cis-EPD 可通过作用于UGT1A1 对肝细胞中胆红素代谢循环产生影响,存在引发肝损伤的可能。
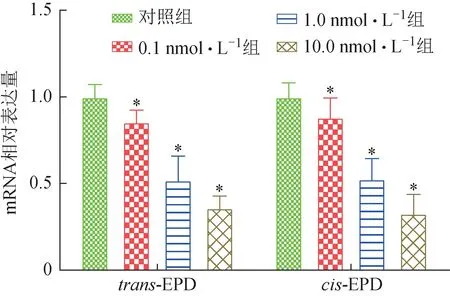
图5 trans-EPD和cis-EPD对HepaRG细胞中UGT1A1 mRNA表达的影响(±s, n=3)
4 讨论
在本课题组前期研究的基础上,本研究以胆红素的唯一代谢酶UGT1A1 为切入点,针对二蒽酮类成分trans-EPD 和cis-EPD 开展了安全性研究。通过分子对接实验,证明trans-EPD 和cis-EPD 均与UGT1A1 结合于site F,该位点同时也为胆红素的结合位点,提示其存在与胆红素争夺代谢酶的可能。trans-EPD 和cis-EPD 与UGT1A1结合的LibDock score 值与胆红素接近,提示两者与UGT1A1 的亲和能力与胆红素相当。分析对接模式发现,trans-EPD和cis-EPD共轭体系较大,分子结构增大的同时刚性增强,2 个化合物均与氨基酸残基形成了较强的疏水结合作用;此外共轭体系还与酶蛋白形成了更为稳定的Pi-Pi T shape 键,增强了化合物与UGT1A1的疏水结合作用。
体外UGT1A1 抑制实验结果显示,trans-EPD 和cis-EPD 均对UGT1A1表现为竞争型抑制,且抑制作用较强。体外细胞毒性实验结果表明,trans-EPD 和cis-EPD 均具有肝细胞毒性作用,低、中、高浓度下可对UGT1A1 mRNA 表达产生显著抑制作用,并且存在明显的剂量依赖关系。
综上所述,初步推测二蒽酮成分trans-EPD 和cis-EPD 可通过作用于UGT1A1影响胆红素代谢,进而可能产生肝毒性作用,同时提示具有这类母核结构的化合物可能同样存在毒性风险。本研究结果将为探讨二蒽酮类成分的临床肝毒性提供参考。
