缰核损毁对2型糖尿病大鼠泪膜破裂时间及泪液分泌的影响
2022-09-07张淼李子昂严宗辉杨娟李坤珂杨利敏
张淼 李子昂 严宗辉 杨娟 李坤珂 杨利敏
2型糖尿病(type 2 diabetes mellitus, T2DM)是一种常见的慢性代谢性疾病,自2000年以来,我国T2DM的发病率呈快速上升趋势[1]。糖尿病并发症是给患者带来身体及精神上伤害的主要因素,其中糖尿病眼病是最常见并发症之一,它能引起患者视力减退,最终导致失明。干眼症是一种受多因素影响的眼表疾病,以泪膜稳态失衡为主要特征,并伴有眼部不适症状,其主要病理生理机制为泪膜不稳定、泪液渗透压升高、眼表炎症、损伤以及神经感觉异常[2]。稳定的泪膜是眼部健康的标志,泪膜保护和湿润角膜,并形成了光线进入视觉系统的第一个界面,干眼患者会有视力下降和视力波动的主诉。有研究显示,干眼症与糖尿病眼病之间具有显著相关性[3]。至今为止,中枢神经系统对干眼症的调控作用尚无相关报道。缰核(habenular nucleus, Hb)是中脑内与大脑和脑干多个脑区具有密切纤维联系的重要中继站,参与机体多种生理功能的调节[4]。有研究显示,缰核损毁可改善T2DM大鼠的葡萄糖代谢紊乱[5],但其对T2DM干眼症是否有改善作用尚不清楚,本研究通过高脂高糖饮食结合低剂量链脲佐菌素诱导T2DM大鼠模型,观察电损毁缰核对T2DM大鼠泪膜破裂时间及泪液分泌的影响,探讨缰核对T2DM干眼症的调控作用。
材料与方法
一、实验动物与试剂
实验研究。SD雄性大鼠(清洁级,大连医科大学实验动物中心提供)24只,体重(210±30)g;饲养于标准环境内[室温(23±2)℃],相对湿度45%~55%,实验室通风良好,所有动物自由进食进水。1周后用电子天平秤称取、记录大鼠体重,并用苦味酸为大鼠标记实验编号。标记后将大鼠随机分为正常组(Control)、模型组(T2DM)、T2DM假手术组和T2DM损毁组,每组大鼠6只。
二、实验方法
1.T2DM大鼠模型制备:按照大鼠体重称取适量高脂高糖饼干喂养2周后,对大鼠进行称重,按照体重计算每只大鼠需要注射的STZ剂量,按35 mg/kg剂量对大鼠进行一次性尾静脉注射。注射STZ后大鼠继续进行高脂高糖饼干喂养,整个过程自由饮水。在整个造模期间要对大鼠血糖进行多次复测,密切观察大鼠血糖变化。直到大鼠空腹血糖持续高于11.1 mmol/L,并出现多食、多饮、多尿及体重减轻的症状并持续2周则被视为模型稳定。
2.Hb损毁:大鼠需禁食12 h,戊巴比妥钠(60 mg/kg)腹腔注射麻醉。应用鼠脑立体定位仪,根据鼠脑图谱定位Hb(前囟后3.4~3.8 mm,中线旁0.6~0.9 mm,硬脑膜下4.2~4.6 mm)所在的位置。应用牙科钻颅骨表面钻孔,电极尖端置入Hb并通电损毁(电流:2 mA,时长:1 min),应用相同方法损毁另一侧Hb。损毁完成后缝合头部皮肤,并消毒。假手术组大鼠经历相同的手术过程,但电极无电流通过。
3.泪膜破裂时间(breakup time,BUT)检测: 在常温、湿度适宜、避光室内环境下进行。使用抗生素滴眼液湿润但无多余残留药液的荧光素试纸接触下眼睑睑缘,使荧光素液体均匀涂布于眼表,在手持裂隙灯下观察角膜情况,运用秒表进行计时,记录最后一次眨眼后角膜表面出现首个黑斑的时间,每只眼至少测量3次,记录结果取平均值。
4.泪液分泌试验(Schirmer Ⅰ test,S I t):Schirmer试纸(5 mm × 35 mm)头端在起始线处折起,置入下眼睑外中1/3交界处的结膜囊内,测量5 min内泪液浸湿试纸的长度。Schirmer Ⅰ试验是无麻醉测试,反映主泪腺的分泌功能。
5.眼压检测:手持式回弹眼压计(TonoLab,Icare,Espoo,Finland)测量眼内压(intraocular pressure,IOP),打开眼压计,安装探针,将眼压计靠近大鼠眼睛,无需眼部麻醉,调整好距离,轻按测量按钮,依次完成6次测量,获得平均值,进行数据分析。
三、统计学分析方法
所有实验数据均使用Prism 8.0进行统计分析。两组间或同一组实验前后数据采用t检验方法进行数据分析。多组间数据比较采用单因素方差分析,组内及 组间两两比较采用LSD检验。以P<0.05为差异有统计学意义。
结 果
一、一般情况
与正常对照组相比,T2DM大鼠体重减轻且精神状态较差,制备模型中后期大鼠出现烦渴和多尿症状,而且由于喂食了高脂肪和高糖饲料,大鼠粪便呈黄色。注射STZ后个别大鼠会出现烂尾情况,且后期大鼠出现腹胀、消化不良、食欲下降,有个别大鼠造模过程中因血糖过高而死亡。T2DM缰核损毁组大鼠在对外界的刺激反应方面较T2DM组大鼠有所缓解,多尿症状也有所改善,精神状态有所好转。
二、Hb损毁降低T2DM大鼠血糖水平
高脂高糖饮食结合低剂量单次STZ尾静脉注射1个月后,与实验前/正常对照组相比大鼠血糖水平明显升高(P<0.01),Hb损毁后,大鼠血糖水平明显降低(P<0.01),但假手术组大鼠在手术前后血糖水平并无显著性变化。见图1。
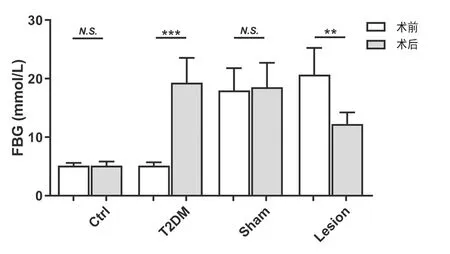
图1 四组大鼠血糖水平的变化
三、Hb损毁可延长T2DM大鼠泪模破裂时间
与实验前/正常对照组相比,T2DM大鼠泪膜破裂时间明显缩短(P<0.01)。Hb损毁后,大鼠泪膜破裂时间明显延长(P<0.001),而假手术组大鼠并无明显变化,且Hb损毁组大鼠的泪膜破裂时间较假手术组亦明显延长(P<0.001)。见图2。
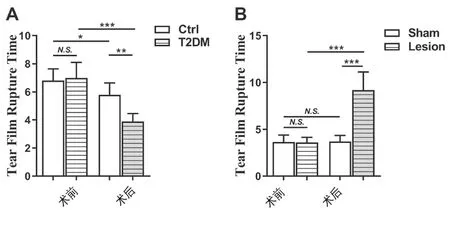
图2 大鼠泪膜破裂时间
四、Hb损毁可增加T2DM大鼠泪液分泌量
与实验前/正常对照组相比,T2DM大鼠泪液分泌明显减少(P<0.01)。Hb损毁后,大鼠泪液分泌明显增加(P<0.001),而假手术组大鼠泪液分泌量并无明显变化。Hb损毁组大鼠的泪液分泌量较假手术组明显增加(P<0.001)。见图3。

图3 大鼠泪液分泌的变化
五、Hb损毁可降低T2DM大鼠眼压
与实验前/正常对照组相比,T2DM大鼠眼压增高(P<0.01)。Hb损毁后,大鼠眼压显著降低(P<0.01),而假手术组大鼠手术前后眼压无明显变化。Hb损毁组大鼠的眼压较假手术组明显降低(P<0.001)。见图4。
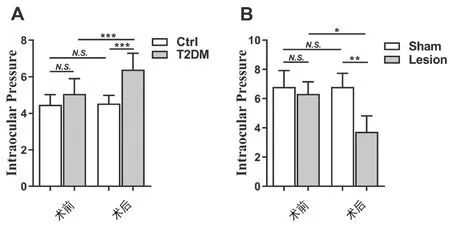
图4 大鼠实验前后眼压的变化
讨 论
糖尿病眼病是最常见的并发症之一,也是糖尿病早期最易出现的并发症,干眼症与糖尿病眼病之间具有显著相关性[3]。因此揭示糖尿病性干眼症的病理机制及其调控机理将有利于临床干眼症的治疗。本研究通过动物实验再次证明T2DM中干眼症的高发率,同时发现中枢神经系统对T2DM干眼症具有重要的调控作用,此发现为临床T2DM干眼症的治疗和预防提供了新的思路。
T2DM是一种慢性代谢疾病,患者特征表现为高血糖、相对缺乏胰岛素、有胰岛素抗性等症状,本研究采用的高脂高糖饮食结合低剂量STZ诱导的T2DM大鼠模型与人类T2DM最为相似的动物模型[6],在此模型基础上的研究也是最可靠和有效的。本研究结果显示,所有T2DM大鼠均存在泪膜破裂时间缩短和泪液分泌减少的症状,这与国内外其他实验室的研究结果完全一致[7]。糖尿病病程、血糖水平等是影响干眼发生发展的主要危险因素,且随着病程的进展,患者多伴有外周神经病变,角膜平均敏感度显著降低,泪膜稳定性降低发生干眼几率和严重程度明显增加[8,9]。长期体内高血糖水平会影响机体正常生理代谢,引起免疫炎症反应激活、细胞凋亡增加和性激素失衡,导致眼表结构发生改变和角膜周围神经病变,泪液分泌功能、泪液成分、角膜上皮表面绒毛结构和渗透压受到影响,导致泪膜不稳,诱使干眼发生。其中角膜神经病变可影响泪液的反射性刺激分泌,泪液中的水、蛋白质、无机盐、葡萄糖、尿素和酶,共同组成眼表的第一道防御屏障,当泪液成分和量发生改变,泪液和眼表神经肽的合成异常且通过缺陷受体发出错误信号,会导致眼表保护清除功能异常,影响对角膜的营养功能,从而加重干眼症[10]。此外,本研究还发现,T2DM大鼠眼压显著升高,这与其他实验室研究结果[11]及人类糖尿病患者眼压升高的临床症状完全一致[12],其发生机理可能与泪膜稳定性下降及泪液分泌失调有关。Hb损毁在改善干眼症状的同时亦可降低T2DM大鼠眼压水平,说明干眼症状与眼压之间存在着某种联系,但具体机制尚需进一步的研究证实。
中枢神经系统在机体多种生理功能的调节方面起着不可忽视的作用,Hb已经证明参与了机体多种生理功能的调节[4]。但关于Hb对T2DM眼功能的调控作用尚无报道。我们的前期研究已经证实,Hb损毁可降低T2DM大鼠血糖水平[5],但对T2DM并发症是否有影响尚未可知。本研究通过电损毁的方式移除T2DM大鼠的Hb,发现消除Hb后不仅可降低T2DM大鼠血糖水平,而且可明显改善T2DM大鼠的干眼症状,同时也降低了T2DM大鼠的眼压。糖尿病眼部病变主要涉及视神经细胞和血管变性、炎症反应以及泪腺中糖基化产物增加和结膜杯状细胞显著减少等机制,Hb损毁改善T2DM大鼠干眼症状很可能是通过对外周神经兴奋性及外周淋巴循环功能的调节而发产生作用,具体机制仍需进一步的实验研究加以揭示。
