84例肿瘤相关性急性胰腺炎的发病特征及预后分析
2022-09-07郑琳琳孔笑华周耘辉刘宁宁
郑琳琳, 何 辉, 孔笑华, 周耘辉, 刘宁宁, 周 琳
1 郑州大学第一附属医院 消化内科, 郑州 450052; 2 河南医学高等专科学校, 郑州 451191
急性胰腺炎(acute pancreatitis, AP)是消化系统急重症,全球年发病率为34/10万[1],病死率高(20%~40%)[2]。AP诱因多见于胆源性(54.4%)、高脂血症(14.4%)和酒精性(14.2%)[3],以及肿瘤、遗传、感染、药物等。近年来,随着胰腺癌发病率增高[4],以其为代表的肿瘤相关性AP的发病也呈日益增高趋势。由于AP和胆胰壶腹部肿瘤具有相似的临床症状及实验室检查结果,在AP救治过程中,肿瘤极易被漏诊,进而影响预后。为探讨肿瘤相关性AP的临床特点,本研究回顾性分析肿瘤相关性AP患者的临床资料,为其早期全面诊治,改善预后提供依据。
1 资料与方法
1.1 研究对象 收集2013年1月—2021年8月郑州大学第一附属医院收治的8106例AP患者的临床资料,肿瘤相关AP共84例作为肿瘤组,从非肿瘤相关AP患者中随机抽取360例患者作为非肿瘤组。肿瘤组根据肿瘤来源又分为壶腹组、胰腺组和胆道组。分析患者一般情况、临床症状、AP初发至肿瘤确诊时间、实验室和影像学检查及肿瘤病理特征,探讨肿瘤及非肿瘤AP、以及不同肿瘤部位AP的临床特征差异。AP患者纳入标准:(1)临床诊断为AP;(2)病历及检验资料完整;排除标准:(1)年龄小于14岁;(2)孕产妇;(3)病历资料不全;(4)胰腺及壶腹部术后。肿瘤组排除标准:(1)病理诊断不明;(2)转移性肿瘤。
1.2 研究方法 AP诊断参考《中国急性胰腺炎诊治指南(2021)》[5],至少需包含以下三项标准中的两项:(1)上腹部持续性疼痛;(2)血清淀粉酶和/或脂肪酶浓度至少高于正常值上限3倍;(3)腹部影像学检查的特征性表现。病情严重程度依据2012年亚特兰大分类标准[6]分为轻症急性胰腺炎(mild acute pancreatitis, MAP)、中度重症急性胰腺炎(moderate severe acute pancreatitis, MSAP)、重症急性胰腺炎(severe acute pancreatitis, SAP)。主胰管最大直径>3 mm被定义为主胰管扩张;胆管直径>10 mm被视为胆管扩张。采用电话或查询病史资料的方式进行随访,规定死亡或者失访为结局事件。随访时间截至2021年10月31日。

2 结果
2.1 AP发病概况 2013年—2021年本院肿瘤相关性AP发病率为1.04%(84/8106),期间年发病率分别为0.29%、0.14%、0.25%、0.23%、0.46%、0.34%、0.81%、3.82%和2.67%,呈上升趋势。
选择2019年8月—2021年8月纳入的2778例AP患者进行具体病因及占比分析,结果如下:胆源性(52.5%)、高脂血症性(16.7%)、特发性(12.7%)、饮食相关(9.5%),还包括感染(0.8%)、酒精(1.4%)、自身免疫(0.4%)、手术操作(1.5%)、透析(0.1%)、外伤(0.5%)、先天性(0.1%)、血栓(0.0%)、胰管结石(0.5%)、中毒(0.2%)、药物(0.1%)、肿瘤(2.4%)、转移瘤(0.2%)和其他(0.3%)。
2.2 一般临床特征 肿瘤相关AP平均发病年龄(56.06±11.50)岁。AP常反复发作,平均发作次数为1.75次(范围1~5次),初发AP至确诊肿瘤平均时间为7.38个月(范围0.5~120个月)。75例为MAP(89.2%),8例MSAP(9.5%),1例SAP(1.2%)。主要症状为腹痛(73/84),偶发黄疸(10/84)。长期吸烟25例(29.8%),长期饮酒13例(15.5%),糖尿病史10例(11.9%),胆石症病史18例(21.4%)。21例伴发腹腔积液,5例腹腔积液中发现肿瘤细胞。根据肿瘤来源部位,胰腺60例、壶腹13例和胆管下部11例。不同来源肿瘤相关AP的临床特征比较见表1。
51例经手术获得大体病理,33例经穿刺获得病理。胰腺组中胰腺头部40例,颈部4例,体部2例,体尾部13例,尾部1例;胰腺不同部位肿瘤特征比较见表2。依据病理分类,腺癌48例,腺泡细胞癌2例,鳞状细胞癌1例,小细胞癌1例,黏液性囊腺瘤6例,实性假乳头状瘤1例,导管内乳头状瘤1例。胰腺组中14例发生肝转移,1例肝合并胰腺体尾部转移,4例侵犯门静脉和肠系膜血管,1例骨转移。壶腹组中绒毛管状腺瘤6例,腺癌7例。胆道组中腺癌9例、高级别瘤变伴癌变1例、绒毛状腺瘤伴癌变1例。壶腹组和胆道组各有1例发生肝转移。
CT受检率(72/84,85.7%)最高,肿瘤检出率95.8%(69/72)。CT可表现为胰管弥漫性扩张或囊性病变、胰头肿块伴体尾部萎缩、胰腺周围渗出并轮廓异常。超声受检率65.5%(55/84),肿瘤检出率83.6%(44/55),超声表现为胰腺体积弥漫性增大,内部回声减低,周围界限不清等。磁共振胰胆管造影(MRCP)受检率45.2%(38/84),检出率97.4%(37/38)。PET-CT受检率13.1%(11/84),检出率81.8%(9/11)。
肿瘤直径(AUC=0.82,95%CI:0.69~0.95)、CEA(AUC=0.77,95%CI:0.66~0.88)是胰腺组区别于壶腹及胆道两组较为有意义的鉴别指标,血钙(AUC=0.68)、CA19-9(AUC=0.66)、白蛋白(AUC=0.65)、血糖(AUC=0.62)、年龄(AUC=0.54)和反复发作(AUC=0.53)鉴别作用较弱。经过两两比较,胰腺肿瘤直径显著大于壶腹肿瘤(调整后P=0.038)和胆道肿瘤(调整后P=0.020),CEA显著高于壶腹肿瘤(调整后P=0.001)和胆道肿瘤(调整后P=0.045)。壶腹及胆道两组肿瘤直径、CEA差异无统计学意义(调整后P值均>0.05)。

表1 不同部位肿瘤相关性AP临床病理特征比较Table 1 Comparison of clinicopathological features of tumor induced AP at different sites
2.3 肿瘤组与非肿瘤组的临床特征比较 肿瘤组与非肿瘤组AP患者的年龄、反复发作、胆管扩张、胰管扩张、严重程度、白细胞计数、中性粒细胞百分比、白蛋白、碱性磷酸酶、脂肪酶、C反应蛋白、血钙、血糖和甘油三脂比较,差异均有统计学意义(P值均<0.05)(表3)。经logistic多因素回归分析,反复发作、胰管扩张、胆管扩张和白细胞计数是肿瘤相关AP的独立影响因素(表4)。
2.4 治疗及预后 48例行胰十二指肠切除术,2例行胃镜下肿物切除术,1例行内镜下肿物切除与支架置入,3例行内镜逆行胰胆管造影支架置入术,3例行超声内镜引导下细针穿刺活检术,1例行内镜下空肠营养管置入。8例手术治疗联合“吉西他滨+紫杉醇”方案化疗,其余行伊立替康+阿帕替尼(2例)、吉西他滨+奥沙利铂(2例)、FOLFOXIRI(2例)、吉西他滨+替吉奥(1例)、吉西他滨(1例)方案化疗。
肿瘤相关AP患者1、2、3、4年累积生存率为63%、49.3%、39.4%、19.7%;中位生存时间306 d(范围30~1521 d)。
3 讨论
AP的发病源自不同病因导致的胰管阻塞,胰管内压升高损坏导管,激活胰酶后自我消化胰腺和胰周组织,从而诱发炎症。肿瘤为AP发作的非常见诱因,因胰腺炎组织水肿渗出,易干扰肿瘤早期影像诊断,不仅延长住院时间,还可诱发严重并发症[7],影响患者预后。
本研究显示,2013年—2021年间肿瘤相关性AP发病率呈升高趋势。肿瘤来源以胰腺为主,尤其是胰腺头颈部;其次是壶腹和胆管下段。肿瘤特征分析显示,胰腺肿瘤直径显著大于胆道和壶腹肿瘤,提示胆道和壶腹肿瘤可能会有更高的漏诊率,更需加强这些部位的影像学监测。病理分析发现,腺癌、腺瘤和黏液性肿瘤是诱发AP常见组织学类型,小细胞癌、腺泡细胞癌、鳞状细胞癌、导管内乳头状瘤、实性假乳头状瘤相对少见。国外也曾报道非霍奇金淋巴瘤、腺肌瘤等少见肿瘤[8]。本研究发现,良恶性肿瘤相关AP均可诱发腹腔积液,但恶性腹水多与肿瘤转移相关。既往研究[9]曾报道,淀粉酶含量高的腹水通常与良性肿瘤相关。综上可见,腹水生化及脱落细胞学检查对胰腺炎患者的全面诊断有重要意义。
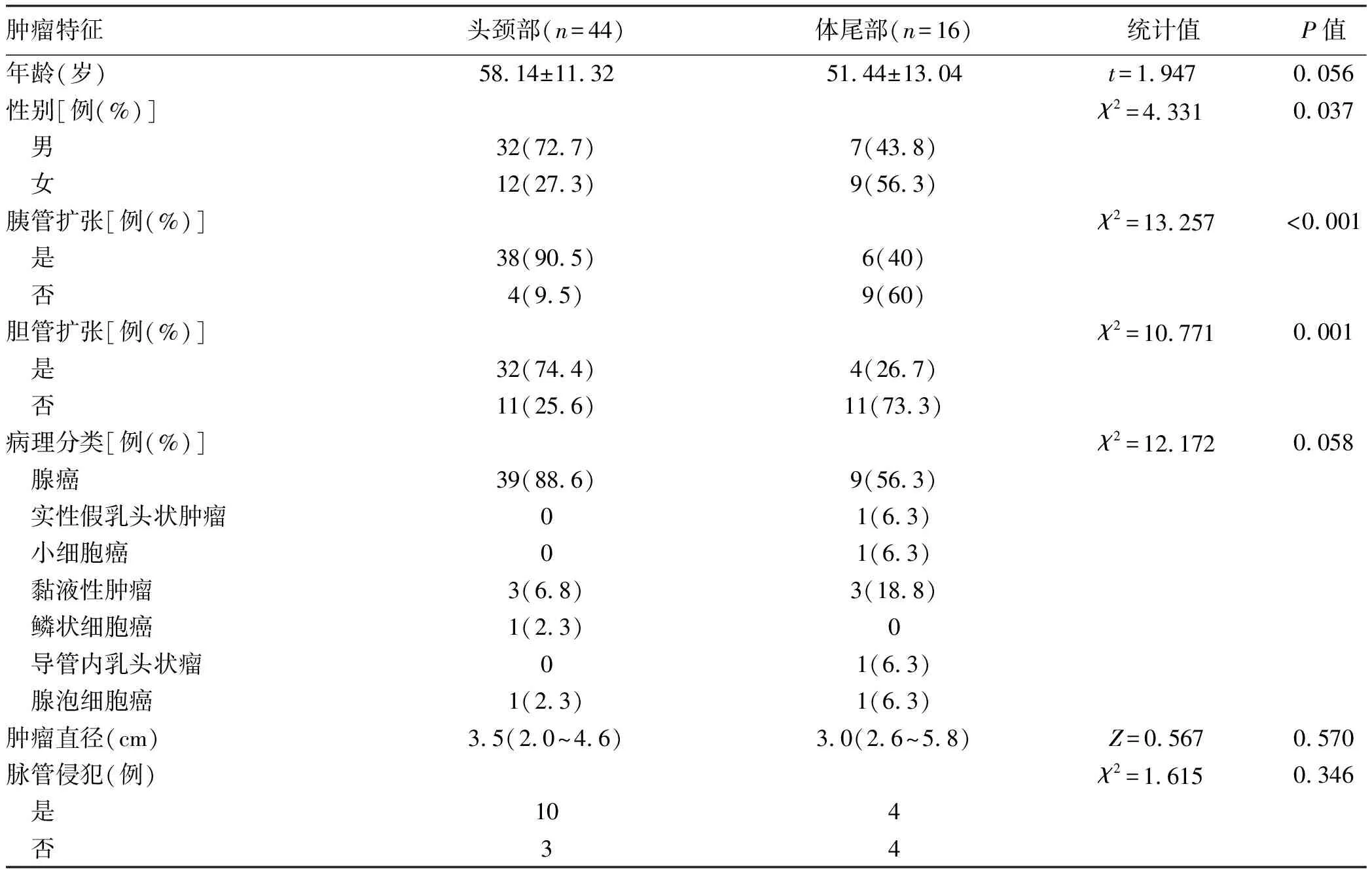
表2 胰腺不同部位肿瘤特征比较Table 2 Comparison of tumor features at different parts of pancreas
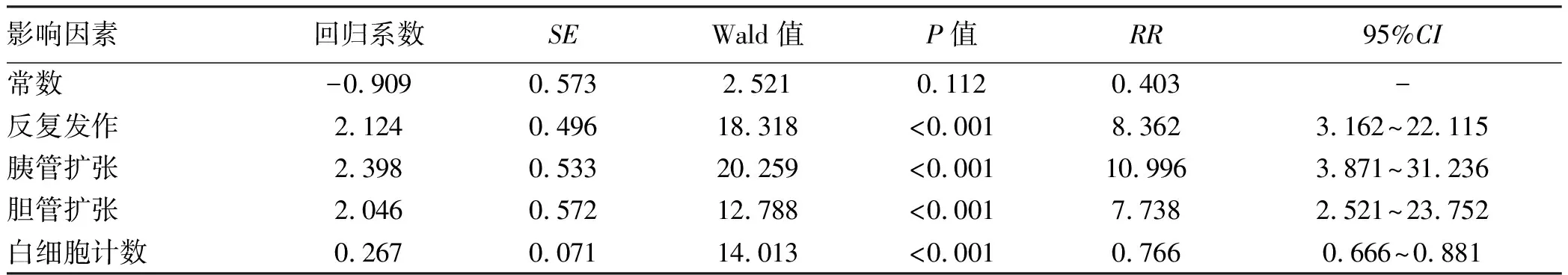
表4 肿瘤相关AP的多因素logistic回归分析Table 4 Multivariate Logistic regression analysis of tumor induced AP
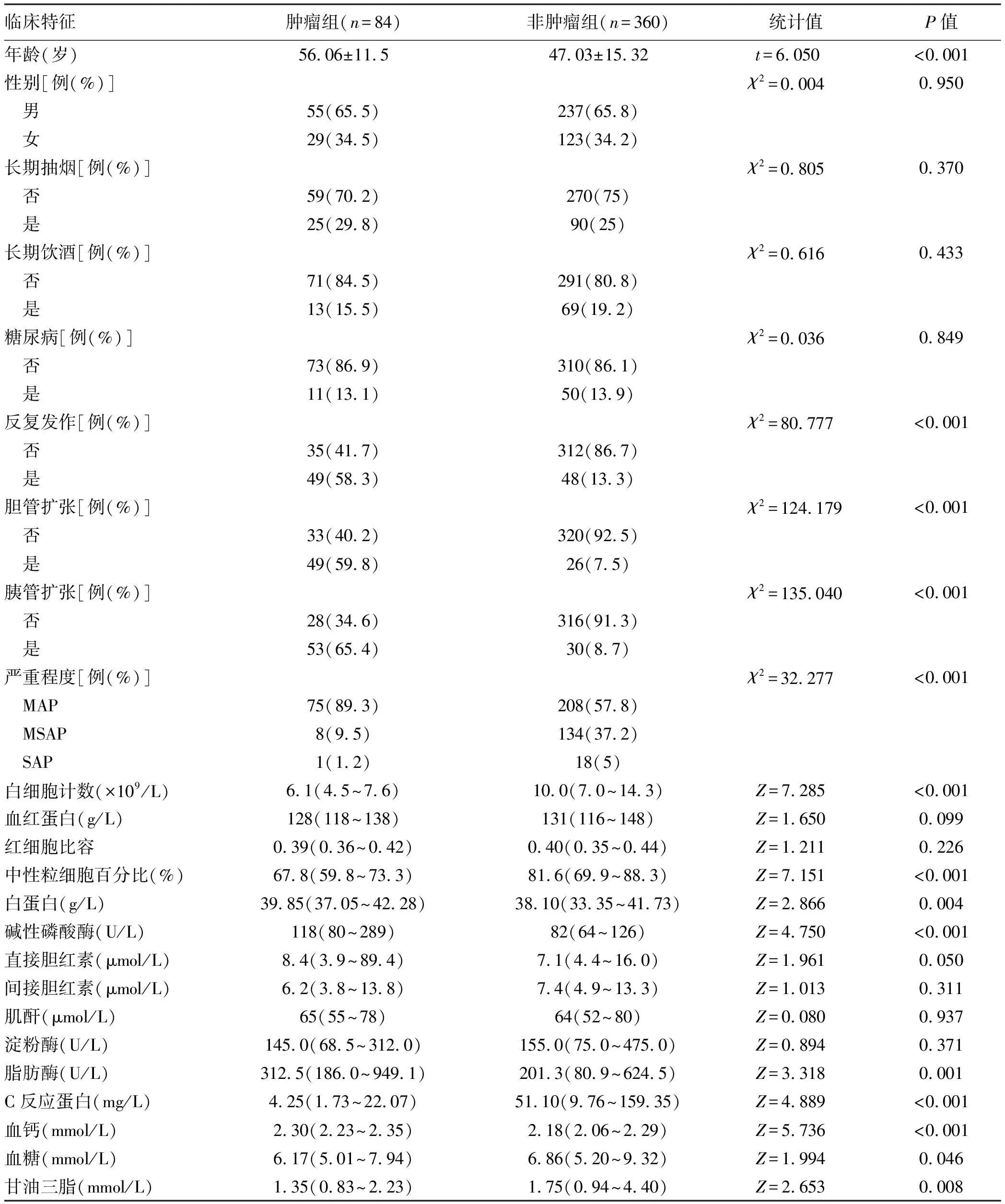
表3 肿瘤相关AP与非肿瘤相关AP患者一般资料比较Table 3 Comparison of general data of patients with tumor induced AP and non-tumor induced AP
本研究中,肿瘤相关AP患者的腹痛具有显著的间断发作并逐渐加重的特点,与非肿瘤组腹痛逐渐缓解趋势不同。除腹胀、恶心呕吐等消化道症状[10-11],肿瘤相关AP还常伴有反复发作、持续黄疸和体质量减轻。因此,AP也可看作是胆胰壶腹部肿瘤的重要临床表现[7,12-14]。肿瘤相关AP多见于中老年男性,非肿瘤组以青壮年男性居多。本研究中,肿瘤相关AP中89.2%为MAP,初发AP到确诊肿瘤平均时间为29.52周;国外曾有研究[13,15]显示初发AP到肿瘤确诊间隔约34周。AP与肿瘤的同步诊断率不高[16],一方面与AP作为相对易诊断的急重症,容易占据诊治重点有关;另一方面也与胰腺炎组织水肿渗出,易干扰肿瘤早期影像诊断有关。
实验室检查方面,肿瘤组AP也有特异性表现:白细胞计数显著低于非肿瘤组,白细胞计数是肿瘤相关AP的独立预测因素。肿瘤组脂肪酶显著高于非肿瘤组,而淀粉酶差异无统计学意义,应与肿瘤细胞可分泌脂肪酶有关[17]。CEA是鉴别胰腺组与壶腹、胆道两组更有意义指标,血清CA19-9、CEA和CA125为相对特异性肿瘤标志物,在肿瘤相关AP中表现为持续升高或AP对症治疗后无下降趋势。
影像学检查是诊断急性胰腺炎和胆胰壶腹部肿瘤的重要手段。但在炎症急性期,胰腺的弥漫性改变可掩盖肿块[15]。本研究及国外同类研究中,胰腺炎和肿瘤的同时诊断率均不高即可说明这一值得重视的现象。Cho等[18]推荐病因不明的AP患者出院后3个月内完善CT检查排除隐匿的肿瘤。MRCP可明确胰胆管阻塞位置,与增强CT联合可增加敏感性,提高肿瘤检出率。PET-CT可用于CT和MRI难以诊断的病例,评价恶性肿瘤远处转移。除占位性病变外,本研究中胰、胆管扩张均多见于肿瘤组。胰管扩张在胰腺组中常见,显著多于胆道、壶腹组,而三组胆管扩张阳性率未见显著差异。胰腺头颈部肿瘤较体尾部更多见胰、胆管扩张。由此可见,胰管扩张是此类疾病的重要影像学特征,且不同部位疾病所致胰管扩张的影像学表现存在差异[19]。单纯胆管扩张与胰胆管合流处及胆总管末端异常狭窄有关;胰胆管同时扩张常见于胰腺疾病,尤其是胰腺恶性肿瘤[20]。胰、胆管扩张分别是肿瘤相关AP的独立预测因素。
治疗方面,由于炎症可加重组织粘连和水肿而增加手术难度和术后并发症,从而影响手术疗效[21],及早控制炎症进展对后续治疗十分关键。胰十二指肠切除术是该部位恶性肿瘤重要的根治性治疗措施[8]。体积小、良性肿瘤或手术风险大于获益者可行内镜下治疗。肿瘤相关AP患者4年累积生存率为19.7%,这可能与诱发AP多为恶性肿瘤有关。总之,早期全面的诊断对延长生存期至关重要。
综上所述,肿瘤相关AP以中老年男性多发,临床表现为MAP、反复发作,多伴胰胆管扩张,肿瘤标志物CA19-9持续性升高。另一方面,AP也可视为胆胰壶腹部肿瘤的重要临床表现。具有前述特征且无典型诱因的AP,需加强AP治疗后随访及胆胰壶腹部的影像学监测,避免肿瘤漏诊影响预后。
伦理学声明:本研究方案于2022年2月14日经由郑州大学第一附属医院伦理审查委员会审批,批号:2022-KY-0134。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:郑琳琳和周琳对研究的思路和设计有关键贡献;何辉、孔笑华、周耘辉参与了研究数据的获取分析解释过程;郑琳琳和刘宁宁参与起草或修改文章关键内容。
