外部验证REAL-B评分对抗病毒治疗的慢性乙型肝炎患者肝细胞癌发生风险的预测价值
2022-09-07楚伟可宓余强
吴 雪, 楚伟可, 周 辉, 牛 斌, 张 鹏, 冯 婧, 宓余强, 李 萍
1 天津医科大学, 第二人民医院临床学院, 天津 300070;2 天津市第二人民医院, 天津市肝病医学研究所, 天津 300192
HBV感染是引起肝硬化和肝癌的主要原因之一[1-2]。抗病毒治疗是当前主要的治疗措施,有效的病毒抑制会降低肝硬化并发症发生甚至降低肝脏相关的死亡率[3-4]。然而长期抗病毒治疗下仍有部分患者进展为肝癌,特别是肝硬化患者[5]。欧洲一项多中心研究[6]发现,在长期恩替卡韦(ETV)或替诺福韦(TDF)治疗的慢性乙型肝炎患者中仍有新的肝癌病例出现。研究[7]表明, ETV治疗超过5年的患者中仍有1.34%患者发生肝癌。因此对于慢性乙型肝炎患者进行合理的肝癌风险监测极为重要。根据美国肝病学会和欧洲肝病学会指南,肝癌监测需要慢性乙型肝炎患者每6个月进行一次筛查,并指出当肝细胞癌(HCC)年发生率大于0.2%被认为是有成本效益的[8-9]。
近年来在接受抗病毒治疗的慢性乙型肝炎患者中,已开发许多风险评分来预测肝癌的风险,包括mREACH-B评分[10]、PAGE-B评分[11]、aMAP评分[12]、mPAGE-B评分[13]以及CAMD评分[14]。最近,基于美国和亚太地区接受抗病毒治疗的慢性乙型肝炎患者,研发了一项包含七个变量[男性、年龄、饮酒史、糖尿病、基线时肝硬化、血小板(PLT)以及甲胎蛋白(AFP)]的REAL-B评分,该评分能有效地对肝癌风险进行预测[15]。然而,对于REAL-B评分是否能有效地运用到临床实践中,仍需更多队列进行验证。本研究对REAL-B评分预测肝癌的性能进行验证,并与mPAGE-B评分、aMAP评分和PAGE-B评分进行比较[11-13]。
1 资料与方法
1.1 研究对象 收集2013年1月—2015年12月在天津市第二人民医院接受抗病毒治疗的慢性乙型肝炎患者,并随访5年。根据美国肝病学会指南(2018版)[8],慢性乙型肝炎诊断标准为:血清HBsAg存在≥6个月;血清HBeAg阳性患者HBV DNA水平通常>20 000 IU/mL,HBeAg阴性患者HBV DNA值一般较低(2000~20 000 IU/mL);ALT和/或AST水平正常或升高;肝组织学检查显示慢性肝炎伴有不同程度的坏死性炎症和/或纤维化。
肝硬化检测通过肝脏病理表现或影像学检查(腹部B超或瞬时弹性成像)证实[16]。
根据原发性肝癌诊疗规范(2019版)[17],HCC诊断通过病理诊断和临床诊断。病理诊断包括肝脏病理组织学和/或细胞学检查;临床诊断包括至少两种影像学检查阳性(动态增强MRI/动态增强CT/Gd-EBO-DAPA增强MRI/超声造影),表现为动脉期病灶明显强化、门静脉或延迟期强化下降的“快进快出”表现,或者一种典型的影像学表现结合病史和血清甲胎蛋白阳性可诊断HCC。所有患者进行每3~6个月的随访,主要的终点事件为HCC。纳入标准:年龄≥18岁,且抗病毒治疗1年及以上。排除标准:(1)合并其他病毒感染,如甲型、丙型、戊型肝炎病毒及HIV;(2)过量饮酒(乙醇摄入量:男性>30 g/d,女性>20 g/d);(3)基线时出现肝癌、失代偿性肝硬化;(4)药物性肝炎;(5)自身免疫性肝损伤;(6)其他肝脏疾病或严重的全身疾病。
1.2 研究方法 收集患者的一般资料,包括性别、年龄、饮酒史、吸烟史、肝癌家族史、高血压、糖尿病等。收集患者实验室检测指标,包括ALT、AST、Alb、TBil、总胆固醇(CHO)、甘油三酯(TG)、尿素氮(BUN)、肌酐(Cr)、白细胞(WBC)、PLT等。

2 结果
2.1 一般资料 共纳入1954例接受抗病毒治疗的慢性乙型肝炎患者,根据排除标准最后纳入1160例患者进行分析(表1)。经过中位时间为5.3(5.0~6.3)年的随访,有108例(9.8 %)患者发生HCC。与非HCC患者相比,HCC患者年龄、AFP、中性粒细胞计数与淋巴细胞比值(NLR)、TBil水平较高以及糖尿病、高血压、HBeAg阳性发生率较高,而Alb、PLT水平较低(P值均<0.05)(表1)。
2.2 HCC发生的危险因素分析 在单因素Cox分析中,年龄(>50岁)、基线时肝硬化、糖尿病、饮酒史、Alb(<40 g/L)、PLT(<100×109/L)、AFP(>10 ng/mL)是HCC发生的影响因素(P值均<0.05)。多因素Cox分析显示,年龄(>50岁)、基线时肝硬化、AFP(>10 ng/mL) 以及PLT(<100×109/L) 是HCC发生的独立影响因素(P值均<0.05)(表2)。
2.3 HCC风险评分预测性能 在3年HCC预测性能上,REAL-B评分均高于其他3个评分(P值均<0.05);在5年HCC预测性能上,REAL-B评分与mPAGE-B评分和aMAP评分表现相似(P值均>0.05),但高于PAGE-B评分(P<0.05)(表3)。
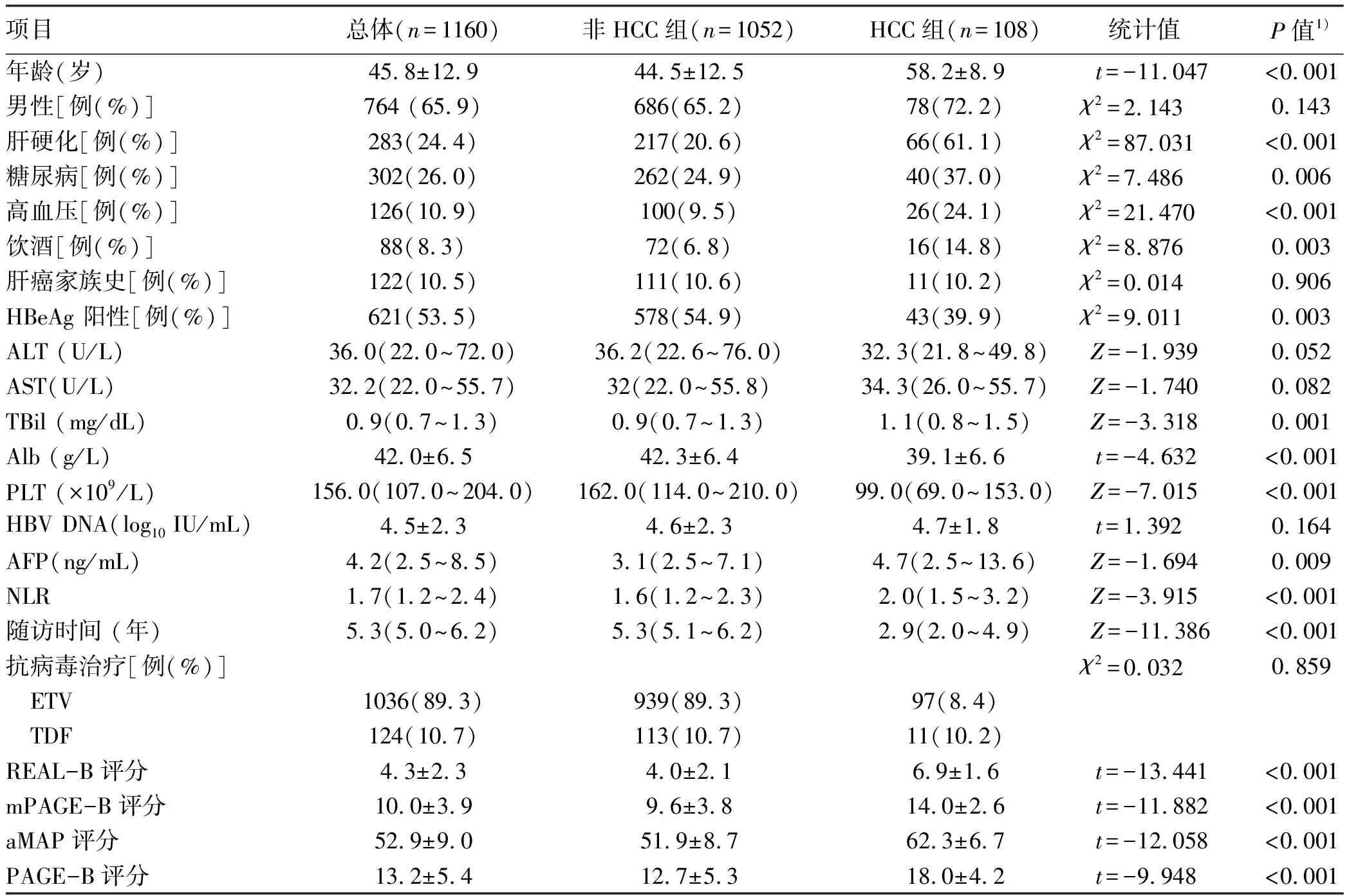
表1 1160例慢性乙型肝炎患者基本特征Table 1 Basic characteristics of 1160 patients with chronic hepatitis B
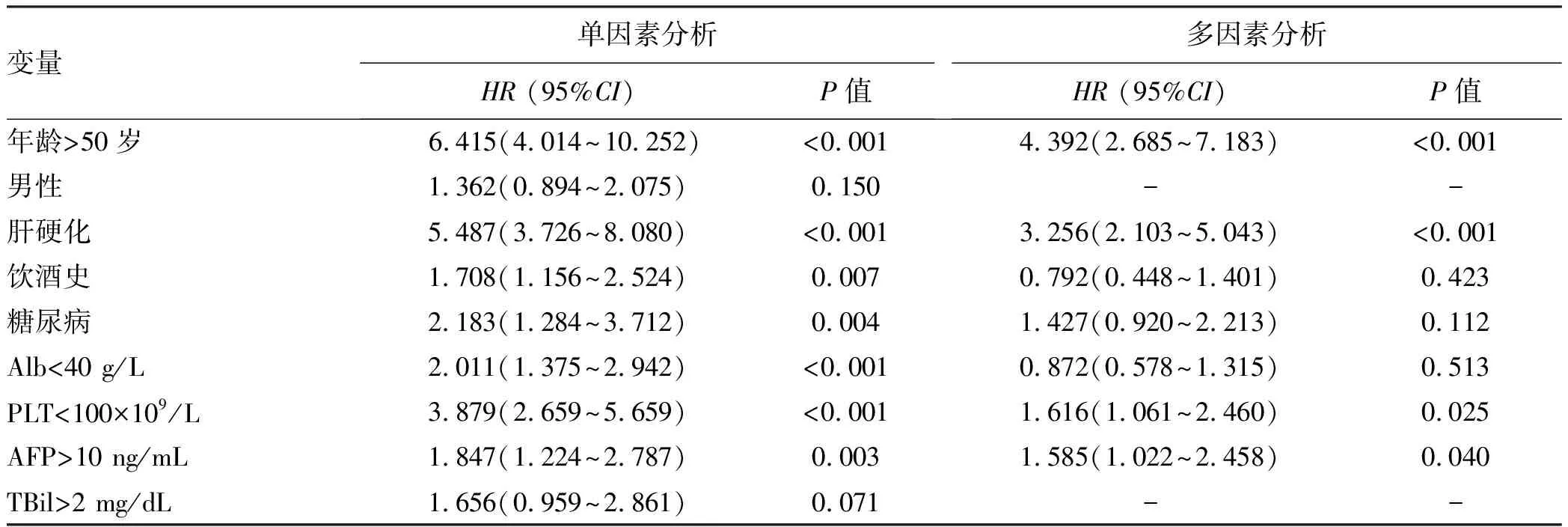
表2 HCC发生的危险因素分析Table 2 Analysis of risk factors for HCC

表3 各HCC风险评分AUC分析Table 3 AUC of different HCC risk scores
2.4 各HCC评分风险分组分析 REAL-B评分低危组(0~3分)3年和5年HCC累积发病率分别为0和0.8%,低于中危组(4~7分)(5.6%、11.8%)和高危组(8~13分)(24.8%、35.6%)(P<0.001)。mPAGE-B评分低危组(≤8分)3年和5年肝癌累积发病率分别为0.3%和0.6%,中危组(9~12分)分别为3.5%和7.8%,高危组(≥13分)分别为13.5%和19.2%;aMAP评分低危组(<50分)3年和5年肝癌累积发病率分别为0.8%和1.1%,中危组(50~60分)分别为3.4%和6.2%,高危组(>60分)分别为15%和20.9%;PAGE-B评分低危组(9分)3年和5年肝癌累积发病率分别为0.4%和0.8%,中危组(10~17分)分别为4%和6.2%,高危组(18分)分别为13.2%和19.4%。在mPAGE-B评分、aMAP评分和PAGE-B评分中同样发现低危组HCC累积发生率低于中危组和高危组(P值均<0.05)(图1)。
此外,研究发现在REAL-B评分低危组中,3年和5年内进展为HCC的阴性预测值分别为100%和99.67%。同样,在mPAGE-B评分、aMAP评分和PAGE-B评分低危组中阴性预测值均高于95%(表4)。
3 讨论
近年来,虽然抗病毒治疗降低了HCC的发生率,但HCC进展仍在持续。因此,制订更为准确的HCC预测模型至关重要。近些年来开发了许多HCC预测模型以更好地对慢性乙型肝炎人群HCC监测进行个性化管理。
在本研究中,与传统HCC预测模型相比,笔者验证了REAL-B评分是接受抗病毒治疗的慢性乙型肝炎患者较好的辅助诊断工具。本研究有几个优势,首先,大样本量增加了HCC风险评分验证的可靠性。在ETV/TDF治疗下,REAL-B评分在3年和5年HCC预测AUC分别为0.865和0.848,且在3年HCC预测性能方面均高于其他三个风险评分(P值均<0.05);其次,在该研究队列中,年龄和PLT是HCC发生的危险因素,这与既往研究一致[18]。而mPAGE-B、aMAP和PAGE-B评分并不涉及肝硬化指标,因此肝硬化可能是REAL-B评分优于其他三个评分的原因之一。同时为进一步提高风险评分的预测性能,可以结合其他非侵入性肝纤维化测定方式,如增加瞬时弹性成像、肝纤维化测试等,从而能够对早期肝硬化患者进行更精细的评估。



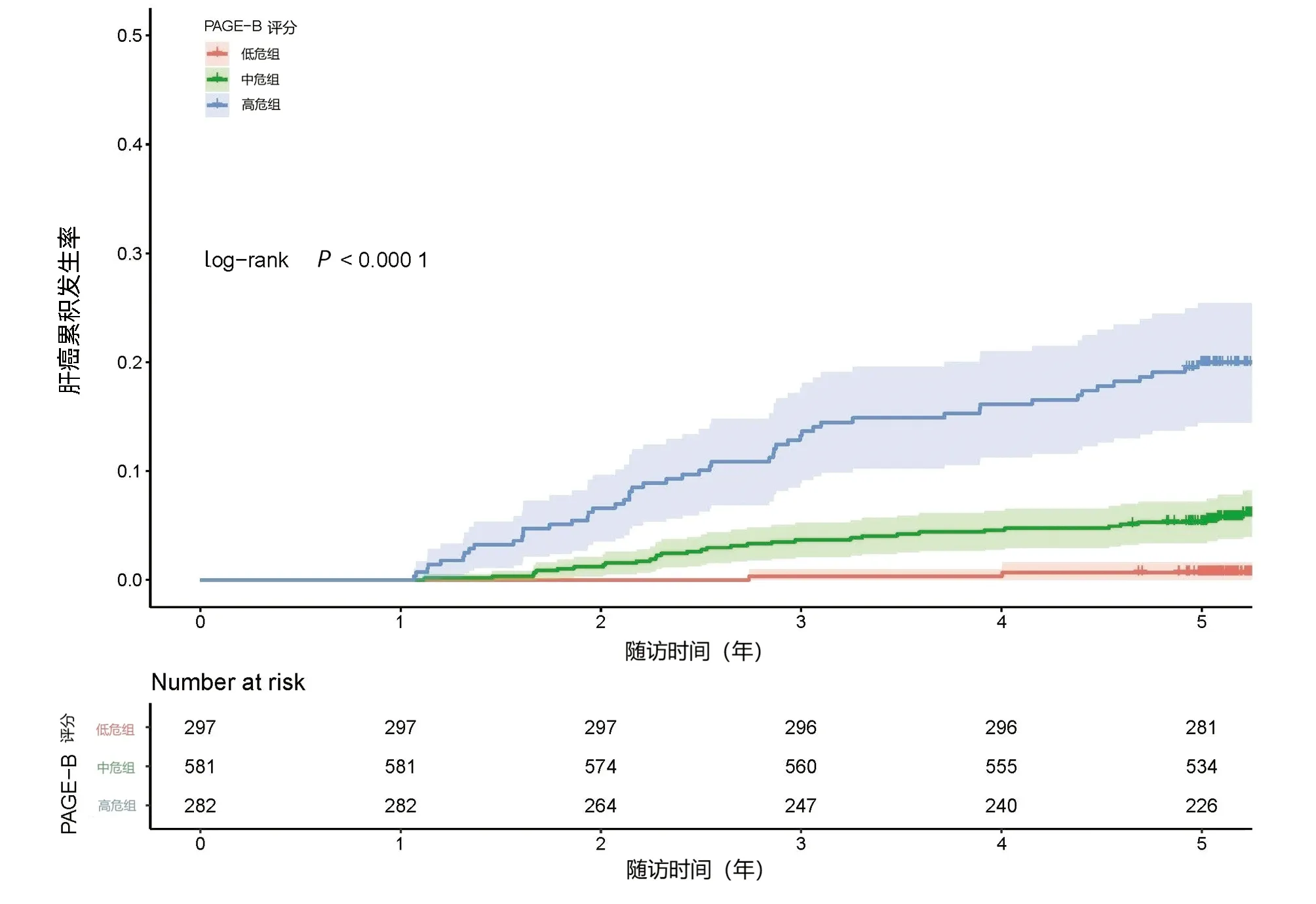
图1 各HCC风险评分分组中肝癌累积发生率Figure 1 Cumulative incidence of HCC in different risk scores
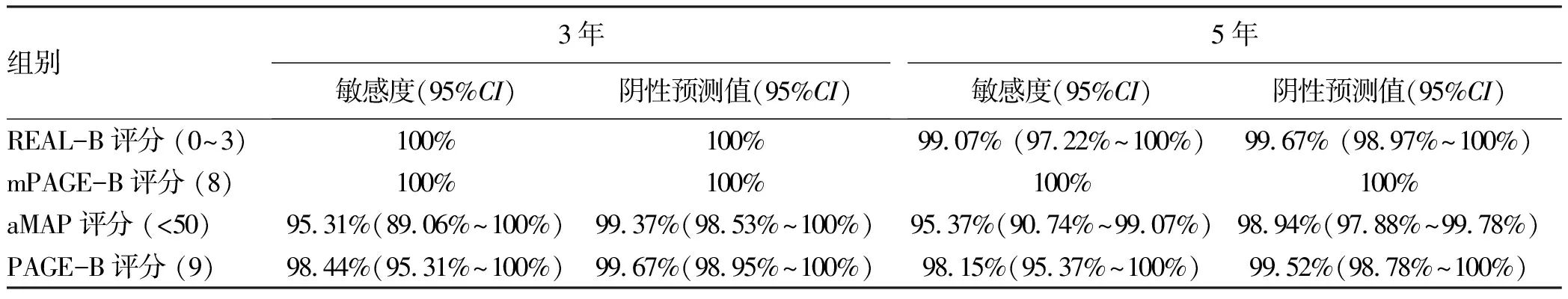
表4 各HCC风险评分低危组诊断性能Table 4 Diagnostic accuracy of low risk groups in different HCC risk scores
REAL-B评分低危组中,HCC累积发病率明显低于中危组和高危组。各HCC预测评分低危组患者5年HCC累积发生率在0.6%~1.1%。PAGE-B评分和mPAGE-B评分低风险组HCC年发生率低于0.2%。在亚洲和欧洲部分慢性乙型肝炎队列研究中也得到验证[11,13,19-20]。一般来说,当非肝硬化患者HCC年风险率超过0.2%或肝硬化患者年风险率超过1.5%时,传统的HCC监测才具有成本效益。因此在REAL-B低风险组中,41.6%的患者可以重新制订HCC预测监测方案并确定个体HCC风险监测的最佳访问间隔和诊断方式。
本研究也存在一些局限性。首先,本研究是单中心回顾性研究,这可能对HCC预测模型结果造成一定偏差。其次,在研究期间并未对所有患者进行瞬态弹性成像检测,因此对于LSM-HCC、CAGE-B以及SAGE-B评分未进行分析[21-22]。最后,虽然本研究对REAL-B评分进行了亚洲部分人群的验证,但所选取的地域以及人群数量较小,故仍需对其他地域人群进一步验证。
综上所述,本研究证明了REAL-B评分在接受抗病毒治疗的慢性乙型肝炎患者3年HCC预测中优于mPAGE-B、PAGE-B和aMAP评分。此外在四个风险评分中,低危组患者HCC年累积发生率接近或低于0.2%,可对这部分患者采取更具成本效益的HCC监测方案。
伦理学声明:本研究方案2019年12月25日经由天津市第二人民医院伦理委员会审批,批号:〔2019〕58号。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:吴雪参与采集、分析数据及起草文章内容;楚伟可、周辉、牛斌、张鹏及冯婧参与数据收集及分析;宓余强、李萍参与文章思路设计,指导文章撰写并最后定稿。
