谷胱甘肽胞质降解酶ChaC1的生物学特征与功能
2022-09-07张炳辉江铭婷
张炳辉, 江铭婷, 郑 敏
(福建医科大学 基础医学院/转化医学研究院, 福州 350108)
谷胱甘肽(glutathione,GSH)是一种神奇的小分子活性肽,由谷氨酸、半胱氨酸及甘氨酸组成。谷胱甘肽在生物体内发挥解毒排毒和抗氧化等重要的作用。当前,对谷胱甘肽的合成代谢已较为明确,但对谷胱甘肽的分解代谢仍不明了。之前的研究认为,只有一种酶可以降解谷胱甘肽,即γ-谷胺酰转肽酶(γ-glutamyltransferase,GGT)。该酶定位于哺乳动物和细菌的质膜上。因而,谷胱甘肽的降解长期以来一直被认为不会发生在细胞质中。近年发现,一些可以在细胞质内降解谷胱甘肽的酶,例如酵母与真菌中的Dug酶(deficient in utilization of glutathione)和高等真核生物中的ChaC1。
最初,ChaC1基因由Aldons J.Lusis团队于2006年在研究人主动脉内皮细胞中的内质网应激基因时被发现,当时命名为MGC4504[1]。该团队在2009年发现,哺乳动物中的MGC4504基因与细菌的cha操纵子(负责Ca2+和H+的逆向转运)中的ChaC基因是同源物,故最终命名为ChaC1[2]。2012年,Kumar A研究团队通过序列分析和生化实验证实,ChaC1是哺乳动物中一类新的谷胱甘肽分解代谢酶[3]。
1 ChaC1基因和蛋白质结构的特征
人的ChaC1基因位于15号染色体,而鼠的ChaC1基因位于2号染色体。人源ChaC1(NM_024111)是由4个外显子,共222个氨基酸组成的25 kD的蛋白质。人源ChaC1的mRNA有2种亚型,分别是isoform 1 (GenBank: NM_024111.3)和isoform 2 (GenBank: NM_001142776.1)。而鼠源ChaC1(GenBank: NM_026929)是由3个外显子共223个氨基酸组成的25 kD的蛋白质。到目前为止,鼠源ChaC1只有1种mRNA (GenBank: NM_026929.4)。
ChaC1基因的氨基酸序列高度保守。在哺乳动物和细菌之间,ChaC1的氨基酸序列约有30%同源性[2]。而人源和鼠源ChaC1的氨基酸序列则约有88%的相似性(Fig.1)。ChaC1蛋白质包含1个从第30位氨基酸到第210位氨基酸的高度保守结构域(ChaC样结构域),该结构域已在酵母蛋白质At5g39720.1和大肠杆菌蛋白质Ytfp中被解析[2]。ChaC1是γ-谷氨酰环转移酶(γ-glutamylcyclotransferase,γ-GCT,GGCT)家族的一员,具有与其他GGCT家族成员相似的BtrG/γ-GCT折叠,该折叠的特征性结构是拥有1个α螺旋围绕的β桶形结构[3]。

Fig.1 Amino acid sequence alignment between Homo sapiens and Mus musculus ChaC1 Human ChaC1 and mouse ChaC1 amino acid sequences are aligned with the basic local alignment search tool (BLAST). The alignment shows that human ChaC1 and mouse ChaC1 share a 88% similarity
2 ChaC1的催化活性
GGCT可以催化γ-谷氨酰氨基酸分解为5-氧脯氨酸(L-焦谷氨酸)和氨基酸。有趣的是,ChaC1作为GGCT家族成员,可以将还原型谷胱甘肽(GSH)分解成半胱氨酰甘氨酸(Cys-Gly)和5-氧脯氨酸(Fig.2)[3],而不作用于氧化型谷胱甘肽(GSSG)。人源ChaC1蛋白的第115位谷氨酸或鼠源ChaC1蛋白的第116位谷氨酸突变,会导致ChaC1丧失降解谷胱甘肽的活性[3]。
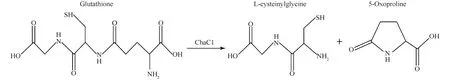
Fig.2 Enzymatic activity of ChaC1 ChaC1 catalyzes degradation of glutathione and production of Cys-Gly and 5-oxoproline
2.1 ChaC1的底物
研究结果显示,ChaC1的主要底物是还原型谷胱甘肽。体外研究发现,ChaC1还会分解某些特异的氨基酸与谷氨酸的γ羧基形成的氨酰键,例如ChaC1能分解γ-谷氨酰丙氨酸(γ-Glu-Ala)[4]。此外,ChaC1在有机硫营养缺陷型菌株中会特异地分解γ-谷氨酰半胱氨酸(γ-Glu-Cys),但它对甲硫氨酸与谷氨酸形成的γ-谷氨酰甲硫氨酸(γ-Glu-Met)缺乏活性[3]。体外研究发现,ChaC1分解谷胱甘肽的活性显著高于γ-Glu-Ala、γ-Glu-Cys以及一些其他的γ-谷氨酰二肽,表明ChaC1对谷胱甘肽的亲和性要高于γ-谷氨酰二肽[3]。
谷胱甘肽是活细胞内含量最丰富的小分子硫醇化合物,其在细胞内的浓度可以达到10 mmol/L。因为γ-谷氨酰键的存在,使得谷胱甘肽在细胞内尤其稳定[5]。在小鼠或大鼠的肝组织以及肾组织中,谷胱甘肽的半衰期是1~5 h[6,7]。除了少数原生动物,谷胱甘肽在真核生物中是必不可少的。在动植物胚胎期中,破坏谷胱甘肽的合成会导致其胚胎期死亡[8, 9]。谷胱甘肽在清除自由基、维持细胞氧化还原平衡和调节细胞存活等方面发挥重要作用。原先认为,谷胱甘肽参与的γ-谷氨酰循环,能够促进氨基酸通过质膜运输,但是近期研究发现,其作用并不明显[5]。
2.2 ChaC1催化反应的产物
ChaC1催化还原型谷胱甘肽分解成Cys-Gly和5-氧脯氨酸[3]。Cys-Gly被二肽酶降解成游离的Cys和Gly,随后被细胞再利用。而另一种产物5-氧脯氨酸的积累通常导致新生儿低血糖、小细胞低色素性贫血和智力障碍[10]。2017年,Peter van der Meer研究团队在心衰动物模型中研究发现,编码5-氧脯氨酸酶(5-oxoprolinase,OPLAH)的基因表达水平下降,导致5-氧脯氨酸的含量增加,进而引起氧化应激[11];体外给予心肌细胞5-氧脯氨酸也得到了相似的结果[12]。该团队又继续对535位急性心衰患者进行了检测,发现在心衰患者的血液中5-氧脯氨酸的含量与患者预后较差有关[12]。
3 ChaC1的表达及其调控
3.1 ChaC1基因表达的空间特异性
ChaC1基因在小鼠的心血管,脑,肝组织以及卵巢组织中均有表达[13],主要定位于细胞质内[2]。通过对HEK293细胞以及来自胚胎期14.5 d的原代神经元前体培养物进行高分辨率共聚焦免疫组化观察,发现ChaC1蛋白与反式高尔基体标记物(TGN38)共定位,而不是与顺式高尔基体标记物(GM130)共定位,说明ChaC1蛋白可能定位在胞质中的反式高尔基体上[13]。
3.2 ChaC1的转录调控
目前研究较为明确了ChaC1基因的转录因子是激活转录因子4(activating transcription factor 4, ATF4),它能识别并结合ChaC1基因启动子上的ATF/cAMP响应元件(ATF/cAMP response element,CRE)、ATF/CRE修饰(ATF/CRE modifier,ACM)元件和CEBP-ATF响应元件(CEBP-ATF response element,CARE)。其中,CRE是ATF4调控ChaC1基因表达的关键序列(Fig.3)[14]。在过表达Cyp2e1基因的肝癌细胞株HepG2中,用乙醇处理后会引起ChaC1基因表达水平升高。同时也发现,ATF4基因表达水平升高[15]。另外的研究使用青蒿琥酯(artesunate)处理CA-46细胞株(人Burkitt’s淋巴瘤细胞),发现ChaC1的mRNA被显著诱导,相应地ATF4基因表达上调[16]。基因敲减ATF4,可阻断上述药物对ChaC1基因的诱导作用,提示在上述应激反应中,ATF4基因参与ChaC1基因的诱导表达。
Tribbles假激酶3(tribbles pseudokinase 3,TRIB3),可被亚砷酸盐诱导表达。其高表达会抑制ChaC1蛋白表达水平,从而使得细胞内存在一个较高含量的谷胱甘肽。有意思的是,ATF4基因可直接激活TRIB3和ChaC1基因的表达。这提示,TRIB3基因可能是ATF4基因诱导ChaC1基因表达的负调控机制[17](Fig.3)。
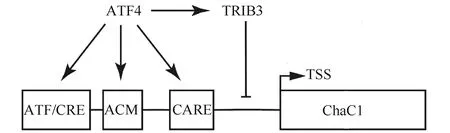
Fig.3 Regulation of ChaC1 expression by ATF4 and TRIB3 ATF4 directly binds to the promoters of ChaC1 on ATF/CRE, ACM and CARE sites to activate ChaC1 transcription. Meanwhile, TRIB3 could also be induced by ATF4 and suppresses the ChaC1 transcription, serving as a negative feedback of ATF4-mediated ChaC1 expression. (TSS:transcription start site)
在神经胶质母细胞瘤中,Temozolomide(一种临床用于治疗神经胶质母细胞瘤的药物)可以通过JNK1/c-Jun诱导ChaC1基因表达上调[18]。ChaC1基因还会在氨基酸缺乏[19]、癌症[20,21]、糖尿病肾病炎症[22]、病毒或细菌感染[23,24]、神经生长发育[13]、动脉粥样硬化、肝代谢[15,25]以及视网膜轴突损伤[26]中表达上调。然而,热激或者短暂的紫外(UV)线照射,并不能引起ChaC1的mRNA表达上调。
3.3 ChaC1蛋白的降解
蛋白酶体抑制剂MG132可以显著增加细胞内ChaC1蛋白的稳定性。在应用转录抑制剂——放线菌酮(cycloheximide,CHX)处理细胞时,ChaC1蛋白含量呈现剂量依赖性下降;而用CHX和MG132共处理时,细胞内并未发现ChaC1蛋白含量降低。这表明,ChaC1蛋白的降解依赖于蛋白酶体。然而,将ChaC1基因与泛素分子共同转染到细胞内,发现ChaC1蛋白确实可以和泛素分子结合,但是结合了泛素分子的ChaC1蛋白在细胞内更稳定。所以,细胞内ChaC1蛋白的降解可能是通过非泛素依赖的蛋白酶体降解途径进行的[27]。
4 ChaC1的功能
4.1 ChaC1在个体发育中的作用
在斑马鱼中,将ChaC1基因敲除会引起斑马鱼死亡。且回补实验证实,野生型ChaC1基因可逆转上述表型[28]。同样,在小鼠中,ChaC1基因的敲除也会导致小鼠胚胎期死亡[29,30]。这说明了ChaC1基因在个体生长发育中发挥了极其重要的功能。
在小鼠的神经发育过程中,ChaC1被鉴别为一种明显上调的蛋白质。当Notch1的第1 669位点的谷氨酸中的γ-羧基结合了甘氨酸后,ChaC1便可以发挥GGCT酶活性,将甘氨酸从谷氨酸上移除,从而抑制了蛋白酶对Notch1蛋白的剪切,进而抑制Notch1的初始成熟过程,使得Notch1处于未成熟状态,最终阻碍了Notch1信号通路和神经发育[4,13]。当然,这种说法还是颇具争议的,因为蛋白质上的谷氨酸缺乏具有去质子化的游离的α-氨基,因此还需要更多的证据来证明这一观点[31]。
4.2 ChaC1在细胞应激与死亡中的作用
志贺氏菌属(Shigella)感染细胞时会导致细胞膜通透性增加。其导致细胞处于氨基酸(尤其是亮氨酸、异亮氨酸、半胱氨酸)缺乏的状态,从而激活GCN2-eIF2-ATF4-ChaC1信号通路,进而引起细胞自噬[19](Fig.4)。在使用铁死亡激活剂Erastin,或临床抗癌药物Sorafenib处理纤维肉瘤HT-1080细胞株时,细胞的Xc-系统(非Na+依赖性逆向转运蛋白质)明显被抑制,导致细胞内的半胱氨酸含量下降,最终激活了ChaC1并引起细胞铁死亡[32](Fig.4)。在三阴性乳腺癌细胞中,胱氨酸缺乏导致细胞内的谷胱甘肽含量降低,超氧化物(reactive oxygen species, ROS)含量升高。这一现象引起了细胞内的综合应激反应(integrated stress response,ISR),从而激活了GCN2-eIF2-ATF4-ChaC1信号通路,进而引起了细胞死亡。在三阴性乳腺癌细胞系中,敲减ChaC1基因或者补充谷胱甘肽,可以降低因胱氨酸缺乏而导致的细胞死亡[33]。谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸组成的三肽,ChaC1能分解谷胱甘肽产生半胱氨酰甘氨酸二肽和5-氧脯氨酸。所以上述现象提示,氨基酸缺乏诱导ChaC1基因表达并分解谷胱甘肽,为细胞提供氨基酸(Fig.4)。同时这也引起了谷胱甘肽水平的下降和ROS的升高,从而诱发了细胞的死亡。

Fig.4 The role of ChaC1 in cell death Shigella, erastin or sorafenib-induced amino acid starvation activates the GCN2 kinase, which phosphorylates eukaryotic initiation factor 2α, leading to activation of the ATF4-ChaC1 pathway. The upregulation of ChaC1 depletes GSH, increases intracellular ROS and finally results in cell death
在HEK293细胞系中,ChaC1基因过表达会引起凋亡诱导因子(apoptosis-inducing factor,AIF)和多聚ADP核糖聚合酶(poly(ADP-ribose)polymerase,PARP)转位到细胞核,剪切DNA并最终导致细胞凋亡。有趣的是,高表达ChaC1基因的细胞并未发现胱天蛋白酶3(caspase-3)蛋白的激活。这一结果说明,在HEK细胞系中,ChaC1基因的高表达诱导细胞死亡并不依赖于胱天蛋白酶3信号通路[2]。但是,在神经胶质母细胞瘤中,ChaC1基因高表达可以激活胱天蛋白酶3/9信号通路[18]。这一现象说明了在不同的细胞系中,ChaC1基因引起细胞死亡的方式不同。
4.3 ChaC1在肿瘤中的作用
幽门螺杆菌感染胃壁细胞过程中,ChaC1基因高表达,这被认为与幽门螺杆菌诱导胃壁细胞突变和胃癌发生有关[34]。在人乳腺癌细胞株(Hs578 T)中,敲减ChaC1基因会减弱细胞的迁移和增殖[20]。此外,在乳腺癌患者和卵巢癌患者病人中,ChaC1的mRNA水平与肿瘤复发和死亡风险呈正相关。在葡萄膜黑色素瘤(uveal melanoma,UM)和肾透明肾细胞癌(kidney renal clear cell carcinoma,KIRC)患者中也发现,ChaC1的mRNA高表达与预后差成正相关[35,36]。这些研究均提示,ChaC1的mRNA水平很有可能是肿瘤患者预后的一个重要指标。
5 问题与展望
近些年,随着ChaC1基因研究的不断深入,人们对于谷胱甘肽的分解代谢过程及其在细胞生长、存活、应激和个体发育中的作用逐步有所了解,但仍有许多未解之谜。尽管大量研究显示,ChaC1基因受外界刺激诱导表达,但ChaC1在上述刺激物致病机制中的作用仍不明了。主要的原因是由于无法获得ChaC1基因全身敲除的小鼠。因而,构建ChaC1条件性基因敲除小鼠,结合各种疾病的小鼠模型,可进一步解析ChaC1基因的病理生理功能。此外,目前的观点认为,ChaC1主要是通过耗竭谷胱甘肽来发挥作用,往往忽略了其催化产物5-氧脯氨酸的作用。有趣的是,临床上会出现5-氧脯氨酸血症(5-oxoprolinemia)[37]。ChaC1是否与之有关有待研究。最后,ChaC1是哺乳动物体内细胞质中谷胱甘肽分解代谢通路的关键基因,它在体内的生理和病理功能的深入研究将有助于人们了解谷胱甘肽分解代谢异常在疾病中的作用,为解析相关疾病的发病机制及寻找治疗策略提供新思路。
