ROPs:植物细胞内多种信号通路的分子开关
2022-09-07廖恒毅王若霖
廖恒毅, 王若霖, 黄 进
(成都理工大学生态环境学院, 成都 610059)
G蛋白(又称GTP结合蛋白)是普遍存在于真核生物细胞中的一类信号转导蛋白质,根据其亚基的组成及分子量大小可划分为异源三聚体G蛋白质(或称大G蛋白)与单体小G蛋白质两大类[1]。其中,单体小G蛋白质超家族也称为 RAS(rat sarcoma)超家族,由RAS、RHO(ras homology family member)、RAB(ras-like in rat brain)、ARF(ADP-ribosylation factor)/SAR(secretion-associated and ras-related protein)和RAN(ras-related nuclear protein)5个家族组成[2]。在动物和真菌中,RHO家族蛋白质可进一步划分为RHO、CDC42和RAC 3个亚家族,而在植物中仅存在1种RHO蛋白质家族,又被称为ROP(Rho-related GTPases of plants)(Fig. 1)[3]。同时,由于ROP蛋白与非植物RAC小G蛋白在氨基酸序列上具有较高的同源性,ROP蛋白也被称为植物RAC蛋白质[4]。研究表明,植物中的ROP蛋白在花粉管的伸长、根毛的发育、叶表皮细胞的极性扩张生长、植物激素的应答以及植物的胁迫反应等诸多生长发育过程中发挥着重要的作用[5-11]。但目前的研究多集中于单个ROP蛋白在某一特定生长发育,或生命活动过程中的作用,对于ROP家族蛋白作用机制的整体性、共性的研究和总结相对较少。本文主要对植物ROP蛋白的结构与特性、信号转导机制及生物学功能的研究进展进行了阐述,并对ROP相关研究中尚未解决的问题进行了分析和探讨,以期为未来ROP相关的研究提供参考。

Fig.1 G protein family members in eukaryotes G proteins in eukaryotes are classified into several groups according to their protein structures. Small G proteins only exit in non-plants are shown in red boxes. The ones only exit in plants are presented in green boxes and the ones exist both in plants and non-plants are indicated in yellow boxes
1 ROP蛋白的结构与家族组成
ROP基因广泛存在于植物中,它们编码的蛋白质在结构上也高度保守。一般来说,植物ROP蛋白约有200个氨基酸,分子质量约为21至24 kD。典型的ROP蛋白一般包含5个高度保守的G-box环(G1-G5 loop)、插入区域(Rho insert)及C端可变区域HVR(hyper-variable region)(Fig. 2)[12]。其中,G1、G3、G4与G5在GTP/GDP的结合及GTP的水解过程中发挥重要作用。G2和G3又被称为开关Ⅰ和Ⅱ(switchⅠand Ⅱ),G2主要负责Mg2+、GAP及下游效应蛋白质的结合。C-端的HVR由富含半胱氨酸(Cys)的基序构成,其作为蛋白质翻译后脂修饰的位点可影响ROP蛋白在细胞质膜上的定位。对于ROP的插入区域的具体功能,由于相关研究较少,目前尚不明确[13]。因此,插入区域在细胞及植物生理过程中的功能仍有待进一步的探究。
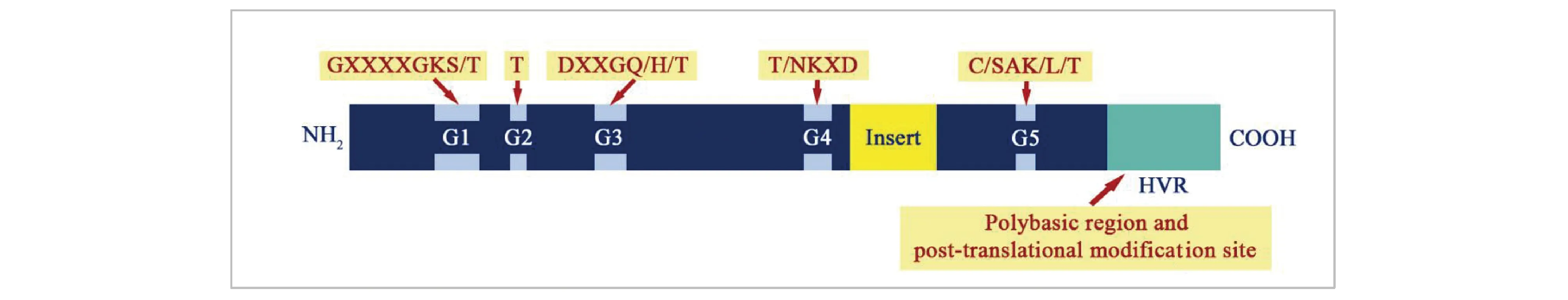
Fig.2 Schematic diagram of the structure of typical domain of ROP proteins There are five G loops in ROP proteins besides Rho insert and C-terminal HVR. G loops are responsible for GTP/GDP binding, GTP hydrolysis and binding with GAP and effectors. C-terminus of HVR regulates the subcellular localization of ROPs. The cellular function of Rho insert, however, remains unclear
通过对数据库中几种常见模式植物基因组的分析,发现高等植物中一般都含有多个ROP基因,例如拟南芥(Arabidopsisthaliana)含有11个,水稻含有7个,玉米含有9个,大麦含有6个。通过系统进化分析,可将拟南芥的11个ROP蛋白(紫色),水稻的7个ROP蛋白(黄色)、玉米的9个ROP蛋白(蓝色)及大麦的6个ROP蛋白(红色)划分为4个进化枝(Fig. 3)。但如果以ROP蛋白效应因子结合位点与插入序列的氨基酸序列的保守性,以及蛋白质C-端可变区域有无保守的CaaL(C为Cys,a为脂肪族氨基酸残基,L为Leu)或GC-CG(G为Gly,C为Cys)序列等为划分依据,则AtROP1~8被划分为第一类(typeⅠ),AtROP9 ~AtROP11为第二类(typeⅡ)。Ⅰ类和Ⅱ类 ROP在其C端虽然都存在富含半胱氨酸(Cys)的HVR蛋白域,但I类 ROP的保守序列为CaaL,而Ⅱ类的ROP的保守序列为GC-CG (G为Gly,a为脂肪族氨基酸残基,L为Leu,C为Cys)。因HVR保守序列的不同,Ⅰ类和Ⅱ类ROP蛋白在细胞内分别通过异戊烯化(prenylation)和脂酰化(S-acylation)作用进行蛋白质翻译后脂修饰,而脂修饰后的ROP蛋白才会结合细胞膜,并发挥其对细胞极性生长等过程的调控作用[14]。
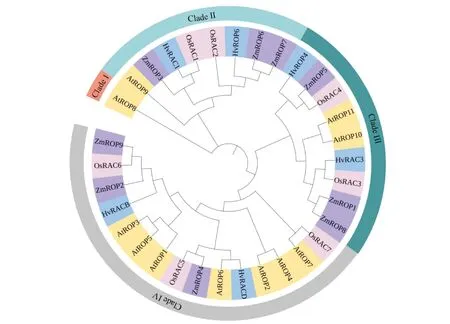
Fig.3 Phylogenetic analysis of the ROP families in Arabidopsis, rice, maize and barley There are 11 ROP proteins in Arabidopsis, 7 in rice, 9 in maize, and 6 in barley, respectively. According to the phylogenetic characteristics, these ROP proteins were classified into 4 clades. Totally 33 amino acid sequences were analyzed. Evolutionary analyses were conducted in MEGA7
2 ROP在细胞中作为“分子开关”的作用机制
与真菌以及哺乳动物细胞中的小G蛋白Ras超家族成员类似,植物ROP蛋白同样通过对GTP的结合与水解来实现激活态与失活态之间的转化,并通过与下游不同效应因子的结合,实现对植物的各种生命活动的“开关”调控[14]。鸟苷酸交换因子(guanine nucleotide exchange factor,GEF)、GTP水解活化蛋白(GTPase-activating protein,GAP)和鸟苷酸解离抑制因子(guanine nucleotide dissociation inhibitor, GDI)是调控ROP在激活态与失活态之间转换,或保持在某种状态的3个关键调控因子。一个完整的ROP信号转导过程可简单归纳为:(1)胞外信号激活细胞表面的类受体激酶(receptor like protein kinase,RLKS);(2)活化的类受体激酶通过磷酸化作用将GEF激活,而激活态的GEF将结合GDP的失活态ROP转变为结合GTP的激活态ROP,即完成了信号由胞外至胞内的传递;(3)激活态ROP通过与一种或多种特定的下游效应因子相互作用,实现对下游信号通路的控制,进而影响植物生长发育或其他生命活动。在此过程中,与GTP结合的激活态ROP水解GTP的能力十分有限,因此,ROP由激活态转换为失活态的过程,即将其自身结合的GTP水解为GDP的过程,还需依赖GAP对其自身GTP水解活性的增强作用(Fig. 4)[15-17]。现有研究认为,GDI结合ROP蛋白后,将其定位于胞质,从而实现对ROP蛋白活性的抑制,使其无法参与信号响应[18]。此外,在包括植物在内的所有生物中,小G蛋白这种复杂的调控机制和作用模式都是较为保守的[18]。
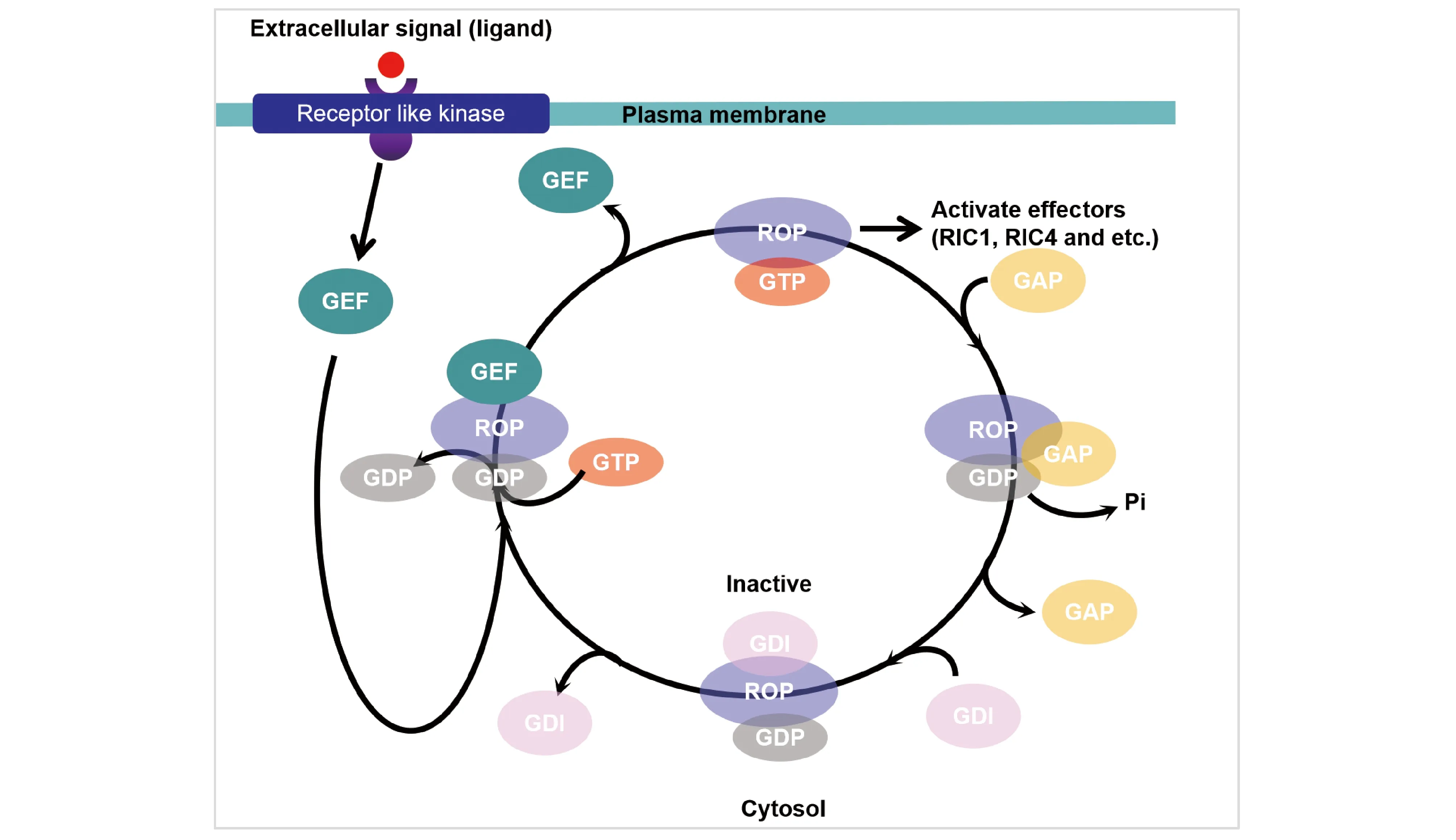
Fig.4 The on-off mechanism of ROPs in the plant cell Via receptor like kinases, extracellular signals activate GEFs. Thereafter, GDPs bound to ROPs are replaced by GTPs. The GTP binding ROPs are switched on and then activate downstream effectors. By GAP mediated hydrolysis of GTPs to GDPs, the ROPs are switched to inactive status again. GDIs further decrease the activity of the inactive ROsP by anchoring the ROP to the cytoplasm
尽管ROP蛋白分子量较小,蛋白质结构简单,但它们与诸多调节因子和效应因子组成了复杂的ROP信号枢纽,并通过与不同效应因子的结合实现功能的多样性,有益于植物应对各种复杂环境。
3 ROP的生物学功能
研究表明,ROP除了在植物细胞的极性生长,例如花粉管的伸长、根毛的发育、叶表皮细胞的极性扩张生长等过程中发挥作用之外,也在植物激素的应答以及植物的胁迫反应等诸多生长发育过程中发挥重要的作用(Table 1)。
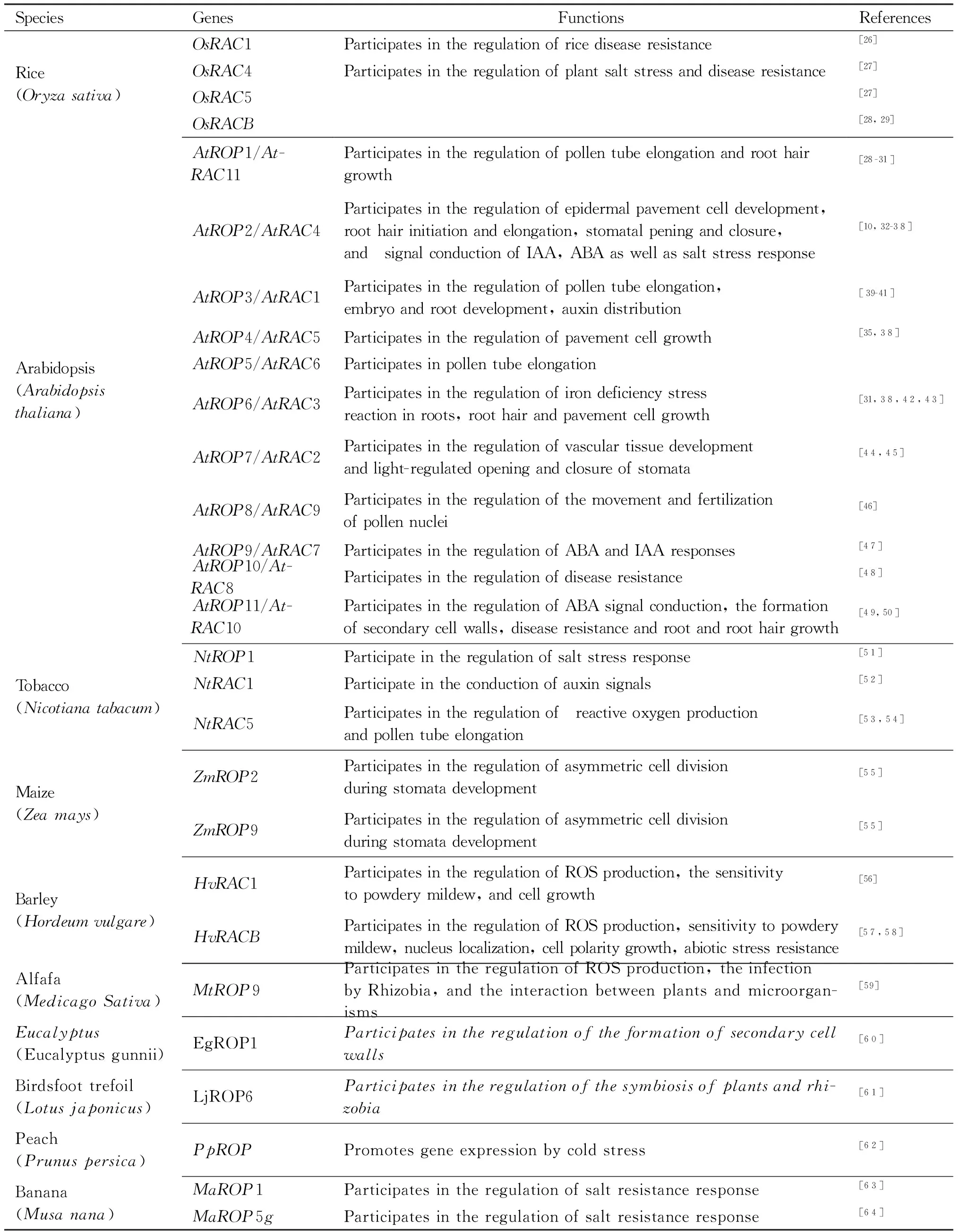
Table 1 The roles of plant ROPs
3.1 ROP参与植物的极性生长
植物细胞的极性生长模式主要分为顶端生长和扩散性生长两种类型。ROP在调控顶端生长的根毛、花粉管及不规划形状的植物表皮铺板细胞的极性生长过程中均发挥关键的作用。
3.1.1 ROP调控根毛的生长 ROP及其调控的下游作用因子通过调控Ca2+、ROS及生长素(auxin)的浓度和分布来实现对根毛生长的调控。根毛是植物根系特异化表皮细胞向外突起伸长形成的管状凸起物,是根表皮细胞的一种特殊结构,在植物吸收矿质养分、水分以及与外界环境相互作用的过程中至关重要[19-21]。研究结果表明,根毛的形成和极性生长均与ROP有关。以ROP2为例,在拟南芥根毛伸长生长过程中,胞外信号激活类受体激酶(receptor like protein kinase,RLK)FER(FERONIA)后,在GEF的作用下激活ROP2。激活态的AtROP2在根毛的起始生长位点开始聚集,并激活下游的效应因子—定位于质膜的RbohC/RHD2(respiratory burst oxidase homologues)。由RbohC产生的ROS作为重要的第二信使启动Ca2+通道,在根毛顶端形成Ca2+浓度梯度,从而调控微丝的动态变化和囊泡运输来调控根毛的产生。与此同时,胞质中增加的Ca2+又可以激活RbohC/RHD2形成正反馈调节[22]。此外,在这个调控过程中,发育调节的质膜多肽(developmentally regulated plasma membrane polypeptide,DREPP)家族成员MAP18(microtubule-associated protein 18)也对AtROP2进行正向调控。MAP18可通过与ROP负调控因子—SCN1/RhoGDI1的竞争作用缓解SCN1/AtRhoGDI1对AtROP2活性的抑制作用,进而促进根毛的极性伸长生长(Fig. 5)[10]。

Fig.5 The schematic diagram of the signaling network of root hair polarized growth regulated by ROPs ROPs and their downstream effectors, such as RbohC manipulate root hair growth by regulating the concentration and distribution of Ca2+, and ROS
有研究表明,生长素对根毛极性生长的调控同样需要ROP的参与才能实现。生长素在生长素输入载体(auxin resistant 1,AUX1)、小G蛋白ADP核糖基化因子(ADP-ribosylation factor,ARF)以及乙烯(ethylene,ETH)信号的共同调控下,会在根尖形成一定的浓度梯度。而生长素的浓度梯度可能决定了ROP的积聚位点,进而决定了根毛的起始位点,但该机制仍有许多细节问题有待阐明[23-25]。此外,是否有其他ROP成员参与了根毛的极性伸长生长调控,及其它影响根毛发育的激素是否也是通过ROP发挥作用的,仍有待深入的研究。
3.1.2 ROP调控花粉管的伸长 ROP通过对下游作用因子活性的控制来调控花粉管内Ca2+浓度、囊泡运输、微管的组装与解聚,进而实现对花粉管伸长生长的调控。在被子植物中,花粉管的伸长是保证开花植物双受精正常完成的关键环节。当花粉落到柱头上时,花粉粒的内壁通过花粉外壁上的萌发孔(或沟)向外极伸长,进而形成管状结构的花粉管。而伸长后的花粉管会受到胚珠信号的吸引通过珠孔进入胚珠,在此处释放2个精细胞,从而完成双受精过程[65]。值得注意的是,花粉管的极性伸长与根毛的极性生长一样,都表现为顶端生长,而ROP基因家族也被证实参与了对花粉管的顶端伸长的调控[6, 66]。在拟南芥中,ROP1分布于花粉管顶端的质膜,并在花粉管生长过程形成一个由激活态ROP1构成的帽状分布(cap of active ROP1),从而驱动花粉管的振荡生长(oscillatory growth)[67]。进一步的研究表明,ROP1在花粉管质膜部位是由被类受体激酶 PRK2磷酸化后的ROP-GEF1激活的。被激活的ROP与GTP,转变为激活态ROP1。处于激活态的ROP1通过激活下游的2个效应因子RIC3 (ROP-interactive CRIB motif-containing protein 3)和RIC4 (ROP-interactive CRIB motif-containing protein 4),来启动由RIC3与RIC4调控的2条微丝动态组装相关信号通路,进而调控在极性生长过程中发挥重要作用的胞吐过程[67]。其中RIC4促进花粉管顶端F-肌动蛋白(F-actin)的聚合,从而将胞吐过程中产生的囊泡靶向运输至位于花粉管顶端的生长位点[68-70]。而RIC3则能够刺激 Ca2+信号通路以提高胞内Ca2+浓度,以调节肌动蛋白解聚速率。不止于此,高浓度的Ca2+也可促进胞吐产生的囊泡与质膜的融合,加速花粉管顶端能量和物质积累,满足花粉管伸长的需求[71]。此外,ROP1还能通过其下游效应因子ICR1/RIP1(interactor of constitutively active ROP1/ROP-interactive partner 1)募集胞吐亚基SEC3,以促进胞吐作用(Fig. 6)[30, 72]。值得注意的是,在整个花粉管极性生长调控过程中,ROP1在花粉管顶端质膜的定位表现出一定的周期性,且这种周期性的定位总是先于该位点Ca2+的振荡变化和花粉管的振荡生长。该结果表明,ROP1在Ca2+调控的花粉管极性生长过程中很可能在信号通路的上游发挥关键性作用[73]。
在花粉管顶端激活态ROP1水平的维持或变化是依靠相关反馈调控机制实现的。ROP1下游RIC4介导的F-肌动蛋白聚合会诱导ROP1在花粉管顶端质膜的侧向扩张,表明F-肌动蛋白具有正向反馈调控ROP1的能力,但该调控作用的具体机制尚待阐明[30]。而花粉管极性生长过程中的胞吐作用也可被ROP1下游靶因子介导的负反馈信号通路抑制。在该反馈抑制信号通路中,囊泡将Rho-GAP成员REN1(ROP1 enhancer 1)运送至顶端质膜上,实现对激活态ROP1的抑制作用[74]。Ca2+下游信号分子钙依赖蛋白激酶(calcium-dependent protein kinases,CDPK)在感受到高浓度的Ca2+水平后也会对激活态ROP1产生抑制作用,但该抑制作用的具体机制仍有待进一步的阐明[71]。其实ROP的反馈抑制信号(Fig. 6)通路不止于此,研究表明,GDI以及磷脂酶C(phospholipases C,PLC)也在负反馈调节中发挥作用[75]。目前关于这些不同的反馈抑制信号通路之间是如何协调作用等问题仍然需要进一步研究。除此之外,除了ROP1介导的信号通路,其它的ROP家族成员是否以及如何参与对花粉管顶端生长调控等问题也仍有待进一步探索。
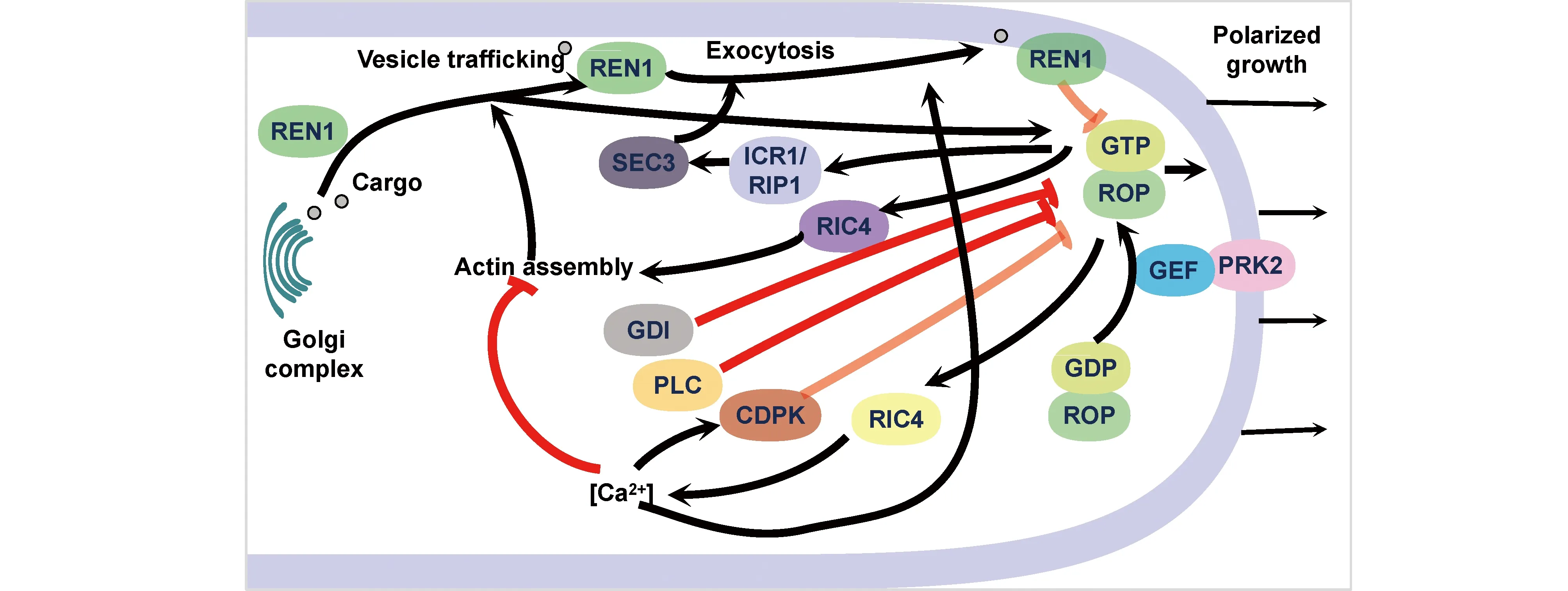
Fig.6 The schematic diagram of the signaling network of pollen tube polarized growth controlled by ROPs In the pollen tube, by controlling the activity of downstream effectors, ROPs regulate the concentration of Ca2+, vesicle transport, and the assembly and depolymerization of microfilaments, thereby realizing the regulation of pollen tube elongation
3.1.3 ROP调控叶表皮铺板细胞的极性生长 ROP通过对其对应下游作用因子活性的调控来控制微管和微丝的动态变化,进而造成对铺板细胞不同区域的凸起或凹陷,最终实现临近细胞的嵌合。叶表皮铺板细胞的形态类似于拼图呈现为版块状,由凹陷和突起彼此相互嵌合形成。这样的极性嵌合生长过程,需要细胞间的相互配合以实现相邻细胞突起区(lobes)和凹陷区(indentations)的协调生长[76, 77]。研究表明,拟南芥ROP2和ROP6以调控细胞骨架形态的方式在叶表皮铺板细胞的极性嵌合生长过程中发挥重要作用。当感受到胞外生长素后,细胞表面生长素结合蛋白1(auxin binding protein 1,ABP1)与跨膜受体样激酶(transmembrane receptor-like kinases,TMKs)组成受体复合体,将胞外信号转移至胞内,并激活信号通路下游的ROP2和ROP6[76, 77]。而在调控拟南芥的叶表皮铺板细胞形态建成时,ROP2与ROP6分别在调控微丝和周质微管形态的动态变化与互相拮抗的不同信号通路中发挥作用,二者的协作保证了叶表皮铺板细胞的有序嵌合。叶表皮铺板细胞突起区的形成依赖于ROP2介导的信号通路。首先位于子叶表皮细胞突起区的ROP2通过其下游影响因子RIC4募集肌动蛋白,并合成微丝。而微丝的形成有利于将细胞膜和细胞壁生长所需的物质运送至极性生长部位。同时,激活态ROP2抑制生长素输出载体PIN1在细胞表面内吞,以保证PIN1在叶表皮铺板细胞凸起区可维持较高水平,从而确保细胞在该区域向外延伸。简而言之,在叶表皮铺板细胞的突起区顶端形成的这个Auxin-ROP2-PIN1-Auxin正反馈调节途径,确保了该区域细胞向外的极性生长[78]。此外,有研究表明,激活态ROP2还能通过抑制RIC1的活性抑制叶表皮铺板细胞形成横向有序的微管,以确保叶表皮铺板细胞突起区的形成(Fig. 7)[79]。而叶表皮铺板细胞凹陷区的形成,则依赖位于子叶表皮细胞的凹陷区ROP6介导的信号途径。ROP6可通过募集RIC1和一种微管切割蛋白-剑蛋白(Katanin),促进周质微管排列成有序的横向微管[80]。而在细胞壁沉积方向纤维素沿着微管横向的沉积,从而限制了细胞在该区域的侧向扩张并最终形成凹陷。在相同细胞区域,ROP6介导的这一信号通路对ROP2有抑制作用,进而确保凹陷区形成(Fig. 7)[80]。
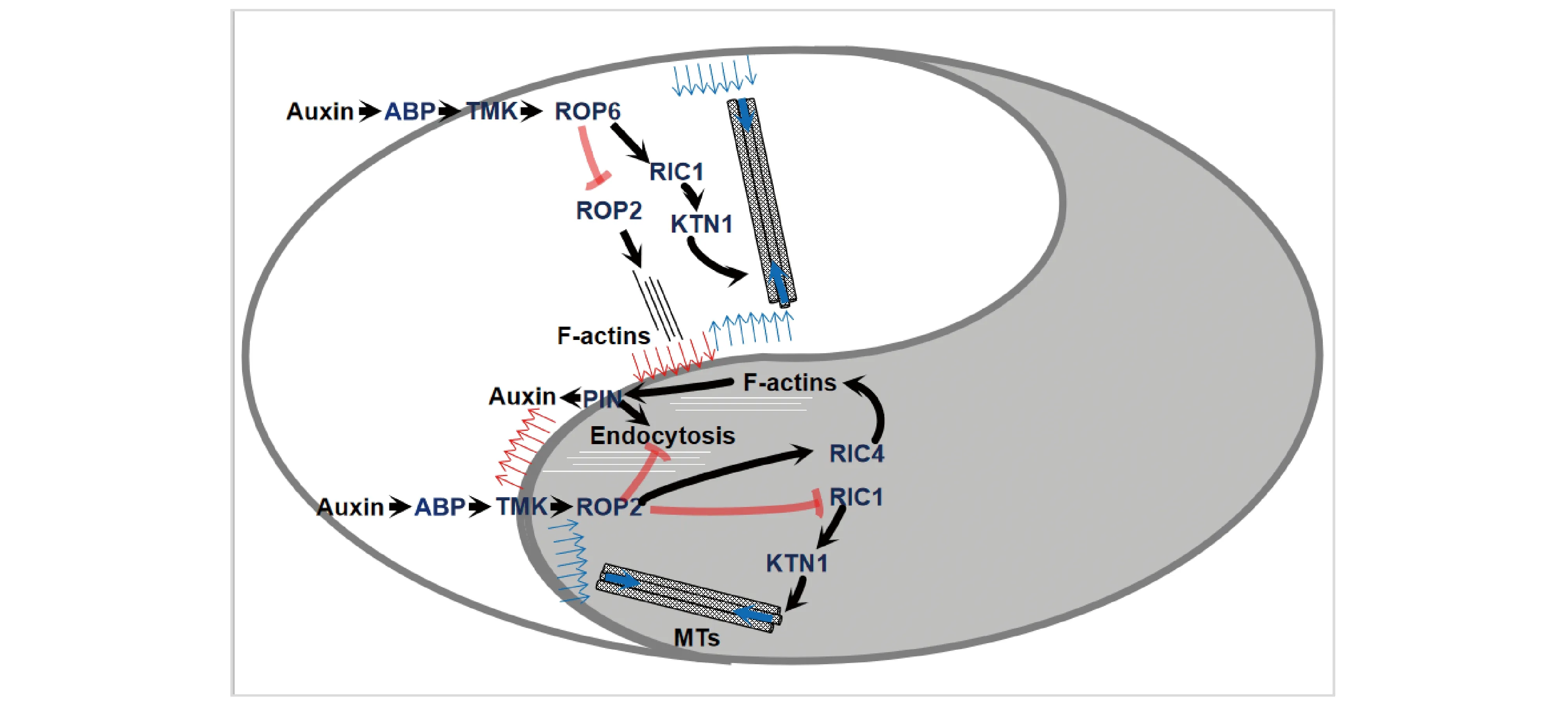
Fig.7 The schematic map of the signaling pathway of the growth of leaf epidermal plating cells regulated by ROPs ROPs and their effectors, such as RIC1 and RIC4, regulate the formation of lobes and indentations of pavement cells, thereby ensure complete interdigitation of adjacent pavement cells
3.2 ROP参与调控植物激素的信号转导通路
ROP作为分子开关,在植物激素调控植物的生长发育等过程中也发挥着重要的作用。植物激素虽然是简单的小分子有机化合物,但它们通过参与大量信号通路的调控,在植物各种生理过程中发挥着不可或缺的作用。
研究表明,ROP在ABA(abscisic acid)信号转导过程中充当负调控因子[81]。有证据表明,在保卫细胞中表达的AtROP6/AtRAC1基因在ABA诱导的气孔开闭过程中发挥重要作用,即组成性激活(constitutively active,CA)的CA-AtROP6突变体干扰ABA介导的叶片气孔关闭[82]。而AtROP11和AtROP10在ABA诱导的保卫细胞肌动蛋白的重组、气孔关闭、主根的伸长、种子萌发、幼苗的萌发后生长以及基因表达等一系列过程中发挥负调控作用。虽然对ROP参与的ABA信号途径的研究已取得一定进展,但ROP参与ABA信号通路的具体机制尚待进一步阐明[83-85]。
不同于对ABA信号通路的负向调控作用,ROP在IAA(auxin)信号通路中发挥正向调控作用。烟草NtRac1基因的过表达或活性丧失均会刺激生长素应答基因的表达,而过表达失活态的DN-NtRac1基因,或该基因的负调控因子则会抑制生长素应答基因的表达[52]。此外有研究表明,IAA可以迅速激活ROP蛋白,激活态ROP蛋白会促进IAA与泛素类蛋白质组成26S具有降解活性的蛋白质小体,通过降解IAA信号负调控相关蛋白,最终确保IAA应答基因的表达[86]。因此推测,ROP可能通过参与蛋白质的水解过程,在各种不同信号的转导途径中发挥作用。此外,拟南芥AtROP2被证明可调控生长素运输载体PIN1在细胞表面的分布,因此,ROP参与的IAA调控的生长过程,也可能是通过影响PIN的极性分布来实现的[87]。基于这些研究结果,ROP参与了IAA的信号转导过程毋庸置疑,但对这些信号通路之间是如何协同作用的系统研究尚少。
除了ABA和IAA,ROP还参与了植物激素油菜内酯素(brassinolide,BR)和ETH的信号转导过程[88]。在光照条件下,CA-AtRop2突变体表现出对油菜素内酯更强的敏感性,而DN-AtRop2突变体则表现出对油菜素内酯的敏感性下降。在暗培养条件下,CA-atrop2突变体也会出现植物受到油菜素内酯处理时下胚轴伸长的表型,DN-AtRop2突变体则会表现出油菜内酯素缺乏时下胚轴伸长的表型[88]。有研究表明,乙烯可造成AtROP7/AtRAC2基因表达的下调,而乙烯合成前体1-氨基环丙烯烷-1-羧酸(1-aminocyclop ropane-1-carboxylate,ACC)则会诱导AtROP1基因表达量的升高,但ROP在乙烯信号通路中的具体作用尚不明确[89]。
3.3 ROP参与胁迫信号转导
ROP作为植物中多种胁迫信号传递的分子开关,参与多种生物与非生物胁迫诱导的信号转导,通过启动对应的胁迫响应机制,在植物逆境响应过程中发挥关键作用。
3.3.1 ROP参与非生物胁迫信号转导 目前,大量研究证实,ROP参与植物非生物胁迫过程中信号转导。例如在缺氧条件下,被激活的拟南芥ROP通过调节NADPH氧化酶的活性产生过氧化氢,过氧化氢又可作为第二信使,一方面通过调控乙醇脱氢酶(alcohol dehydrogenase,ADH)的活性,为无氧呼吸提供能量,增强拟南芥植株应对缺氧胁迫的能力;另一方面,过氧化氢可以诱导ROP负调控因子GAP的活性,抑制ROP的活性。这种反馈抑制机制既可保证植物体内有足够的过氧化氢用于诱导下游的信号途径,又可避免过氧化氢水平过高对细胞产生毒害作用[89, 90]。受盐胁迫时,NtROP1的拟南芥过表达植株与野生型植株相比,过氧化氢或活性氧的含量增加,相对电导率水平均明显升高,根变短,对盐胁迫表现出更高的敏感性[51]。另有研究表明,在盐胁迫条件下,过表达OsRacB的转基因烟草表现出更强的抗盐特性[28]。此外,也有研究发现,拟南芥ROP2-RIC1信号途径可通过调节微管重组以应对高盐胁迫[32]。
有相关研究表明,ROP在缓解冷害对植物损害过程中也发挥着积极的作用。例如,枇杷果实中的3个ROP基因家族成员EjROP1、EjROP2和EjROP3对冷害诱导的枇杷果实(Eriobotryajaponica)木质化的形成有正向调控作用[91]。玉露桃(Prunuspersica)遇到冷害时,PpROP基因的表达水平显著升高,而程序降温(low temperature conditioning,LTC)处理可使PpROP基因的表达水平受到明显抑制。该研究结果表明,玉露桃对冷害胁迫的响应是受到PpROP调控的[62]。苹果(Malusdomestica)果实中的ROP通过调节ROS的水平,在苹果应对冷害胁迫的过程中发挥着重要的作用[17]。
3.3.2 ROP参与生物胁迫信号转导 关于植物ROP在植物应对生物胁迫过程中作用的研究开展的比较广泛。水稻ROP家族成员OsRac1在水稻抵抗真菌病害稻瘟病,以及细菌病害白叶枯病的过程中发挥正向调控作用[92]。研究表明,OsRac1可以通过调控NADPH氧化酶活性促进ROS的产生和局部的细胞凋亡,即产生超敏性坏死反应(hypersensitive response,HR),从而提高水稻植株对稻瘟病与白叶枯的抗病能力[93, 94]。此外OsRac1还可以激活负责植物木质素合成的肉桂酰辅酶A还原酶1(cinnamoyl coA reductase 1,CCR1),并促进细胞壁的形成,因此可在植物抵御病原菌入侵时发挥重要作用[95]。
大麦ROP家族成员HvRacB也是参与抗病反应的重要调控因子,研究表明,HvRacB的RNAi转基因大麦对白粉病真菌(BlumeriaGraminis)的抗病性增强[96]。反之,CA-HvRacB转基因小麦显示出对白粉病病原真菌更强的敏感性[97]。白粉菌作为活体营养型病原体,需要通过入侵和吸取活体宿主细胞的营养物质以维持生存和致病力,因此,侵染及发病过程会尽量避免触发植物体内的高敏反应,而ROP可能是植物应对白粉菌侵染过程中负责坏死反应的抗病机制中的重要因子之一。此外,白粉菌入侵宿主细胞的过程中,需要造成宿主细胞质膜的内陷,而这个过程正是通过ROP信号通路介导的[98]。也有研究表明,大麦 ROP 蛋白质还能正调控肌动蛋白丝的极化,通过物理性的强化作用来抵御白粉菌对植物组织的入侵[96]。此外,在其他植物中也有一些关于ROP参与植物抗病作用的研究报道,例如拟南芥AtROP6基因的非激活态突变体能够提高拟南芥对白粉菌的抗病性,而这可能与水杨酸(salicylic acid,SA)信号转导途径有关[99]。
4 问题与展望
目前通过利用各种过表达植株和功能缺失突变体进行的一系列研究证明,ROP蛋白在植物中作为分子开关参与调控根毛与花粉管的极性生长、叶表皮铺板细胞的扩散性生长、植物激素信号转导,以及生物胁迫信号转导等一系列生理及生长发育过程(Fig.8)。但ROP在各种信号通路中的具体作用仍然有许多缺失的环节,例如植物中不同ROP家族成员在同一个调控信号通路中扮演的角色通常是不同或者是完全相反的,那么这种功能上的不同具体是如何实现的?ROP 在不同的信号调控通路中与不同的调控因子和效应因子具体是如何相互作用的?还有哪些未知的调控因子和效应因子?ROP对某一个植物发育或者生理过程的调控经常会通过同时参与几条完全不同的信号通路来实现,这些信号通路之间是如何联系或协调作用的?正如本文所述,ROP在ABA的信号转导过程中发挥着重要的作用,而ABA在促进植物叶片衰老中的作用也已经被广泛的研究,但目前尚无ROP参与调控植物衰老的直接证据,ROP在植物衰老中的作用也值得进一步的探究。
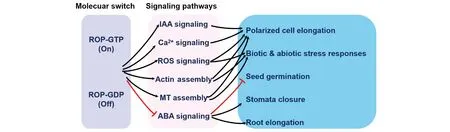
Fig.8 The development and physiology functions regulated by the pathways which are modulated by ROPs By turning on or off ROP-mediated pathways, such as IAA signaling, ABA signaling, ROS signaling, Ca2+ signaling and so on, the process or activities such as polarized growth, biotic or abiotic stress responses, seed germination, stomata closure and root elongation are regulated
本研究团队前期的研究发现,FORMIN基因与水稻根毛发育相关,也有研究表明,在拟南介中ROP也直接参与了根毛发育的调控,但对于二者是否是在同一信号通路中调控根毛发育的相关研究较少[100,101]。对动物FORMIN和小G蛋白质的相关研究表明,两者在同一信号通路中通过互作控制肌动蛋白的动态变化[102]。植物FORMIN在调控肌动蛋白(actin)动态变化的过程中是否正如动物FORMIN蛋白一样需要小G蛋白质的参与?如果是这样的话,无明显GTPase结合域的植物FORMIN又是如何实现与小G蛋白的相互作用,并共同行使它们对肌动蛋白动态的调节功能的?在根毛极性生长过程中,RIC1和RIC4及其同家族蛋白质是否也作为ROP的效应因子在极性生长过程中发挥作用?这些未知之谜仍有待深入的探究。在未来的研究中,可在参考借鉴哺乳动物中小G蛋白质的作用机制研究的基础上,结合植物自身生长发育的特点,利用近年来迅速发展起来的基因编辑、基因组学等技术对植物ROP的功能、作用机制等进行更加深入的研究。
