厚壳贻贝鸟氨酸-尿素循环中的关键代谢物及基因分析
2022-09-07范孝俊张晓林范美华严小军
王 莹, 范孝俊, 刘 菲, 张晓林, 范美华, 严小军, 廖 智
(浙江海洋大学 海洋科学与技术学院 海洋生物资源与分子工程研究室, 浙江 舟山 316022)
鸟氨酸-尿素循环(ornithine-urea cycle,OUC)是生物体新陈代谢过程中的一个经典代谢途径,不仅与生物体含氮废物的排泄直接相关,也涉及渗透压调节、能量的代谢调节等诸多生物学过程[1,2]。OUC通常被认为是陆生生物的代谢特征之一,其代谢产物尿素是陆生生物含氮废物的主要排泄形式。而水生生物通常被认为以直接排氨为主[3]。但水生生物中也发现OUC途径的存在,例如较早就注意到双壳贝类中具有OUC相关酶的存在[4]。由于水生生物的生存环境的特殊性,其含氮废物的排泄主要以直接排氨为主,尿素形式排泄所占比例极低[5]。此外,近年发现水生生物的OUC途径可能与其他生物过程相关。例如,在鱼类中,OUC途径与其免疫反应的调控存在关联[6,7];在贝类中,OUC途径可能与其低氧耐受有关[8]。上述结果表明,尽管水生生物可能存在OUC途径,但其途径可能并非以排泄含氮废物为主要目的,而是参与了体内的其他生物学过程。
OUC途径涉及6种关键的代谢酶,包括氨甲酰磷酸合酶I(carbamoyl phosphate synthase I,CPS-I)、鸟氨酸转甲基酶(ornithine transcarbamoylase, OTC)、精氨琥珀酸合酶(argininosuccinate synthase,ASS)、精氨琥珀酸裂解酶(argininosuccinate lyase,ASL)、精氨酸酶(arginase,ARG)以及脲酶(urease,URE)。目前,水生生物OUC途径研究在鱼类[9]、藻类[10]以及两栖类[11]等物种中已有相关报道,但是对于贝类OUC途径的研究尚不多见。对于贝类OUC途径的代谢过程及其可能的生物学功能仍缺乏系统和深入的认识。
贻贝(Mytilus)是一类具有全球广泛性分布且具有重要经济价值的双壳贝类,因其强繁殖能力、强环境适应性以及滤食性特征,贻贝在自然界的能量流动、水质保护、环境监测等方面具有重要的生态意义,并在自然界中占据了极为重要的生态位[12,13]。近年来,厚壳贻贝(Mytiluscoruscus),地中海贻贝(Mytilusgalloprovincalis)等代表性贻贝物种的基因组序列先后被解析[14-16]。值得关注的是,在贻贝基因组序列中,已发现OUC途径相关基因的存在,包括ASS(数据库编号:CAC5402095.1)、ASL(数据库编号:CAC5396990.1)、URE等 (见Fig.1)。但OUC途径对贝类的生物学作用及其相关机制目前仍不明确。
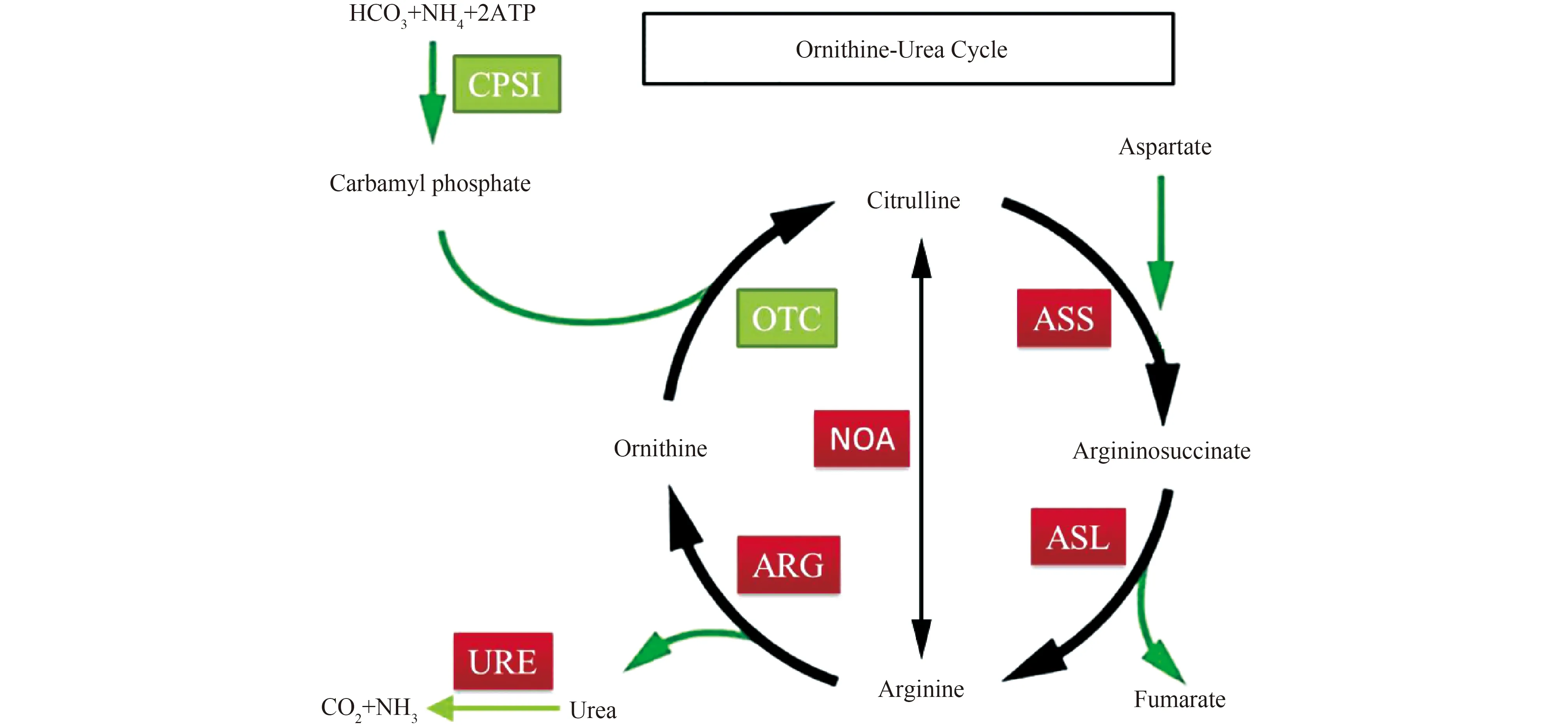
Fig.1 Schematic diagram of OUC pathway in M. coruscus Red frame and green frame represent the identified and unidentified genes from M. coruscus genome, respectively
以往的研究表明,贻贝表现出对海洋酸化的较强耐受性[17],这一特征导致贻贝成为某些高二氧化碳浓度海域的优势物种[18,19]。作为生物矿化的典型产物,贻贝贝壳的形成依赖于两个方面,一是钙离子的募集,二是CO32-的产生。因工业革命使海洋酸化导致海水的平均pH值已下降了约0.1个单位,继而导致海水CO32-浓度显著下降[20,21]。因此,海水酸化会导致贝类生物矿化受阻而导致大规模死亡。目前,已知部分低等生物(例如部分植物,细菌和真菌等)中,尿素代谢途径所产生的CO32-与其生物矿化直接相关[22,23]。例如,微生物诱导碳酸钙沉淀已经被证实是一种在自然界中广泛存在的生物矿化过程[24]。这一过程的关键在于脲酶(urease, EC3.5.1.5)辅助的碳酸钙矿化,其机制在于脲酶催化尿素的降解,产生碳酸和氨,氨进一步促进pH值的上升。之后上升的pH促进碳酸分解为CO32-,继而与钙离子结合形成碳酸钙[25]。贻贝贝壳的生物矿化对海水酸化表现出的较强耐受性[17-19]。我们推测,这可能与其体内的尿素循环有关。为此,本文以厚壳贻贝为研究对象,对其OUC途径中的关键代谢物和关键基因进行分析,以期为了解贝类OUC途径与生物矿化之间的关联提供新的科学认知。
1 材料与方法
1.1 厚壳贻贝外套膜鸟氨酸-尿素循环关键代谢物分析
成年厚壳贻贝采集自浙江舟山嵊泗海域。以洁净海水暂养于恒温水族箱(22 ℃,盐度25 ‰)中。取厚壳贻贝外套膜与后闭壳肌组织,迅速以液氮研磨,参照潘晨等[26]方法,以超滤法(截留分子量为3 kD)收集各组织小分子提取物,经冷冻干燥后冻存备用。利用微量全自动氨基酸组成分析仪(LA8080,日本日立公司)进行OUC途径关键代谢物定性与定量分析。标准品为AN-II型标准品混合液(货号:011-14463,含标准氨基酸及尿素,鸟氨酸和瓜氨酸等标准品,日本和光纯药工业株式会社),参照潘晨等[26]方法上机分析。
1.2 精氨酸补充对厚壳贻贝各组织鸟氨酸-尿素循环关键代谢物的影响分析
采用后闭壳肌注射方式,对厚壳贻贝进行精氨酸补充。精氨酸预先以生理盐水配制成1 mg/mL,注射体积20 μL。注射后分别在0.5、1、2、4和8 h,取厚壳贻贝外套膜及后闭壳肌组织,经液氮研磨和代谢物提取后,上氨基酸分析仪,进行尿素、精氨酸、鸟氨酸和瓜氨酸的含量变化分析。
1.3 厚壳贻贝鸟氨酸-尿素循环相关酶的基因序列获取及序列分析
厚壳贻贝的5种OUC途径关键基因的序列通过厚壳贻贝基因组数据库(数据库编号:GCA_011752425.2),以及组织全长转录组数据库 (数据库编号:SRX791940和SRX792025)进行筛选,经序列验证后,提交GenBank数据库,编号分别为ASS(MZ665473)、ASL(MZ665474)、NOA(MZ665475)、ARG(MZ665476)和URE(MZ665478)。
通过生物信息学手段开展序列分析。其中,开放阅读框采用Lasergene软件(版本7.0)分析;蛋白质的理化性质通过Expasy数据库软件Protparam (http://web.expasy.org/protparam/)进行在线分析;同源序列搜索在NCBI网站上,利用BLAST软件在线(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行;结构域预测及三级结构预测分别采用SMART(http://smart.embl-heidelberg.de/)以及SWIEE MODEL (https: //swissmodel.expasy.org/)在线进行。
1.4 厚壳贻贝尿素代谢相关酶的基因表达分析
分别收集厚壳贻贝外套膜及后闭壳肌组织。组织总RNA提取采用柱式microRNA抽提试剂盒(上海生工)并按照说明书进行。总RNA逆转录采用试剂盒 (PrimeScriptTMRT reagent Kit, TaKaRa)进行;以逆转录后的cDNA作为模板,进行荧光定量PCR扩增,扩增条件为95 ℃预变性3 min,95 ℃ 20 s,59 ℃ 20 s,72 ℃ 25 s。循环数为35。以厚壳贻贝β-肌动蛋白为内参,所用引物见Table 1。荧光定量PCR扩增采取3次重复实验,采用最小二乘法(2-ΔΔCt法)处理数据。

Table 1 Primers for qPCR analysis
1.5 13C稳定同位素分析
将13C稳定同位素标记的尿素(购自赫澎生物),以生理盐水配置成1 mg/mL浓度,采取后闭壳肌注射方式注射至贻贝体内;以同体积生理盐水注射组为对照组。取注射后的贻贝贝壳,将贝壳研磨成粉末,参照文献[27]方法,以0.5 mol/L氢氧化钠溶液在60 ℃条件下进行脱有机质处理。处理后的贝壳粉末样品经离心收集沉淀,并反复以去离子水洗涤,烘干称重。称取一定量的贝壳粉末样品放置于元素分析仪(Isotope cube,德国Elementar公司)样品盘中,样品中的碳元素转化为纯净的CO2气体后,上样同位素质谱仪(Biovision,德国Elementar公司)检测。稳定同位素测定的标准物质包括B2155(δ13C=-26.98‰)、IAEA-CH-6(δ13C=-10.449‰)以及USGS64(δ13C=-40.81‰),碳稳定同位素的定值参照国际通用标准设定为美洲拟箭石。仪器测定精度为δ13C <±0.2‰。13C稳定同位素比值计算按照公式δ13C =[(Rs / Rst)-1] ×103计算。其中, Rs和Rst 分别表示样品和标准物质中的重同位素与轻同位素比值(13C/12C)。
1.6 统计学分析
采用平均值±方差 (mean±SD)记录数据,采用3次平行试验。利用SPSS 22.0软件包中one-way ANOVA单因素方差检验进行统计学分析,P<0.05代表显著性差异,P<0.01代表极显著差异。
2 结果
2.1 厚壳贻贝存在尿素循环途径及其关键基因
目前,厚壳贻贝基因组序列已被解析[15-16]。厚壳贻贝各组织的转录组数据也已公布,包括外套膜[28]、血细胞[29]和足[30]等组织。通过对厚壳贻贝基因组以及组织转录组数据挖掘,本文对厚壳贻贝参与OUC途径的关键基因进行了鉴定,结果如Fig.1所示。由图可见,厚壳贻贝基因中,参与OUC途径的包括精氨琥珀酸合酶(ASS)、精氨琥珀酸裂解酶(ASL)、精氨酸酶(ARG)以及脲酶(URE)。此外,还发现厚壳贻贝中存在一氧化氮相关蛋白(nitric oxide-associated protein,NOA),该蛋白质催化精氨酸和瓜氨酸之间的代谢。但厚壳贻贝基因中缺乏氨甲酰磷酸合酶-I(CPS-I)和鸟氨酸氨甲酰基转移酶(OTC)(Fig.1)。该结果表明,厚壳贻贝OUC途径并不完整,但至少存在从瓜氨酸到精氨琥珀酸,再到精氨酸以及尿素和鸟氨酸,与尿素分解为二氧化碳和氨的代谢途径。上述5条基因的序列分析结果见Table 2。结构域及三级结构预测结果见Fig.2。Table 2表明,厚壳贻贝OUC途径5种关键基因的序列主要与其他贻贝属物种的同源序列具有较高相似性,其序列相似性可达90%以上。而与其他双壳贝类的同源序列的相似性在60%~80%之间。与脊椎动物的同源序列相比,则其序列相似性低于50%。5种关键基因的序列中,均含有与其功能对应的特征结构域。其中,ASS和ARG含有1个特征结构域,而ASL和URE均含有4个特征结构域,NOA则含有3个特征结构域(Fig.2)。预测的三级结构特征提示,厚壳贻贝OUC途径5种关键基因的表达产物均形成特定有序的空间构象。其中,ASS和ASL为四聚体结构模型,NOA 为单体结构模型,ARG和URE均为三聚体结构模型(Fig.2)。
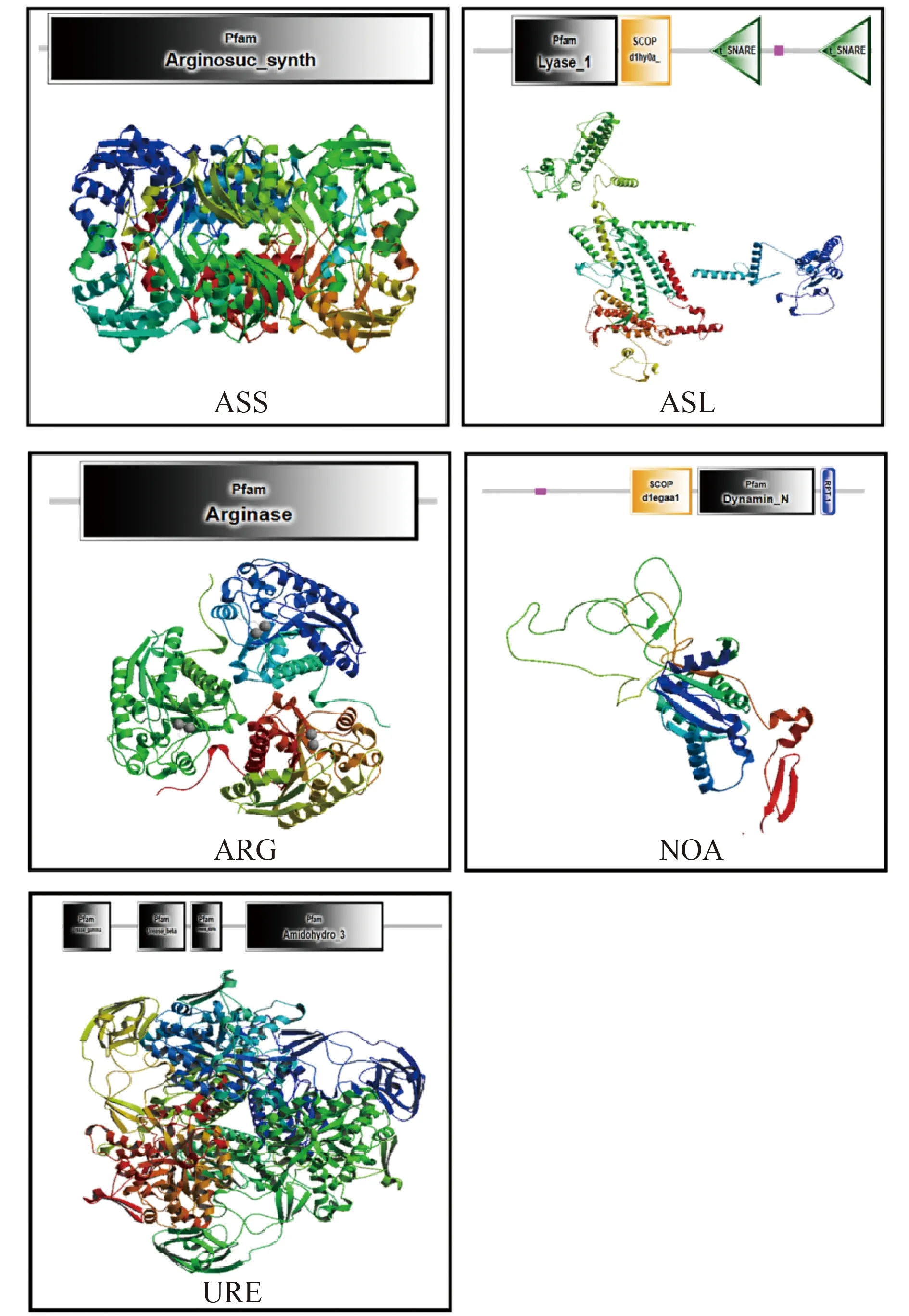
Fig.2 Domain and tertiary structure prediction of the five proteins encoded by the genes involving in OUC pathway in M. coruscus The domain was predicted by SMART. The spatial structure was predicted by SWISS MODEL server. The models of five proteins are tetramer for ASS and ASL, trimer for ARG and URE, and monomer for NOA, respectively

Table 2 Sequential features of five key genes involving in the OUC pathway in M. coruscus
2.2 精氨酸诱导可促进厚壳贻贝组织中尿素代谢的代谢物含量变化
为探讨厚壳贻贝OUC途径关键代谢物的含量以及OUC途径是否与贻贝生物矿化有关,考虑到外套膜是贝壳形成最为关键的组织[31]。为此,选择外套膜作为代表性组织,分析其OUC途径关键代谢物的含量,同时以后闭壳肌组织作为参照。利用氨基酸分析仪分别对外套膜及后闭壳肌组织进行了游离氨基酸分析。结合标准品的洗脱时间及曲线下面积,重点计算了精氨酸、鸟氨酸、瓜氨酸、尿素和天冬氨酸的含量,结果见Fig.3。由Fig.3可见,OUC途径关键代谢物在厚壳贻贝外套膜组织中的含量差异较大。其中,尿素在外套膜组织中含量最高,达到79.54±0.87 μg/g干组织,其含量约为瓜氨酸的260倍,鸟氨酸的20倍。而精氨酸与天冬氨酸则在外套膜中未检出。在后闭壳肌中,5种代谢物均能检出。其中,尿素含量最高,达到69.28±1.16 μg/g干组织;天冬氨酸含量最低,仅为0.18±0.027 μg/g干组织。
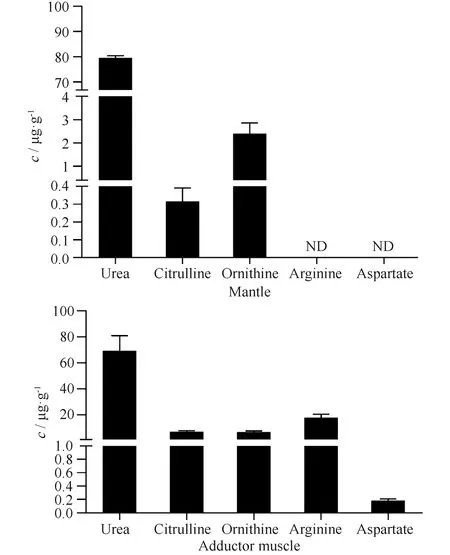
Fig.3 The concentration of five metabolites of OUC pathway in mantle and adductor muscle of M. coruscus The concentration of metabolites was determined by an amino acid analyzer using standard urea, citrulline, ornithine, arginine, and aspartate, respectively, and calculated by the area under the curve (AUC) comparing with the standard curve. The data were presented as mean ± SD (n = 3); ND represents no detection
进一步采用精氨酸注射诱导。诱导后,不同代谢物在外套膜和后闭壳肌组织中的含量变化见Fig.4。
由Fig.4可见,精氨酸注射后,外套膜组织中,5种代谢物含量均发生明显变化。其中,尿素含量在注射后1 h即达到峰值。其含量相比对照组(0 h组)增加约1.8倍;之后在2 h明显下降(P<0.01),之后逐步回升至对照组水平。瓜氨酸含量在精氨酸注射后,在2 h及4 h急剧下降至不能检测到。鸟氨酸含量变化不明显(P>0.05),维持在3.29 ± 0.025至11.40 ± 1.55 μg/g干组织之间;而精氨酸和天冬氨酸则在对照组中未能检出。但在注射精氨酸后,其含量分别增加至19.72 ± 0.05和 21.81 ± 0.01 μg/g干组织,随后保持平稳。后闭壳肌中,精氨酸注射后导致尿素含量出现明显增加(P<0.01),其峰值出现在2 h,相比对照组,含量上升约1.5倍。瓜氨酸含量在注射精氨酸后急剧下降至无法检测;鸟氨酸含量在精氨酸注射后有轻微上升,而精氨酸本身在后闭壳肌注射精氨酸后明显上升,并在0.5 h后维持稳定。天冬氨酸在精氨酸注射后0.5 h出现明显上调,随后急剧下降,在2和4 h已无法检测到。随后,在8 h恢复至对照组水平(Fig.4)。

Fig.4 The content changes of five metabolites of OUC pathway in mantle and adductor muscle M. coruscus was injected with 20 μL arginine (1 mg/mL). The mantle and the adductor muscle were collected, respectively at post-induction of 0, 0.5, 1, 2, 4, and 8 hours. The concentration of metabolites was determined by amino acid analyzer. The data were presented as mean ± SD (n = 3); The statistical analysis of differences was performed by SPSS (v25.0) with one-way ANOVA followed by Tukey’s multiple range test. * and ** represents the significance of the difference P<0.05 and P<0.01 (n=3), respectively, compared with that in control group (0 h). ND represents no detection
2.3 精氨酸诱导可促进厚壳贻贝组织中尿素代谢关键基因的表达量变化
对5种厚壳贻贝OUC途径关键基因的表达差异分析结果见Fig.5。由图可见,厚壳贻贝5种OUC途径关键基因的表达量在外套膜及后闭壳肌组织中的表达谱类似,相对表达量较高的分别为NOA、ASL和ARG,而ASS和URE表达量较低。

Fig.5 The expression level of five genes involving in OUC pathway in mantle and adductor muscle of M. coruscus The relative expression level was calculated by 2-△△Ct method with actin as the reference gene, and presented as mean ± SD (n = 3)
进一步采用精氨酸注射诱导,分析诱导后5种OUC途径关键基因在外套膜及后闭壳肌组织中的表达量变化,结果见Fig.6。精氨酸注射后,外套膜组织中,ASS基因的表达量相对于对照组出现先显著上调(P<0.01)后显著下调(P<0.01);ASL基因的表达量则在精氨酸注射后2 h出现显著上调(P<0.01),随后恢复正常水平;NOA基因的表达量在注射精氨酸后2 h出现急剧下降,随后恢复正常水平;ARG基因的表达量在注射精氨酸后基本维持稳定,仅在2 和4 h有轻微下调(P<0.05);URE基因的表达量则在精氨酸注射2 h后急剧上升(P<0.01),其表达量峰值相比对照组增加约100倍。后闭壳肌中,ASS基因表达量在注射精氨酸后出现稳步下调;而ASL基因表达量则稳步上调;NOA基因表达量在精氨酸注射后2 h急剧下调(P<0.01);ARG基因表达量则在精氨酸注射后出现明显上调(P<0.01),峰值出现在注射后4 h,随后恢复正常水平;而URE基因表达量则在精氨酸注射后出现稳步上调,其峰值出现在8 h(Fig.6)。

Fig.6 The change of expression level of five genes involving in OUC pathway in mantle and adductor muscle after injection of arginine M. coruscus was injected with 20 μL arginine (1 mg/mL), and the mantle and the adductor muscle were collected respectively at post-induction of 0.5 , 1 , 2 , 4 , and 8 hours. The relative expression levels of five genes were calculated by 2-△△Ct method and presented as mean ± SD (n = 3). The statistical analysis of differences was performed by SPSS (v25.0) with one-way ANOVA followed by Tukey’s multiple range test. *and ** represents the significance of the difference P<0.05 and P<0.01 (n = 3), respectively, compared with that of 0.5 hours
2.4 13C标记尿素注射促进厚壳贻贝贝壳中δ13C比值上升
厚壳贻贝经13C稳定同位素标记尿素注射后,其贝壳中13C稳定同位素分析结果见Fig.7。由Fig.7可见,厚壳贻贝贝壳中13C/12C的比值(δ13C)在注射不同浓度的13C标记尿素后,相比于对照组(0 h组)均明显上升(P<0.05)。其上升趋势呈现一定的时间依赖性,在24 h后即达到峰值(P<0.01);但浓度依赖性不明显,20 μg及以上注射量并未导致δ13C值发生明显变化(P>0.05)。
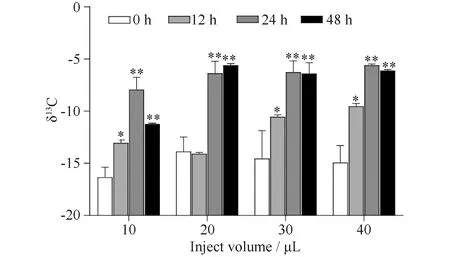
Fig.7 The changes of 13C/12C (δ13C) in mussel shell after injection of 13C labeled urea M. coruscus was injected with different volume (10, 20, 30, and 40 μL) of 13C labeled urea(1mg/mL). The shell was collected at post-injection of 0, 12, 24, and 48 hours, respectively. The changes of δ13C were determined by an isotope mass spectrometer. The data were presented as mean ± SD (n = 3); Statistical analysis of differences was performed by SPSS (v25.0) with one-way ANOVA followed by Tukey’s multiple range test. * and ** represents the significance of the difference P<0.05 and P<0.01 (n=3), respectively, compared with that of control group at 0 hour
3 讨论
此前研究中,尽管发现贝类中存在OUC途径关键基因及其主要代谢物,但是该途径在贝类中的生理作用及代谢过程尚不明确。本文通过对厚壳贻贝外套膜及后闭壳肌组织OUC途径的关键代谢物和关键基因分析,首先确认了5种OUC途径关键基因及其主要代谢物在上述组织中的存在。厚壳贻贝外套膜及后闭壳肌组织均具有较高浓度的尿素(Fig.3),但外套膜中精氨酸含量极低,推测外套膜组织中,绝大多数精氨酸可能已分解为尿素并储存于该组织中。这也表明,外套膜中高浓度的尿素必然有其特定的意义。精氨酸是尿素分子合成的前体物质。本文研究确认,精氨酸注射可诱导厚壳贻贝外套膜组织产生更多的尿素分子并进一步激活URE,进而促进尿素的降解。但奇怪的是,精氨酸注射虽然导致外套膜中尿素分子含量上升,但精氨酸分解为尿素过程中的另一种产物,即鸟氨酸的含量却并未明显增加;同时也发现,外套膜中ARG基因的表达量仅在精氨酸注射后1 h有轻微上升(Fig.6),这表明,外套膜中精氨酸注射后尿素浓度的增高可能还有其他因素参与。值得关注的是,由于精氨酸注射部位是后闭壳肌,本文发现,后闭壳肌中精氨酸注射导致了ARG的表达量明显上升,且其表达量上升幅度约为外套膜中的20倍(Fig.6)。同时,后闭壳肌中精氨酸注射也导致了尿素含量的明显上升,但其上升幅度较外套膜组织要低(Fig.4)。因此,推测后闭壳肌注射精氨酸,激活了后闭壳肌的精氨酸酶,导致产生更多的尿素,同时后闭壳肌中的尿素进一步转运至外套膜,从而导致外套膜中尿素含量的急剧增加。此外,外套膜中,鸟氨酸含量的稳定可能与其在维持组织细胞渗透压中的重要贡献有关[32,33],推测鸟氨酸可能在外套膜中维持了某种稳态,且精氨酸注射导致产生的多余鸟氨酸可能通过别的途径进行了转化。但该推测尚需后续实验证实。
瓜氨酸与天冬氨酸均为精氨琥珀酸的合成前体,ASS是催化这一过程的关键基因。本文发现,ASS表达量的上调可加快精氨琥珀酸的合成速率,导致瓜氨酸的含量的下降;而随后ASS表达量的下调会使这一反应过程减缓,从而导致瓜氨酸的积累。这可能是外套膜中精氨酸注射后,瓜氨酸含量出现急剧下降以及随后恢复正常水平的内在原因。此外,天冬氨酸在外套膜中随着精氨酸注射出现含量的急剧增加以及后续的稳定保持,表现出积累效应,这一点尚无法解释。但本文注意到精氨酸注射后4 h,外套膜中ASL的基因表达量出现轻微下调,推测精氨琥珀酸的分解速率会因此下降,从而导致外套膜中精氨琥珀酸的含量会在后期出现积累,而精氨琥珀酸的积累会导致天冬氨酸的积累,这一点在最近针对贝类低氧状态下OUC途径的研究中获得证实[8]。与外套膜不同的是,后闭壳肌中ASS基因的表达量随着精氨酸的注射表现出下调,但是ASL基因表达量则出现稳步上调趋势,推测ASL的上调导致了精氨琥珀酸的持续降解,从而导致更多的瓜氨酸和天冬氨酸合成为精氨琥珀酸,因而瓜氨酸和天冬氨酸含量均显著下降。
值得关注的是,厚壳贻贝中,精氨酸和瓜氨酸之间存在直接代谢通路(Fig.1),其关键基因在于NOA。精氨酸注射对瓜氨酸含量具有明显抑制作用,推测精氨酸抑制了NOA的表达。精氨酸注射后,NOA基因的表达量下调证实了这一推测(Fig.6)。NOA基因目前被认为是植物中通过催化精氨酸转化为瓜氨酸并释放出一氧化氮的关键基因,因而对植物中一氧化氮合成以及免疫调节具有重要作用[34];而在动物中,一氧化氮的产生被认为与一氧化氮合酶(Nitric oxide synthase,NOS)有关[35]。尽管NOS基因的同源序列在贻贝属中已被鉴定到,但该基因在贻贝中的生理学作用尚未可知。已有研究发现,贝类中NOS与一氧化氮的合成以及贻贝的免疫和变态发育存在密切关系,但其NOS与NOA基因在序列上具有较大差异,两者分属于不同的基因家族[36,37]。本研究中观察到,精氨酸注射不论是对瓜氨酸含量还是NOA基因表达量均具有抑制作用,表明NOA在厚壳贻贝中催化的可能并非精氨酸转化为瓜氨酸的过程,而是催化了瓜氨酸转化为精氨酸的反应(Fig.1)。但该推测尚需进一步的研究证实。
OUC途径的终产物是尿素分子。目前,对于尿素在贝类中存在的意义通常被认为有如下两种可能,其一是通过尿素合成,防止缺氧条件下,游离氨对贝类组织的毒性[8,38];其二是尿素在贝类中可能作为其共生藻类的氮源[39]。而在部分植物以及微生物研究中,尿素已被证实是一种生物矿化相关主要分子[22,40]。厚壳贻贝外套膜中高浓度的尿素分子暗示着在贻贝中,尿素可能也参与了其贝壳的生物矿化过程。利用13C稳定同位素标记的尿素注射厚壳贻贝,结果表明,厚壳贻贝贝壳中13C/12C比值明显升高(Fig.7)。在本研究中,贻贝贝壳粉末经强碱处理以确保贝壳中的有机物能被全部去除,从而排除了尿素所转化的有机物在贝壳中的存在[27]。贝壳中13C/12C比值的升高意味着尿素分子中的C元素参与了贝壳碳酸钙的形成,但具有某种饱和性 (Fig.7),表明尿素参与贝壳形成具有一定限制。近年来,人们已开始注意到,贝壳形成过程中的CO32-虽然主要来源于海水,但内源性CO32-对贝类贝壳形成也可能具有重要作用[41,42];早期研究中,人们发现贻贝在海水酸化胁迫下,其贝壳形成虽未明显受到影响,但其摄食速率和代谢速率会明显增加[42,43]。这一现象表明,贻贝贝壳在生物矿化过程中,其内源性CO32-对其贝壳形成具有重要作用,甚至可以抵消外源性CO32-浓度的下降而导致的生物矿化异常,以此来对抗环境变化对贝壳形成的不利影响。但目前人们对于贝类贝壳的形成中其内源性CO32-的来源尚不明确。本研究结果初步证实,OUC途径在贻贝体内的存在,以及该循环的终产物尿素可能参与了贝壳的形成。上述研究为深入了解贻贝OUC途径与生物矿化之间的关联,以及探讨贻贝对海水酸化耐受性的内在分子机制奠定了基础。
