Cdkn2a示踪小鼠:研究创伤性骨关节炎软骨退变细胞衰老的新模型
2022-09-07樊逸菲许博洋敖英芳胡晓青
吴 桐, 樊逸菲, 许博洋, 程 锦, 敖英芳, 胡晓青
(北京大学第三医院运动医学科,北京大学运动医学研究所运动医学关节伤病北京市重点实验室, 北京 100191)
骨关节炎(osteoarthritis,OA)是一种慢性的关节退行性疾病,是包括关节炎症、软骨退变和结构改变在内的关节整体的变化,临床上会出现关节疼痛、活动受限和关节畸形的表现,影响患者的活动、生活质量,甚至致残[1]。当前,我国65岁以上人群中OA的发病率超过50%,75岁以上人群中超过80%[2]。OA的病因复杂,目前的治疗方法只有消炎镇痛、软骨保护等对症治疗和关节置换手术,仍无针对病因的有效治疗手段。
OA主要病理特征是关节软骨退变及其细胞外基质(extracellular matrix, ECM)代谢稳态失衡,OA软骨退变与衰老、创伤、代谢紊乱及异常应力有关[3]。衰老(aging)参与调控机体多种复杂生理和病理过程,贯穿整个生命周期[4]。已有研究表明,衰老与OA软骨退变进程密不可分[5, 6],包括长年使用所致关节软骨组织磨损,以及关节内组织出现细胞衰老现象,影响软骨组织的修复再生能力[6, 7]。然而,细胞衰老如何影响OA软骨退变进程及其具体作用机制仍不清楚,靶向清除衰老细胞来延缓OA软骨退变进程已成为研究热点。
学者们利用多种细胞衰老标记物研究细胞衰老与疾病的关系,包括基因Cdkn2a(p16,p16INK4a)和Cdkn1a(p21,p21CIP)编码的p16和p21蛋白质,β-半乳糖苷酶(β-galactosidase,β-gal)、DNA损伤、衰老相关分泌表型(senescence-associated secretory phenotype,SASP)等[8]。现有OA动物模型大多需要处死动物来明确OA疾病进程及软骨损伤程度,缺乏无创、实时观察细胞衰老与OA疾病进程相关性的动物模型。本研究利用CRISPR/Cas9技术,获得Cdkn2a基因定点敲入Luc-2A-tdTomato-2A-CreERT2-WPRE-pA杂合子小鼠,对该转基因小鼠进行手术诱导建立体内OA模型,验证该基因工程小鼠对于OA和衰老关系研究的作用,并探讨该模型小鼠用于靶向衰老治疗OA的临床研究的可能作用。
1 材料与方法
1.1 实验动物
实验所用的C57BL/6小鼠来自于上海南方模式生物科技股份有限公司。所有动物实验操作符合北京大学实验动物福利伦理审查,并遵守北京大学动物保护规定。小鼠饲养在特定的无病原体(specific pathogen-freefacility,SPF)设施条件的动物房,动物房采用12 h光照和12 h黑暗循环,同时保证小鼠可自由进食和喝水。年轻小鼠为10 ~ 12周龄,雌鼠和年轻的同窝雄鼠分笼饲养(伦理批准号:LA2020353),每个笼子不超过5只。
1.2 荧光示踪小鼠的获得
采用CRISPR/Cas9技术,通过同源重组的方式,在Cdkn2a基因Cdkn2a-201转录本exon 2(第62个氨基酸之后)定点敲入Luc-2A-tdTomato-2A-CreERT2-WPRE-pA表达框。简要过程如下:通过体外转录的方式,获得Cas9 mRNA和gRNA;通过In-Fusion cloning的方法构建同源重组载体(donor vector),该载体包含4.0 Kb 5′同源臂、Luc-2A-tdTomato-2A-CreERT2-WPRE-pA和4.0 Kb 3′同源臂。将Cas9 mRNA、gRNA和donor vector显微注射到C57BL/6J小鼠受精卵中,获得F0代小鼠。经长片段PCR鉴定,共获得2只正确同源重组的F0代小鼠;F0代小鼠与C57BL/6J小鼠交配获得6只阳性F1代小鼠。由F1代小鼠进行繁殖和培育,共选取24只小鼠进行实验。
1.3 小鼠骨关节炎模型的构建
将小鼠随机分为3组:正常组、假手术组(sham)、前交叉韧带横断术组(anterior cruciate ligament transection,ACLT)。ACLT组通过前交叉韧带切断术构建小鼠创伤后骨关节炎模型。选取的小鼠麻醉后,备皮消毒,在膝关节内侧切开皮肤、皮下组织、关节囊,暴露前交叉韧带。用显微剪切断前交叉韧带。并进行前抽屉试验检查前交叉韧带是否已经断裂。消毒后逐层缝合。实验组小鼠双侧腿均进行手术。假手术组小鼠麻醉后,常规备皮消毒,在膝关节内侧逐层切开皮肤、皮下组织、关节囊,不切断前交叉韧带。随后消毒、逐层缝合。所有动物实验操作符合北京大学实验动物福利伦理审查,并遵守北京大学动物保护规定。上述动物实验都依据相应的国际准则实施。
1.4 活体成像
采取异氟烷麻醉小鼠,在其关节内注射10 μL荧光素酶底物,15 min后用 IVIS Spectrum体内成像系统测量发光。
1.5 热板分析
将小鼠置于55 ℃热板仪(UGO BASILE srl,意大利)。出现后肢反应(例如,摇晃、跳跃或舔舐)时间被记录为手术前和手术后不同时间点的反应时间。每只小鼠至少进行了3次测量,每次测量间隔时间≥30 min。观察者和记录者对小鼠的基因型和干预措施不知情。
1.6 显微CT
采用显微CT(Micro-CT,Siemens,Inveon MM Gantry,美国)检测小鼠膝关节形态、骨赘形成和软骨下骨质结构情况。收取ACLT术后 4 周的小鼠膝关节,切除关节囊周围的肌肉和其他软组织。使用Micro-CT对标本进行扫描(每组n=7 只)。使用Mimics Research software 对 micro-CT 图像进行3D 重建。对胫骨平台处软骨下骨的形态学进行评估。使用Inveon Research Workplace software对其进行CT定量分析,测量数据包括骨体积分数(trabecular bone volume pertotal volume,BV/TV)和骨小梁模式因子(trabecular bone pattern factor,Tb. Pf)。
1.7 免疫组织化学染色
收取各组小鼠的膝关节标本。移除关节囊周围的皮肤和软组织、肌肉等,将组织放入10%的中性甲醛中浸泡固定3 d。固定后的标本冲洗后脱钙24 h,随后流水冲洗过夜。组织脱水后石蜡包埋、切片(厚度5 μm)。石蜡切片脱蜡、过氧化物酶阻断、胃蛋白酶抗原修复、Cdkn2a一抗(稀释比例1∶200,abcam ab54210,英国)4 ℃孵育过夜、山羊抗小鼠二抗、DAB显色、脱水、透明、封片。
1.8 番红O固绿液染色
小鼠膝关节组织的石蜡切片脱蜡、固绿染液染色、1%冰醋酸固定,番红O染液染色,95%乙醇洗去浮色,脱水、透明、封片。
1.9 OARSI评分
OARSI评分采用国际骨关节炎研究协会(Osteoarthritis Research Society International,OARSI)评分系统进行。评分标准为:正常软骨为0分,蛋白质多糖、基质、软骨细胞丢失及基质出现纤维化,占全部软骨的5% ~ 10%为1分,上述病变占软骨11% ~ 25%为2分,占26% ~ 50%为3分,占全部软骨51% ~ 75%为4分,75%以上为5分。总分为0 ~ 30分。
1.10 统计学方法
实验数据表示为平均值±标准差。使用SPSS 18.0 statistical software(IBM Corp)进行数据分析。统计学差异P<0.05。采用one-way ANOVA进行统计学检验。
2 结果
2.1 构建Cdkn2a小鼠,且术后关节区域荧光增加
利用CRISPR/Cas9技术,在Cdkn2a-201基因的转录本exon 2(第62个氨基酸之后)敲入Luc-2A-tdTomato-2A-CreERT2-WPRE-pA,获得Cdkn2a-e(Luc-2A-tdTomato-2A-CreERT2-WPRE-pA)1定点敲入的杂合子小鼠。该小鼠体内Cdkn2a阳性的衰老细胞可以通过荧光报告,在体外也可以通过红色荧光原位显示Cdkn2a的表达及分布。
为了在手术诱导模型小鼠中观察OA进展和局部衰老的情况,对小鼠进行了ACLT手术,建立手术诱导OA的模型。在术后4周收取小鼠,通过动物活体成像跟踪Cdkn2a表达来确定衰老细胞是否在小鼠关节创伤后发生(Fig.1A)。通过ACLT手术在小鼠中诱导了创伤后OA。在ACLT手术后,Cdkn2a示踪小鼠关节区域的荧光均值31 483p/s远高于正常组和假手术组9 749 p/s和5 822 p/s(Fig.1B),提示Cdkn2a表达升高。进行荧光发光的量化统计,也存在显著的差异(P<0.05)。
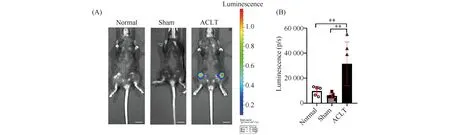
Fig.1 Representative luminescence imaging in vivo after surgery The CRISPR/Cas9 technique was used to get heterozygous mice with Cdkn2a-e (Luc-2A-tdTomato-2a-CreerT2-Wpre-PA)1. The Cdkn2a tracer mice were treated with no surgery,sham and ACLT, respectively. Cdkn2a expression was shown by fluorescence imaging in vivo (normal, n=5; sham, n=7; ACLT, n=6) of ACLT mice 4 weeks after surgery (A) and quantification of the luminescence (B) was shown (in arbitrary units, p/s). Values were presented as mean ± SD. **P<0.01. Scale bars, 1 cm
2.2 ACLT术后4周发生膝关节软骨退变
在ACLT术后4周,通过组织学检测来验证骨关节炎的情况和软骨的退化。对比正常组和假手术组的番红O固绿染色,ACLT术引起损伤减少了蛋白多糖的番红O染色,在组织学层面也可以观察到软骨变薄、表面软骨面不连续(Fig.2A),表明ACLT术明显诱导了小鼠膝关节软骨组织的退变。同时,采用国际骨关节炎研究学会(OARSI)评分系统对小鼠膝关节OA的严重程度进行评分。OARSI评分表明,与正常组和假手术组相比,ACLT术后膝关节软骨组织的OARSI评分明显升高,大于0和1分(P<0.05),表明ACLT术成功诱导了的膝关节骨关节炎的进展与软骨组织的退行性病变(Fig.2B)。
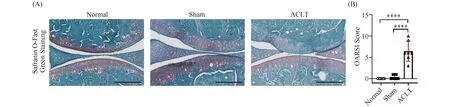
Fig.2 Cartilage degeneration after surgery for 4 weeks Knee tissues of Cdkn2a mice were collected after surgery for 4 weeks. Safranin O-Fast Green Staining(A)and OARSI Score(B)were then performed to confirm the degeneration of cartilage (normal, n=7; sham, n=7; ACLT , n=7). Values were presented as mean ± SD. ****P<0.0001. Scale bars, 200 μm
2.3 术后膝关节Cdkn2a阳性衰老软骨细胞表达升高
为了验证骨关节炎关节中衰老的表达和定位关节中衰老软骨细胞,对Cdkn2a进行了免疫组织化学染色。在ACLT手术诱导的小鼠中,Cdkn2a阳性的细胞明显增多,主要出现在浅表的软骨区域(Fig.3A)。相反,在非手术和假手术对照组小鼠中,Cdkn2a蛋白染色阳性的细胞较少。本文结果发现,与未进行ACLT手术的小鼠相比,表达Cdkn2a的细胞数目在ACLT小鼠的软骨表面更多。

Fig.3 Expression of Cdkn2a positive cells in the cartilage Immunohistochemical staining was performed to detect the expression of senescence markers in OA. The Cdkn2a positive cells were also shown (normal, n=4; sham, n=4; ACLT, n=4). Scale bars, 100 μm
2.4 术后小鼠出现疼痛症状及软骨下骨改变
采用功能学实验对ACLT小鼠的骨关节炎疼痛进行评估。骨关节炎引起的疼痛症状评估表明,将小鼠置于55 ℃的发热平台上,因为膝关节损伤,小鼠对于高温的疼痛耐受限度更低,小鼠表现出舔舐、跳跃等规避疼痛动作的反应时间更短(平均反应时间10.35 s)(Fig.4A)。这一反应时间在非手术组(平均时间13.22 s)和假手术组(平均时间13.37 s)都更长。实验中,检测了ACLT术小鼠膝关节骨赘和软骨下骨的变化。小鼠的Micro-CT检测的3D重建影像证明,在小鼠ACLT术后4周时,胫骨平台处有少量的骨赘形成、表面粗糙等骨关节炎的典型影像学变化(Fig.4B)。同时,在Micro-CT扫描成像图上选择感兴趣区域做阈值分割等操作,进行CT定量分析发现,ACLT小鼠的骨密度均值为1 166 mg/cm3,低于正常组(均值为1 309 mg/cm3)和假手术组(均值为1 272 mg/cm3),提示松质骨密度或骨矿物质密度降低。在感兴趣区骨组织(TV)相同的条件下,ACLT小鼠的骨体积分数BV/TV均值为44.40%,这一均值低于正常组的71.41%和假手术组的62.76%,提示骨量减少。通过3D重建能对骨小梁微结构进行无损3D成像,通过骨小梁的微结构计算得到骨小梁模式因子(trabecular pattern factor,Tb.Pf),可以表现骨质状态。对比非手术、假手术对照组都小于0 mm-1的均值,ACLT小鼠的Tb.Pf均值增加为3.990 mm-1,提示骨小梁从板状变为杆状,发生了骨关节炎导致的骨质疏松的表现。测量各组的平均皮质骨厚度未见统计学差异(Fig.4C)。
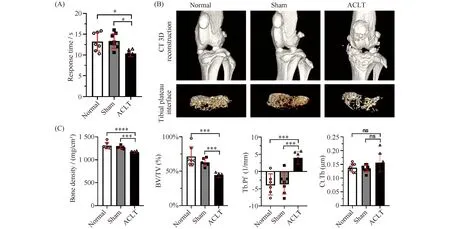
Fig.4 Pain symptoms and imaging detection in mice after surgery The Cdkn2a mice were placed on the heating platform at 55℃ and the reaction time of licking and jumping was shown(A). Micro-CT of joints from mice was performed. The 3D reconstruction of CT indicates the bone changes and the tibial plateau section shows the structure of bone trabeculae(B). Bone density(mg/cm3), bone volume fraction(BV/TV,%),trabecular pattern factor(Tb.Pf,1/mm)and cortical bone thickness were used to assess subchondral bone changes in osteoarthritis by quantitative CT(C). Values were presented as mean ± SD. *P<0.05,***P<0.001,****P<0.0001(normal, n=7; sham, n=7; ACLT, n=7)
3 讨论
骨关节炎是世界上最为常见的关节疾病。随着社会进步发展与人口老龄化问题凸显,OA的发病率也逐年上升,成为巨大的社会负担。临床上主要是对症治疗[9, 10],最终只能进行手术置换关节[11]。这阻碍了高龄和存在基础疾病的患者得到治疗。因此,明确OA发生发展的病理生理,寻找针对病因的根治手段,是研究者和临床医生都迫切希望解决的问题。
衰老是OA的最大危险因素之一。研究者从接受关节置换手术的患者的软骨组织中发现了衰老的软骨细胞[6, 12, 13]。细胞衰老是细胞周期停滞的一种永久性状态,在衰老的机制中发挥主要作用。衰老"清除"小鼠模型的应用是研究衰老与机体机制的里程碑。表达p16INK4a的衰老细胞被靶向消除后,可以显著改善小鼠的健康和活力,延长其寿命[14]。靶向衰老的治疗可以缓解衰老相关疾病的发生发展[15-19]。但衰老在OA病理发展中确切作用尚未完全清楚,靶向衰老调节治疗OA仍停留在实验室研究阶段。
目前,主要研究障碍之一是缺乏合适的研究关节软骨细胞衰老的体内模型,现有的几种模型也各有利弊[20]。当这些模型应用于靶向衰老研究OA时,均存在一个共同的缺点,无法直观地、无创地观测活体动物中的衰老细胞及其标志物,缺乏研究衰老细胞在OA发生发展中的即时变化数据。为了克服这一障碍,本研究提出一种Cdkn2a示踪小鼠模型。该模型可在体外直观、无创地即时跟踪Cdkn2a的表达来观察衰老细胞在小鼠关节创伤后的变化情况。
本文评估了该模型在研究创伤后骨关节炎相关病理中的软骨细胞衰老的适用性。本文将Cdkn2a示踪小鼠分别进行假手术及前交叉韧带的横切术,以评估各组关节软骨中衰老标志物的表达及骨关节炎的发生情况。首先,通过使用动物活体成像观察关节腔发光的方法,本文能够直观地观察到骨关节炎发生时衰老的出现(Fig.1)。同时通过组织学检测验证了小鼠ACLT术后骨关节炎的发生和软骨的退化(Fig.2)。本文发现,ACLT术后小鼠关节软骨的Cdkn2a表达上调,这一结果与前人的研究结果一致[15],进一步表明该模型能有效地利用荧光示踪方法直观地反映细胞衰老的变化(Fig.3)总之,本文发现通过使用细胞衰老小鼠模型,利用Cdkn2a示踪的方法可以有效地研究ACLT术后诱导引起骨关节炎的病理特征及其与衰老的关系。
本研究的突出优势在于,通过结合活体小鼠成像和影像学的检查,可以在特定时间点观察小鼠OA的进展及衰老的变化情况。这使得对OA和衰老进展变化的观察更具有即时性也更直观无创,这种观察无需处死动物,却能实时获取疾病的进展和衰老的变化特征,为后续用药物靶向衰老治疗OA的研究提供了跟踪治疗全程的便利,这对于OA的新型药物治疗的研究无疑也是有力的工具。荧光素酶底物发光可以多次应用,荧光素酶底物的半衰期为3 h。每次显色间隔3 h以上,耗尽底物后即可无创的进行二次发光评估,这也为重复实验提供了便利。除此之外,本文的Cdkn2a示踪小鼠也同时插入了tdTomato基因片段,在离体组织或细胞中可以进行Cdkn2a表达的原位观察。同时,此基因敲除小鼠也可以作为Cre工具鼠,在Cdkn2a阳性的细胞中特定敲除某种基因,这为进一步开展OA的机制研究提供了更便利的模型工具。由于CRISPR/Cas9技术的使用,该模型小鼠全身Cdkn2a基因表达都可以通过荧光示踪。因此,我们也期待Cdkn2a示踪小鼠模型的建立能够为其他衰老相关疾病的研究提供辅助作用。
本研究的局限性在于,只分析了特定的传统细胞衰老标记物,未详细分析衰老的转录组和蛋白质组标记物。这可能是探索ACLT术后骨关节炎中细胞衰老发生发展机制的一个角度;另外,本研究缺乏展示该模型小鼠可用于Cdkn2a动态观察的多时间点数据,我们将在未来工作中深入进行研究。
总而言之,本研究是一次尝试,利用了Cdkn2a示踪小鼠作为骨关节炎的衰老模型。结果提示,在未来的研究中应当更多地关注Cdkn2a示踪小鼠,进一步探究细胞衰老在衰老引起的疾病(例如骨关节炎)进展中的作用机制,以及去除衰老细胞是否能减轻疾病的表型等应用前景。该模型的使用将有助于识别细胞衰老及骨关节炎之间的相互作用,为寻找有效的治疗手段提供了未来的方向。
