北美鹅掌楸LtAGO1基因的克隆、表达及其启动子分析
2022-09-07魏灵敏温少莹马际凯李嘉昱吴栩佳李火根
魏灵敏, 温少莹, 马际凯, 夏 辉, 李嘉昱, 吴栩佳, 李火根
( 南京林业大学 林木遗传与生物技术教育部重点实验室, 南京林业大学 南方现代林业创新中心, 南京 210037 )
叶是高等植物进行光合作用和蒸腾作用的主要器官,叶原基起源于茎顶端分生组织(shoot apical meristem, SAM)的周边区。在控制细胞由分裂转入生长的形态建成过程中,叶原基发生了极性分化(Bowman & Eshed, 2000)。1基因的突变将会影响叶原基分化及器官极性的选择等一系列发育进程(Wu et al.,2009; Liu & Nonomura, 2016)。王永益(2019)通过点突变能获得拟南芥针状叶的1-27突变体和卷曲芽状复叶的1-38 突变体。李素芬等(2014)对1超表达得到了叶缘呈锯齿状的拟南芥。在模式植物水稻和玉米中,采用敲除、过表达1基因及互补缺陷突变体的方法,初步明确1基因的缺失会降低水稻的结实率和花粉育性,而1基因的过表达能使叶片正面卷曲、株高降低(徐东东, 2014;Li et al.,2019)。番茄168靶向调控1基因的表达,增强了番茄对低钾胁迫的抗性(Liu et al.,2020);拟南芥1-27比野生型对淹水更敏感,且在低氧条件下和4共同调控该胁迫信号的的传递(Elena et al.,2020)。姚晓华等(2021)发现,青稞1编码的蛋白在抗条纹病的调控通路中发挥重要作用。近期研究发现,1是通过诱导茉莉酸(JA)信号通路中相关基因的产生并激活JA反应来响应胁迫(Liu et al.,2018)。可见,1通过多种途径参与植物抗逆的响应及调节过程。此外,1参与小麦花药和花粉粒的发育(冯楠,2018),拟南芥根分生组织需要1的活性来维持细胞的增殖(Adrien et al.,2019)。1基因在植物器官极性选择、分生组织分化、花器官发育和胁迫响应等多方面起重要调控作用。
北美鹅掌楸与鹅掌楸都是以叶形奇特、干型优美为特色的具有观赏价值的园林树种,其叶片具有三裂和五裂的形态差异,是研究观叶树种叶形多样性及品种改良的理想材料。近年来,杨颖等(2014)证实北美鹅掌楸中有9个基因参与叶片的衰老进程。Ma等(2018,2019)探明鹅掌楸从叶原基分化成叶片4个阶段的形态发育过程,从转录组中筛选验证10条与叶发育相关的差异基因,发现6基因可使拟南芥叶序紊乱、叶片深裂及不育。然而,目前对于北美鹅掌楸奇特叶形的形成机制仍不清楚,1基因是否参与了叶形发育的调控进程,与北美鹅掌楸叶芽和花芽孕育的关系也尚未明确。
高等植物的生长发育过程受基因的表达量控制,基因的转录水平受包含顺式作用元件的启动子影响(Dey et al.,2015)。拟南芥和启动子可调控花和花药的发育 (Shih et al.,2014;Dai et al.,2019),表明启动子在影响植物的性状和调控方式上发挥重要作用。本研究采用RACE克隆技术获得北美鹅掌楸1基因的全长cDNA,并对其进行生物信息学预测及组织差异表达分析,初步了解该基因功能,并重点关注1基因启动子序列的分析和组织表达特异性,旨在为1基因启动子对相关基因的调控机制研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 不同组织的取样 在南京林业大学的鹅掌楸种源试验林中,选取物候期基本一致的北美鹅掌楸(美国南卡罗来纳州种源)和鹅掌楸(中国武夷山种源)作为供试材料。2018年4月,分别采集长势良好的3个株系幼嫩叶片的3个部位(叶缘、叶基部和叶中部),具体参考沈宗根等(2003)的方法。同时,采集北美鹅掌楸同一时期的8个组织样品(叶片、茎、雄蕊、雌蕊、花芽、花萼、叶芽和花瓣)。2018年3—8月期间,分别采集北美鹅掌楸叶芽萌动期、幼叶期、叶成熟期和叶衰老期的叶片,具体参考肖怀娟(2014)的方法。可将其划分为7个部分,即a、c和e为叶缘凸出部分,b和d为叶缘凹陷部分,f为叶柄,g为叶中间部分。据前期的物候观察发现,在7月,北美鹅掌楸叶片的形态变异最大。因此,本研究于2018年7月采集北美鹅掌楸不同大小的叶片,用消毒的剪刀分离样品至1 g,具体参考李四游(2015)的方法。所有样品重复取样3次,置于-80 ℃超低温冰箱中保存,用于提取RNA。
1.1.2 生化试剂 植物总RNA提取试剂盒购自天根(TIANGEN)生物公司,PrimeScriptRT Master Mix(Perfect Real Time)反转录试剂盒、3′-Full RACE Core Set with PrimeScriptRTase试剂盒、SMARTerRACE 5′/3′ Kit 反转录试剂盒、PrimeSTARMax DNA Polymerase高保真酶、DL 2 000 DNA marker和SYBR Premix Ex Taq酶均购自Takara公司,核酸染料Gel Stain、Easy Pure Quick Gel Extraction Kit凝胶回收试剂盒和Blunt载体均购自北京全式金生物技术有限公司,ClonExpressUltra One Step Cloning Kit重组酶购自诺唯赞生物公司,大肠杆菌()T1与农杆菌()GV3101购自上海唯地生物公司,过表达载体PBI121-GUS由本实验室提供,引物合成由南京金斯瑞公司完成,其编号及序列见表1。
1.2 方法
1.2.1 目的基因的克隆 根据北美鹅掌楸()转录组数据库(http://ancangio.uga.edu/content/liriodendron-tulipifera),筛选出注释名为1基因的EST序列,通过Oligo 7软件设计PCR扩增引物,以北美鹅掌楸叶芽的cDNA、3′-RACE和5′-RACE为模板,扩增1基因的3个目的片段。PCR体系为50 μL,扩增程序:98 ℃ 3 min;98 ℃ 10 s,58 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃彻底延伸5 min。将目的片段连接至Blunt载体后转化大肠杆菌T1感受态细胞,挑菌送测。利用DNAMAN软件拼接后获得全长cDNA序列,使用NCBI ORF Finder 在线软件(https://www.ncbi.nlm.nih.gov/orffinder/)预测开放阅读框并设计引物,验证基因克隆的正确性。依据验证成功的1基因CDS序列,查找其上游启动子序列。该启动子序列信息来自鹅掌楸(庐山种源)NJFU-Lchi-2.0基因组测序结果(Chen et al.,2019),利用同源克隆法设计验证引物,引物序列见表1。使用改良CTAB法(马明等,2007)提取采样组织的DNA,以此为模板扩增出约2 000 bp的启动子序列并测序确认。

表 1 引物序列Table 1 Primer sequences
1.2.21基因的生物信息学分析 使用NCBI conserved domain在线软件(https://www.ncbi.nlm.nih.gov/cdd)预测LtAGO1蛋白的保守结构域。使用ExPASy中的Protparam工具(https://web.expasy.org/protparam/)在线分析蛋白质理化性质,使用SOPMA在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和Phyre2在线软件(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分别预测蛋白质二、三级结构,使用SignalP 5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白是否含信号肽,使用PSORT在线软件(https://wolfpsort.hgc.jp/)预测蛋白亚细胞的定位情况。在NCBI数据库BLASTx中查找同源序列,使用Clustal X软件分析LtAGO1蛋白同源性和 MEGA 7软件构建Neighbor-Joining系统进化树。使用PlantCARE 数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)对克隆得到的启动子序列进行顺式作用元件分析。
1.2.31基因的表达分析 使用植物总RNA提取试剂盒分别提取鹅掌楸属不同发育时期的叶片及不同组织的总RNA,并反转录合成cDNA的第一链,稀释20倍后作为RT-qPCR模板。通过Oligo 7软件设计荧光定量PCR引物,参考本实验室鹅掌楸内参基因97(Tu et al.,2019)进行实时定量qPCR反应,引物序列见表1。反应体系为20 μL,分别为 SYBR Premix Ex Taq Ⅱ10 μL,上下游引物各0.4 μL(5 μmol·L),ROX Reference Dye or Dye Ⅱ0.4 μL,模板(100 ng)2 μL,RNAase-free ddH0 6.8 μL。扩增程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,40个循环。试验进行3次生物学重复,用2法(Livak et al.,2001)计算并分析基因的相对表达量。
1.2.4 构建载体及转化、筛选 使用I和Ⅲ 酶分别酶切超表达载体PBI121质粒,经电泳跑胶确定目标产物后切胶, 并回收目的片段1。利用诺唯赞同源重组酶将带酶切位点的PCR目的产物构建到酶切后的表达载体PBI121上,并转入大肠杆菌中扩增, 获得GUS表达载体PBI121-1-GUS。将经PCR、酶切及测序后鉴定正确的GUS表达载体质粒转进农杆菌GV3101,并通过花序浸染法(Clough & Bent, 1998)转染到野生型拟南芥中。将收种得到的T0代拟南芥种子播种在含有50 mg·L卡那霉素(Kanamycin)的1/2MS培养基上,筛选出具有抗卡那霉素的转基因植株,利用启动子测序引物对T1代拟南芥叶片的DNA进行PCR鉴定,以野生型植株为阴性对照。将符合预期结果的转基因植株继代筛选至T2代,用于GUS染色分析。
1.2.5 转基因拟南芥植株表型观察 转基因株系和野生型拟南芥的种子先后经75%酒精、10%次氯酸钠消毒和3次无菌水洗涤,之后播种在1/2MS培养基(pH=5.8)中,4 ℃春化2 d后,置于温度为25 ℃、光周期为16 h光照/8 h黑暗、光照强度为5 000 lx的人工光照培养箱内。光照培养10 d后,测量拟南芥幼苗根长并记录,5次重复。
1.2.6 转基因拟南芥植株GUS组织化学染色 参照Solarbio 公司即用型GUS试剂盒说明书,分别选取在1/2MS培养基上生长4、6、9、12、16、20、25 d等不同时期及不同组织的转1∷GUS的T2代拟南芥转化株,按Jefferson(1987)的方法放到染色液中染色,37 ℃过夜孵育,75%酒精洗涤脱色5~6次后在体视显微镜下拍照。以GV3101空菌株浸染野生型拟南芥为阴性对照,35S∷GUS空载体浸染的拟南芥为阳性对照。
2 结果与分析
2.1 LtAGO1基因全长cDNA的获得
从北美鹅掌楸叶芽中获得1中间片段长度为3 592 bp,利用RACE克隆获得长度为440 bp和636 bp的5′端和3′端序列(图2:A),经拼接得到4 258 bp的cDNA全长序列。经ORF finder预测到5′ -UTR序列长度为78 bp,3′-UTR序列长度为880 bp,含13个polyA,ORF长度为3 300 bp,共编码1 100个氨基酸。对ORF两端设计引物扩增并测序验证,结果显示开放阅读框序列长度大小与拼接序列一致,且无变异位点。蛋白结构分析得到该蛋白包含2个保守结构域,即Gly-rich-AGO1和Piwi。其中,Piwi结构域位于AGO1的C端,含有RNA 5′ 端结合位点和对mRNA有切割作用的活性位点(图2:B)。以上结果验证了所得cDNA序列的正确性,故将该基因命名为1。
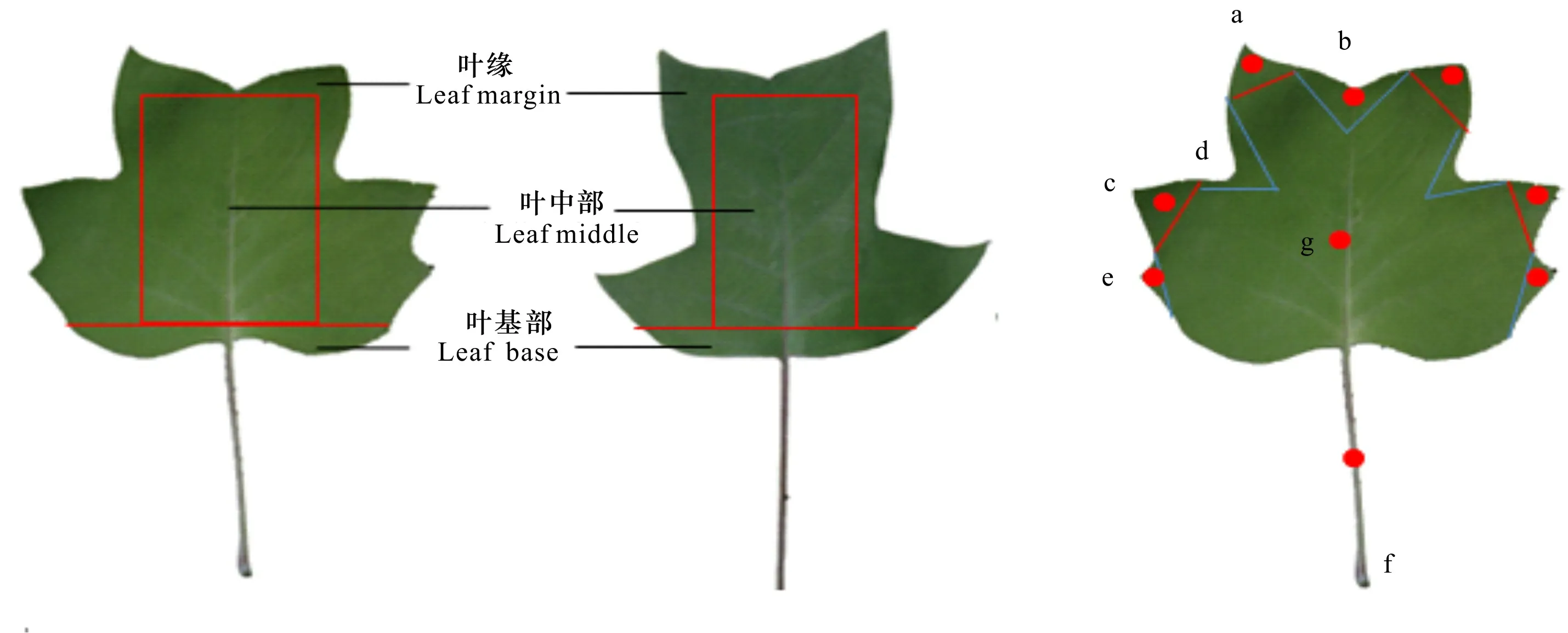
图 1 北美鹅掌楸和鹅掌楸的叶片和采样部位Fig. 1 Leaves and sampling parts of Liriodendron chinense and L. tulipifera
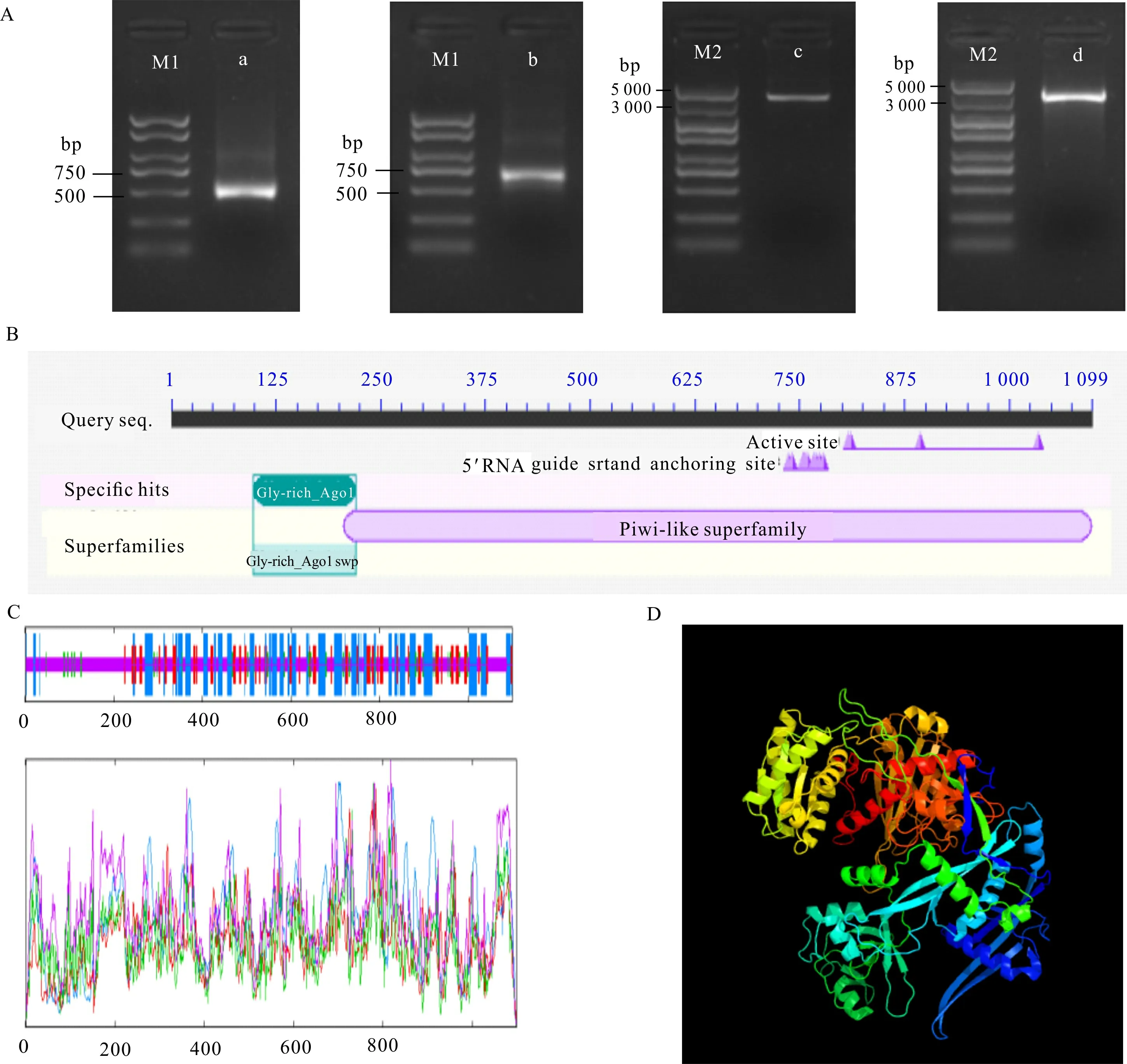
A. a. 5′-RACE; b. 3′-RACE; c. 中间片段; d. 开放阅读框; M1. Maker 2 000; M2. Maker 5 000; B. 保守结构域; C. 二级结构; D. 三级结构。A. a. 5′-RACE segment; b. 3′-RACE segment; c. Middle segment; d. Open reading frame(ORF) fragment; M1. Maker 2 000; M2 . Maker 5 000; B. Conserved domain; C. Secondary structure; D. Tertiary structure.图 2 LtAGO1的克隆与结构分析Fig. 2 Cloning and structure analysis of LtAGO1 proteins
2.2 LtAGO1蛋白二级、三级结构和功能预测
图2:C显示,该蛋白由延伸链(extended strand)、α螺旋(h)、β转角(t)和无规则卷曲(c)组成,其中无规则卷曲最多,占52.14%;此外,占氨基酸序列较多的是α螺旋(28.57%)和延伸链(13.83%),β转角最少(5.46%)。为深入了解蛋白结构,对LtAGO1预测并模拟蛋白三级结构(图2:D),结果显示LtAGO1蛋白结构与AGO2蛋白最为相似,且置信度达100%。利用SignalP 5.0 Server 预测得到D值(信号肽均值与Y-max的平均值)较小(0.001 6),推测该基因编码的蛋白不含信号肽,为非分泌蛋白。对LtAGO1蛋白亚细胞定位的预测结果显示,LtAGO1蛋白位于微体、细胞核、细胞质和细胞膜的分值分别为0.3、0.3、0.1和0,说明该蛋白可能定位于细胞核和微体中。
2.3 LtAGO1蛋白同源性比对及进化树分析
将1编码的氨基酸序列与NCBI数据库中的序列比对发现,与沉水樟()、海枣()和小果野蕉()等的AGO1蛋白同源,且相似性较高(72.97%~76.33%)。经多序列比对发现LtAGO1蛋白与其他物种AGO1同源蛋白总体表现为C端较保守,N端保守性较差,且同源序列中均存在一个保守的Piwi结构域(图3)。LtAGO1蛋白与不同种类植物AGO1蛋白序列一致性较高,说明该基因在植物进化过程中比较保守。通过与其他物种AGO1同源蛋白比对及构建的进化树发现,北美鹅掌楸与樟科的沉水樟AGO1蛋白(RWR84608.1)聚在一起,亲缘关系最近,与海枣(XP_008812792.1)、小果野蕉(XP_009386429.1)的亲缘关系较近,与麻风树(XP_012079244.1)和橡胶树(XP_021670505.1)的亲缘关系相对较远(图4)。

图 3 LtAGO1蛋白同源性分析Fig. 3 Homology analysis of LtAGO1 protein
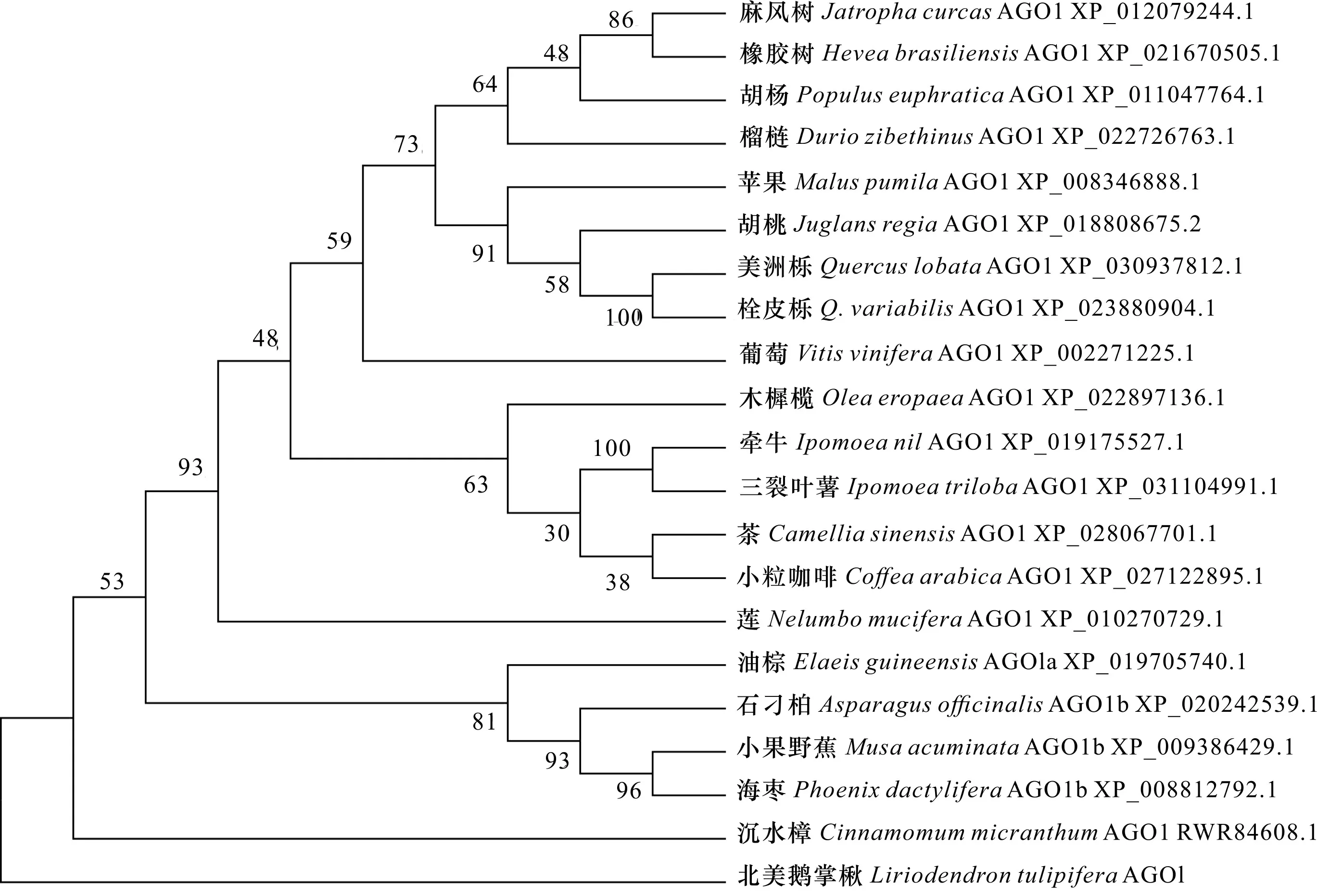
图 4 LtAGO1蛋白系统进化分析Fig. 4 Homology and phylogenetic analysis of LtAGO1 protein
2.4 LtAGO1的时空表达差异分析
利用RT-qPCR检测分析1在北美鹅掌楸8个组织中的表达量,结果如图5:A所示,1在北美鹅掌楸所有的组织中均有表达,但表达量存在一定差异。其中,雄蕊和花芽的相对表达量较高,显著高于其他组织,其次是花瓣,在花萼、花芽、叶片、叶芽和雌蕊中的表达量较低,1在北美鹅掌楸不同组织间的相对表达量为雄蕊>花芽>花瓣>花萼>叶片>雌蕊>叶芽>茎。该基因在花器官中特异表达,推测1可能在花器官发育过程中发挥着重要作用。
对叶基部、叶中部和叶缘进行RT-qPCR检测,结果如图5:B所示,在北美鹅掌楸中,1的相对表达量为叶缘>叶中部>叶基部;在鹅掌楸中,1的相对表达量为叶缘>叶基部>叶中部。由此可见,1主要在鹅掌楸和北美鹅掌楸叶片中的叶缘部位表达,且该基因在鹅掌楸叶片所有部位的相对表达量均高于北美鹅掌楸的相对表达量,尤其是鹅掌楸叶中部和叶基部的表达量是北美鹅掌楸的4.5~7.5倍,说明1在两个种间叶片的空间分布上存在差异。
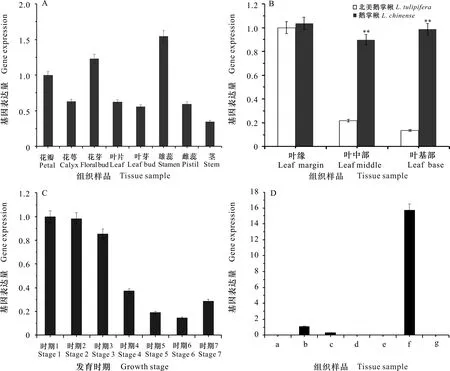
A. AGO1在北美鹅掌楸不同组织中的表达; B. AGO1在鹅掌楸属不同组织中的表达; C. AGO1在北美鹅掌楸不同发育时期叶中的表达; D. AGO1在北美鹅掌楸叶不同部位中的表达。 表示差异极显著(P<0.01)。A. AGO1 gene expressions of different tissues in L.tulipifera; B. AGO1 gene expressions of different tissues in Liriodendron; C. AGO1 gene expressions of different times of leaf in L.tulipifera; D. AGO1 gene expressions of different parts of leaf in L.tulipifera. means extremely significant differences(P<0.01).图 5 AGO1基因在鹅掌楸属不同组织中的表达模式Fig. 5 Expression patterns of AGO1 gene in different tissues of Liriodendron L.
对叶芽萌动期(时期1和时期2)、幼叶期(时期3)、成熟期(时期4至时期6)和衰老期(时期7)的叶片进行RT-qPCR检测,结果如图5:C所示:在叶芽萌动期至展叶期,1的表达量随着叶芽的逐渐膨大而降低;在生长期,1的表达量与叶片大小呈负相关的关系,且在叶面积最大时达到最低值;当叶片进入衰老期,1的表达量比生长后期的表达量高,但比展叶期的低,且在叶原基形成的过程中,1的表达量远高于叶成熟期的表达量。1在北美鹅掌楸叶片不同发育阶段的相对表达量为叶芽萌动期>幼叶期>衰老期>成熟期,说明1在北美鹅掌楸分生组织生长较旺盛的时期表达。
对叶缘凸出部分(即叶尖,a, c和e)和凹陷部分(b和d)进行RT-qPCR检测,结果如图5:D所示,1在叶柄的相对表达量远高于其他部位的表达量,相较而言,该基因在凹陷部位(b)的相对表达量高于凸出部位(c),此外在其他部位基本不表达。因此,1在北美鹅掌楸叶片中的相对表达量为叶柄>叶凹陷>叶尖,说明1可能在叶柄的形成中起着重要作用。
2.5 LtAGO1蛋白共表达网络
LtAGO1蛋白共表达网络显示(图6),1不仅与逆境应激响应基因、6 和3发生互作, 还与介导miRNA叶极性分化的1和1基因发生互作。 据报道,长度20~24 nt的小RNA(sRNA)能响应多种逆境胁迫(Chen et al.,2002;Zhang et al.,2008),其sRNA的产生主要依赖、和基因家族所编码的蛋白(Saito & Siomi , 2010 )。3与6协同作用能将单链RNA转录为dsRNA,诱导产生转录后基因沉默,降低病原菌的危害(Yoshikawa et al.,2013)。此外,6还与7、3和4共同调控trans-acting siRNA通路,其下游靶基因是参与叶形远轴化的生长素响应因子(Peragine et al.,2004)。在烟草中,1的沉默导致植株矮小,叶片畸形。1通过介导miRNA来调节-Ⅲ 基因的表达,从而维持叶的平展发育(Yu et al.,2005)。1最早被发现和花器官发育相关(Chen et al.,2002),拟南芥中绝大部分miRNA均受到1的调控(Yu et al.,2006),和1-3一样,1既能调控发育,又能参与ABA信号通路的调控(Park et al.,2002)。1与这些基因相互作用,协同发挥抗逆及发育的调控作用。
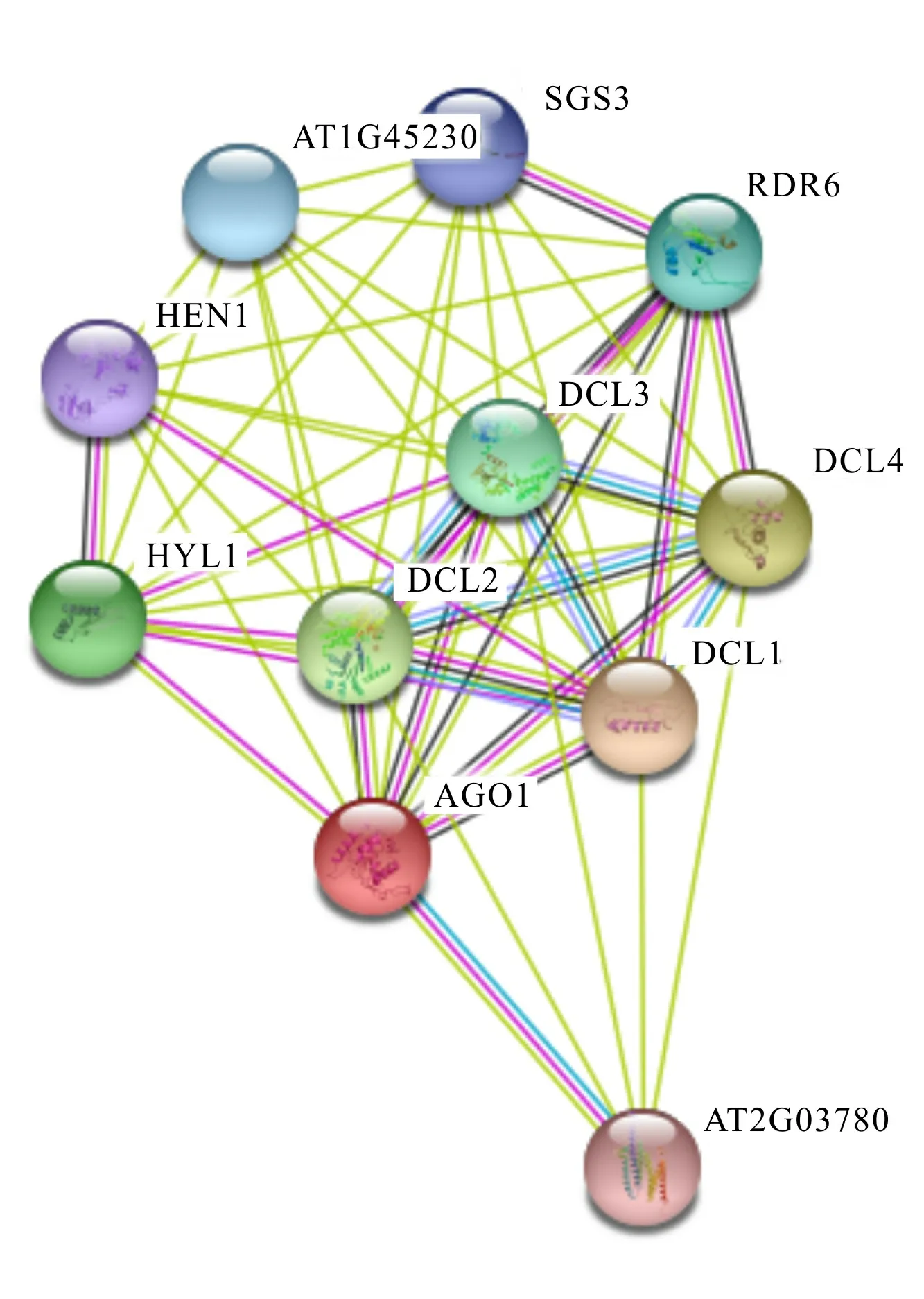
图 6 LtAGO1蛋白共表达网络Fig. 6 Co-expression network of LtAGO1 protein
2.6 LtAGO1启动子克隆、表达载体的构建及鉴定
以北美鹅掌楸基因组DNA为模板进行RT-PCR扩增,将扩增产物进行测序,得到2 001 bp的1启动子序列(图7:A)。将启动子扩增产物1连接到植物表达载体PBI121上(图7:D),连接产物经菌落PCR发现,大肠杆菌PCR扩增产物大小为2 000 bp左右,与阳性对照条带大小相一致(图7:B),检测后的测序结果与数据库序列一致。经双酶切电泳后的结果(图7:C)显示,重组的质粒被酶切成两条条带,一条大小为12 758 bp的条带,另一条几乎与1大小一致的序列条带,说明1启动子成功构建到PBI121表达载体中。
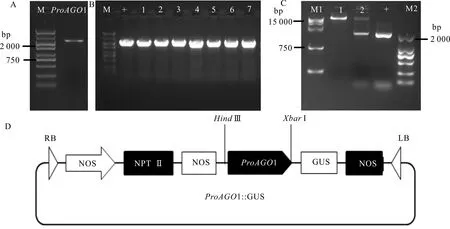
A. M. DNA marker DL5 000; ProAGO1. LtAGO1启动子序列; B. 菌液PCR检测; C. M1. DNA marker DL15 000; 1. Hind Ⅲ 单酶切; 2. Hind Ⅲ和XbarⅠ双酶切; + . LtAGO1启动子序列; D. PBI121-ProAGO1-GUS表达载体的构建。A. M. DNA marker DL5 000; ProAGO1. LtAGO1 promoter sequence; B. PCR detection of Escherichia coli; C. M1. DNA marker DL15 000; 1. Single-digestion products by Hind Ⅲ; 2. Double-digestion products by Hind Ⅲ and XbarⅠ; +. LtAGO1 promoter sequence; D. PBI121-ProAGO1-GUS vector construction.图 7 LtAGO1启动子的克隆及载体构建Fig. 7 Cloning and vector construction of LtAGO1 promoter
2.7 LtAGO1启动子顺式作用元件分析
利用PlantCARE软件对1启动子序列进行分析,结果如表2所示,1启动子中含有RNA聚合酶Ⅱ起始转录所必需的CAAT-box、TATA-box元件和较多的光响应元件(如Box 4 、G-box、GT1-motif和 MYB等),此外还包含与防御相关的响应元件(如防御与应激元件TC-rich repeats,茉莉酸甲酯响应调节元件CGTCA/TGACG-motif,水杨酸响应元件TCA-element,ABA响应元件MYC,冷胁迫相关元件as-1,厌氧诱导调控元件ARE)和生长调控相关元件(如分生组织表达调控元件CCGTCC-box、玉米醇溶蛋白代谢调控元件O-site)。
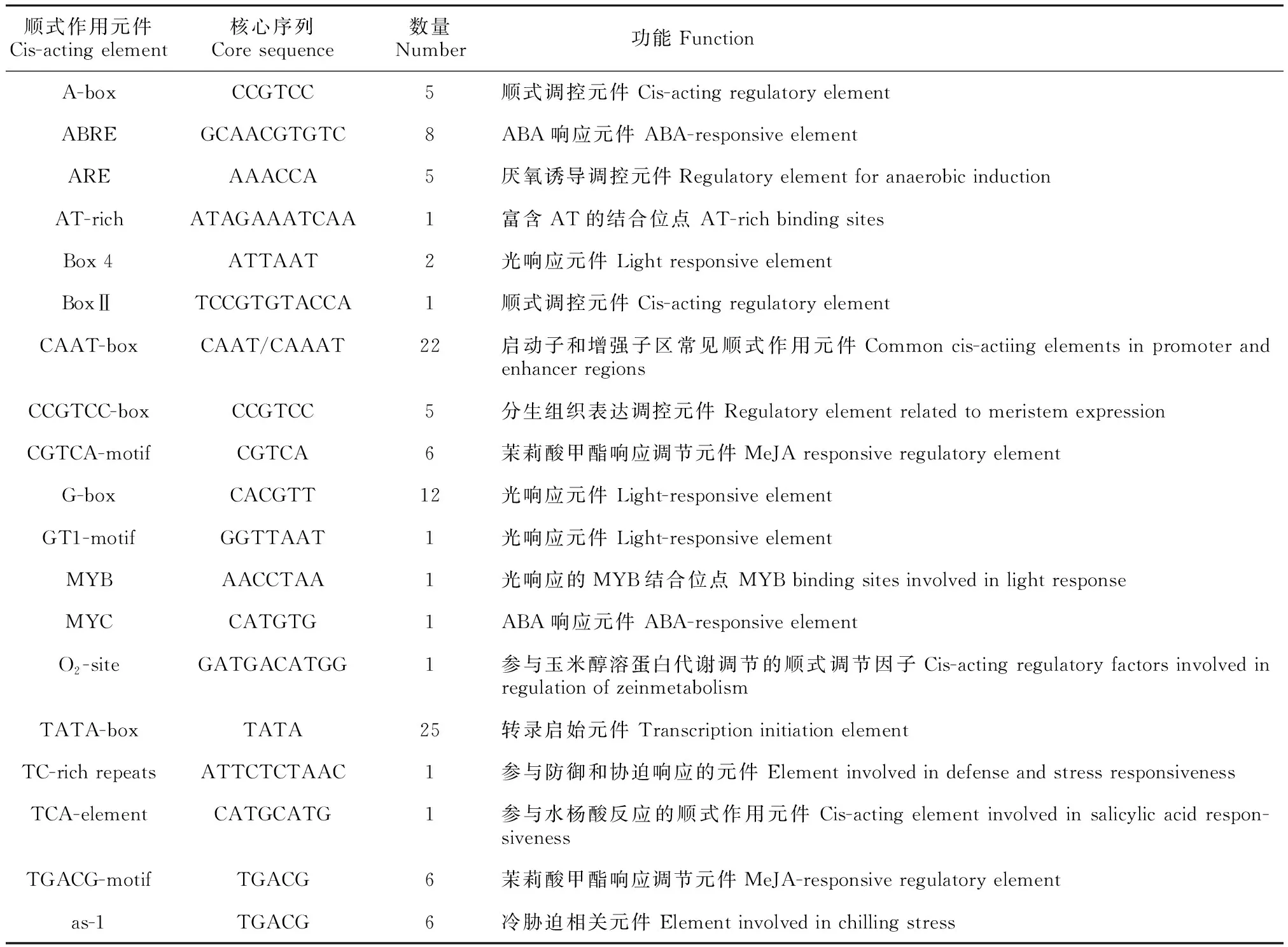
表 2 LtAGO1启动子中的顺式作用元件预测Table 2 The cis-acting elements in promoter sequence of LtAGO1
2.8 转基因植株的检测及表型观察
经PCR检测后,共获得1∷GUS转基因阳性植株11株(图8:C)。收种并播下T2代转基因植株,发现野生型的根长为(1.5±0.2)cm,转基因的根长为(0.5±0.2)cm,且须根和主根一样发达(图8:D),叶面积较野生型小,第二对真叶的顶端出现凹形缺刻和白化。30 d时,鉴别出两种表型的株系,主要特征如下:植株矮小(图8:F),抽薹较晚,且出现不育的重瓣花,大部分莲座叶表面积较野生型小(图8:E)。其中,株系1有1片向中-侧轴方向延伸生长的叶片,叶基部狭窄,叶形呈扇形,其他叶片表面积是野生型的一半,且呈叶基歪斜、叶柄弯曲、中-侧轴向和基-顶轴向的不对称发育。株系2的莲座叶数量较野生型少2片,叶形缺刻程度较株系1更深,其中有1片叶的叶面积是其他叶片的5~10倍,叶基楔形,叶顶端凹陷呈心形,其他叶基歪斜,叶的主要生长方向由基部至顶端方向延伸生长,叶形态呈线形或条状发育,叶柄较短。推测1启动子从叶原基分化期就开始影响拟南芥的叶片在中-侧轴及基-顶轴两个方向上发生程度各异的极性分化,且随着时间而加深变异的程度,最终使叶缘缺刻的表型得以维持。
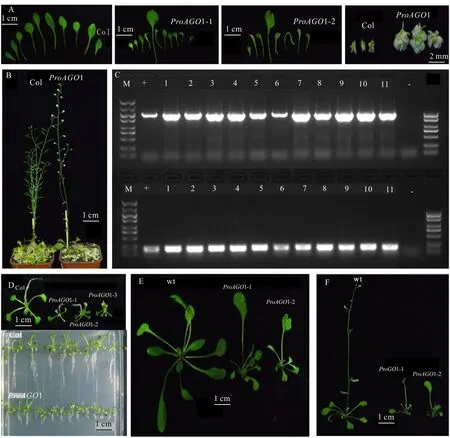
A. 拟南芥叶片和花的表型; B. 拟南芥花不育的表型; C. M为DL 5 000 DNA分子标准量; +. LtAGO1启动子序列; 1-11. 转ProAGO1∷GUS拟南芥植株; - . 阴性对照; D. 拟南芥幼苗根的发育; E. 拟南芥莲座叶的发育; F. 拟南芥花的发育。A. Leaf and flower phenotypes of A. thaliana ; B. Phenotype of floral sterility in A. thaliana; C. M. DNA marker DL 5 000; +. LtAGO1 promoter sequence; 1-11. Transgenic ProAGO1∷GUS in A. thaliana plants; - . Negative control; D. Root development of A. thaliana seedlings; E. Development of rosette leaf in A. thaliana ; F. Flower development in A. thaliana.图 8 转ProAGO1∷GUS拟南芥植株的PCR鉴定和表型观察Fig. 8 PCR identification and phenotype of transgenic ProAGO1∷GUS Arabidopsis thaliana plants
2.9 LtAGO1启动子活性分析
图9显示,由1启动子控制的基因在植株发育过程中呈阶段性表达。在萌发后的第4天和第6天,幼苗的GUS活性不表达(图9:B1-B2);在叶芽分化期(第9天至第25天),1启动子驱动GUS在叶芽顶端稳定表达,且在新分化的叶柄上启动活性最强(图9:B3-B7)。在生殖生长阶段,其在主叶脉、叶缘锯齿尖、果柄、花萼及雌蕊等部位表达,说明1在成熟的花、果荚、叶和茎的维管束中均表达(图9:B8-B11)。因此,1启动子的GUS活性强度为叶顶芽>花器官>维管束,属于分生组织特异性启动子。

A1-A9. 生长4、6、9、12、16、45 d的野生型植株; B1-B11. 生长4、6、9、12、16、20、25、45 d的转ProAGO1∷GUS植株; C1-C9. 生长4、6、9、12、16、45 d的转35S∷GUS植株。A1-A9. Wild A. thaliana seedlings of 4, 6, 9, 12, 16, 45-day-old; B1-B11. Transgenic ProAGO1∷GUS A. thaliana seedlings of 4, 6, 9, 12, 16, 20, 25, 45-day-old; C1-C9. Transgenic 35S∷GUS A. thaliana seedlings of 4, 6, 9, 12, 16, 45-day-old .图 9 转基因拟南芥组织GUS染色分析Fig. 9 Promoter-GUS assay of transgenic Arabidopsis thaliana in different parts
3 讨论与结论
本研究克隆得到北美鹅掌楸1基因,通过生物信息学分析发现1和其他物种1的相似性很高,亚细胞定位于细胞核,这些信息与李红英等(2018)在胡杨中的研究结果相吻合。组织特异性分析发现,1在叶原基分化期的表达量明显高于成熟期和衰老期,且在幼叶的叶缘部位高含量表达,而在成熟叶中只在叶柄表达;1在玉米的幼叶及吐丝期的雌穗中表达量最高(徐东东,2014),且在玉米新生叶中的表达量高于老叶(许鑫等,2014)。在北美鹅掌楸生殖生长过程中,1在雄蕊的表达量最高,其次是花芽,与龙眼(杨曼曼,2015)、苹果(鹿游等,2013)的组织特异性研究结果类似,说明1在幼苗期参与叶原基的分化,而在生殖期普遍存在于细胞分裂生长较旺盛的花器官中。
启动子是基因转录的调控中心,本研究预测到1基因启动子上含有多个光响应、激素诱导、分生组织表达及多个非生物胁迫响应元件,进一步研究发现1能成功启动GUS表达,其表达具有时空特异性:GUS在幼苗期的顶端分生组织表达,随着顶端逐渐分化出新的叶片,该启动子仅在新分化的叶柄处表达,后期在成熟的花、果荚、叶和茎的维管束中表达。Vaucheret等(2006)对转1∷GUS的拟南芥分析发现,1在整个发育过程中表达,尤其在分生组织和维管束组织中的表达丰度最高。这说明1的表达不仅在顶端分生组织, 也在侧生分生组织中的其他部位,但目前有关相应的表达机理还未见报道。
叶极性分化是原基细胞感受极性分化信号并作出相应反应的过程,而沿着近-远轴、基-顶轴和中-侧轴3个极性方向分化的过程又决定了叶形态的建成过程(Du et al.,2018)。本研究通过转1∷GUS表达载体得到叶柄弯曲、叶中-侧轴向和基-顶轴向极性丧失的拟南芥株系。在番茄中下调1的表达,会导致远轴面出现与近轴面相同的毛状体,且叶片小叶柄出现发育缺陷 (Wang et al.,2015)。此外,1启动子的表达能促使拟南芥在发育过程中发生异位分生组织的活动,致使拟南芥叶基楔形、叶顶端缺刻呈心形。在对1功能缺失突变体的其他研究中,发现1的缺失会促使植物体的叶卷曲、植株矮化及结实率下降(Wu et al.,2009; Liu & Nonomura, 2016),Kidner等(2005)对过表达1和双突变的拟南芥分析发现,1是通过激活基因调节干细胞功能从而影响叶的极性效应。由此可知,1基因的缺失和过表达都会不同程度地影响叶极性的丧失,推测1可能是通过两种不同的调控途径参与到叶的形态建成中。目前, 对这一分子机制的研究普遍认为,叶原基和叶发育的过程皆需要处于激活状态,且家族其他基因处于沉默状态。Yang等(2006)发现1是通过正向调控和抑制的表达而决定叶片和花瓣近-远轴的发生。Arunika等(2004)研究认为,叶片的形态建成(如叶中孔洞的形成、叶缘的裂痕)均与关键部位的细胞发生程序性死亡(PCD)相关,而Zhang等(2009)的研究也证实正向卷曲叶片的发生是因为背面叶肉细胞的程序性死亡。那么,1是否也是通过调控细胞的分化方向和速度而影响叶形的多样性,且该基因如何响应叶原基分化的起始信号,其具体调控机制有待进一步研究。在生殖发育方面,该研究的表达株系抽薹较晚,花大而重瓣且不育,这一现象与Li等(2019)的研究结果相吻合。究其原因,可能是花器官由顶端分生组织分化形成,1在顶端分生组织中持续而稳定的表达,从而能参与到叶与花器官的形态建成中。但是,两者之间有无相关的基因共同被1所调控,还有待于进一步研究。
本研究以北美鹅掌楸为研究对象,首次分析了1在不同组织部位的时空表达谱,明确了其启动子在拟南芥分生组织中的表达模式,初步探索了1对北美鹅掌楸叶形发育的调控作用。下一步我们将会构造1超表达载体转化杨树,并将1与叶形发育的关键成员家族基因进行蛋白互作研究。本研究结果将为进一步分析1基因在木本植物生长发育过程中的作用提供理论参考,也为促进观叶树种的叶形态遗传改良研究提供良好的实践意义。
