血清HBV RNA 定量检测在慢性乙肝患者抗病毒治疗中临床研究
2022-09-06孙华宝李美琦赖启南斯志娟漆童丰王淑梅
孙华宝,李美琦,赖启南,斯志娟,漆童丰,王淑梅
(1.南昌市第九医院检验科,江西 南昌 330002;2.南昌市第九医院感染科,江西 南昌 330002)
乙型肝炎病毒(Hepatitis B Virus,HBV)感染是一个严重的全球公共卫生问题, 全世界有超过20 亿人感染乙肝病毒。 据估计,每年约有78.6 万人死于慢性HBV 感染相关疾病,包括肝硬化或肝细胞癌(Hepatocellular carcinoma,HCC)。 据2016年中国疾病预防控制中心数据显示, 我国现约有9000 余万人感染HBV,其中约三分之一为CHB 患者,且每年因感染HBV 所致的肝衰竭、肝硬化和肝细胞癌去世的患者有60 余万人[1]。 一直以来,CHB 的发病机制较为复杂, 迄今尚未完全阐明。HBV 在患者体内长期高水平地复制激发了机体免疫清除应答反应,从而导致肝细胞的损伤。 《慢性乙型肝炎防治指南(2015 版)》指出,CHB 临床治疗的核心措施就是抗病毒优化治疗,其中核苷(酸)类似物(Nucleic acid drugs,NAs)方便给药、副作用少、抑制病毒作用强而得到广泛应用。 NAs 可以通过抑制病毒逆转录途径从而抑制DNA 合成来发挥抗病毒作用, 但它不能够清除共价闭合环状DNA (Covalently closed circular DNA,cccDNA),导致患者一旦停药后常常会发生病毒学反弹和疾病复发的现象,很难实现临床治愈,需要患者长时间甚至终生服药[2]。 由此看来,在NAs 抗病毒治疗过程中,寻找能够预测CHB 患者发生HBeAg 阴转血清学转换和安全停药的生物标志物, 对于抗病毒治疗和减轻患者负担显得尤为重要。
cccDNA 作为HBV 复制的初始模板, 其在肝细胞核内水平的检测是评价NAs 疗效及停药的重要指标,但由于该检测需要收集肝组织标本而存在一定的局限性[3]。 近年来,已有研究发现血清HBV RNA 与肝组织HBV cccDNA 水平存在一定的相关性, 且在接受NAs 治疗的患者血清中发现其水平与患者病毒学应答和预后有关, 因此HBV RNA 可以作为cccDNA 的替代标志物[4]。早在1996年,Kck 等在研究中发现CHB 感染者的血清中存在HBV RNA。 此外,根据近期的国内外慢性乙肝指南[5],研究者已经将血清HBV RNA 作为一种新型的标志物,并指出其主要成分前基因RNA(pgRNA)是以病毒样颗粒释放入血的。 因为pgRNA 是cccDNA 的直接转录体,所以其水平能够精确地反映肝细胞中cccDNA 的存在状态。 由此看来,血清HBV RNA 的检测将为CHB 患者体内病毒复制状态及其治疗效能提供更为直接的证据[6]。 因此,在临床实践中, 接受NAs 治疗的患者HBV DNA 与HBV RNA 水平是否存在相关性,存在相关性的显著程度以及HBV RNA 的检测能否用来判断病毒学应答, 这一系列的问题是本研究需要进一步研究和探讨的。本研究采用前瞻性随访, 选择两型CHB 患者接受NAs 抗病毒治疗中及停药后进行HBV RNA、高敏HBV DNA、HBeAg 及HBsAg 等指标检测并研究其间各指标相关性,以用来评估HBV RNA 作为病毒学应答的判定标准、 疗效判定和安全停药指标用于临床实践的可行性。
1 病例与方法
1.1 病例 选取南昌市第九医院2019 年1 月至2021 年6 月收治的280 例CHB 患者。 纳入标准:临床诊断均符合2000 年第十次全国病毒性肝炎与肝病学术会议修订的《病毒性肝炎防治方案》的标准,NAs 治疗适应症采用2015 版《慢性乙型肝炎防治指南》的标准,肝炎病史半年以上,所有患者均签署知情同意书。 入组排除标准:(1)酒精性、药物性、感染性、遗传性、免疫性及其他病毒性肝脏疾病;(2)合并严重的心血管、肾、内分泌、血液系统、神经系统疾病及精神病患者;(3)垂体、甲状腺疾病者;(4)妊娠、哺乳期妇女。 本研究通过医院伦理委员会批准(2018 伦审字02 号)。
1.2 方法
1.2.1 血清丙氨酸转氨酶 (Alanine transaminase,ALT)和谷草转氨酶(Aspartate transaminase,AST)检测: 采取患者清晨空腹血, 采用速率法上机检测, 使用的试剂盒为北京九强生物技术股份有限公司,仪器为HITACHI7600 型自动生化分析仪。
1.2.2 血清HBV RNA 和HBV DNA 检测 采用定量聚合酶链式反应 (quantitative polymerase chain reactio,qPCR) 技术,HBV RNA 定量测定试剂盒为湖南圣湘生物技术股份有限公司,HBV DNA 定量检测试剂盒为瑞士罗氏制药公司;HBV RNA 检测下限是100 copies/mL,HBV DNA 检测下限是20 IU/mL,检测仪器分别为ABI 7500 和Cobas 480。操作严格按照说明书。
1.2.3 血清乙肝五项定量检测 化学发光法测定,仪器和试剂是北京科美生物技术有限公司配套产品,其中HBsAg 检测参考值为0~0.05 IU/mL、线性范围为0~125 IU/mL,HBeAg 检测参考值为0~0.7 PEIU/L、线性范围为0~60 PEIU/L。 若初始检测值高于检测上限,则对样品进行稀释(1∶100)后检测。
1.3 统计分析 统计软件采用SPSS 17.0 , 正态计量资料采用“±s”进行描述,多组独立、正态、方差齐资料组间比较采用单方差分析, 两两比较采用LSD 法,P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象的一般资料 选取HBeAg 阳性组和HBeAg 阴性组CHB 患者各140 例, 其中男性218例、女性72 例,年龄最小23 岁、最大75 岁,二组患者在性别、年龄方面比较,差异无统计学意义(P>0.05),具有可比性,见表1。
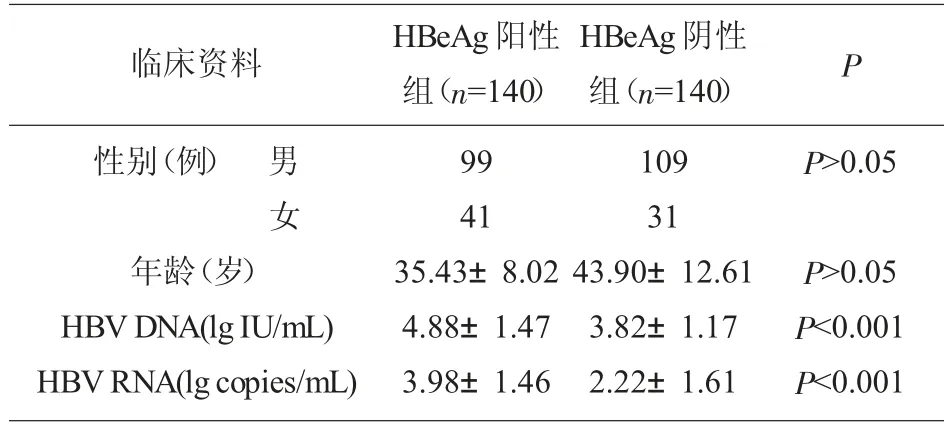
表1 试验分组一般资料
2.2 HBeAg (+) 组NAs 治疗期间HBV DNA 与RNA 转归变化 比较各治疗节点患者血清HBeAg、HBV DNA 与RNA 转归情况, 其中HBV DNA 下降水平、 阴转率最快最高,HBeAg 和HBV RNA 转归较慢,且较同步,见表2、表3、图1。
表3 HBeAg(+)组NAs 治疗期间HBV DNA 与RNA 转变水平(±s)

表3 HBeAg(+)组NAs 治疗期间HBV DNA 与RNA 转变水平(±s)
项目名称 治疗前 治疗24 周 治疗48 周 治疗72 周 F P HBeAg(PEIU/L)HBV DNA(lg IU/mL)HBV RNA(lg copies/mL)846.38±1417.64 4.88±1.47 3.98±1.46 533.04±1098.69 3.18±2.23 3.88±1.36 283.7±800.71 1.52±1.60 2.97±1.66 106.98±384.68 1.00±1.57 1.89±1.86 14.404 141.808 52.0368 0.000 0.000 0.000
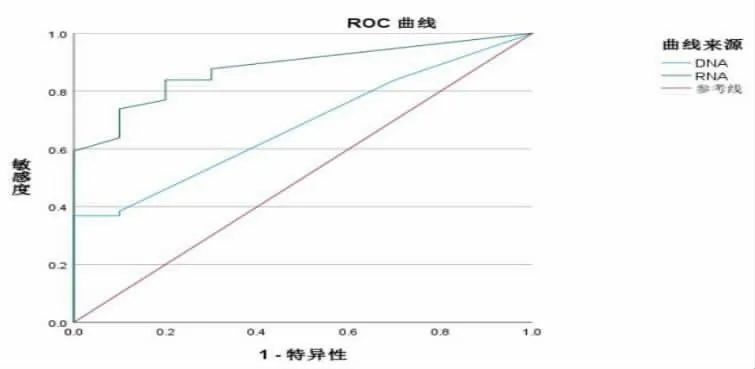
图1 HBV DNA 与HBV RNA 预测HBeAg 转阴ROC 曲线图
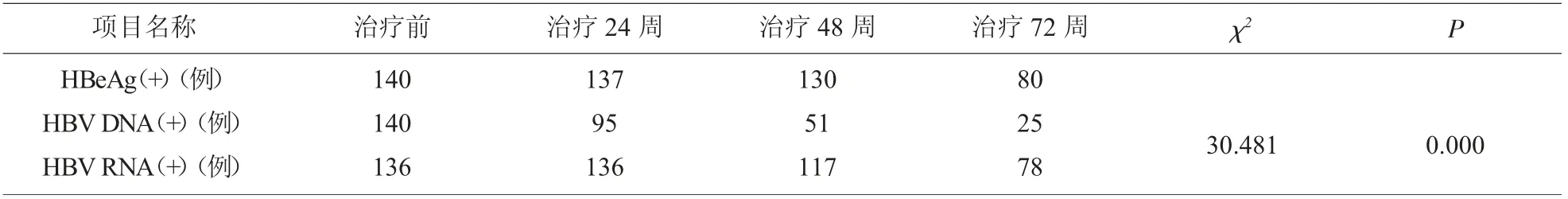
表2 HBeAg(+)组NAs 治疗期间HBV DNA 与RNA 转归
2.3 HBeAg (-) 组NAs 治疗期间HBV DNA 与RNA 转归变化 比较各治疗节点患者血清HBV DNA 与RNA 转归情况, 其中HBV DNA 下降水平、 阴转率最快最高,HBV RNA 转归较慢,同HBeAg(+)组基本相同,见表4—表5。

表4 HBeAg(-)组NAs 治疗期间HBV DNA 与RNA 转归情况

表5 HBeAg(-)组NAs 治疗期间HBV DNA 与RNA 转变情况
2.4 高敏HBV DNA 检测在CHB 患者NAs 治疗期间临床应用 临床检测HBV DNA, 常规试剂检测下限为100 IU/mL, 罗氏高敏检测试剂为20 IU/mL,并有三种结果模式即阳性(具体数字)、阴性(检测到乙肝基因片断但结果<20 IU/mL)、阴性(未检测到乙肝基因片断)。 见表6—表7。

表6 HBeAg(+)组高敏HBV DNA 结果一览表

表7 HBeAg(-)组高敏HBV DNA 结果一览表
3 讨论
对于采用NAs 治疗的CHB 患者预后,国内外指南中仍以血清HBV DNA 低于检测值下限作为病毒学应答(Viralgical response, VR)[7]。 然而,由于NAs 对cccDNA 缺乏直接抗病毒作用, 且HBV 感染无法被完全消除,因此血清HBV DNA 的消失仅仅代表了病毒逆转录的过程被有效抑制, 并不能反映cccDNA 的转录活跃状态。 在NAs 治疗初期,患者血清中可以检测到HBV DNA,随着NAs 治疗的进行,患者血清中HBV DNA 逐渐下降至无法检测到的水平, 但与此同时,cccDNA 的活动并未停止。 在cccDNA 耗竭或转录沉默前,核衣壳包裹的来自cccDNA 的前基因组pgRNA 仍可以RNA 病毒样颗粒的形式释放, 且其过程不为NAs 治疗所阻断[8],这可能是导致目前CHB 患者通过NAs 治疗难以实现临床治愈的原因之一。 HBV RNA 是反转录酶催化合成负链DNA 的模板,也是携带病毒遗传信息的第一道传递者,对于病毒复制、耐药产生和疗效监控都有重要生物学意义[9]。 近期的国内外慢乙肝指南[10]均指出血清HBV RNA 作为一种新型的血清标志物,能精确地反映肝细胞中cccDNA 的存在状态, 因此它的检测将为CHB 患者体内病毒复制状态及其治疗效能提供更为直接的证据[11]。 为了更加准确的评估抗病毒效果,有学者建议将血清HBV RNA 的检测纳入病毒学应答的评估中,并将血清HBV DNA 和HBV RNA 共同持续消失(低于检测下限)重新定义[12]。 因此,在临床实践中, 接受NAs 治疗的CHB 患者血清中HBV DNA 与HBV RNA 是否存在相关性, 其相关性程度大小及HBV RNA 的水平检测能否用来判断病毒学应答,是需要进一步研究解答的问题。
本研究采用前瞻性随访设计, 分为HBeAg 阳性和阴性均接受NAs 治疗的CHB 患者两实验组各140 例并检测其治疗前、 治疗24 周、48 周、72周四个时间节点的高敏HBV DNA、HBV RNA、HBsAg、HBeAg、ALT、AST 等血清标志物水平,并分析其相关性,结果显示。
3.1 HBV RNA 和HBV DNA 动态变化相关性 在慢性乙肝患者接受NAs 治疗中,HBV RNA 和HBV DNA 水平均成下降趋势, 两者成正相关,但HBV DNA 下降水平、转阴率均显著高于HBVRNA(P=0.000),且HBeAg 阴性组下降水平、转阴率均高于HBeAg 阳性组,说明HBV RNA 比HBV DNA更能反映患者病毒复制情况及用于疗效监测,与之前Butler EK 等研究结果相同[13]。
3.2 HBV RNA 预测HBeAg 阴转的能力 在HBeAg阳性组,HBV DNA 阴转速度明显快于HBeAg 和HBV RNA, 但HBeAg 与HBV RNA 阴转几乎同步,HBV DNA 的AUCROC=0.680,P=0.059,HBV RNA的AUCROC=0.878,P=0.000, 说明当血清HBV DNA被药物完全抑制到难以检测的水平时, 血清HBV RNA 的变化水平在一定程度上可以用来预测HBeAg 的血清学转换, 这与之前Huang YW 等研究结果相同[14]。 同时,HBeAg 阴性患者血清HBV RNA 阳性检出率低于HBeAg 阳性患者;HBeAg 阳性患者血清HBV RNA 与其他的病毒血清学指标的相关性优于HBeAg 阴性患者,这可能是HBeAg阳性患者体内的cccDNA 转录活性相较于HBeAg阴性患者活跃所造成的。
3.3 HBV RNA 与HBeAg 动态变化的相关性 在HBeAg 阳性CHB 患者接受NAs 治疗中,HBV RNA 和HBeAg 水平均成下降趋势, 两者成正相关, 但HBeAg 水平下降幅度大, 两者差异显著,HBV RNA 更能反映患者体内病毒复制状况,说明HBV RNA 比HBeAg 能更好地监测疗效。
3.4 HBV DNA 高敏检测临床意义 本研究检测两组CHB 患者治疗期间高敏HBVDNA 标本,结果显示随着治疗期延长,HBV DNA 水平逐渐下降,但<20 IU/mL 结果数量明显高于结果阴性 (未检测到乙肝基因片断)数量,提示若采取常规DNA 核酸检测,这部分患者将显示为阴性,差异有统计学意义 (P=0.000),HBV DNA 高敏检测用于监测CHB患者NAs 疗效意义显著。
综上所述,来源于非整合的完整的HBV 基因组的HBV RNA,是病毒复制和预后的敏感性血清标志物, 可以作为监测CHB 患者cccDNA 活性的一个潜在的新型标记物, 其血清水平更能够反映和监测慢CHB 患者NAs 抗病毒疗效,可用于抗病毒安全停药的评估。
