丙泊酚在低氧条件下对胰腺癌细胞增殖和侵袭的影响及可能的机制△
2022-09-06戴劲彭铁立余相地
戴劲,彭铁立,余相地
1广州医科大学附属第六医院(清远市人民医院)消化内科,广州医科大学消化病研究所,广东 清远 511500
2贵州省人民医院麻醉科,贵阳 550001
胰腺癌是病死率最高的恶性肿瘤之一。2015年全球共411 600人死于胰腺癌,其在美国恶性肿瘤相关死亡最常见原因中居第四位[1]。目前胰腺癌的主要治疗方式包括手术切除、放疗、化疗、姑息治疗或多种方法联合治疗,然而其疗效在很大程度上取决于肿瘤的临床分期和个人健康状况[2]。手术切除依然是胰腺癌最主要的治疗方式,然而手术应激、免疫抑制和围手术期内环境的改变为肿瘤细胞的转移提供了有利条件,是术后肿瘤复发的关键因素[3]。研究表明,麻醉药同样可以诱导并参与肿瘤细胞的生理和病理过程,如细胞增殖、血管生成和细胞凋亡。一项回顾性研究表明,肿瘤患者手术期间以丙泊酚为基础的全凭静脉麻醉(total intravenous anesthesia,TIVA)比吸入性麻醉药能够显著降低死亡率(15.6%vs22.8%)[4]。由此可以推测丙泊酚具有潜在的抗肿瘤作用。研究表明,丙泊酚可通过上调微小RNA(microRNA,miRNA)-328的表达抑制解整合素样金属蛋白酶8(a disintegrin and metalloproteinase domain 8,ADAM8)的表达,从而抑制胰腺癌细胞的增殖和转移[5]。ADAM8在很多恶性肿瘤(包括骨肉瘤、结肠癌、胃癌和胰腺癌)中与肿瘤细胞的增殖、转移和不良预后有关。考虑到实体瘤特征性的低氧微环境,低氧可以诱导ADAM8表达上调。ADAM8在侵袭性乳腺癌中的表达会促进肿瘤细胞的扩散和转移[6]。在胰腺癌中,具有抗炎作用的巨噬细胞通过上调基质金属蛋白酶(matrix metalloproteinase,MMP)和ADAM8的表达促进肿瘤细胞的侵袭[7]。本研究通过体外实验探讨丙泊酚在低氧条件下对胰腺癌细胞增殖和侵袭的影响及其可能的机制,现报道如下。
1 材料与方法
1.1 细胞培养
人胰腺癌细胞株Panc-1购自美国模式菌种收集中心(American Type Culture Collection,ATCC)。将细胞置于含10%胎牛血清的DEME培养基中,37℃、5%CO2的培养箱中培养24 h后,将细胞随机分为Hypo组(低氧)、Hypo+P组(低氧+10 μg/ml丙泊酚)和正常组(正常培养)。其中Hypo组和Hypo+P组在低氧培养箱中继续培养,正常组在常规条件下继续培养。
1.2 CCK 8法检测细胞增殖能力
将处于对数生长期的细胞以104/孔接种于96孔培养板中。使用CCK8试剂盒检测24、48、72 h细胞的增殖情况。采用酶标仪测定细胞在450 nm处的吸光度值并绘制细胞生长曲线。
1.3 Transwell实验检测细胞侵袭能力
参照说明书使用Corning Costar Transwell Cell Culture Inserts进行细胞侵袭实验。丙泊酚或对照溶剂乙醇处理24 h后,加入无血清培养基,制成单细胞悬液,密度为1×105/ml。上层小室加入100 μl细胞悬液,下层小室加入培养基。12 h后应用4%的多聚甲醛固定液固定迁移的细胞,然后用结晶紫溶液染色15 min。采用荧光显微镜拍摄图片。
1.4 蛋白质印迹法检测ADAM 8蛋白表达情况
采用RIPA裂解液裂解细胞并提取细胞总蛋白,采用BCA试剂盒测定蛋白浓度后,取30 μg蛋白进行聚丙烯酰胺凝胶电泳。电泳完毕后半干法转膜,将胶上的蛋白质转移至硝酸纤维素膜上。采用5%的脱脂奶粉室温封闭60 min。将1∶1000稀释的一抗4℃孵育过夜,1∶1500稀释的二抗室温孵育120 min。采用Odyssey Imaging Systems显影并保存图像。采用Image J软件分析蛋白条带灰度值。以β-actin为内参,计算ADAM8蛋白的相对表达量。
1.5 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 丙泊酚对低氧条件下胰腺癌Panc- 1细胞增殖活性的影响
培养24、48、72 h,Hypo组胰腺癌Panc-1细胞的增殖活性均高于正常组和Hypo+P组,差异均有统计学意义(P﹤0.05)。(图1、表1)

图1 CCK 8法检测不同组别胰腺癌Panc- 1细胞的增殖活性
表1 不同时间点不同组别胰腺癌Panc- 1细胞增殖活性的比较()

表1 不同时间点不同组别胰腺癌Panc- 1细胞增殖活性的比较()
注:*与Hypo组比较,P<0.05
组别正常组Hypo组Hypo+P组1.4±0.2*1.7±0.2 1.2±0.1*2.2±0.2*3.6±0.3 1.5±0.2*3.1±0.4*4.9±0.5 1.9±0.3*24 h 48 h 72 h
2.2 丙泊酚对低氧条件下胰腺癌Panc- 1细胞侵袭的影响
Hypo组胰腺癌Panc-1细胞侵袭数目多于正常组和Hypo+P组,差异均有统计学意义(P﹤0.05)。(图2、表2)
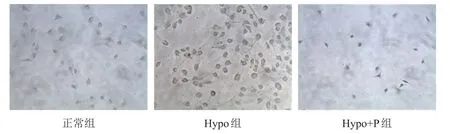
图2 Transwell实验检测不同组别胰腺癌Panc- 1细胞的侵袭能力
表2 不同组别胰腺癌Panc- 1细胞侵袭数目的比较()

表2 不同组别胰腺癌Panc- 1细胞侵袭数目的比较()
注:*与Hypo组比较,P<0.05
组别正常组Hypo组Hypo+P组侵袭细胞数目12.7±3.5*23.5±4.7 8.7±2.2*
2.3 丙泊酚对低氧条件下胰腺癌Panc- 1细胞中ADAM 8蛋白表达情况的影响
Hypo组胰腺癌Panc-1细胞中ADAM8蛋白相对表达量高于正常组和Hypo+P组,差异均有统计学意义(P﹤0.05)。(图3、表3)
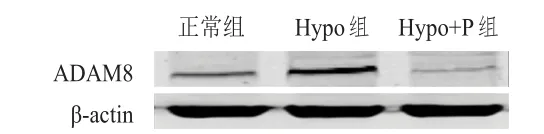
图3 蛋白质印迹法检测不同组别胰腺癌Panc- 1细胞中ADAM 8蛋白的表达情况
表3 不同组别胰腺癌Panc- 1细胞中ADAM 8蛋白相对表达量的比较()

表3 不同组别胰腺癌Panc- 1细胞中ADAM 8蛋白相对表达量的比较()
注:*与Hypo组比较,P<0.05
组别正常组Hypo组Hypo+P组1.6±0.5*2.2±0.7 1.3±0.4*ADAM8蛋白相对表达量
3 讨论
以丙泊酚为基础的TIVA对改善肿瘤手术患者的预后具有重要意义,但其分子机制尚不明确[4]。研究表明,低氧环境会导致ADAM8过表达,并与骨肉瘤、结肠癌、胃癌和胰腺癌中肿瘤细胞的恶性增殖、转移和不良预后相关[8]。低氧环境会刺激Panc-1细胞,使ADAM8的前体和活性形式都显著上调。使用丙泊酚可以很好地抑制ADAM8在胰腺癌细胞中的表达,在低氧条件下,丙泊酚对胰腺癌细胞的增殖和侵袭能力均具有抑制作用。本研究结果显示,低氧条件下,丙泊酚可以抑制胰腺癌Panc-1细胞中ADAM8蛋白表达,并抑制细胞的增殖及侵袭能力。
大多数实体瘤中氧供应和需求之间的不平衡导致低氧微环境,这对促进人类恶性肿瘤的发展具有至关重要的作用[9]。越来越多的证据揭示了缺氧对胰腺癌的作用。Cao等[10]报道了缺氧通过诱导旁分泌骨桥蛋白/整合素αvβ3的表达来促进胰腺癌细胞上皮-间充质转化,并通过调节叉头框蛋白M1(forkhead box M1,FOXM1)表达促进肿瘤干细胞产生。Deng等[11]研究表明,低氧诱导的长链非编码 RNA(long non-coding RNA,lncRNA)-BX111通过调节E盒结合锌指蛋白1(zinc finger E-box binding homeobox 1,ZEB1)的转录促进胰腺癌转移和进展。Li等[12]研究揭示了lncRNA-NORAD能够增强低氧诱导的上皮-间充质转化,从而促进胰腺癌的转移。Lu等[13]研究提出miRNA-142通过靶向肿瘤微环境中的缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)调节胰腺癌细胞的增殖和侵袭。Chen等[14]阐明低氧不仅能够诱导TWIST蛋白激活上皮-间充质转化,还能在体外和裸鼠中促进胰腺癌细胞增殖。本研究发现,丙泊酚能够在低氧环境下抑制ADAM8的表达。
综上所述,丙泊酚可能通过抑制ADAM8的表达拮抗低氧环境,从而抑制胰腺癌细胞的增殖和侵袭。
