鸭疫里默氏菌贵州分离株OmpA基因的克隆及生物信息学分析
2022-09-06马光强刘丽娟陈国权吴良涛刘军泽李潇蒙潘成文周碧君
马光强,刘丽娟,陈国权,吴良涛,杨 均,刘军泽,李潇蒙,潘成文,周碧君*
(1.黔南民族职业技术学院,贵州都匀 558000;2.都匀市农业农村局,贵州都匀 558000;3.贵州大学动物科学学院,贵州贵阳 550025)
鸭疫里默氏菌(Riemerellaanatipestifer,RA)为里氏杆菌科黄杆菌属,革兰氏阴性菌,能引发家鸭、野鸭、雏鹅、火鸡等多种禽类发生以纤维素性心包炎、肝周炎、气囊炎和脑膜炎为主要特征病变的急性或慢性、接触性、败血性传染病[1-4]。该病是目前危害养鸭业最主要的细菌性传染病之一,患病鸭感染率及病死率高,生长缓慢,品质下降,饲料报酬率低,治疗难度增大,给养鸭业造成巨大经济损失[5]。用抗菌药物是治疗该病的主要措施,而滥用抗菌药物致使RA易产生多重耐药性,用疫苗免疫预防是比较安全有效的途径[6]。
外膜蛋白是革兰氏阴性菌外膜的重要成分,在维持细菌形态、调节物质合成、跨膜转运、信号转导及诱导机体产生免疫应答等方面具有重要作用[7-8]。外膜蛋白A(OmpA)是细菌外膜蛋白的主要成分,在维持细菌结构的完整性、参与黏附侵袭宿主和逃逸宿主防御机制中发挥重要作用[9]。RA的OmpA包含6个EF-hand钙结构域和2个PEST结构域,OmpA可能是潜在致病因子的结构基础[10]。Th4ΔOmpA对Vero细胞的黏附能力、血液载菌量和对雏鸭的致病力较亲本株显著下降,表明OmpA可能是RA的重要毒力因子[11]。OmpA有4个胞外环状分子暴露在细胞表面且该蛋白基因序列高度同源,可能具备良好保守性与免疫原性,适合作为新型疫苗研制的候选蛋白[12]。为明确RA贵州分离株OmpA基因特性和遗传特征,本试验克隆OmpA基因并对其进行原核表达,分析其生物信息学功能,以期为进一步研究RA OmpA蛋白的功能和基因工程亚单位疫苗的候选蛋白筛选奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和载体 13株RA贵州分离株包括RA-SS-1-12于2018年-2019年分离于贵州省三穗县,RA-AS-1于2019年分离于贵州省安顺市,由贵州省动物疫病与兽医公共卫生重点实验室分离保存;大肠埃希氏菌DH5α购自北京擎科生物科技有限公司;pMD19-T载体,购自TaKaRa公司。
1.1.2 主要试剂 无菌脱纤维绵羊血,南京便诊生物科技有限公司产品;胰酪大豆胨液体培养基,杭州微生物试剂有限公司产品;新生牛血清,浙江天杭生物科技有限公司产品;酵母粉和胰蛋白胨,OXOID公司产品;细菌基因组DNA提取试剂盒和2×TaqPCR MasterMix,天根生化科技(北京)有限公司产品;DL 2 000 DNA Marker、DL 5 000 DNA Marker、PrimeSTAR®Max DNA Polymerase、连接酶Solution Ⅰ、限制性内切酶BamH Ⅰ和Hind Ⅲ,均为TaKaRa公司产品;Gel Extraction Kit胶回收试剂盒和 Plasmid Kit质粒提取试剂盒,Omega公司产品;氨苄青霉素,北京索莱宝科技有限公司产品;其他试剂均为国产分析纯。
1.1.3 主要仪器 高压灭菌锅,上海申安医疗器械厂产品;电热鼓风干燥箱,上海实验仪器厂有限公司产品;台式高速冷冻离心机,丹麦LABOGENE公司产品;双人单面超净工作台,苏州净化设备有限公司产品;二氧化碳培养箱和电热恒温培养箱,上海一恒科学仪器有限公司产品;全温培养摇床,上海新苗医疗器械制备有限公司产品;多功能梯度PCR仪,美国ABI公司产品;Implen微量核酸测定仪,德国Implen公司产品;电泳仪,北京六一生物科技有限公司产品;全自动数码凝胶成像系统,上海天能科技有限公司产品;颗粒制冰机,美国Grant公司产品;迷你离心机,丹麦Scanspeed公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中公布的RA Yb2株OmpA基因序列(登录号:CP007204),用Primer Premier 5.0设计1对特异性引物,上游引物为OmpA-F:5′-CGCGGATCCATGGACAAGGAGTTTATGTTG-3′(下划线处为BamHⅠ酶切位点),下游引物为OmpA-R:CCCAAGCTTTTATTTTCTTTTCTTTTTTACT ACT(下划线处为Hind Ⅲ酶切位点),预扩增片段大小为1 164 bp,引物由生工生物工程(上海)股份有限公司合成。
1.2.2OmpA基因的克隆 应用OmpA基因特异性引物,以13株RA贵州分离株基因组DNA为模板,PCR扩增OmpA基因。PCR反应体系25 μL:2×TaqPCR MasterMix 12.5 μL,模板DNA 2 μL,上、下游引物各1 μL,ddH2O 8.5 μL。PCR反应程序:94℃ 3 min;94℃ 30 s,50℃ 30 s,72℃ 70 s,35个循环;72℃ 10 min。PCR扩增产物进行12 g/L琼脂糖凝胶电泳检测,用凝胶成像系统观察结果。
1.2.3 载体构建及测序 PCR产物用12 g/L琼脂糖凝胶检测分离,将目的DNA片段进行胶回收纯化。pMD19-T载体用限制性内切酶BamHⅠ和Hind Ⅲ进行双酶切,回收酶切产物,将回收的OmpA基因片段按pMD19-T载体说明书操作方法进行连接,连接反应体系10 μL:Solution Ⅰ 5 μL,目的基因纯化产物4 μL,pMD19-T载体1 μL,16℃连接过夜。取10 μL连接产物与100 μL大肠埃希氏菌DH5α感受态细胞混合,冰上孵育30 min后42℃热激45 s,迅速置于冰上作用3 min,加入890 μL LB液体培养基,37℃、160 r/min培养1 h进行复苏。复苏结束后取100 μL菌液涂布于含有Amp(终浓度为100 μg/mL)的LB平板上,37℃培养过夜。挑平板中的单菌落接种于5 mL含有Amp(终浓度为100 μg/mL)的LB液体培养基中,37℃、160 r/min振荡培养12 h。以菌液DNA为PCR模板,按1.2.2中的PCR反应体系进行菌落PCR鉴定,将鉴定正确的质粒送生工生物工程(上海)股份有限公司进行测序。
1.2.4 生物信息学分析 用Blast(NCBI)和DNAStar软件对13株RA贵州分离株OmpA基因序列与参考序列进行核苷酸同源性和遗传进化分析(表1);分别用在线软件Protparam和Protscale分析预测RA OmpA蛋白的理化性质及氨基酸组成和亲水性;分别用在线软件TMHMM server v.2.0和SignalP-5.0分析预测RA OmpA蛋白的跨膜结构和信号肽;分别用DNAStar软件包Protean提供的Kyte-doolittle法、Karplus-schulz法、Emini法和Jameson-wolf预测RA OmpA蛋白B细胞抗原表位的亲水性、柔韧性、表面可及性和抗原指数;分别用在线软件SOPMA和SWISS-MODEL预测RA OmpA蛋白的二级结构和三级结构。
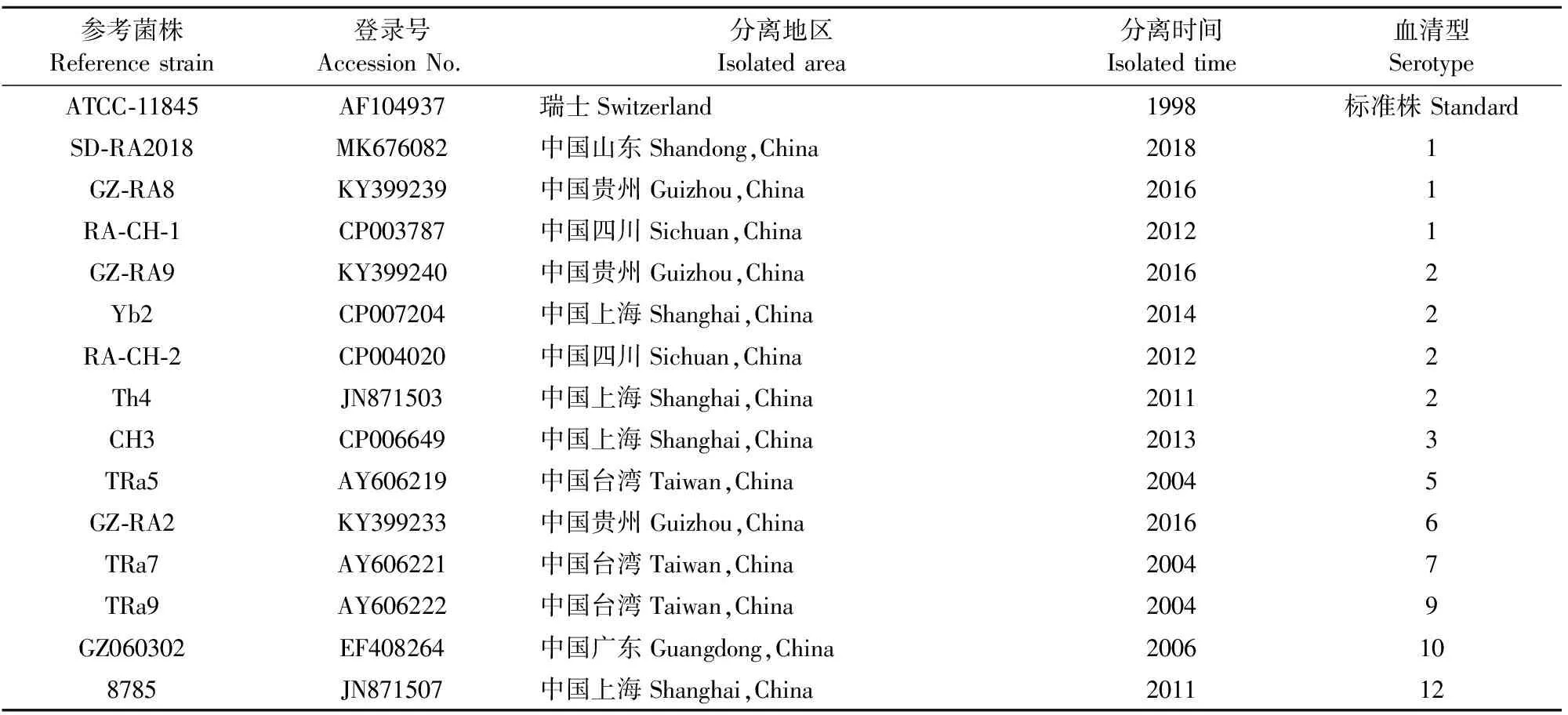
表1 RA参考株OmpA基因序列信息
2 结果
2.1 RA贵州分离株OmpA基因PCR扩增
以13株RA贵州分离株基因组DNA为模板,用RAOmpA基因特异性引物进行PCR扩增,经电泳检测。结果显示PCR产物大小约为1 164 bp,与预期扩增片段大小相符(图1)。
2.2 RA贵州分离株OmpA基因重组质粒PCR鉴定
将构建的13株RA贵州分离株OmpA基因重组克隆质粒进行PCR鉴定,经电泳检测。结果显示,PCR产物大小约为1 164 bp,与预期扩增片段大小相符(图2)。

M.DNA标准 DL 2 000;1~12.RA-SS-1-12;13.RA-AS-1;-.阴性对照;+.阳性对照M.DNA Marker DL 2 000;1-12.RA-SS-1-12;13.RA-AS-1;-.Negative control;+.Positive control

M.DNA标准DL 2 000;1~12.RA-SS-1-12;13.RA-AS-1;-.阴性对照;+.阳性对照M.DNA Marker DL 2 000;1-12.RA-SS-1-12;13.RA-AS-1;-.Negative control;+.Positive control
2.3 RA贵州分离株OmpA基因重组质粒双酶切鉴定
用BamH Ⅰ和Hind Ⅲ对13株RA贵州分离株OmpA基因的重组克隆质粒进行双酶切鉴定,经电泳检测。结果显示,得到大小约为2 692 bp的pMD19-T载体片段和大小约为1 164 bp的RAOmpA基因片段(图3)。表明RAOmpA基因已成功插入pMD19-T克隆载体,且测序结果与预期结果相符。
2.4 RA OmpA基因同源性及进化分析
用DNAStar的MegAlign软件,对13株RA贵州分离株OmpA基因序列与GenBank上登录的RA参考株相应序列进行核苷酸同源性比对和遗传进化树分析。结果显示,13株RAOmpA基因核苷酸同源性为100%,与参考株OmpA基因核苷酸同源性为93.0%~100%;13株RAOmpA基因与GZ-RA8(KY399239)、GZ-RA9(KY399240)、GZ060302(EF408264)、SD-RA2018(MK676082)、Yb2(CP007204)株的同源性高达100%(图4)。RA分离株OmpA基因遗传进化树分析发现,13株RAOmpA基因与参考株处于同一大分支,其中13株RAOmpA基因与SD-RA2018(MK676082)、Yb2(CP007-204)、GZ060302(EF408264)、GZ-RA9(KY399240)、GZ-RA8(KY399239)株处在同一小分支,亲缘关系较近;与中国台湾分离株TRa9(AY606222)处于较远的亲缘关系(图5)。结果表明,13株RA贵州分离株OmpA基因高度保守。
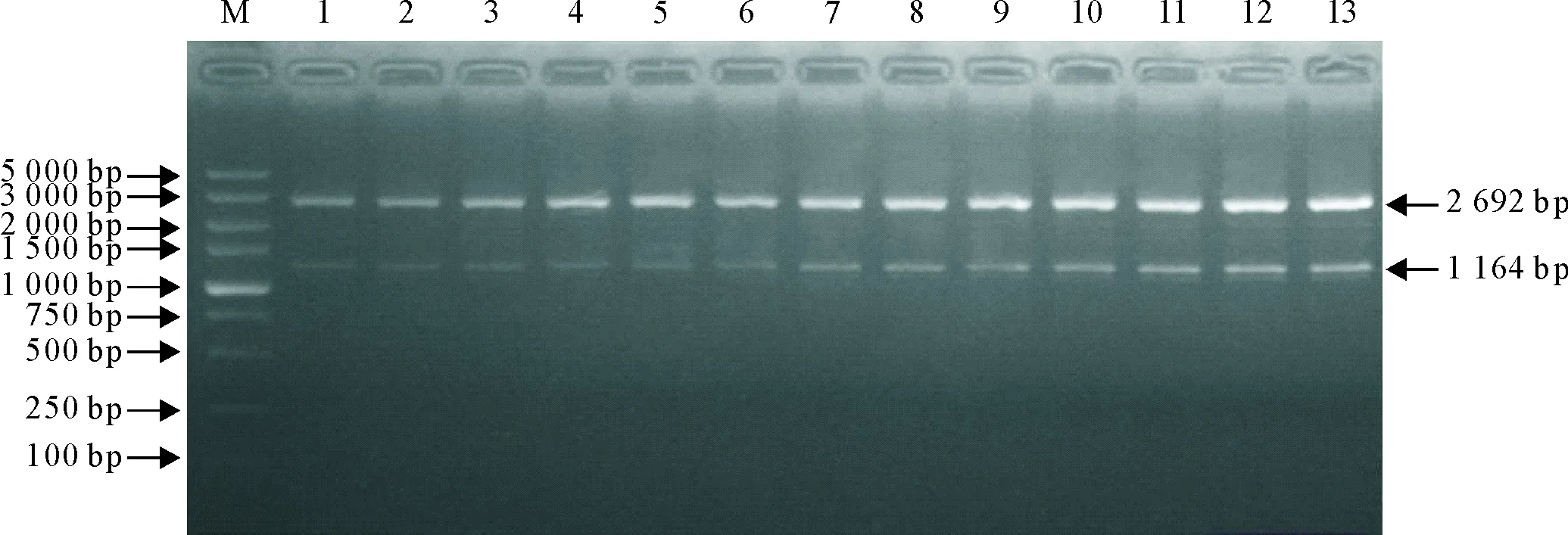
M.DNA标准DL 5 000;1~12.RA-SS-1-12;13.RA-AS-1M.DNA Marker DL 5 000;1-12.RA-SS-1-12;13.RA-AS-1图3 RA OmpA基因重组质粒双酶切鉴定结果
2.5 RA OmpA蛋白理化性质分析
RAOmpA基因开放阅读框为1 164 bp,共编码387个氨基酸,分子质量约为41.8 ku,理论等电点(pI)为4.89,预测其蛋白分子式为C1840H2854N502O588S12;正电荷氨基酸残基(Arg+Lys)45个,负电荷氨基酸残基(Asp+Glu)58个;蛋白的不稳定指数为20.58,推测该蛋白为稳定蛋白;脂肪指数为68.79,亲水性的平均值为-0.552,推测该蛋白为亲水性蛋白。用在线软件ProtScale预测RA OmpA氨基酸序列的亲疏水性,纵轴大于0为疏水区,分值越高疏水性越强;反之,小于0则为亲水区。结果显示,RA OmpA蛋白在第9位氨基酸分值最高(1.83),具有最强疏水性;在第351位氨基酸分值最低(-3.21),具有最强亲水性。该蛋白除局部为疏水区域外,大部分均为亲水区域,表明该蛋白属于亲水性蛋白,符合成为优势抗原的条件(图6)。
2.6 RA OmpA蛋白跨膜结构和信号肽预测
用在线软件TMHMM Server v.2.0、SignalP-5.0对RA OmpA蛋白的跨膜区域和信号肽进行预测分析。RA OmpA蛋白无跨膜结构域(图7);此蛋白无信号肽,即为非分泌蛋白(图8)。

图4 RA OmpA基因核苷酸同源性分析结果
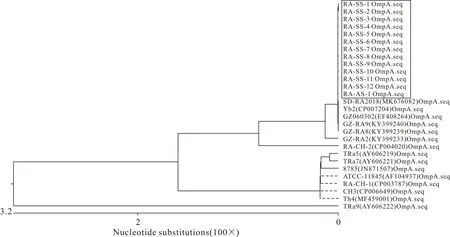
图5 RA OmpA基因核苷酸序列的遗传进化树
2.7 RA OmpA蛋白B细胞抗原表位预测
用Protean软件对RA OmpA蛋白的亲水性、柔韧性、表面可及性和抗原指数进行分析。结果显示,RA OmpA蛋白具有良好的亲水性;柔韧性分布较为均匀;表面可及性和抗原指数偏高,且在61-73、125-132、233-244、264-275、344-354、380-387肽段表面可及性和抗原指数较高(图9)。
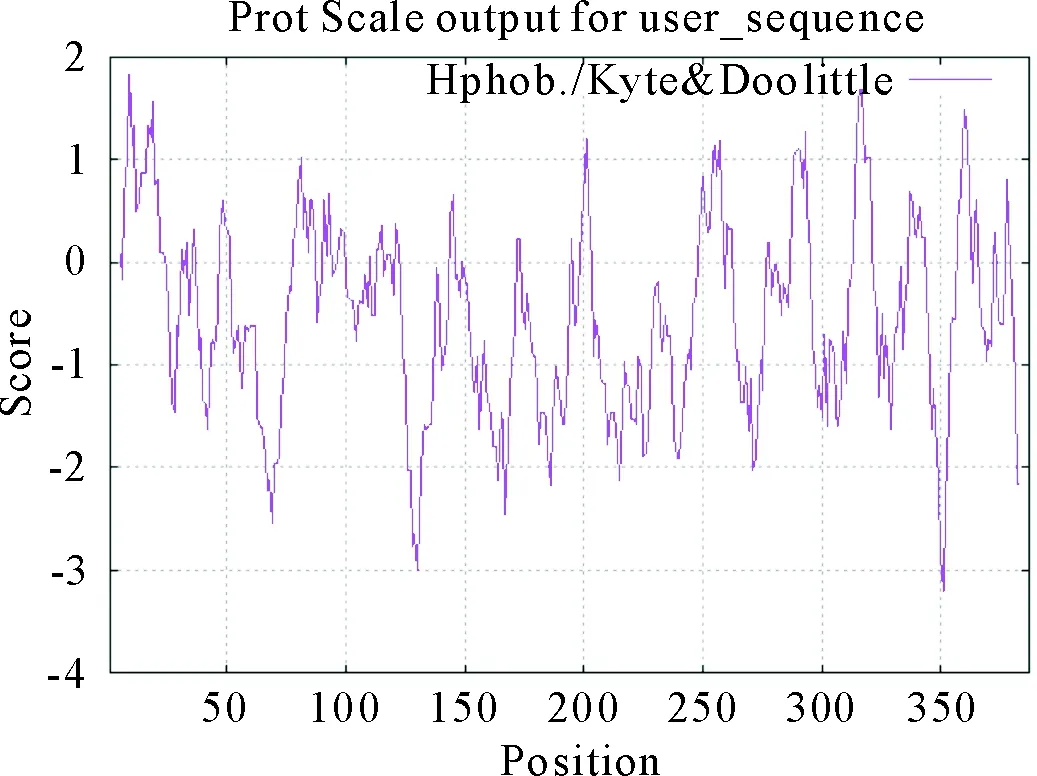
图6 RA OmpA蛋白亲/疏水性预测结果
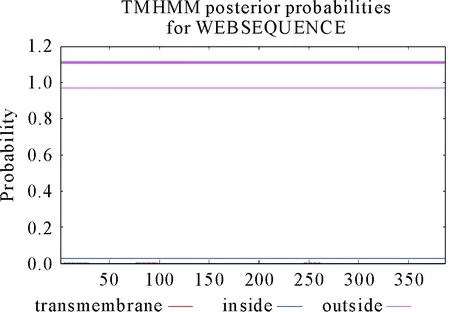
图7 RA OmpA蛋白跨膜结构预测结果
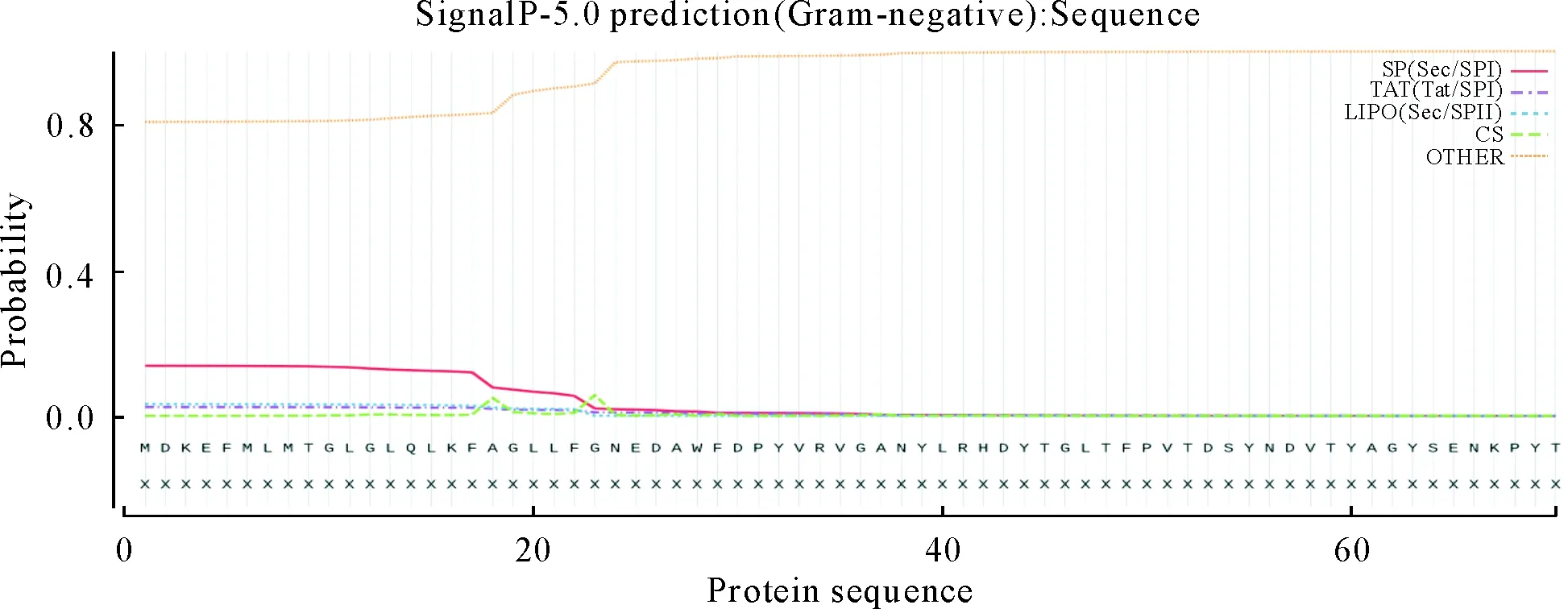
图8 RA OmpA蛋白信号肽预测结果
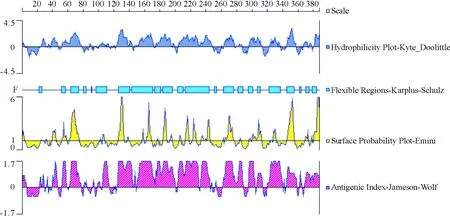
图9 RA OmpA蛋白B细胞抗原表位预测结果
2.8 RA OmpA蛋白二级结构和三级结构预测
用在线软件SOPMA对RA OmpA蛋白的二级结构进行预测分析。结果显示,该蛋白由59.17%(229/387)的无规则卷曲、18.86%(73/387)的α-螺旋、15.50%(60/387)的延伸链和6.46%(25/387)的β-转角构成(图10)。该蛋白的二级结构主要以无规则卷曲为主,有利于与其周围的极性环境相接触,为抗原表位的形成创造了有利条件。应用SWISS-MODEL在线软件对RA OmpA蛋白的三级结构进行预测分析,该蛋白的三级结构主要包括无规则卷曲、α-螺旋和延伸链,与二级结构预测结果相符(图11)。
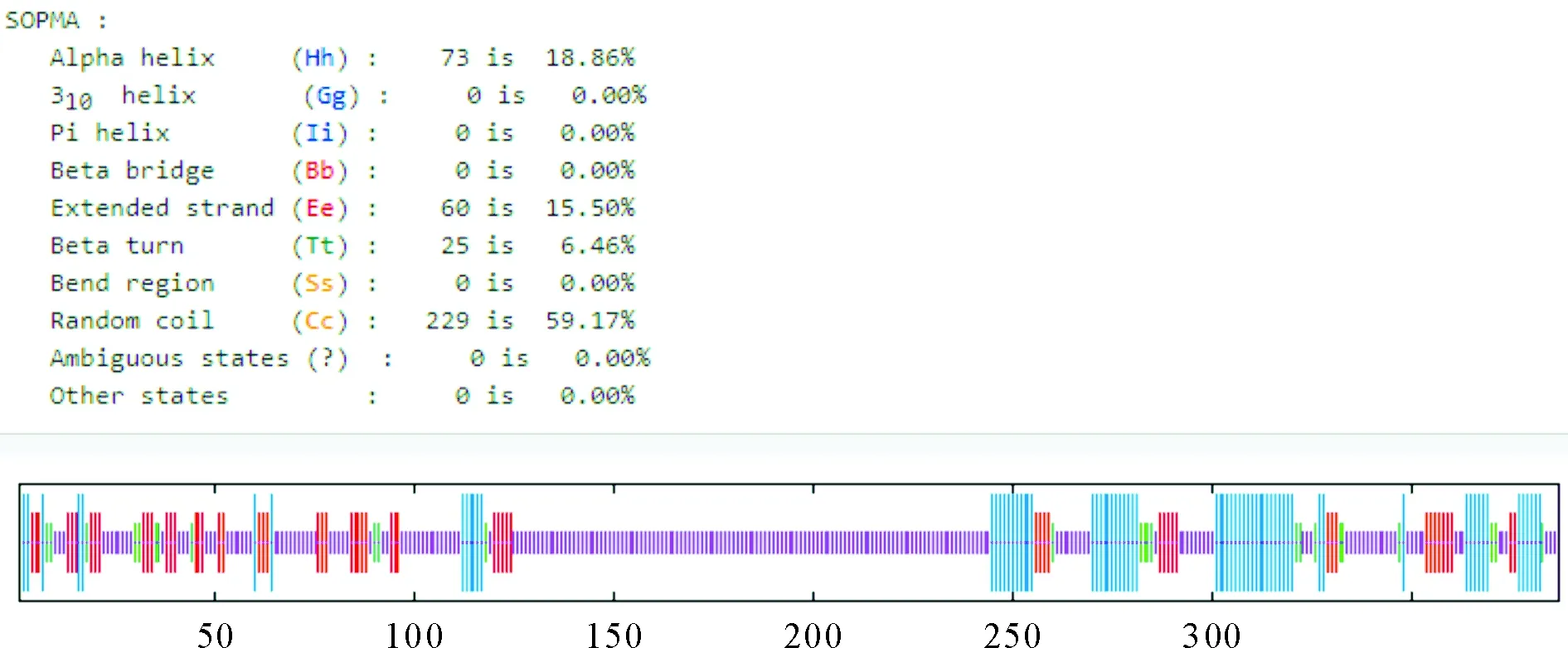
图10 RA OmpA蛋白二级结构预测结果
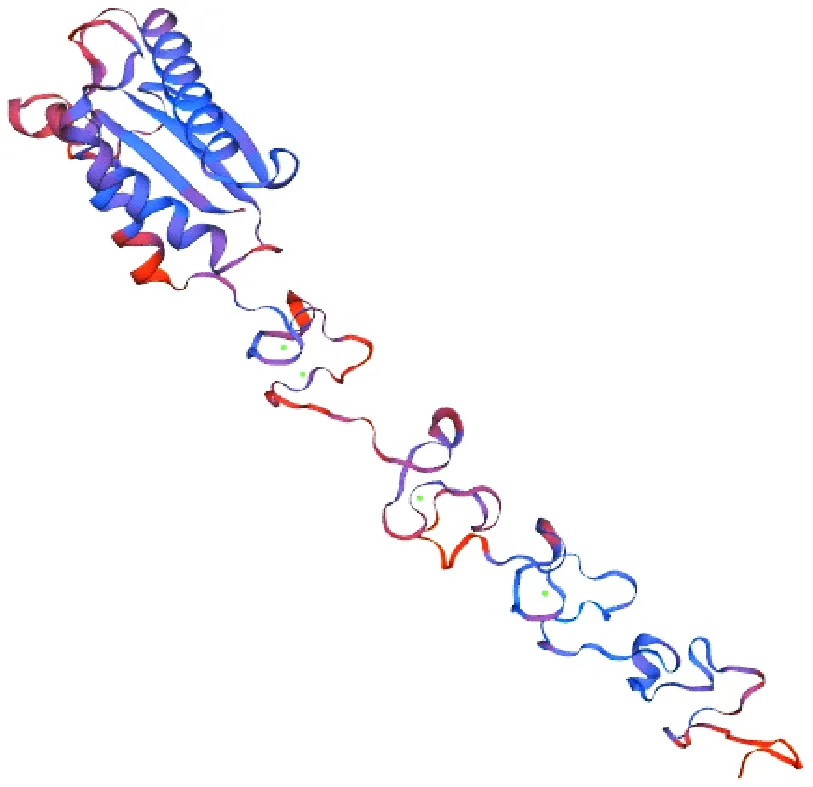
图11 RA OmpA蛋白三级结构预测结果
3 讨论
外膜蛋白A(OmpA)是革兰氏阴性菌中外膜蛋白(OMPs)的主要成分,是介导细菌生物膜形成、真核细胞感染、抗菌药物抗性和免疫调节的关键毒力因子[13]。相关文献表明,OmpA在参与RA黏附和侵袭宿主细胞以及诱导宿主产生免疫应答过程中起关键作用[11]。近年来,鉴于OmpA具有良好的免疫原性,将OmpA用于亚单位疫苗开发已成为当前研究的热点。本试验应用分子克隆技术对13株RA贵州分离株OmpA基因进行克隆分析,经测序发现13株RAOmpA基因片段大小均为1 164 bp,其同源性达100%;与参考株GZ-RA8、GZ-RA9、GZ060302、SD-RA2018和Yb2株的同源性高达100%,与文献[14-15]研究结果一致。表明众多RA血清型菌株均含有OmpA基因序列,且具有高度的同源性和保守性。
抗原表位也称抗原决定簇,是指外源抗原分子激发免疫机体产生免疫应答的最基本结构,广泛用于新型疫苗研制、单克隆抗体制备、诊断试剂和药物开发等[16]。B细胞抗原表位是指抗原分子表面可被B细胞表面受体或抗体特异性识别并结合的化学基团[17]。随着生物信息学与免疫信息学等交叉学科的快速发展和不断成熟,应用生物信息学技术预测和筛选蛋白的B细胞抗原表位已成为主要研究方法。应用生物信息学预测B细胞抗原表位一般包括3个参数,即亲水性、柔韧性和表面可及性。亲水性大小与B细胞抗原表位数量正相关,柔韧性强弱与B细胞受体结合能力正相关,表面可及性大小与B细胞受体识别并结合的难易程度正相关。本试验应用生物信息学技术对RA OmpA蛋白B细胞抗原表位进行预测,根据多参数综合分析OmpA可能存在的优势抗原位点。预测结果显示,OmpA蛋白在61-73、125-132、233-244、264-275、344-354、380-387肽段具有良好的B细胞抗原表位。表明RA OmpA蛋白具有较多的优势抗原表位结构,可初步应用于免疫学相关研究。本试验结果为基于RA OmpA蛋白的亚单位疫苗研制奠定了基础。
