实验性肺结核病变类型与特点
2022-09-06包容高建峰饶艳
包容 高建峰 饶艳
肺结核是由结核分枝杆菌或结核分枝杆菌复合群的其他菌株感染引起的传染性疾病,其在临床病理上分为多种类型;但实验性肺结核病变与临床肺结核不完全相同。因为菌株、接种、动物品系、病程等诸多因素不同,实验性肺结核的病变呈现出自身的特点。目前,实验性肺结核病理分型缺乏一致的认识,有的分类比较粗略、主观性强。如有文献按由重到轻的顺序将病变程度分为3类[1];但这种分类不是很准确,如结核性肺炎,虽病变面积广、病变重,却归于次重组。也有按照病变轻重和性质分类,如把肉芽肿类型由重到轻分为3型[2];或者按照结节大小、数量、性质等因素把病变类型分为4类[3];或将病变由轻到重分为5类[4];还有文献把肺结核病变分为纤维化、结节、坏死等6种类型[5];但这些分类方法均随意性比较强,且缺乏具体病理病变类型,分类方法不够细致全面。本文阐述了实验性肺结核病灶发生发展的过程,并全面总结了实验性肺结核的各种病变类型,这有利于提升对实验性结核病变的认知,有助于对实验性肺结核病变程度的评估,有利于抗结核药物与结核疫苗的有效性评价。
一、实验性肺结核动物模型
在用于结核病临床前研究的动物中,使用最多的动物是小鼠,超过60%;其次是豚鼠,接近25%;再次是兔子,超过10%;其他如非人灵长类(non-human primate,NHP)等很少[6]。在用于结核疫苗评价的动物中,使用最多的动物也是小鼠,其次是豚鼠、牛,兔、猴、羊较少。大小鼠、豚鼠和NHP对结核分枝杆菌(Mycobacteriumtuberculosis,MTB)敏感,而牛和兔对牛分枝杆菌(M.bovis)敏感,且小鼠因个体小、费用低而有明显优势。因此,兔、大鼠和豚鼠都适合抗结核药物与疫苗的研究,而小鼠特别适合大规模药物与疫苗筛选[7]。小鼠作为实验动物也被认为有不足之处,因为小鼠不是MTB的自然宿主;而空洞作为肺结核的一个重要指标,也没有在常见的两个小鼠品系中被观察到[8]。豚鼠在感染时表现出敏感的免疫反应,是抗结核疫苗评价的良好模型。猴结核模型具有与患者相似的临床症状和典型的肉芽肿结构,是疾病机制研究的重点[9]。
自然途径感染动物模型受到关注。低剂量MTB气溶胶途径的感染模型能更好地模拟临床肺结核发病的经过,被认为是与人类自然感染过程更接近的动物模型[10]。随着硬件设施设备的提升,高菌落形成单位(CFU)感染模型或者静脉途径感染逐渐被低CFU气溶胶途径感染模型取代。
潜伏感染模型也受到关注。为了探索治疗性疫苗的有效性,减少潜伏感染者化疗药物的使用,需要一个动物模型来评价疫苗对MTB的破坏力。这个模型倾向于使用低的感染剂量和相对不敏感的动物,如在小动物中选择小鼠,或者在NHP中选择食蟹猴。
NHP动物使用逐渐增多。这是因为从免疫反应与药物反应看,NHP与人类更接近,所以相关研究结果可以与临床研究进行比较。这些NHP主要是食蟹猕猴(食蟹猴)和普通猕猴(恒河猴)。恒河猴对MTB敏感,容易出现严重病例和死亡。食蟹猴对MTB相对有抗性,因此也是潜伏感染模型的选择对象之一。
高分辨率CT(HRCT)、PET/CT、FDG-PET/CT和核磁共振(MRI)已经应用于动物实验。这些技术可以对病灶进行三维重建,评估病灶大小、性质与位置,从而更精确的评估病变程度。
二、结核性病灶的发生与发展
临床上,结核病灶标本的病变比较典型或者相对严重,但感染极早期的变化却很难见到;不过我们可以通过动物实验再现这一过程。这与普通细菌感染的极早期表现有类似之处,开始仅表现为血管周围炎(perivasculitis/periangitis)或者细/小支气管周围炎(peribronchiolitis)。血管与细/小支气管周围的淋巴细胞浸润是结核性结节形成前的病变。在MTB感染后,淋巴细胞较早在细/小支气管和血管周围聚集,形成周围炎(图1、2)。这在实验性肺结核中较常见[11-14]。这种病变也在病毒感染的动物模型中可见,如小鼠新冠病毒感染[15]。

图1、2 C57BL/c小鼠MTB标准菌株H37Rv气溶胶感染后极早期的周围炎(肺组织切片;HE染色:×100)。图1为小血管周围炎表现。图2为细支气管周围炎表现 图3 C57BL/c小鼠MTB感染后肺组织切片(HE染色:×200):细胞性结核结节,结节中可见大量泡沫状巨噬细胞
周围炎继续扩大可形成单个或多个以淋巴细胞为主的小结节[13-14, 16]。巨噬细胞也会进入病灶周围的肺泡内并吞噬病原菌,逐渐形成胖大的泡沫状巨噬细胞(foamy macrophage, FM)[14,16-18](图3)。细胞性结节中的巨噬细胞表现为上皮样巨噬细胞[19-20]或上皮样细胞[21-23]。推测肺泡中的FM会逐渐失去泡沫状特征而成为上皮样巨噬细胞,并最终成为上皮样细胞。这些成分共同构成或大或小的结节病灶[24]。被巨噬细胞浸润的肺泡逐渐与周围炎病灶形成小结节[14],小结节逐渐形成大结节,大结节则融合成片[25]。结节在扩张的过程中会逐渐将含大量淋巴细胞的周围炎病灶包裹进去,大的细胞性结节可包含多个周围炎病灶[2]。
三、实验性肺结核的病变类型
实验性肺结核的病变类型包括结节性和非结节性病灶(如周围炎、结核性肺炎、间质性肺炎)。又根据其病灶性质分为以下类型:(1)坏死性病灶:脓性结节、干酪性结节、结核性肺炎、肺脓肿;(2)实性病灶:细胞性结节、纤维性结节、混合性结节;(3)肺间质病变:包括间质性肺炎和肺间质纤维化;(4)其他:如周围炎、肺水肿、肺充血、肺气肿等。
(一)结节性病灶
结节性病灶有多种,包括实性细胞性、坏死性、脓性、纤维性结节等。
1.细胞性结节:细胞性结节属于增生为主的病变,其病变发生较早,易在小鼠模型[1]中发现。因为实验的菌株、攻毒、免疫等诸多因素的不同,病变也有较大差异[26]。细胞性结节包括淋巴细胞、巨噬细胞、成纤维细胞、肺泡上皮细胞、多核巨细胞等多种成分,以前三种为主。早期的结节主要由淋巴细胞构成[13],多种表型的淋巴细胞参与了细胞性结节的构成[14, 27];随后巨噬细胞逐渐增多,与淋巴细胞相互混杂[17]。典型的细胞性结节[5, 19]的中心由密集的上皮样巨噬细胞或上皮样细胞组成[21, 25],结节边缘可有多核巨细胞[28],结节外围常见淋巴细胞[20, 25]。也有部分病灶的肺间质明显增宽而无明显结节化,渗出也不明显,周边组织无明显炎性细胞浸润,使得肺组织形成疏松多孔结构或不规则病灶[29],残存少数大的含气肺泡。细胞性结节性病灶为多中心性,小结节边缘逐渐向外延伸并相互连接,逐渐融合成大结节。大结节进一步发生片状融合、中心坏死、外周纤维化或实变,或急性进展为结核性肺炎。
2.干酪性结节:干酪样变是MTB感染的特征性病变,也是最常见的病变类型。干酪化意味着比较严重的炎症反应。多个细胞性结节相互融合,中央坏死后逐渐形成干酪化病灶。
在坏死病灶早期,MTB较多,巨噬细胞因吞噬过多的MTB,抗酸杆菌染色呈红色[3]。有些干酪化坏死区外也有一圈FM包绕[30],其形态与结节形成初期肺泡中的FM不同;后者形态圆润而饱满,类似气球。这些FM呈椭圆形,脂质溶解后外观空亮(图4),免疫组化染色可见其分布与表型[12]。也有很多坏死的结节仅有成纤维细胞、淋巴细胞包裹[12, 31],这些环绕的淋巴细胞被称为淋巴细胞套(lymphoid mantle)[2, 18]或淋巴细胞圈层(lymphocytic rim)[31]。这些外围的纤维化成分有助于炎症的控制,如果病灶局限化,则病情相对稳定。
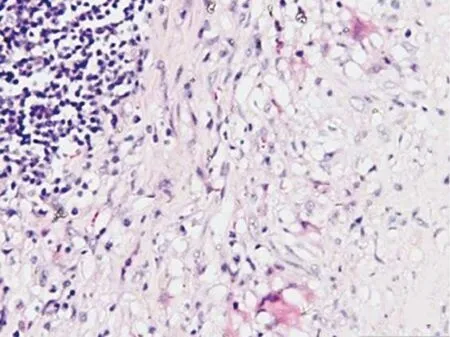
图4 小鼠肺组织切片(HE染色:×200):干酪样坏死性结节(右)外围有一层富脂质的梭形巨噬细胞包绕,其细胞透亮,最外层可见淋巴细胞套
多种实验动物的肺结核可出现干酪样坏死,如绒猴[32]、食蟹猴[5, 33-34]。病变轻的肺叶仅有少数绿豆大或者更小的结节,呈切面干酪样;而全肺实变的肺结核坏死灶的切面也可呈干酪样。这种病灶在其他动物中也可见,如羊[31]、豚鼠[35]等。有文献认为小鼠肺结核不形成干酪样坏死灶[36],但实际上这在C57[3]、C3H小鼠[1, 30, 37]中也可见。另外,多种分枝杆菌感染可以引起小鼠干酪化病变,包括MTB Erdman 株[1, 37]和H37Rv株[38]、多重耐药株[33],甚至鸟分枝杆菌(M.avium)[3]等。
3.脓性结节(suppurative granuloma)与脓肿(abscess):脓性结节这个概念可能会引起争议,其实脓性结节在临床中较常见,如淋巴结核。与固化的干酪样坏死不同,脓性结节包含液化坏死的脓性物质,主要是死亡的炎性细胞,特别是中性粒细胞碎片。结节中脓性成分很少,但脓肿不同。病肺的肺叶还可有巨大脓肿形成,特别是对MTB敏感的恒河猴[28](图5)或者在攻毒剂量大的情况下。肺部病灶发生液化性坏死时,常合并胸膜粘连,切开粘连后可见脓性液体,质地湿稠,而非干性或干酪样。有这类病灶的实验猴往往因为呼吸衰竭而濒临死亡。脓肿可见于肺、支气管组织,还可见于肝脏;但最常见的是淋巴结,特别是纵隔淋巴结、肺门淋巴结,这可能与中性粒细胞反应有关。
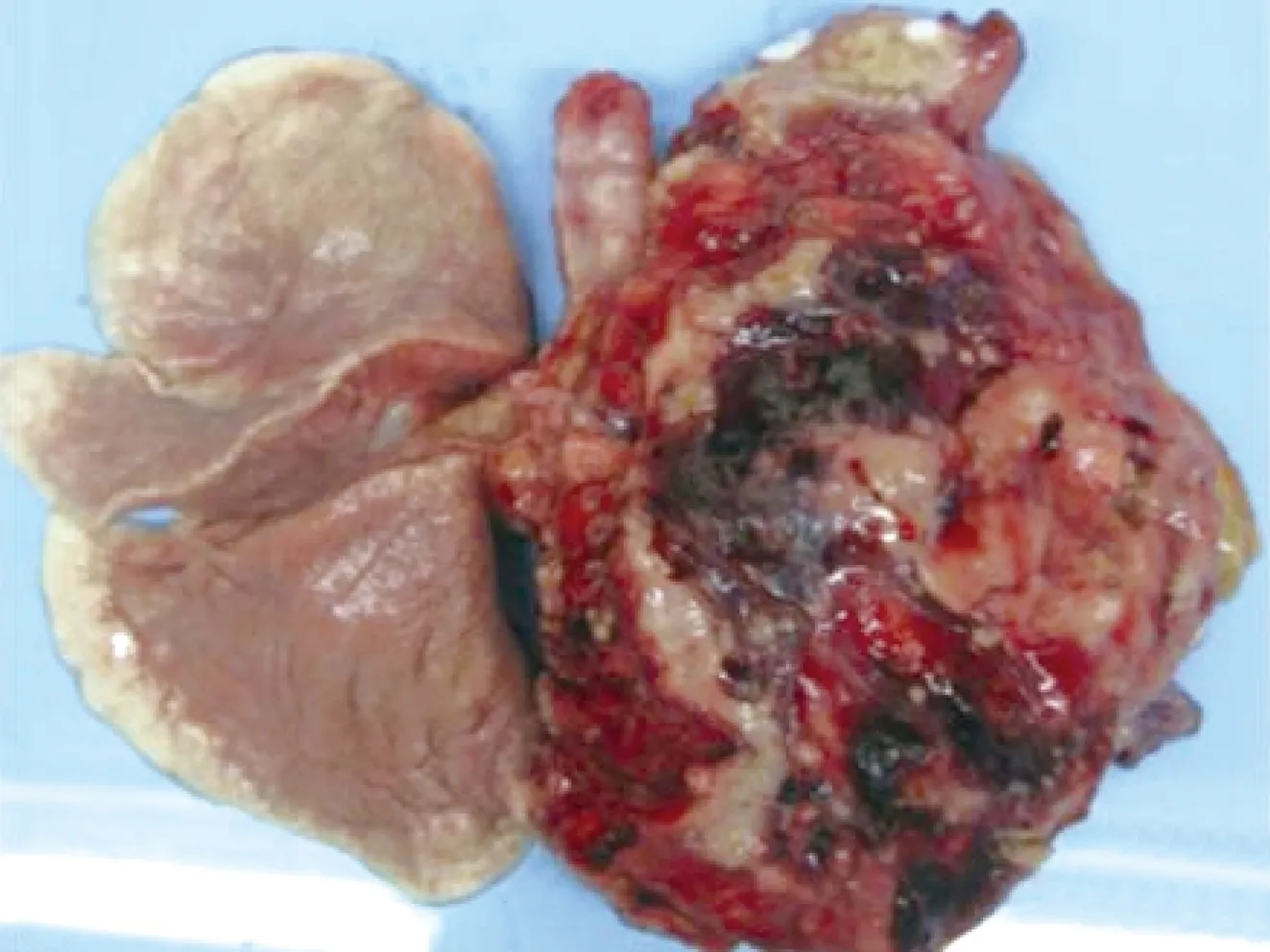
图5 中国恒河猴支气管途径MTB Erdman株感染。大体解剖,右肺切开可见巨大脓肿形成
结节性病灶还可能含有一种以上的成分,或者兼具某种过渡类型的特征[25],如同时含有坏死组织和细胞成分;有的结节性病灶则带有明显的纤维化成分[13, 39],也有以胶原成分为主的结节性病灶[5],但较少见。

图6~8 C57BL/c小鼠感染MTB后的结核性肺炎坏死性病灶与抗酸染色。图6为结核性肺炎肺组织切片HE染色(×40):结核结节可见明显的坏死灶,结节外可见大片炎性渗出病灶。图7、8为肺组织切片抗酸染色(×400),图7可见大量紫红色抗酸杆菌,图8可见少数抗酸杆菌
(二)非结节性病灶
1.结核性肺炎(tuberculous pneumonia):结核性肺炎并未被常规列为肺结核的病理类型,是结核性炎症扩散引起的,并不属于结节性病变,而是比单纯的干酪性病变更严重的病变类型。该类病变变态反应剧烈,病灶面积广,进展迅速,易导致实验动物死亡。大面积的坏死与渗出并存是结核性肺炎的重要特征。镜下可见多个相连的干酪样坏死区域,呈地图样改变,同时坏死区周边肺泡可见渗出[5](图6)。这类病变可见于小鼠[40],如 H37Rv[41]或Erdman株[1, 30]感染的C3HeB/FeJ小鼠、免疫缺陷小鼠[42]等;这类病变更常见于NHP的肺结核动物模型[5, 32]。因此,结核性肺炎是NHP实验中比较常见的病变类型,特别是在动物MTB敏感或者MTB攻毒剂量大的情况下[5],而并非Flynn认为的属于偶尔出现的病变[39]。
结核性肺炎期或者急性期,在充满渗出液和细胞的肺泡中可见大量的抗酸杆菌(图7), 随着坏死、纤维化、结节化的进程,菌量明显减少;在坏死时间较长或者完全坏死的组织中,甚至见不到典型的抗酸杆菌,而在边缘的纤维化区域,也仅仅有数个典型的MTB(图8)。
2.间质性肺炎(interstitial pneumonia,ILD):又称肺间质纤维化(pulmonary fibrosis)或弥漫性实质性肺疾病。间质性肺炎因为长期的肺组织损伤引起细胞外基质的沉积,胶原组织替代正常肺组织,导致肺泡壁增厚、变硬[43],并非普遍认同的结核病变类型,但部分文献认为肺纤维化属于肺结核的病变后果[43-44],结核病研究大家Flynn也将“间质纤维化”列为肺结核的病变类型[5,39,45-46]。
小鼠实验性肺结核均可见不同程度的间质性肺炎(图9),C57BL/6小鼠的病变表现为肺间质巨噬细胞、淋巴细胞浸润和肺间质纤维化[2]或者肺间质弥漫性增宽[38],这也被称为弥漫性肉芽肿肺炎[47],镜下可见类似模式小鼠的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)[48-49];也有更严重的肺间质纤维化和肺实变[50]。C3HeB/FeJ小鼠在接种Erdman菌株后肺间质发生纤维化并伴坏死[1]。Balb/c小鼠在H37Rv感染后可见广泛的渗出和肺间质淋巴细胞浸润[35]或者很重的间质性肺炎[47]。
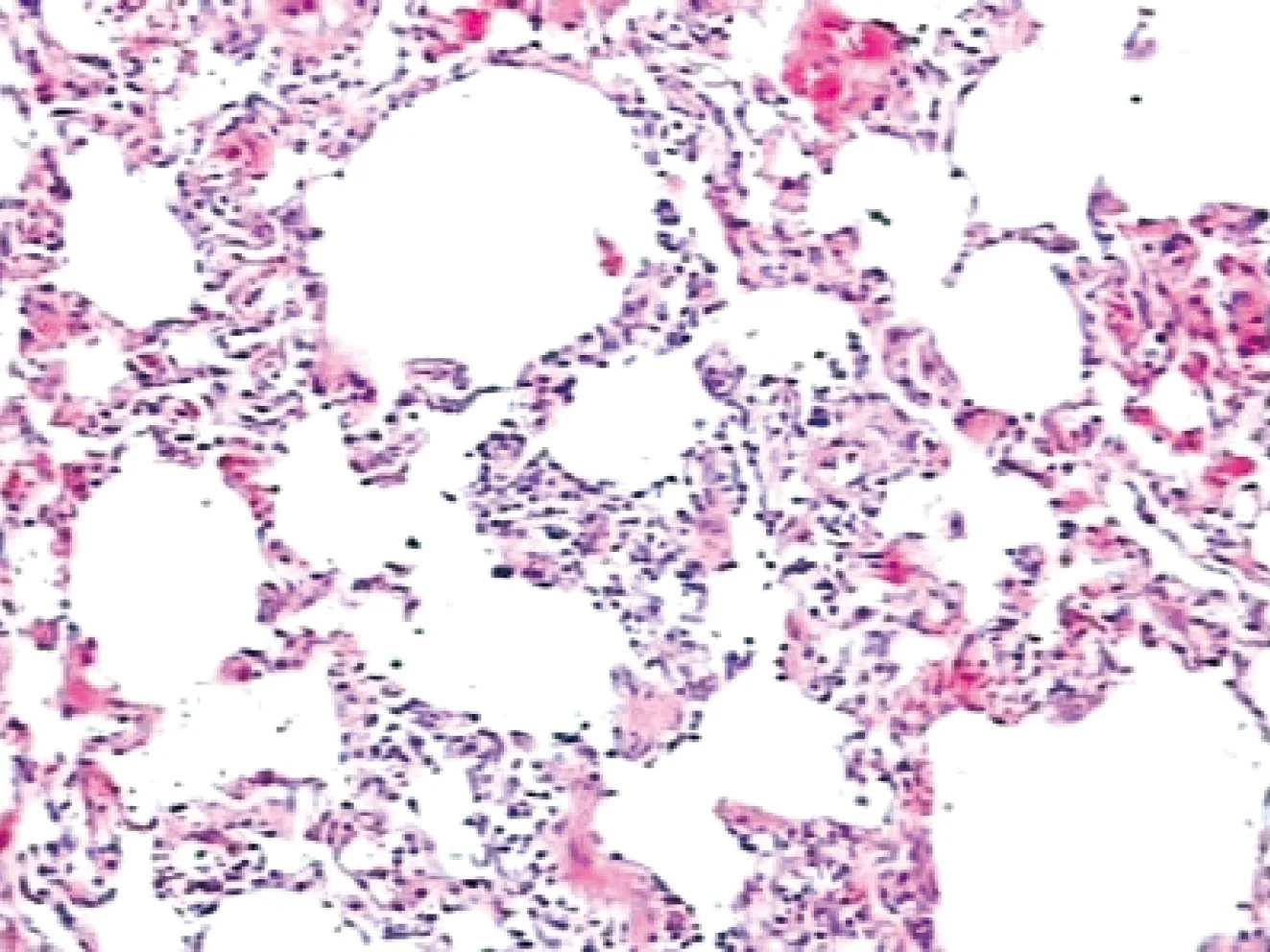
图9 小鼠间质性肺炎肺组织切片HE染色(×200):可见肺间质增宽,并有淋巴细胞浸润,巨噬细胞增生间质性肺炎
NHP的MTB感染可出现坏死性病灶伴肺间质明显增宽[33, 51],类似病毒性肺炎[34]。其他实验动物如大鼠[16]、兔[52]、山羊[31]和豚鼠[53]的MTB感染也可出现间质性肺炎。
值得注意的是,某些“间质性肺炎”[54]是由解剖或取材时肺组织受到外力挤压,肺泡内空气被排出而形成的,所以可能会导致误判。由于缺乏结节性病灶,间质性肺炎的病变程度评分较困难,但肺相对质量和肺浮重可以作为评价指标。与结节性病灶不一样,间质性肺炎的病灶不会明显局限化,其严重程度取决于残存肺泡的数量与肺间质宽度。如果合并其他病灶,如肺内占位性病变,则动物容易出现呼吸困难。
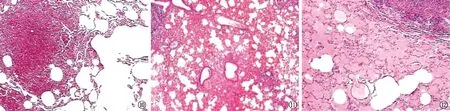
图10~12 C57BL/c小鼠感染MTB后实验性肺结核的其他肺结核病变类型。 图10为肺组织切片(HE染色:×200),可见肺组织结节旁的代偿性肺气肿,结核结节旁有部分肺泡破裂,融合。图11为肺组织切片(HE染色:×100),可见广泛性肺充血伴局灶性肺水肿。图12为肺组织切片(HE染色:×200),可见结节旁广泛性肺水肿
3.镜下的空洞与钙化:有文献指出,MTB实验性感染也会出现钙化与空洞,包括MTB、M.bovis感染的各种实验动物[36];也有文献指出恒河猴和食蟹猴都会形成结核空洞,但不一定出现钙化与干酪化[55];但诸多文献证实多种动物包括食蟹猴[5]、兔[52]、豚鼠[14]、山羊[31]的肺结核都有钙化与空洞形成。还有文献认为兔、豚鼠、猴肺结核都能发生空洞和钙化,而小鼠肺结核不形成空洞,一般也不形成干酪样病灶[56];这意味着小鼠模型不能模拟人肺结核的全部病变类型,模型有一定缺陷。稍后的研究发现,小鼠肺结核也有明显的大的空洞形成,如C3HeB/FeJ、CBA/J小鼠[2]。尽管空洞与钙化被认为是很重要的标志,但从大体解剖与镜下诊断看,实验性肺结核的钙化[39]与空洞都属于不常见的病变类型。
实验性肺结核的干酪化坏死物被吸收后收缩,形成空洞,而浓缩的坏死物则形成钙化灶,呈现空洞与钙化并存的现象,是同一病变的多种表现形式;钙化在未完全形成时空洞特征不明显。实验性肺结核的空洞与钙化的病灶比较小,且空洞非开放性,这与临床肺结核不同。组织切面的结节中间有圆形空缺,有可能是细/小支气管的横截面,不一定是结核性空洞。随着化疗药物的发展,肺结核的临床结核病变类型已经发生了很大的变化,过去常见且严重的病变类型如纤维空洞型、干酪样肺炎已经变得很罕见,所以纠结于是否形成空洞与钙化或许已没有现实意义。另外,因为动物伦理和福利等原因,现在也很难通过动物模型复制与人类结核病相似的空洞性肺结核动物模型。
4.其他类型的病变:除以上病变外,肺结核还可伴有其他病理改变,如周围炎、肺水肿(渗出)、肺充血、肺气肿、支气管炎、钙化/空洞。其中,肺气肿、肺水肿、肺充血等这些并不是特征性病变,所以可能会被忽略或者回避。
(1)代偿性肺气肿:是肺结核的继发性病变。长期严重的咳嗽可引起肺泡过度扩张或者部分肺组织实变后出现代偿性肺气肿。镜下可见猴肺泡扩大,并伴有肺泡壁破坏、肺泡融合、肺间质增宽、肺泡过度充气等[28];这在小鼠中也可见[38](图10)。另外,肺气肿常伴随纤维化改变[28]。(2)肺充血:是因为炎症反应,使小血管增粗,结核病灶周围可见明显广泛的肺充血[1,38],或肺组织中炎性细胞增多并出现明显的充血[57],或充血伴水肿[58](图11)。(3)肺水肿:是肺组织炎性渗出,HE染色见肺泡内充满粉红色物质,为渗出的蛋白。在小鼠感染的各阶段肺组织局部均可发现肺水肿[29]。恒河猴在减毒株感染后也可见广泛性肺水肿[54](图12)。这种渗出可以是一过性的,肺部渗出液会逐渐吸收,从而使缺氧得到缓解;如果范围过大,动物可能因此缺氧而死亡。(4)支气管病变:细/小支气管周围炎继续进展为细小支气管炎,周围组织的坏死过程也会波及细小支气管[59];脓性或者干酪样坏死物可能会突破小支气管壁,进入管腔,或者堵塞支气管[60]。MTB感染还可以引发淋巴管炎[14, 59]。
结核结节只是肺结核的典型病变,而不是肺结核的唯一病变类型。除了常见的坏死性、细胞性、纤维性、混合性结节外,结核性肺炎也属于肺结核的病变类型。另外,本文还将血管周围炎、细/小支气管周围炎、间质性肺炎、(代偿性)肺气肿、肺水肿、肺脓肿、肺充血、支气管炎等列为肺结核的病变类型。
四、病变类型与时间进展
病变类型和病变程度与多种因素有关,如动物品系、菌株类型、接种剂量、干预因素以及病程等。病变因动物品系而有所差异,如C3H小鼠病变比Balb/c小鼠严重[41];如大鼠对MTB不敏感,慢性期病灶会逐渐缩小[16]。
一般情况下病变会进行性加重,也有病变逆转的报告。敏感动物感染后病灶会逐渐进展,随感染时间延长,病变面积逐渐增加,病灶占肺组织比例逐渐升高;结节逐渐增大,增多;如M.bovis感染山羊[31]和CBA/J小鼠[25]。干预因素处理组病变也有类似的趋势,只是进展相对缓慢[29];但也有相反的情况,如疫苗组小鼠后期比前期病变更轻[47]。可能的原因是,在干预因素作用下细菌数量得到有效控制,肺泡中的渗出被吸收,炎性细胞浸润减少,病灶缩小。
病变与时间进程并不一致,同一时间可以出现多种病变类型或者同一种病变类型可以在不同时间出现。如小鼠肺组织病变从结构松散的小结节或者到出现泡沫状细胞,时间从几周到几个月都有可能[17-18];如C3H小鼠在感染后的1~2个月内出现几种不同病变程度与类型的病灶,包括以坏死为主的结节、结核性肺炎以及细胞性结节病灶[1];如豚鼠的钙化灶可以在感染后6周内、 60 d后[14]或者29周后发生[36]。
另外,病变也与感染剂量有关,菌量过低时,病变进展缓慢,表现为弥散的、结构松散的结节病灶;而高剂量组的坏死性病变则会更早出现,也更容易出现结核性肺炎。
五、病变程度的评分
肺结核病变程度的评价有多种方法。包括大体解剖评分、组织病理学评价、脏器指数(肺相对质量)、肺浮重(密度)、免疫组化染色等[61]。大体解剖是最直观的方法,正常的肺组织取出后会因为失血而颜色变浅,而病肺因为炎性病灶而颜色变深,且质地与质量取决于病变程度;组织病理学评价可以明确病变类型、病灶数量、病变面积;大体解剖与组织病理学具体评分方法见文献[61]。脏器指数与肺浮重可以量化肺损伤的程度。大动物可以通过称量肺浮重和脏器指数评价肺部炎症的程度,因为渗出或者坏死、纤维化等组织实变,肺相对质量(肺指数)会有增加。所有动物的肺指数都可以通过称量得出,而肺浮重只有较大的动物才容易测量。免疫组化染色可以判断免疫细胞亚群和分布范围以及浸润程度等。
六、药物和疫苗的有效性评价
抗结核药物与疫苗有效性评价的方法包括组织的细菌载量、病理评分、免疫应答强度和影像学检测等。
细菌载量是常用方法之一,可以量化评价药物或疫苗效果;细菌载量同时也是非常客观的指标。细菌载量与病变程度有相关性,但相关程度并不是非常高;所以有必要结合其他方法来评价。抗酸染色也是一种直观的方法,其坏死组织的结核分枝杆菌形态不典型,很难判断,不能反映病变后期组织中的菌量,所以应用受到一定限制。
病理评分是病变程度的量化,虽然有一定的主观性;但不失为最直接、最准确的评价方法。病理评分包括大体解剖的评分和细胞病理学评分。大体解剖评分的参数包括病变的体积与数量;细胞病理学评分的参数包括多种细胞类型或者病变类型。肺相对质量(肺指数)与肺浮重(肺密度)也是病变大体评价方法的一种。肺指数适合大小不同的动物,而肺浮重仅适合大动物;小动物肺太小而难以计算体积。
疫苗效果的预测常用到免疫学参数,包括特异性抗体滴度和细胞免疫应答强度,如CD4+T细胞和CD8+CLT细胞或者其他免疫细胞比例等。酶联免疫斑点测试(Elispot)是另外一种检测细胞免疫的方法,可以反映分泌特异性干扰素(IFN-γ)的效应性T细胞数量。
核磁共振(MRI)和各种类型的CT等影像学方法也逐渐应用于结核动物实验,这不仅可以量化病变的体积大小与病灶的数量,还可以更客观、更直观地动态观察病变进展,有别于传统的检测方法。但这些仪器只是在少数实验室中被使用,暂时难以普及。
另外,生存时间、死亡率等也都可以作为评价的指标。
总之,结核性病变是复杂的。血管周围炎、细/小支气管周围炎、结核性肺炎、间质性肺炎都是实验性肺结核的表现形式。全面认识实验性肺结核的病变形态,并认识到结核病变的多样性,对结核动物模型的构建、抗结核药物与疫苗的研发,以及临床诊断结核病有着非常重要的意义。
利益冲突所有作者均声明不存在利益冲突
作者贡献包容:负责课题设计,查阅文献,撰写论文;高建峰:负责文章修改与润色;饶艳:负责文章修改,审核,并最后定稿
