不同生长型沉水植物配置对生物量积累和水质净化效果的影响*
2022-09-05李宇辉杨予静彭秋桐李中强
胡 傲,李宇辉,2,杨予静,彭秋桐,李中强
(1:湖北大学资源环境学院区域开发与环境响应湖北省重点实验室,武汉 430062) (2:三峡生态环境投资有限公司,宜昌 443004)
生态系统的稳定性、生产力、养分循环等多个功能和过程受物种多样性及其组成控制[1]. 在水生态系统中,有关水生植物多样性与生态系统功能的早期研究发现较高的物种多样性能维持较高生产力和显著降低水体磷的浓度[2];生物净增量越大,对水体中的氮磷物质直接吸收和净化增效作用越明显,对营养物质的去除率越高[3-4]. 但最近关于不同多样性沉水植物组合对生物量累积和水质影响的研究发现,沉水植物多样性对生物量的累积和水质净化能力无显著影响[5-7]. 这些研究表明水生植物多样性和水生态系统的生产力与水质净化等主要功能间的关系尚不清楚,亟需进一步研究. 除了不同生活型外,水生植物可划分为不同生长型[8]. 植物的生长型是根据植物的形态、外貌和结构划分的生态类群,是对植物的生长条件以及遗传背景的综合反映[9],可以在一定程度上反映沉水植物在不同生态位上的适应策略. 由于水中可溶性营养物质分布相对均匀,不同生长型的植物可能更倾向于对生存空间、光照[5,8,10]等资源的竞争;如冠层型的穗状狐尾藻(Myriophyllumspicatum)在水面形成密集的冠层[11],而莲座型苦草(Vallisnerianatans)喜弱光[12],二者分别占据水表层和中下层空间生态位. 另一些研究表明环境因子如基质营养能显著影响苦草和黑藻(Hydrillaverticillata)的竞争能力[13]. 这些研究表明环境因子会影响不同生长型沉水植物种间的竞争,进而影响其在群落中的优势度及群落的结构和功能. 然而,关于不同生长型水生植物组合与水生植物群落生产力等功能关系的研究极少. 因此,未来应加强不同生活型、不同生长型水生植物组合与水生态系统主要生态功能间的关系研究.
淡水生态系统特别是浅水湖泊是世界上受威胁最为严重的生态系统[5,14],由于人类活动和全球变化的影响,淡水生态系统的生物多样性危机正持续加深[15],导致其生物多样性减少、水质恶化、水生植物退化或消失,湖泊从清水态转变为浊水态,极大地影响了生态系统服务功能[5,16]. 修复退化的湿地生态系统已成为世界各国所普遍面临的严重现实问题. 水生植物在淡水生态系统中发挥着创造生境、维持生物多样性和清水稳态等重要作用[16-17]. 目前,国内外开展的大部分水生态系统修复工程中均以构建稳定的水生植物群落作为一项关键的实施内容,但这些修复工程往往以经验为依据[18-20]. 在已发表的有关生态修复的文献中,近50%的文献显示其生态修复仅用到一个种[19]. 然而,自然稳定的水生植物群落中往往由多种生长型和生活型的水生植物所构成. 因此,以往的恢复实践显然忽视了水生植物多样性特别是不同生活型、生长型及功能群水生植物组合在水生生态系统恢复中的重要作用. 由此,本研究以我国水生态修复常用的3种不同生长型的沉水植物为研究对象,研究不同生长型沉水植物组合在不同实验阶段对系统生物量的累积和氮磷等营养物质去除率随时间变化的影响,以期为我国受损水生生态系统修复提供科学依据.
1 材料与方法
1.1 实验材料与实验设计
本研究选择我国在水生态修复常用的3种不同生长型的沉水植物,莲座型的苦草[8]、直立型的黑藻[8,21-22]和冠层型的穗状狐尾藻[8]为实验材料,实验材料均采自湖北梁子湖. 实验开始前,3种植物材料在室温条件下预培养1周;栽培时,在预培养的材料中选取健康的植株,其中苦草为完整植株,黑藻和穗状狐尾藻为植株的顶端部分,苦草、黑藻、穗状狐尾藻的长度分别为(15±2)、(20±2)、(25±2)cm,种植前去除3种植株的侧枝或匍匐茎.
实验在湖北大学资源环境学院实验平台进行(室温(29±5)℃,6:00-18:00光照强度10000 lx,光暗比为12 h∶12 h),时间为2019年8月1日-2019年11月30日. 实验系统由24个直径为40 cm、高为63 cm的塑料桶组成,桶内水深设置为50 cm. 实验用水采自武汉市沙湖(30°34′39″N,114°20′28″E)上层水,经过静置沉降后使用25#浮游生物网(孔径0.064 mm)过滤去除水中漂浮物和藻类. 实验采用24个底部直径为18 cm、高为12 cm的塑料盆作为水生植物栽植容器,塑料盆中装有8 cm厚的细沙;细沙使用前先经过自来水反复淘洗直至出水清澈后用0.2 mol/L的稀盐酸浸泡24 h,去除其中可溶性氮磷等营养物质,最后用蒸馏水冲洗3次并混匀后随机装入塑料盆中,装有细沙的塑料盆用绳子悬系以便后期采样.
实验共设置8个处理,包括苦草、黑藻、穗状狐尾藻、苦草+黑藻、苦草+穗状狐尾藻、黑藻+穗状狐尾藻及苦草+黑藻+穗状狐尾藻7种植物配置方式和无植物对照组,每种处理设置3个重复. 7种植物配置方式的种植密度均为6株(种植间距4~5 cm),即1种生长型6株、2种生长型各3株、3种生长型各2株. 实验开始时,将预培养的植株用纯水洗净至根部无泥沙后进行种植,植物配置按照实验设置随机栽植于底部的塑料盆中. 21个种植植物的塑料盆和3个未种植植物的塑料盆随后分别以随机的顺序缓慢放入24个塑料桶中. 实验过程中,每两天补充纯水使桶内水深保持在50 cm.
1.2 数据获取与测定
实验开始时用纸巾轻轻包裹至植株不滴水且无明显水珠,测定并记录每个植株的初始鲜重和株高. 在塑料盆放入塑料桶前取水样测定pH值、溶解氧(DO)含量、总氮(TN)、总磷(TP)和氨氮(NH3-N)浓度作为初始值. 其中pH值和DO使用多功能水质检测仪(YSI 6600V2)测定,TN、TP和NH3-N浓度分别采用碱性过硫酸钾分光光度法(HJ 636-2012)、钼酸铵分光光度法(GB 11893-1989)和纳氏试剂分光光度法(HJ 535-2009)测定. 实验用水为武汉市沙湖水,属于国家地表中的Ⅴ类水,总氮、总磷、氨氮的初始浓度分别为1.585、0.256、1.064 mg/L. 在实验开始第30、60、90、120天时分别采集实验系统中水样并测量上述水质指标,同时测定各植物母株和分株株高. 在120天采样时,除测量所有母株和分株的长度外,同时称量包括根、茎、叶部分的生物量.
实验系统中水生植物生物量测定采用株高模拟法[23]进行拟合估算,每种植物总株高为母株株高和所有分株株高的总和. 每种植物的株高与生物量数据的拟合线性关系为:
苦草:y=0.157x-1.072 (R2=0.768,P=0.002)
(1)
黑藻:y=0.057x-0.390 (R2=0.833,P=0.001)
(2)
穗状狐尾藻:y=0.063x+0.116 (R2=0.869,P=0.001)
(3)
式中,x为各种植物的单株株高,cm;y为对应植物的单株生物量,g.
水生植物生物量累积量=各时间的水生植物总生物量-起始生物量
(4)
水体TN、TP和NH3-N的去除率根据以下公式计算:
(5)
式中,yi代表TN、TP和NH3-N的去除率,C0为实验开始时各处理组TN、TP和NH3-N的初始浓度,Ct为时间t时各处理组的TN、TP和NH3-N浓度.
1.3 数据处理
数据使用前经过正态性检验(Kolmogorov-Smirnov)和方差齐性检验,数据经过cos转换之后均满足分布正态性和方差齐性(P>0.05). 采用重复测量方差分析检验不同生长型组合、采样时间以及二者交互作用对实验系统水生植物的生物量累积量、DO变化值、pH变化值及TN、TP和NH3-N去除率的影响. 生长型组合分别为1种生长型单种、2种生长型混种和3种生长型混种,采用方差分析检验同一取样时间下不同生长型组合对生物量累积量、pH值、DO浓度及TN、TP和NH3-N去除率的影响,采用Duncan检验进行多重比较(P<0.05). 采用Pearson相关性分析实验系统中水生植物总生物量、pH值、DO、TN、TP和NH3-N浓度之间的关系,数据分析采用不同实验阶段所测的所有数据. 分别使用SPSS 20和Origin 9.0软件进行数据分析和绘图.
2 结果
2.1 不同生长型组合实验系统间水生植物生物量累积量及水质比较
重复测量方差分析结果显示,生长型组合显著影响系统中水生植物生物量累积量、水中pH值、DO浓度以及TN、TP和NH3-N去除率;实验系统中的生物量累积量、水中pH值、DO浓度及TN、TP和NH3-N去除率均随实验时间发生显著变化. 除生物量累积量和TP去除率外,实验处理与时间二者交互作用均显著影响实验系统中pH值、DO浓度、TN去除率和NH3-N去除率(表1).

表1 重复测量方差分析检验生长型组合、采样时间及二者交互作用对实验系统水生植物生物量累积量、 pH变化值、DO变化值及TN、TP和NH3-N去除率的影响
ns:P>0.05.
实验结束时,不同生长型组合处理间生物量累积量差异显著,呈现出生长型越多的实验处理其生物量累积量越少的趋势(图1a);除TN去除率外,各生长型组合实验系统中的pH值、DO浓度及TP和NH3-N去除率差异均不显著. 但种植水生植物系统中实验系统中的pH值、DO浓度及TP和NH3-N去除率均显著高于未种植水生植物的实验系统(图1b,c,e,f). 就TN去除率而言,1种生长型实验系统TN去除率显著高于3种生长型混种的实验处理,且1种生长型和2种生长型混种的实验系统TN去除率显著高于对照组(图1d).

图1 不同生长型组合系统间水生植物生物量累积量(a)、水体pH值(b)、DO浓度(c)以及 TN(d)、TP(e)和NH3-N去除率(f)间的比较(横坐标C:无植物对照组; 1:1种生长型;2:2种生长型混种;3:3种生长型混种)(平均值±标准误)Fig.1 Comparison of aquatic macrophyte biomassaccumulation (a), pH (b), DO concentration (c), removal rate of TN (d), removal rate of TP (e) and removal rate of NH3-N (f) among different growth form submerged macrophyte assemblage systems (C: control, 1: one growth form, 2: two growth forms, and 3: three growth forms) (mean±SE)
2.2 不同生长型组合实验系统间水生植物生物量及水质参数随时间的变化规律
不同生长型组合实验处理中的水生植物生物量累积量随时间总体均呈现增加趋势,在实验早期,不同生长型组合的实验系统间植物生物量差异不显著;实验中后期,特别是实验后期1种生长型组合系统中的生物量显著高于2种和3种生长型混种实验系统,且有3种生长型混种的系统生物量最低(图2a).
实验期间,各不同生长型组合处理系统中pH值总体上均呈现随实验时间增加而逐渐升高的趋势,系统间pH值差异不显著(图2b,2c);实验结束时,种植植物实验系统中的pH值显著高于对照租(图2b). 各实验系统中DO浓度与pH值变化格局大致相似,整个实验阶段,种植植物实验系统中的DO浓度均显著高于对照组(图2c),从不同生长型组合处理来看,实验早中期1种生长型组合系统中DO浓度显著高于3种生长型混种实验系统,但实验后期不同生长型组合实验系统间DO浓度无显著差异. 就TN、TP和NH3-N浓度而言,各生长型组合系统中三者浓度总体随实验时间呈下降趋势,在实验中后期TP和NH3-N浓度在种植有植物的系统显著低于未种植植物的实验系统(图2e,2f),而TN浓度仅1种生长型在实验中后期显著低于对照实验系统(图2d). 从不同实验期间看,不同生长型组合系统间TP和NH3-N浓度在实验中后期无显著差异(图2e,2f),二者浓度仅在实验前期或前中期1种生长型的系统显著低于3种生长型混种的实验系统. 而TN浓度在实验早期各生长型组合处理间差异不显著,仅实验中后期1种生长型系统中TN浓度显著低于3种生长型混种实验系统(图2d).
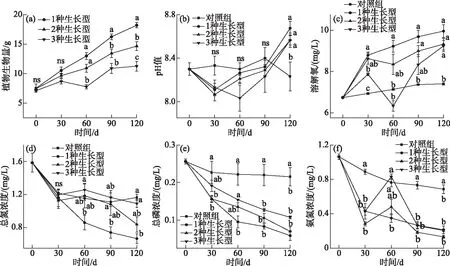
图2 不同采样阶段各实验处理系统间水生植物生物量(a)、pH值(b)以及DO(c)、 TN(d)、TP(e)和NH3-N(f)浓度的比较(平均值±标准误)Fig.2 Comparison of aquatic plant biomass (a), pH (b) and concentrations of DO (c), TN (d), TP (e) and NH3-N(f) between systems in experimental treatment system during different sampling stages (mean±SE)
2.3 不同生长型组合实验系统中生物量、pH值以及DO、TN、TP和NH3-N浓度之间的关系
Pearson相关分析显示,系统水体中pH、DO浓度与系统中生物量呈极显著正相关,TN、TP和NH3-N浓度与实验系统中生物量、pH及DO浓度均呈极显著负相关(表2).
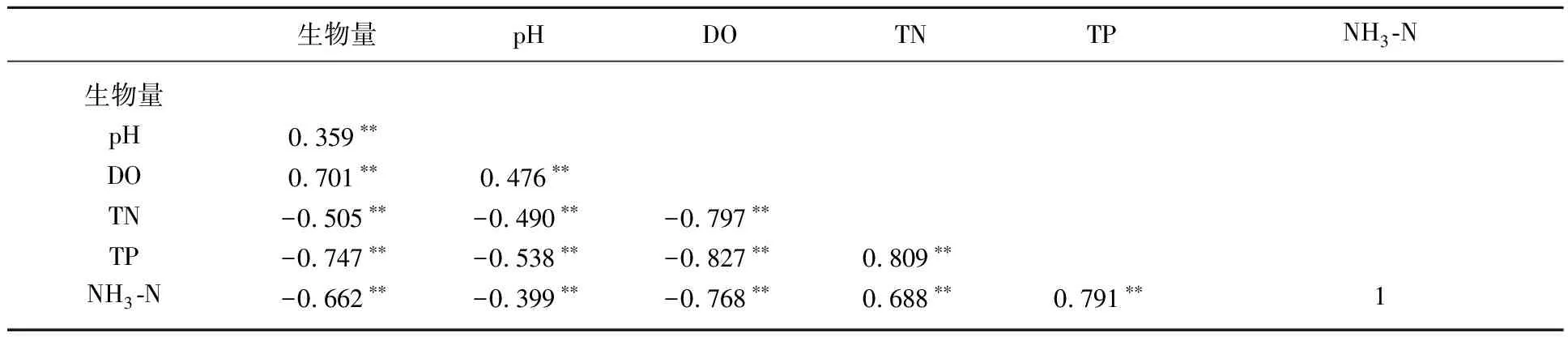
表2 实验系统中总生物量、pH以及DO、TN、TP和NH3-N浓度的Pearson相关性系数
3 讨论
大量研究证明植物物种多样性可以显著影响各种生态系统功能,如增加群落生产力、改善群落环境和维持群落生态系统稳定性[1,6,24-26]. 与大多数陆生生态系统中生产力与物种多样性呈正相关关系的规律相反[27-29],本研究发现在生长型较多的系统中水生植物群落生产力较低. 造成这种关系的主要原因可能是两个系统间光、水、矿质营养资源水平不同(different resource-partitioning levels)及两个系统的不同植物功能群间互补效应不同[5]. 以往的研究认为,生态位互补效应可以提高生物对资源在数量和速率上的利用程度,而种间的功能属性差异造成的功能互补是其关键基础[30]. 在陆生生态系统中,特别是草地,可划分为禾草、非禾草和豆科植物等不同的功能群. 同一功能群内物种的生理形态、生活史和资源利用方式相同或相似,不同功能群的物种生态位互补效应明显[31];而在水生生态系统中,由于环境的相对同质性,沉水植物的生理形态和资源利用方式相似,弱化了生活型相同的不同功能群物种间的补偿作用[5];同时最近对水生植物功能群与生态系统功能的研究表明,生态互补效应在水生生态系统中可能并不显著,且水生植物功能分散度指数与水生植物群落生产力呈现显著的负相关关系[32-33],群落优势种的性状对群落生产力起主要控制作用[32]. 有趣的是,不同于水生植物物种多样性对群落生物量积累影响不大的相关研究结果[5-7],本研究发现生长型较少的实验组合更有利于系统中生物量的累积,其可能的原因是3个受试物种种间竞争比种内竞争更加剧烈. 虽然本研究中受试物种生活型均为沉水植物,但由于生长型区别明显而占据着水环境中不同的空间生态位. 本实验条件下可溶性营养物质在水体中分布相对均匀,3种沉水水生植物在生长过程中对资源竞争可能主要集中于生长空间和有效光合辐射[34]. 已有研究发现,穗状狐尾藻的种植密度影响幼苗期和成株苦草对光的利用,进而显著影响了苦草的竞争能力[35];随着水深的增加和光强的衰减,黑藻的株高和节间距增加,茎节数和分枝数减少[36]. 在实验结束时,3种生长型的系统中穗状狐尾藻、黑藻和苦草的平均高度分别为(47.17±3.17) 、(29.30±0.96) 和(15.50±2.48) cm,在系统中的空间分布差异明显;而单独黑藻和苦草的平均高度分别为(54.63±4.72) 和(25.73±1.50) cm,显著高于3种生长型组合种植系统中黑藻和苦草株高. 由此可判断本实验中冠层型的穗状狐尾藻和直立型的黑藻可能会影响莲座型苦草的有效光合辐射及生长空间,而黑藻同时与苦草、穗状狐尾藻竞争下层和上层的生长空间[24,34],这些由于在系统中所占据不同空间而导致光照等资源的分布差异可能使得这3个物种种间竞争远较种内竞争更加剧烈.
水生植物能显著影响水生生态系统中水体的理化性质,包括DO和各种矿质元素[37-39]. 与以往研究结果相同,种植水生植物群落的实验系统在不同生长阶段均对水柱中的氮和磷有较强的净化效果[3,40-42]. 该研究发现实验中期不同生长型组合系统中TN、TP和NH3-N浓度存在显著差异,且生长型种类较单一的系统具有更低的TN、TP和NH3-N浓度,这主要与系统中生物量积累有关,在植物生长旺盛时对可溶态氮磷物质的吸收较快[39,41];同时,植物分泌的助凝物质加速悬浮颗粒态的氮磷物质在植物叶片表面的富集[3],也降低了水体中的氮、磷浓度. 而实验后期,不同生长型组合系统中水生植物群落对TN、TP和NH3-N的去除率明显下降,且各生长型组合系统间无显著差异. 产生该结果的主要原因可能有:1)实验后期,水生植物生长相对缓慢而减少了对水柱中的氮、磷吸收和同化;2)生长型组合较复杂的实验系统中水生植物群落形成更丰富的空间层次,为更多的附着藻类和微生物提供多样性的栖息环境[5,43-44],水柱中的氮、磷可能主要被附着藻类吸收和被微生物转化[5,45-46]. 本研究结果发现,单一生长型的沉水植物群落相较于多种生长型的沉水植物群落具有更高的生物量累积量和更强的水质净化效果. 因此建议在受损水生生态系统修复管理过程中,应强化物种的选择和恢复过程的管理;如在生态恢复早期,可以选择适应能力强、生长较快的沉水植物进行单种种植,以尽快积累生物量、改变生境[47]. 在生态恢复过程中,可根据水生植物生长状况适时进行收割,这样既可保证水生植物有相对较长的旺盛生长期,也可通过收割去除水中的N、P等营养物质. 已有研究表明,自然生态系统内不同功能群物种间复杂的相互作用会对生态系统的结构和功能产生显著影响[48-49],水生植物功能群的组成与群落生产力更是有着直接的联系[32-33],合理配置水生植物功能群能够使区域植被群落更加稳定[50]. 因此,在生态恢复后期,需考虑补植不同生长型、生活型及功能群的水生植物,也需增加不同营养级物种,如消费者螺、鱼类等,以丰富生态系统生物多样性,保证生态系统的功能发挥[51].
本研究通过室内受控实验研究了沉水植物不同生长型组合对系统群落生产力和水质的影响,但受控实验条件与野外自然条件差异巨大,后期应加强不同生长型沉水植物组合的原位实验研究,以期为受损湿地生态系统修复提供科学依据.
4 结论
通过苦草、黑藻和穗状狐尾藻3种不同生长型的组合研究发现: 1)对于沉水植物而言,单一生长型的水生植物群落比多个生长型的水生植物群落具有更高的群落生产力;2)在生长较为旺盛的时期,单一生长型的水生植物群落比多个生长型的水生植物群落对系统水体中TN、TP和NH3-N的去除率更高. 同时,建议在水生态系统修复的不同阶段,分阶段考虑不同生活型、生长型、植物功能群及营养级物种对生态系统结构和功能的影响.
