基于生物信息学的肝内胆管癌差异表达基因谱中关键基因的筛选及分析
2022-09-05陈伟毅陈立军
陈伟毅,陈立军
(湖南医药学院医学院,湖南怀化418000)
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是指起源于肝内胆管上皮的一种恶性肿瘤。ICC 约占肝脏原发恶性肿瘤的10%~15%,是发病率仅次于肝细胞肝癌的肝脏原发恶性肿瘤[1]。ICC 早期往往无典型临床症状,大多数患者确诊时往往已失去了手术的机会,而未行手术治疗者,预后极差[2]。因此对ICC 的早期诊断对于改善患者的预后具有重要意义。
目前临床上诊断ICC 所使用的肿瘤标记物特异度及敏感度欠缺,诊断价值很低[3],寻找新的具有临床诊断价值的潜在生物标志物对提高ICC 患者的早期诊断率具有重要作用。
随着生物学技术的发展,二代测序技术已广泛应用于探索肿瘤新的生物标志物和治疗靶点[4]。现今研究[5]表明,基因组的不稳定性以及变异性可能会对ICC 的发生和发展产生影响。本研究通过生物信息学方法筛选ICC 的关键调控基因,评估关键调控基因对ICC 的预测能力,为诊断和治疗ICC 患者提供新的思路,为深入认识ICC 疾病提供新的方法。
1 材料与方法
1.1 原始数据下载
从公共数据库GEO 中下载2个ICC 转录组数据集,编号分别为GSE107943 和GSE119336。数据集信息、检测平台以及样本分类等信息具体见表1。

表1 ICC转录组数据信息和样本分类Table 1 ICC transcriptome data information and sample classification
1.2 方法
1.2.1 转录组数据预处理过程 GSE107943 数据集预处理过程:⑴使用MAP-R Seq 管道进行分析RNA 测序样本。⑵采用bowtie1 软件进行选项比对,双端读段由TopHatv2 对比人类参考基因组hg19后构建。⑶使用FeatureCounts 软件量化基因表达,每个样本的映射读段与ENSEMBL 的GRCh37.75 RNA 特征参考基因定义文件对齐,然后量化。⑷将与每个RNA 特征对齐的原始读取数标准化为RPKM值。GSE119336 数据集预处理过程:⑴测序读段被修剪为适配器序列,屏蔽低复杂性或低质量序列。⑵使用TopHat (v2.0.10) 将序列与人类参考基因组(hg19 版本)和RefSeq 注释基因进行比对,发现转录本剪接位点。⑶根据TopHat 生成的基因图谱,使用Cufflinks (v2.1.1) 评估基因表达水平。⑷将每个基因的表达水平标准化为FPKM 值,以便于样本之间的转录水平比较。
1.2.2 差异表达基因筛选 转录组数据预处理后,采用R 语言的edgeR 包对ICC 组织和正常组织进行差异表达基因筛选,设置校正P<0.01 且|log2FC|≥2为阈值条件。
1.2.3 差异表达基因的GO 和KEGG 富集分析 使用R 语言 的clusterProfiler、org.Hs.eg.db程序包对差异表达基因进行GO 功能(包括生物学过程BP、细胞组分CC、分子功能MF)和KEGG 通路富集分析,并将TOP5 的显著富集结果以气泡图展示。
1.2.4 差异表达基因的蛋白质-蛋白质相互作用网络(Protein-Protein Interaction,PPI)Networks 构建与关键模块挖掘 采用STRING 数据库(https://www.string-db.org)对差异表达基因进行PPI 网络分析,设置combined score>0.9 为阈值条件,然后使用Cytoscape 软件对其进行可视化。采用Cytoscape 软件中的MCODE 插件对PPI 网络中的关键子网络进行辨别,并从中挖掘出关键调控基因,设置参数为:Degree Cutoff=2,Node Score Cutoff=0.2,Max. Depth=100,K-Core=2。
1.2.5 关键调控基因的表达分析与验证 通过SPSS26.0 分析关键调控基因在ICC 组织和正常组织中的表达,分析方法采用独立样本t检验,采用UALCAN、GEPIA 数据库对基因表达进行验证。
1.2.6 关键调控基因的泛癌表达分析 在UCSC XENA 数据库(https://xenabrowser.net/datapages)下载经统一处理的TCGA 和GTEx 的RNAseq 数据,使用R 语言的ggplot2 包对关键调控基因进行泛癌表达分析。
1.2.7 关键调控基因在ICC 中的共表达基因分析、PPI 网络分析、富集分析 在TCGA 数据库(https://portal.gdc.cancer.gov)下载胆管癌RNAseq 数据,使用R 语言的stat 包分析编码基因与关键调控基因的相关系数,选取相关系数TOP10 的编码基因进行可视化。采用STRING 数据库对相关系数TOP10 的编码基因和关键调控基因进行PPI 网络分析,利用Metasacape 网 站(http://metascape.org)进行富集分析。
1.2.8 关键调控基因的表达与肿瘤分期、分级、淋巴转移、预后关系的分析 利用UALCAN 数据库分析关键调控基因与肿瘤分期、分级、淋巴转移的相关性。利用GEPIA 数据库分析关键调控基因与患者预后的相关性。
1.2.9 关键调控基因表达对ICC 免疫细胞浸润的影响分析 在TCGA 数据库下载胆管癌RNAseq 数据,使用R 语言GSVA 包计算免疫浸润相关性及显著性。
1.2.10 绘制ROC 曲线评价关键调控基因对ICC 的诊断能力 使用Graphpad 8.0 软件绘制受试者工作特征曲线(ROC 曲线)。ROC 曲线下面积(AUC)越接近于1.0,其诊断效果越好。
1.2.11 细胞及培养 人肝内胆管上皮细胞(HIBEC)购于北京北纳创联生物技术研究院,人肝内胆管癌细胞(RBE)购于中科院上海细胞库,两种细胞株均采用含10% 的胎牛血清的RPMI 1640,培养于37 ℃、5% CO2孵箱中,每48 h 进行消化传代。
1.2.12 RT-qPCR 检测mRNA 表达 采用TRIzol 法(美国Invitrogen 公司)提取细胞总RNA,用分光光度计检测RNA 浓度,用逆转录试剂盒(日本TaKaRa 公 司) 将RNA逆转录成cDNA,然 后 用SYBR Green 法(美国Thermo Fisher 公司)进行实时荧光定量PCR,以GAPDH 为内参,采用2-ΔΔCt法计算目的基因的相对表达量。Polo 样激酶1 (Pololike Kinase, PLK1)上游引物:5'-GCT GGG CAA CCT TTT CCT G-3',下游引物:5'-CCA GTG GGA TCT GTC TGA AGC-3';羟基酸氧化酶(hydroxyacid oxidase 2,HAO2)上游引物:5'-TGA CAG ACT TTC AGG CCC AT-3',下游引物:5'-CAC TGA TCT CCT CCC CTT GG-3';纤维胶凝蛋白(ficolin-2,FCN2)上游引物:5'-CTG CCA TGT GT CAA ACC TGA A-3',下游引物:5'-TTC CCC GAC TTC CAG TTG ATG-3';GAPDH 上游引物:5'-GAG TCA ACG GAT TTG GTC GT-3',下游引物:5'-GAC AAG CTT CCC GTT CTC AG-3'。
1.2.13 Western blot 检测蛋白表达 提取细胞蛋白,采用BCA 法测量蛋白浓度,每组取60 g 蛋白样品进行电泳,之后将蛋白转移到PDVF 膜上,5%脱脂奶粉封闭后加入一抗4 ℃孵育过夜,再加入二抗孵育2 h,曝光显影,以GAPDH 为内参计算蛋白相对表达量。PLK1、HAO2、FCN2、GAPDH 抗体均购自美国Abcam 公司。
2 结 果
2.1 ICC差异表达基因分析结果
采用R 语言的edgeR 包对两个转录组数据进行分析,设置校正P<0.01 且|log2FC|≥2 为阈值条件。GSE107943 数据集中共筛选出2 242个(3.88%)差异表达基因,其中上调基因1 320个,下调基因922个(图1A)。GSE119336 数据集中共筛选出1 663个(6.50%) 差异表达基因,其中上调基因904个,下调基因759个(图1B)。两个数据集共同的差异表达基因为1 123个(图1C),其中有567个基因为共同上调基因(图1D),527个基因为共同下调基因(图1E)。表2 罗列了2个数据集中差异表达最大的5个共同上调和共同下调基因。共同上调和共同下调的基因共1 094个。在ICC 的发生机制中这1 094个差异表达基因可能起着非常重要的作用,故后续分析都根据此。
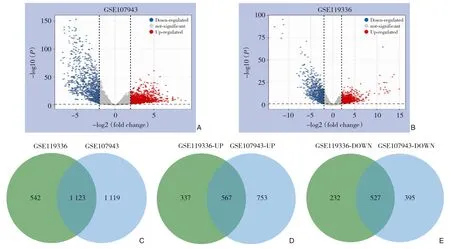
图1 ICC差异表达基因的分析结果 A:GSE107943差异表达基因火山图;B:GSE119336差异表达基因火山图;C:两个数据集共同差异表达基因Venn图;D:两个数据集共同上调基因Venn图;E:两个数据集共同下调基因Venn图Figure 1 Results of analysis of differentially expressed genes in ICC A: Volcano map of GSE107943; B: Volcano map of GSE119336; C: Venn diagram of differentially expressed genes both in GSE107943 and GSE119336; D: Venn diagram of up-regulated differentially expressed genes;E:Venn diagram of down-regulated differentially expressed genes
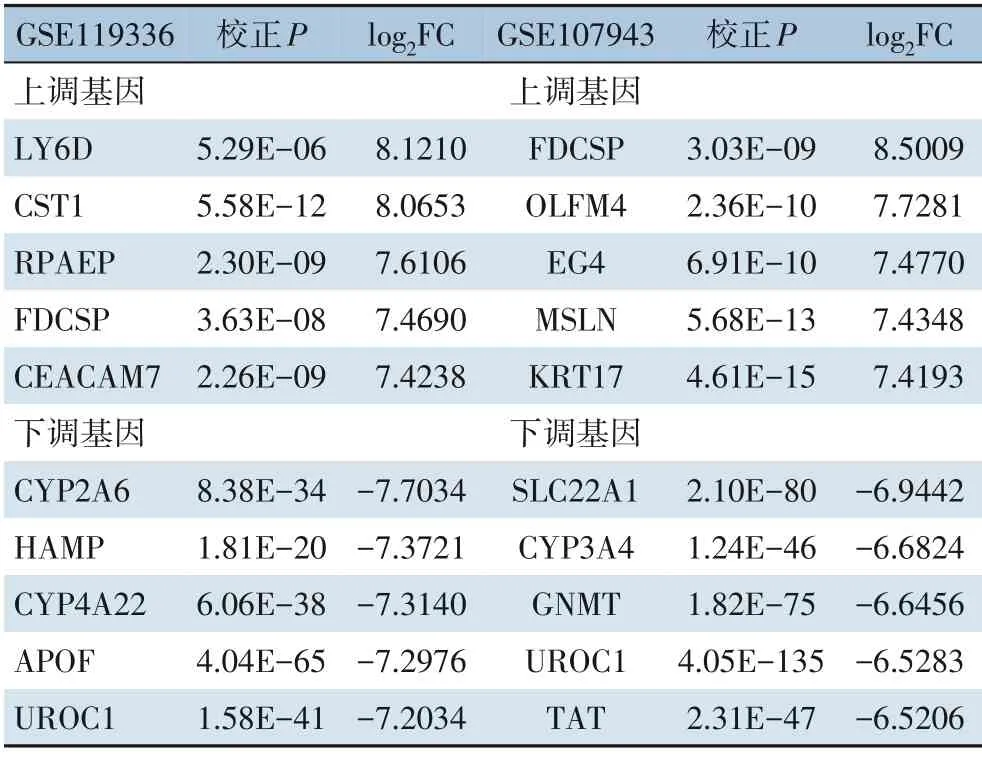
表2 两个数据集中差异表达最大的5个共同上调和下调基因Table 2 The five co-up-regulated and co-down-regulated genes
2.2 ICC差异表达基因功能和通路富集分析
对1 094个差异表达基因进行GO 富集分析结果显示:1 094个共同差异表达基因主要参与BP 的小分子分解代谢、有机酸生物合成、羧酸生物合成、羧酸分解代谢、有机酸分解代谢等过程(图2A);CC 主要与含胶原的细胞外基质、细胞顶端、内质网内腔、顶端质膜、血液微粒等有关(图2B);MF 主要与酶结合、硫化合物结合、羧酸结合、维生素结合、单加氧酶活性等有关(图2C)。KEGG通路分析发现,1 094个共同差异表达基因主要参与碳代谢、补体与凝血级联、氨基酸生物合成、缬氨酸、亮氨酸和异亮氨酸降解、甘氨酸、丝氨酸和苏氨酸代谢等(图2D)。

图2 ICC共同差异表达基因的功能和通路富集 A:共同差异表达基因的GO—BP富集;B:共同差异表达基因的GO—CC富集;C:共同差异表达基因的GO—MF富集;D:共同差异表达基因的KEGG通路富集Figure 2 GO and KEGG enrichment of common differentially expressed genes in ICC A: GO—BP enrichment; B: GO—CC enrichment;C:GO—MF enrichment;D:GO—BP enrichment
2.3 ICC 差异表达基因的PPI 网络分析及关键子网络分析
采用STRING 数据库对1 094个共同差异表达基因进行PPI 网络的构建,使用Cytoscape 进行可视化,该PPI 网络共有451个节点和1288 条边(图3)。使用MCODE 插件一共筛选出17个关键子网络,取得分最高的前3个子网络进行分析(表3)(图4),从中挖掘出3个关键调控基因PLK1、HAO2、FCN2(表4)。

图3 ICC差异表达基因的PPI网络Figure 3 PPI network of the differentially expressed genes in ICC

表3 得分前三的子网络模块信息Table 3 Information of the top 3 sub-network modules
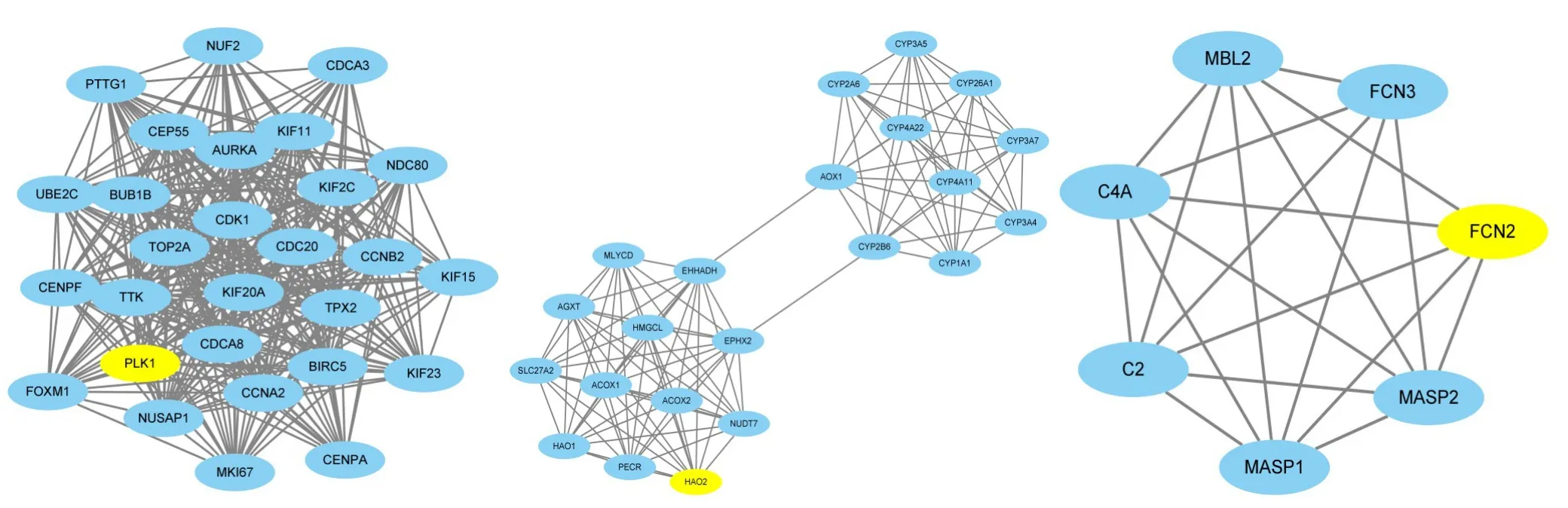
图4 ICC差异表达基因PPI网络中3个关键子网络Figure 4 Three key subnetworks in ICC differential expression gene PPI network

表4 关键蛋白调控功能基因节点信息Table 4 Node information of the key genes
2.4 关键调控基因表达分析及验证
采用独立样本t检验比较ICC 组织和正常肝脏组 织 中PLK1、HAO2、FCN2 表达,ICC组织中PLK1 表达明显高于正常组织,HAO2、FCN2 表达明显低于正常组织,差异均有显著性(均P<0.001)(图5A)。结果表明PLK1 在ICC 中呈高表达、HAO2、FCN2 在ICC 中呈低表达。利用UALCAN 中的TCGA 数据库对3个基因在ICC 中的表达进行验证,发现PLK1 在ICC 中高表达,HAO2、FCN2 在ICC 中低表达,与分析结果一致(图5B)。利用GEPIA 数据库对3个基因的表达进行验证,发现PLK1 在ICC 中高表达,HAO2、FCN2 在ICC 中低表达,与分析结果也是一致的(图5C)。
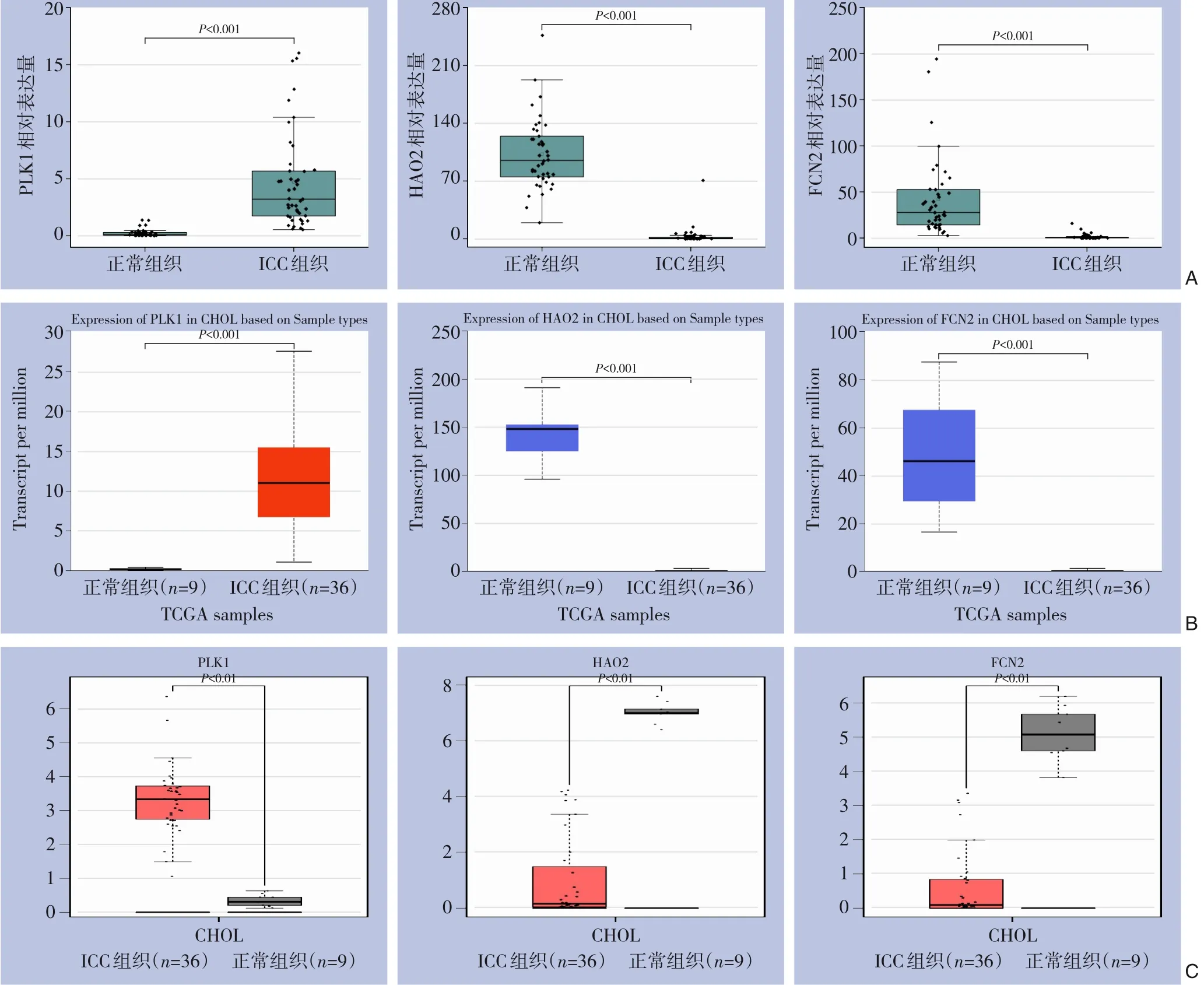
图5 关键调控基因的表达分析及验证 A:PLK1、HAO2、FCN2在ICC组织和正常组织中的表达差异;B:PLK1、HAO2、FCN2在UALCAN数据库中的表达差异;C:PLK1、HAO2、FCN2在GEPIA数据库中的表达差异Figure 5 Expression analysis and validation of the key regulatory genes A: The expression differences of PLK1, HAO2 and FCN2 between ICC and normal tissues; B: The expression differences of PLK1, HAO2 and FCN2 in UALCAN database;C:The expression differences of PLK1,HAO2 and FCN2 in GEPIA database
2.5 关键调控基因在肿瘤中的表达分析
采用UCSC XENA 数据库分析PLK1、HAO2、FCN2 在肿瘤中的表达情况。发现在33 种肿瘤中,PLK1 在28 种肿瘤表达明显增高(图6A),HAO2 在24 种肿瘤表达明显降低(图6B),FCN2 在27 种肿瘤表达明显降低(图6C)。

图6 PLK1、HAO2、FCN2在肿瘤中的表达情况分析 A:PLK1在28/33种肿瘤中表达上调;B:HAO2在24/33种肿瘤中表达下调;C:FCN2在27/33种肿瘤中表达下调Figure 6 Analysis of the expressions of PLK1, HAO2 and FCN2 in tumors A: Up-regulation of PLK1 in 28/33 tumors;B:Down-regulation of HAO2 in 24/33 tumors;C:Down-regulation of FCN2 in 27/33 tumors
2.6 关键调控基因在ICC中的共表达基因分析
采用TCGA 数据库分析关键调控基因在ICC 中的共表达基因,发现PLK1 与CCNA2、GTSE1 等基因共表达相关性最强(图7A),HAO2 与MTTP、CPS1 等基因共表达相关性最强(图7B),FCN2 与FAM99A、 GDF2 等基因共表达相关性最强(图7C)。
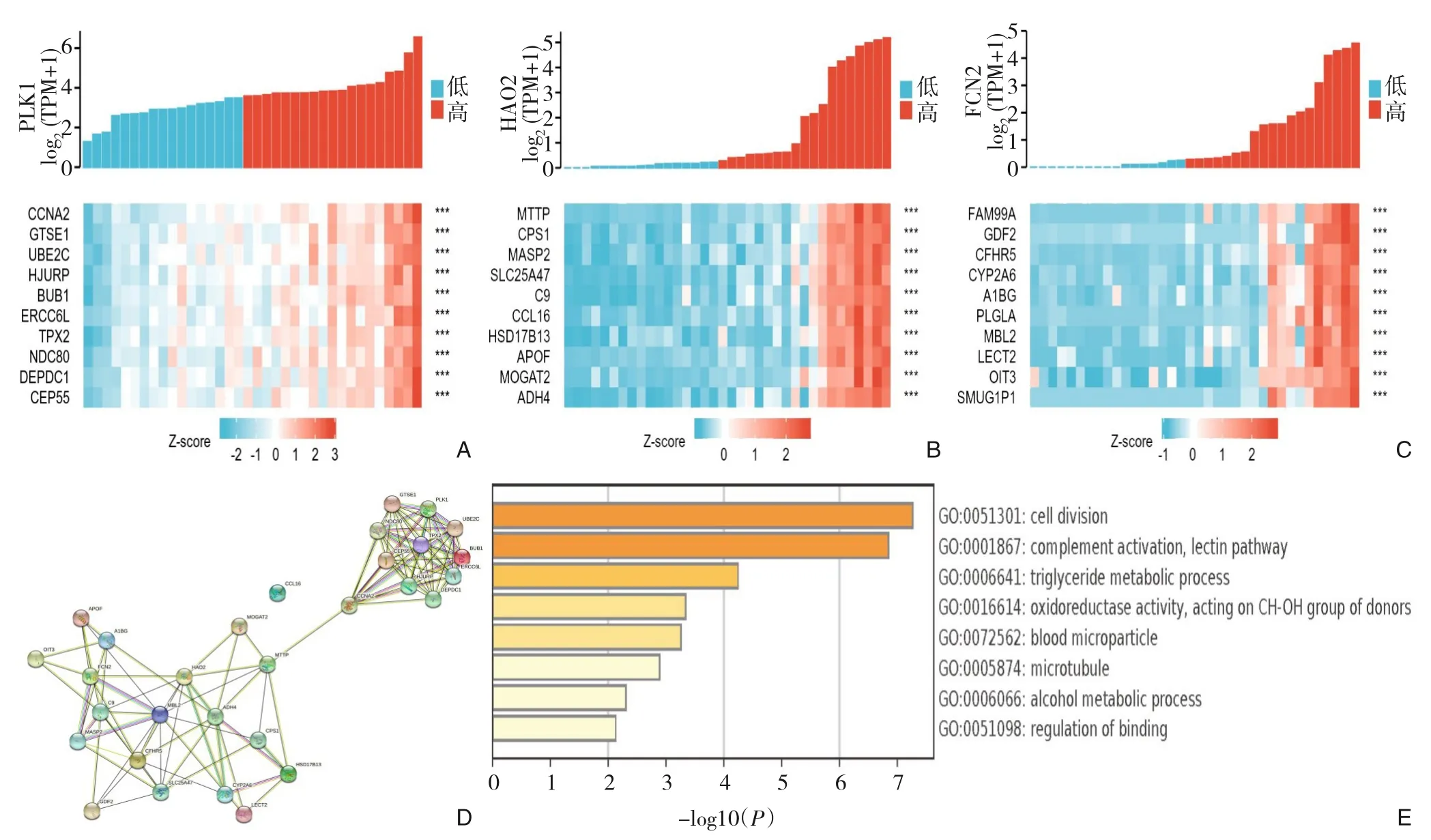
图7 关键调控基因在ICC中的共表达基因分析 A:PLK1共表达基因热图;B:HAO2共表达基因热图;C:FCN2共表达基因热图;D:共表达基因和关键基因的PPI网络;E:共表达基因GO和KEGG富集分析Figure 7 Co-expression gene analysis of the key regulatory genes in ICC A: Heat map of PLK1 co-expressed genes; B: Heat map of HAO2 co-expressed genes; C: Heat map of FCN2 co-expressed genes; D: PPI network of co-expressed genes and key regulatory genes;E:GO and KEGG enrichment of co-expressed genes
利用STRINGS 数据库构建共表达基因和关键基因的PPI 网络,该PPI 网络共有30个节点和110 条边(图7D)。采用Metascape 网站对共表达基因进行富集分析,发现共表达基因主要参与细胞分裂、补体激活、凝集素途径、甘油三酯代谢过程等(图7E)。
2.7 关键调控基因对ICC的发展、预后的影响分析
利用UALCAN 中的TCGA 数据库分析关键调控基因对ICC 发展的影响。结果显示,PLK1、HAO2、FCN2 表达与肿瘤分期、分级、淋巴转移有关,PLK1 表达越高、HAO2、FCN2 表达越低,肿瘤分期越高、分化越差、越易出现淋巴转移(图8A-C)。
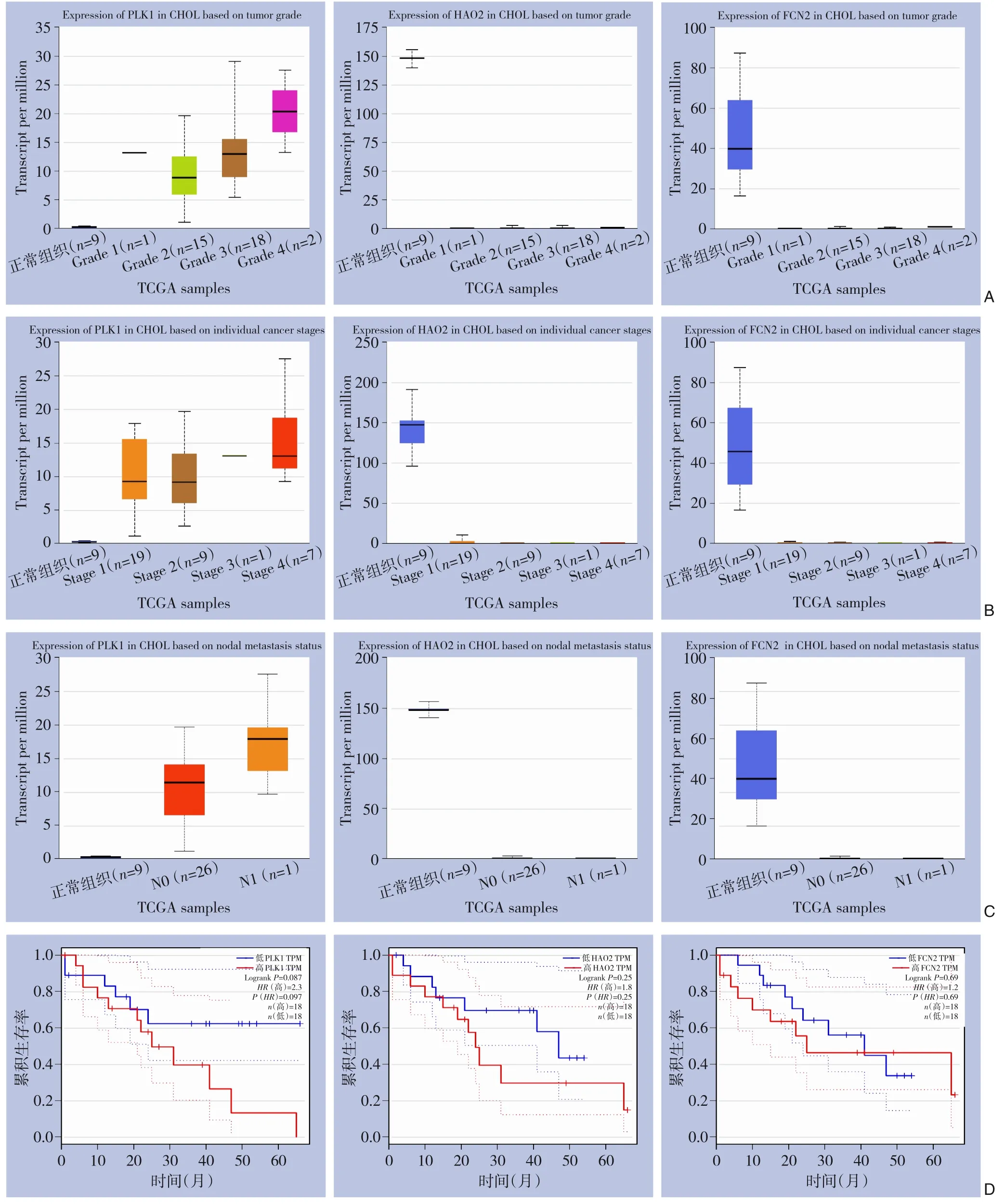
图8 关键调控基因对ICC发展、预后的影响 A:PLK1、HAO2、FCN2对肿瘤分级的影响;B:PLK1、HAO2、FCN2对肿瘤分期的影响;C:PLK1、HAO2、FCN2对肿瘤淋巴转移的影响;D:PLK1、HAO2、FCN2对患者预后的影响Figure 8 Effects of the key regulatory genes on the development and prognosis of ICC A: Effect of PLK1, HAO2, FCN2 on tumor grade; B: Effect of PLK1, HAO2, FCN2 on tumor stages; C: Effect of PLK1, HAO2, FCN2 on tumor nodal metastasis;E:Effect of PLK1,HAO2,FCN2 on prognosis of patients
利用GEPIA 数据库分析关键调控基因对ICC 患者预后的影响。结果显示PLK1、HAO2、FCN2 与ICC 患者总体生存率无相关性(图8D)。
2.8 关键调控基因表达对ICC免疫细胞浸润的影响分析
分析关键调控基因表达与免疫细胞浸润水平的相关性。结果发现PLK1 表达与Th2 细胞浸润正相关性最大,与NK 细胞浸润负相关性最大;HAO2 表达与中性粒细胞浸润正相关性最大,与CD8 T 细胞浸润负相关性最大;FCN2 表达与Tcm浸润正相关性最大,与aDC 浸润负相关性最大(图9A)。
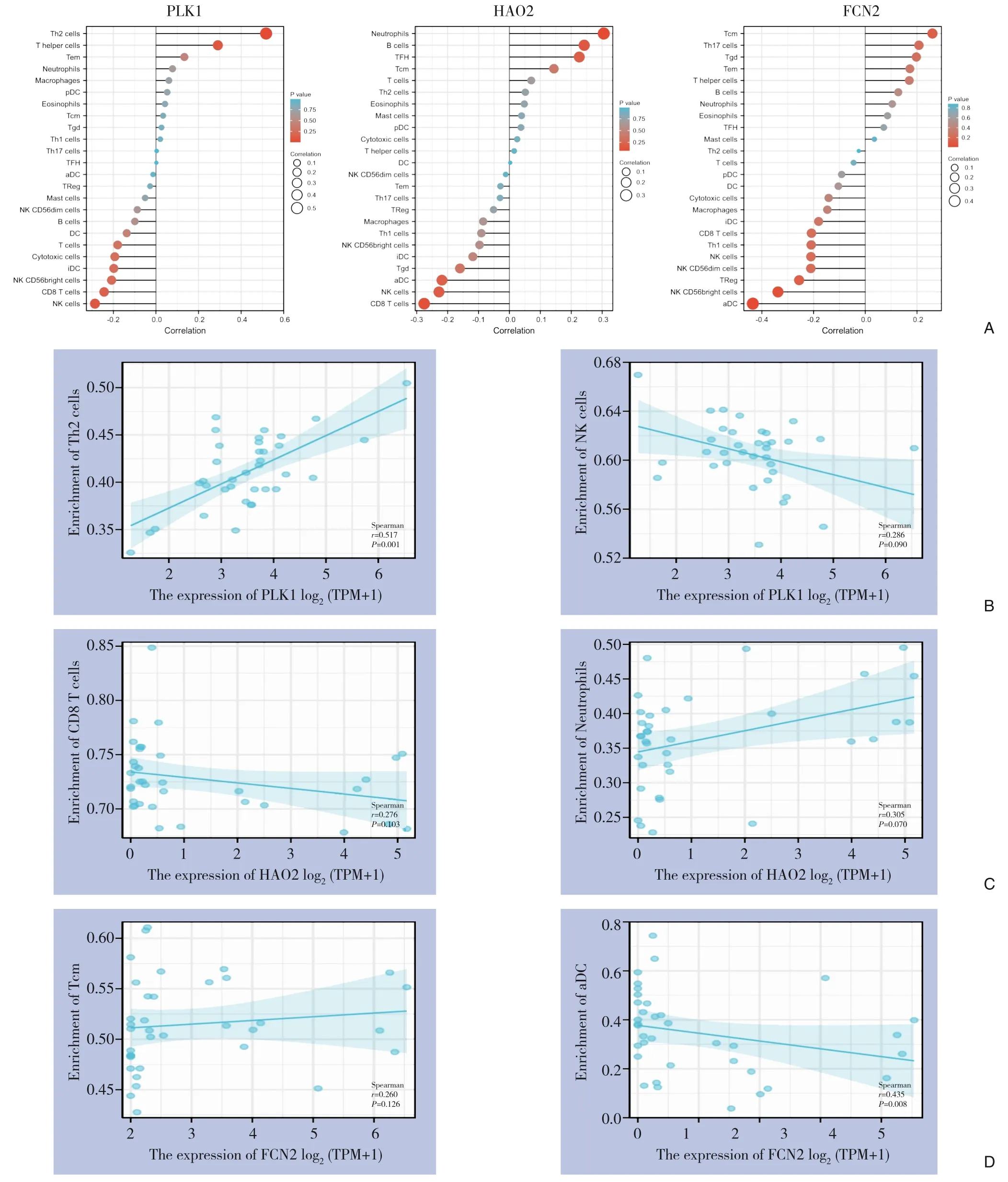
图9 关键调控基因对ICC 免疫浸润水平的影响 A:PLK1、HAO2、FCN2 表达与免疫细胞浸润水平的相关性;B:PLK1表达与Th2细胞、NK细胞浸润相关性;C:HAO2表达与中性粒细胞、CD8 T细胞浸润相关性;D:FCN2表达与Tcm、aDC浸润相关性Figure 9 Effect of key regulatory genes on ICC immune infiltration level A: Correlation between PLK1, HAO2, FCN2 expression and immune cell infiltration level; B: Correlation between PLK1 expression and Th2 cells as well as NK cell infiltration; C: Correlation between HAO2 expression and neutrophils as well as CD8 T cells infiltration; D: Correlation between FCN2 expression and Tcm as well as aDC
进一步分析关键调控基因表达与正、负相关性最大细胞浸润的显著性。结果发现PLK1 表达与Th2 细胞浸润呈显著正相关(r=0.517,P=0.001),PLK1 表达与NK 细胞浸润相关性不显著(P=0.090)(图9B);HAO2 表达与CD8 T 细胞、中性粒细胞浸润相关性均不显著(P=0.103,P=0.070)(图9C);FCN2 表达与Tcm 浸润相关性不显著(P=0.126),FCN2 表达与aDC 浸润呈负相关(r=0.435,P=0.008)(图9D)。
2.9 评估关键调控基因对ICC的诊断能力
绘制ROC 曲线评估关键调控基因诊断ICC 的效果。结果发现PLK1、HAO2、FCN2 3个基因对ICC 的AUC 值均>0.98,表明3个基因对ICC 均有较好的诊断能力,其中HAO2 的AUC 值最大,表明HAO2 诊断能力最 好。PLK1 联 合HAO2 或FCN2 后AUC 值均为1.000,表明PLK1 联合HAO2 或FCN2 对ICC 具有非常好的诊断能力。HAO2 和FCN2 联合应用后AUC 值为0.999 5,诊断能力略微下降。PLK1、HAO2 和FCN2 3个基因联合应用后AUC 值为1.000,表明3个基因联合应用同样具有非常好的诊断能力(图10)。

图10 关键调控基因对ICC的诊断能力分析Figure 10 Diagnostic abilities of the key regulatory genes for ICC
2.10 关键调控基因在肝胆管癌细胞中的表达验证
检测关键调控基因在HIBEC 和RBE mRNA 和蛋白表达差异,结果发现PLK1 mRNA 和蛋白在RBE 中表达显著高于HIBEC (P<0.01,P<0.001),HAO2、FCN2 mRNA 和蛋白在RBE 系中表达显著高低于HIBEC (P<0.01,P<0.001)(图11)。实验结果表明关键调控基因在细胞中表达差异与生物信息学分析结果一致。
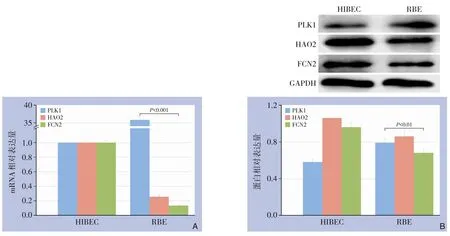
图11 关键调控基因在HIBEC 和RBE 表达差异 A:两种细胞株PLK1、HAO2、FCN2 mRNA 表达差异;B:两种细胞株PLK1、HAO2、FCN2蛋白表达差异Figure 11 Differential expression of key regulatory genes in HIBEC and RBE A: Differential expression of PLK1, HAO2,FCN2 mRNA in two cell lines;B:Differential expression of PLK1,HAO2,FCN2 protein in two cell lines
3 讨 论
ICC 约占肝脏原发恶性肿瘤的10%~15%,近年来发病率呈上升趋势[6]。由于缺乏特异典型的临床表现和敏感可靠的诊断标志物,多数ICC 患者被确诊时已进入晚期,因此急切面临对ICC 分子机制的切实解析与探究[7-8]。本研究首先在GEO 数据库中筛选出ICC 转录组层面的2个高通量数据集GSE107943 和GSE119336,从中筛选出3个关键调控基因PLK1、HAO2、FCN2。对关键调控基因表达进行分析,发现PLK1 在ICC 组织中呈高表达,HAO2、FCN2 在ICC 组织中呈低表达。采用TCGA和GTex 数据库联合分析关键调控基因在泛癌中的表达,发现PLK1 在28 种肿瘤显著高表达,HAO2在24 种肿瘤显著低表达,FCN2 在27 种肿瘤显著呈低表达。通过UALCAN 数据库分析关键调控基因与ICC 肿瘤分级和分期、淋巴转移的相关,发现PLK1 高表达、HAO2、FCN2 低表达提示分化差、分期高、易淋巴转移。分析关键调控基因表达与免疫细胞浸润水平的相关性,发现PLK1 表达与Th2 细胞浸润呈显著正相关,FCN2 表达与aDC 浸润呈显著负相关。绘制ROC 曲线评估PLK1、HAO2、FCN2 对ICC 的诊断效果,发现3个基因对ICC 均有较好的诊断能力。采用细胞实验验证关键调控基因在ICC 中的表达,发现在RBE 中PLK1 表达显著上调,HAO2、FCN2 表达显著下调。
PLK1 是一种高度保守的丝/苏氨酸激酶,其在有丝分裂进程中的重要作用已经被阐明[9]。最近的研究发现,PLK1 有诱导DNA 合成、DNA 完整性的检修以及防止细胞凋亡方面的作用[10]。PLK1 还能通过磷酸化p53 而抑制其转活性,进而抑制p53 发挥检验点蛋白和诱导细胞凋亡的功能[11]。另外,PLK1 与肿瘤的发生发展密切相关,研究发现PLK1在多种人类肿瘤中呈高表达[12]。本研究发现PLK1在ICC 中的表达明显高于正常组织,与上述研究结果一致。同时本研究发现PLK1 高表达与ICC 患者肿瘤分期、分级和淋巴转移、免疫细胞浸润有关,且对ICC 有较好的诊断能力,表明PLK1 有望成为ICC 诊断和治疗的新靶点。
过氧化物酶体普遍存在于真核细胞内,参与多种代谢途径[13]。 羟基酸氧化酶(hydroxyacid oxidase,HAO)是过氧化物酶体中所包含的一类氧化酶,一共有3个亚型,其中HAO2 主要在肝脏和肾脏中表达[14]。研究[15-16]发现HAO2 在肝癌、肾透明细胞癌中表达下降,与患者的不良预后相关。本研究发现HAO2 在ICC 中表达同样下降,且HAO2 低表达提示患者生存较差。HAO2 是催化含羟基的脂肪酸的酶类,直接参与脂肪酸的氧化分解过程,而肿瘤代谢的过程脂肪酸分解减少、合成增加[17]。本研究发现HAO2 在ICC 中低表达,提示ICC 可能通过降低HAO2 表达适应其脂代谢重编程的需要,HAO2 可能是纠正ICC 代谢异常的一个潜在靶点。
FCN2 能够与凝集素相关丝氨酸蛋白酶形成复合体,是少数能激活凝集素补体途径的分子[18-19]。目前FCN2 研究多集中在感染性疾病,研究报道其单核苷酸多态性与肺结核、越南登革热、意大利风湿热、风湿性心脏病等疾病有关[20-23]。关于肿瘤方面只有少量报道,Yang 等[24]发现FCN2 在肝癌组织中呈表达下调,FCN2 低表达与肝癌的侵袭转移相关。本研究发现FCN2 在ICC 组织中同样表达下降,与ICC 患者肿瘤分期、分级和淋巴转移、免疫细胞浸润等相关,提示FCN2 在ICC 中发挥重要作用,可能是ICC 的一个潜在的作用靶点。
免疫细胞在调节肿瘤细胞行为中发挥重要作用,越来越多的证据支持它们在预测许多癌症类型的结果和治疗效果方面的具有重要价值[25]。本研究分析了PLK1、HAO2、FCN2 基因表达与ICC 中各种肿瘤免疫细胞浸润的相关性,发现PLK1 表达与Th2 cells 浸润呈显著正相关,FCN2 表达与aDC浸润呈显著负相关,因此PLK1 和FCN2 可能通过调节肿瘤免疫影响ICC 进展。
本研究筛选出3个对ICC 具有诊断能力的基因,这3个基因在ICC 中均未见报道但在其他肿瘤中均有报道,且报道结果与本研究结果基本一致,表明本研究筛选结果具有较高的可信度。但是本研究也存在着以下不足。第一,该研究是通过生物信息学方法进行的,只进行了细胞实验验证,缺乏临床试验和动物实验验证,因此后续还需临床试验和动物实验来进一步验证。第二,因为ICC自身的发生机制具有异质性,而研究样本数量是有限的,可能要依赖单细胞水平的下一代测序技术迅速发展来解决这一难题[26-27]。第三,由于ICC疾病在发生发展过程中受到多种因素影响[28-30],只通过转录组层面来看的话,具有一定的片面性,本研究尚未把代谢组、基因组、蛋白质组等多组学之间的数据信息进行结合分析,多组学的数据信息是否有相关性还需进一步探讨。
综上所述,本文通过生物信息学方法筛选出ICC 中3个关键调控基因PLK1、HAO2、FCN2,这3个基因对ICC 具有很好的诊断和预测能力,有可能成为ICC 潜在的治疗靶点。本研究筛选出的3个关键调控基因在肿瘤中均有报道,研究结果具有较高的可信度,可以为深入理解ICC 的分子机制提供新的观点和思路。
利益冲突:所有作者均声明不存在利益冲突。
