二维NiFe-LDH/Mo(OS)x 纳米片协同促进电催化析氧反应
2022-09-05张成
张 成
(上海理工大学 材料与化学学院,上海 200093)
电催化水分解生成氢气和氧气,为氢能、可充电金属-空气电池和燃料电池等能源供应领域提供了一种有前景的方案。然而,析氧反应(oxygen evolution reaction,OER)动力学过程缓慢,极大地限制了水分解效率。因此,迫切需要高效的OER 电催化剂来降低反应能量壁垒。研究表明,氧化钇(IrO)和氧化钌(RuO)具有优异的OER 催化活性和稳定性,但是,Ir 和Ru 都为贵金属,稀缺并且成本高,极大地限制了它们在规模化开发中的应用。研究人员把目光放在了地球储量丰富的元素上,如过渡金属氢氧化物/氧化物和钼基硫化物/磷化物,这些材料在碱性溶液中表现出良好的OER 活性和稳定性。
过渡金属基层状双氢氧化物(layer double hydroxides,LDH),具有金属阳离子的可替代性、插层阴离子的可交换性、形态可控以及在碱性溶液中性能稳定等优点,作为OER 催化剂具有很大的发展前景。其中NiFe-LDH 具有较高的OER 催化性能,但是NiFe-LDH 的导电性较差,其OER 催化性能不能充分发挥。通过与其他纳米组分耦合、构建异质结构,或制备三元LDH 可提高NiFe-LDH 的OER 活性。Zhang 等在泡沫镍表面制备了异质结构NiFe-LDH@NiCoP,在10 mA/cm电流密度下,1 M KOH 水溶液中仅有220 mV 的OER 过电势,并在连续运行100 h 后表现出优异的稳定性。Yang等通过水热和电沉积的方法制备了一种新型CoFe-LDH 和NiFe-LDH 纳米片阵列,该纳米片阵列在电流密度为10 mA/cm下仅具有1.59 V 的电势,可用于全分解水。基于以MoS为代表的非铂产氢电催化剂,因其廉价和较高的性能引起了广泛的关注。MoS中催化反应发生的活性位点位于其片层结构的边缘。增加MoS电催化剂活性边缘位点是提高其电催化性能的一个重要途径。
目前,对NiFe-LDH 和氧硫化钼在电催化应用中的研究已经有很多,而对两者复合的报导非常少。因此,本文通过电沉积法,将氧硫化物与NiFe-LDH 复合(NiFe-LDH/Mo(OS)),制备了高性能的异质结构OER 电催化剂。通过调节NiFe-LDH 的形貌以及结构,提高其OER 活性。
1 试 验
1.1 催化剂的制备
采用电沉积法在泡沫镍表面制备NiFe-LDH/Mo(OS),工作电极、对电极和参比电极分别为样品、Pt 和Ag/AgCl。在电沉积之前,先将泡沫镍剪成1 cm×1 cm 的正方形,用浓盐酸清洗样品表面的氧化物,随后用无水乙醇和去离子水依次清洗。先制备NiFe-LDH,电解液为7.5 mmol/L 六水合硝酸镍(NiNO·6HO,98%)和1 mmol/L 七水合硫酸亚铁(FeSO·7HO)。采用计时安培法在泡沫镍表面电沉积NiFe-LDH,用去离子水冲洗沉积完的样品,随后室温晾干。第二步采用循环伏安法(cyclic voltammetry,CV)在NiFe-LDH 表面制备Mo(OS)。电解液为1.5 mmol/L四硫代钼酸铵(NHMoS,99.95%,阿拉丁),沉积电势范围是−0.8~0.1 V,研究了循环圈数(2,4,6,8)对Mo(OS)沉积量的影响,所得样品用去离子水冲洗,并室温晾干。
1.2 催化剂的表征
采用扫描电子显微镜(scanning electron microscope,SEM)和透射电子显微镜(transmission electron microscopy,TEM)对样品进行形貌和结构分析。采用X射线衍射仪(X-ray diffractometer,XRD,D8 Advanced,40 kV,40 mA,Cu Kα)、拉曼光谱仪(Raman spectrometer,Raman,)和傅里叶红外仪(Fourier transform infrared spectrometer,FTIR)对样品的相组成和化学键合性质进行了表征。用X 射线光电子能谱(X-ray photoelectron spectrometer,XPS)研究了催化剂价态和物相组成。
1.3 电化学测试
采用Ivium 电化学工作站对电极进行电化学性能测试,电极系统为三电极体系,样品为工作电极,1 cm碳纸为对电极,Hg/HgO 作为参比电极,测试溶液为1 mol/L KOH 水溶液。线性扫描伏安法(linear sweep voltammetry,LSV)测量的扫描速率为5 mV/s,电势范围是1.1~1.6 V,电化学阻抗谱(electrochemical impedance spectroscopy,EIS)测 量频率范围是100 kHz~0.01 Hz,稳定性测试采用计时电位法,电流密度为10 mA/cm。
2 结果与分析
2.1 样品XRD、Raman 和FT-IR 分析
图1(a)为NiFe-LDH/Mo(OS)纳米片制备流程以及试验条件,样品在室温下制备完成的。样品的XRD 谱图如图1(b)所示,除了基底Ni 的特征峰外,在2角为11.5°、34.8°、60.4°、61.5°处出现了NiFe-LDH 的特征峰(PDF#51~0463),这表明第一步成功制备出NiFe-LDH。但是,第二步沉积Mo(OS)后,并未观察到有新的衍射峰增加,原因是沉积量太少,通过XRD 无法检测出来,需要通过其他测试手段对样品物相进行表征。
样品的Raman 光谱如图1(c)所示,位于538、454 cm的两个主拉 曼峰对应于NiFe-LDH 中的Ni(OH)和FeOOH,这两相为NiFe-LDH 的OER 活性相。第二步沉积Mo(OS)后,280 cm处特征峰为MoS,是由于(振动模式)g 和纵向声子模的振动引起的。此外,NiFe-LDH/Mo(OS)的Raman 光谱910 cm左右对应于MoO的对称拉伸模式。图1(d)是NiFe-LDH/Mo(OS)的红外光谱,3 232 cm处的谱带是水分子H-O-H 伸缩振动引起的,1 620 cm处的吸收峰与水的弯曲模态有关,1 080 cm处的峰与CO有关,1 395 cm处的峰与NiFe-LDH 层间的NO有关。
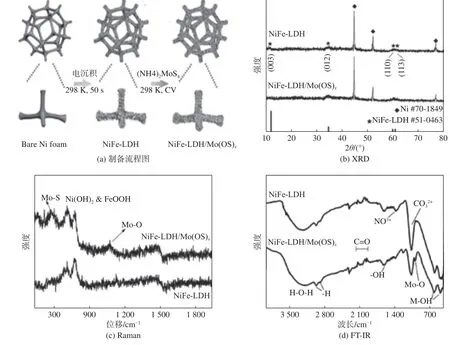
图1 样品制备流程图以及XRD、Raman 和FT-IR 谱图Fig.1 Sample preparation flow chart and XRD,Raman and FT-IR spectra
2.2 样品形貌和微观结构分析
图2(a)~(c)为NiFe-LDH/Mo(OS)的SEM 图,由图可见,NiFe-LDH 纳米片均匀地包覆在泡沫镍表面,并伴有少量NiFe-LDH 颗粒聚集。电沉积制备的Mo(OS)也为二维层状结构,所以两相没有明显的相界面。图2(d)为样品的TEM 图,可以观察到NiFe-LDH 的片层结构,证实了NiFe-LDH 的存在。
图2(e)~(f)表明,间距为0.25 nm 的晶格条纹对应于NiFe-LDH 的(012)面,0.24 nm 的晶格条纹对应于MoO的(200)面,0.22 nm 的晶格条纹对应MoS的(103)面,0.21 nm 的晶格条纹对应NiFe-LDH的(111)面,这与Raman 和FT-IR 结果相对应。

图2 NiFe-LDH/Mo(OS)x 形貌及微观结构图Fig.2 Morphologies and microstructure images of NiFe-LDH/Mo(OS)x
采用XPS 分析NiFe-LDH 和NiFe-LDH/Mo(OS)的表面组成和化学环境。从图3(a)的XPS 全谱可以看出,NiFe-LDH/Mo(OS)中存在Ni、Fe、O、C、Mo、S 元素。从图3(b)可以看出,NiFe-LDH/Mo(OS)的Mo 3d 光谱中,236.4、233.4、234.1、231.1、228.1 eV分别属于Mo3d3/2、Mo3d5/2、Mo、Mo3d3/2和Mo3d5/2。Mo和Mo峰分别属于MoO和MoS。Mo表明存在氧空位,S2p 图谱分析如图3(c)所示,在161.9 eV 处的S2p3/2 轨道和在162.9 eV 处的S2p1/2 轨道证实了存在MoS,168.0 eV 处为S-O 键,SO(169.6、170.5 eV)来自前驱体FeSO。综上所述,Mo(OS)主要是MoO、MoS、MoO和SO的混合物。

图3 NiFe LDH 和NiFe-LDH/Mo(OS)x XPS 谱图Fig.3 XPS spectra of NiFe-LDH and NiFe LDH/Mo(OS)x
如图3(d)所示,Ni结合能位于855.18(Ni2p3/2)、872.77 eV(Ni2p1/2),对应的卫星峰位于860.83、878.66 eV。根据图3(e)中的Fe2p 光谱可知,Fe 主要存在+2 和+3 两种价态。对于NiFe-LDH,712.62、725.82 eV 结合能处为Fe。另外,710.57、723.77 eV结合能处为Fe。与NiFe-LDH 相比,NiFe-LDH/Mo(OS)中Ni 和Fe 的结合能没有明显变化,但是Fe的相对含量发生变化。沉积Mo(OS)后,Fe相对含量从32.72%提高到62.03%,OER 性能得到改善。同时,如图3(f)所示,O 主要由O-H(532.3 eV)组成,主要来自吸附的水分子、金属氢氧化物(M-OH,531.2 eV)和金属氧化物(Ni-O 和Fe-O,529.8 eV)。Mo(OS)沉积后,531.1 eV处出现了Mo-O 结合。NiFe-LDH/Mo(OS)样品的XPS 分析结果如表1 所示。
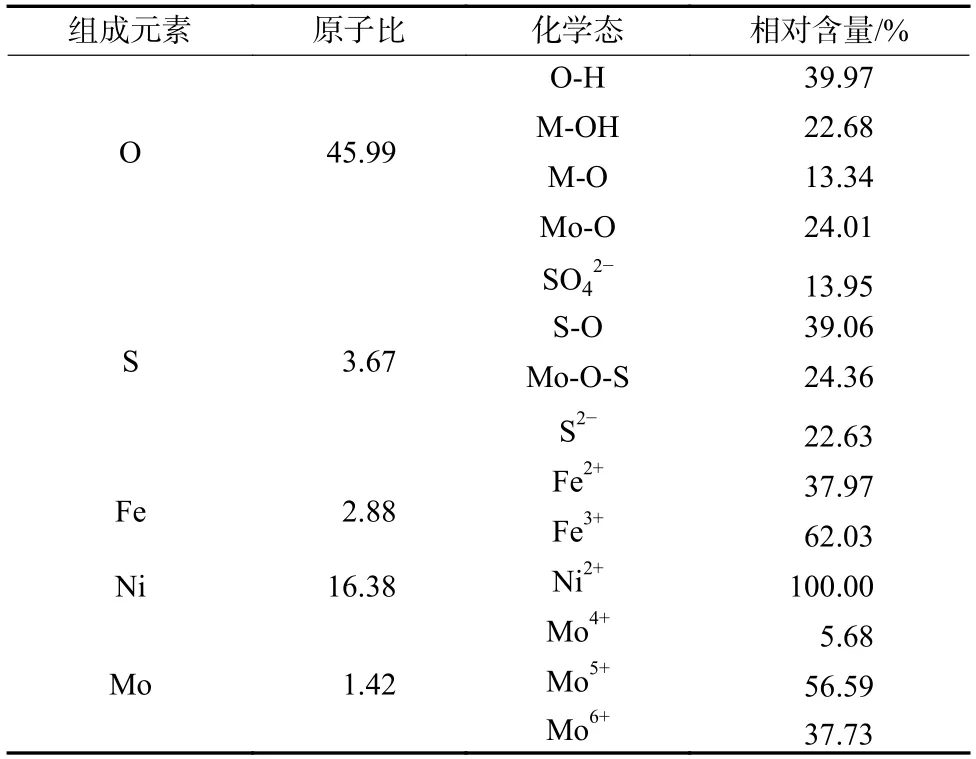
表1 NiFe-LDH/Mo(OS)x 组成元素原子比和相应的化学组分Tab.1 Atomic ratio of constituent elements and chemical components of NiFe-LDH/Mo(OS)x
2.3 OER 电化学性能测试
采用LSV 研究NiFe-LDH 和NiFe-LDH/Mo(OS)nCV(以下简称-CV,其中为电沉积循环圈数,=2、4、6、8)催化剂在1M KOH 水溶液液中的电化学性能。如图4(a)所示,当电流密度为10、100 mA/cm时,样品-4CV 具有较低的过电势,分别为220、253 mV。相比,NiFe-LDH 的为225 mV,为263 mV,IrO/泡沫镍的为342 mV。此外,在大电流密度下,-4CV 仍具有较小的过电势,仅为304 mV。

图4 样品在1 M KOH 水溶液中OER 电化学性能测试Fig.4 OER electrochemical performance test of the sample in 1 M KOH aqueous electrolyte
各样品在100、500 mA/cm下的过电势比较如图4(b)所示,由图可知,-4CV 具有最好的OER 性能。图4(c)为各样品的Tafel 曲线,Tafel 斜率大小表明电化学动力学反应快慢。-4CV 的Tafel斜率较小,为35 mV/dec,具有较快的OER 动力学。EIS 测量了样品的电荷转移电阻()和串联电阻(),通过等效电路模型拟合试验数据,如图4(d)所示。拟合数据以及OER 性能参数对比见表2。结果表明,-4CV 样品的(0.46 Ω)小于NiFe-LDH 样品的(0.57 Ω),这表明-4CV 参与电化学反应时具有较快的电子转移和良好的反应动力学。
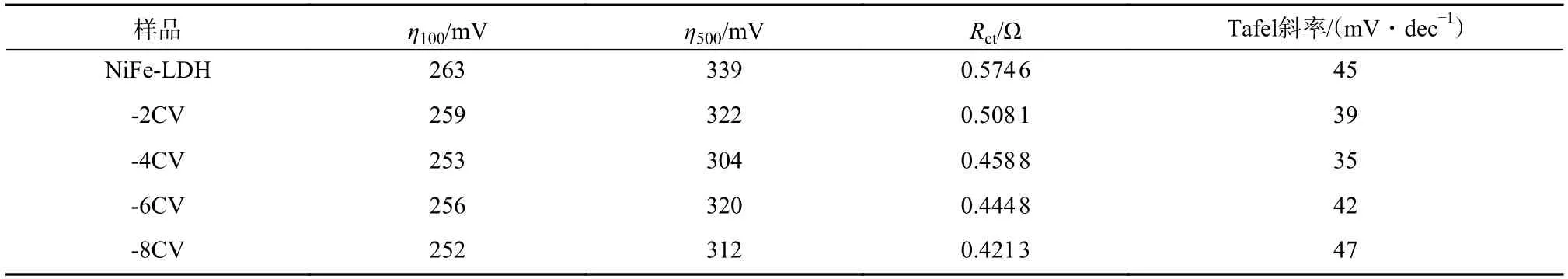
表2 样品OER 性能参数对比Tab.2 Comparison of the OER performance parameters of the samples
2.4 稳定性及机制分析
NiFe-LDH/Mo(OS)在1M KOH 水溶液中的电化学稳定性如图5(a)所示,NiFe-LDH-Mo(OS)在10 mA/cm电流密度下连续催化24 h 后,在碱性溶液中仍表现出优异的稳定性。图5(b)表明,沉积Mo(OS)后,样品氧空位量增加,这也是性能提高的原因之一。因此,NiFe-LDH 和NiFe-LDH/Mo(OS)样品的形成机制有待进一步研究。对于NiFe-LDH样品,NiOOH 结构中的Fe 为OER 活性位点,且Fe 的价态大部分为+2,经过Mo(OS)改性后,NO层间部分被MoO取代,层间距增大,电子传输能力增强。同时,Fe和氧空位数量增加,这也是性能提高的主要原因。
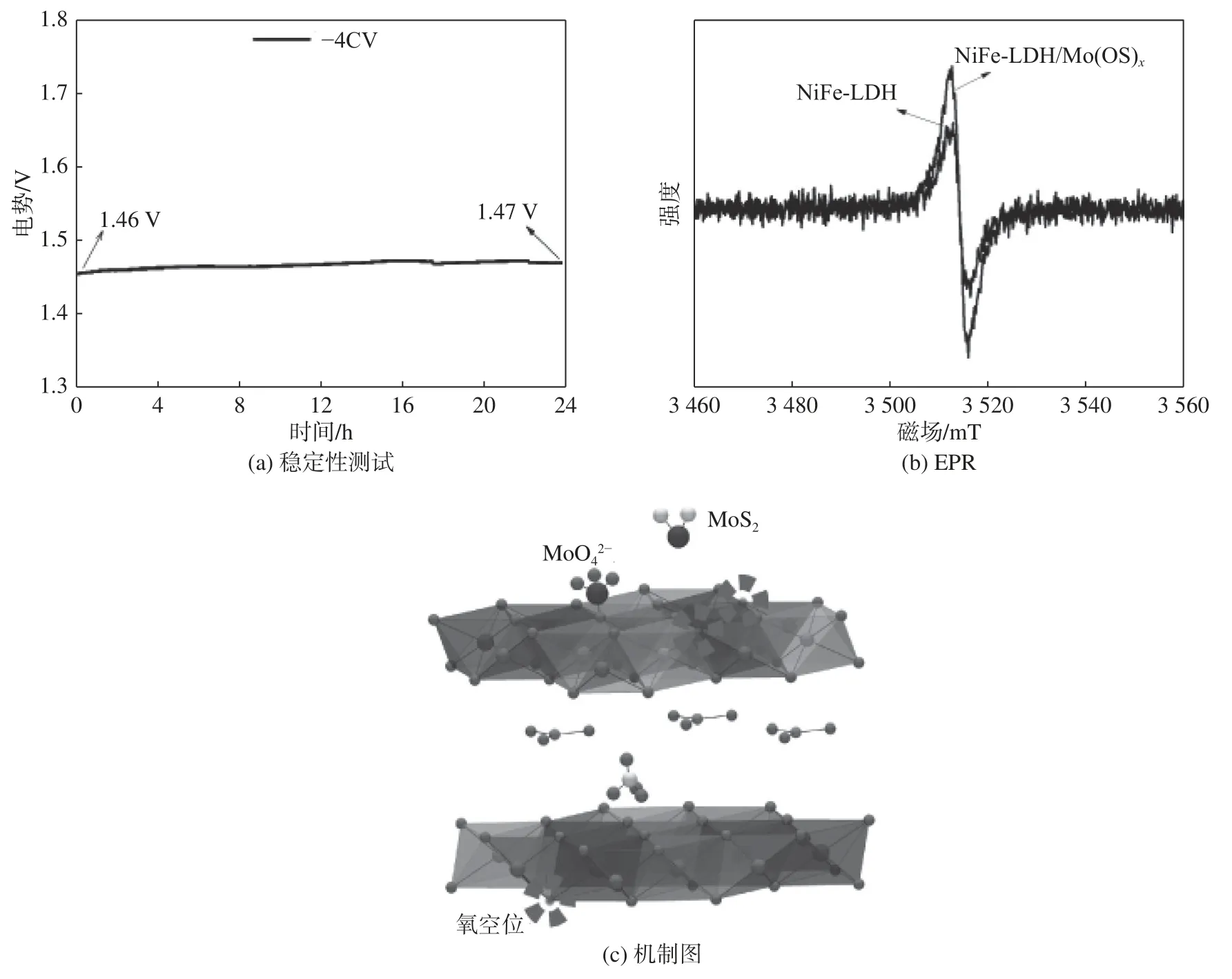
图5 稳定性测试以及机制分析Fig.5 Stability test and mechanism analysis
3 结论
综上所述,本文在碱性介质中通过一种简单的电沉积方法将氧硫化钼与NiFe LDH 纳米片复合,制备的电极具有长期稳定性和较小的电荷转移电阻,特别是在大电流密度下。同时,沉积Mo(OS)后,Fe和氧空位相对含量增加,OER 性能显著提高。在1 M KOH 水溶液中,10、100、500 mA/cm电流密度下,NiFe-LDH/Mo(OS)只需220、253、304 mV的过电势,远远小于NiFe-LDH 和IrO电极的。
