乳酸菌发酵驼乳工艺优化及抑制α-淀粉酶和α-葡萄糖苷酶活性的研究
2022-09-03买尔哈巴艾合买提崔卫东陈钢粮侯新强
买尔哈巴·艾合买提,曹 英,2,崔卫东,陈钢粮,侯新强,薛 杉,2,侯 敏
1 新疆农业科学院微生物应用研究所/新疆特殊环境微生物实验室,新疆乌鲁木齐 8300912 新疆大学生命科学与技术学院,新疆乌鲁木齐 8300523 新疆旺源生物科技集团有限公司,新疆福海 836400
0 引言
糖尿病是一种由遗传和环境因素相互作用,因胰岛素分泌绝对或相对不足及细胞对胰岛素敏感性降低等一系列代谢紊乱的临床综合征[1]。根据国际糖尿病联盟(IDF)公布的最新数据,2021年全球约5.37 亿成年人患有糖尿病,我国是全球糖尿病第一大国,患者数高达1.298 亿人,其中Ⅱ型糖尿病占比超过90%。目前Ⅱ型糖尿病的主要治疗方法是口服降糖药物、合理饮食控制体重、达到降低血糖的目的[2]。但多项研究显示,长期使用降糖药物会产生恶心、胃肠道不适等不良反应[3],严重影响患者的生活质量。因此研发副作用小、兼顾治疗并发症的药物,特别是天然物质的开发利用,在治疗糖尿病方面成为一种新的流行趋势[4]。
发酵驼乳是以新鲜驼乳为原料,经杀菌、接种发酵后制成的pH值降低的产品[5]。经微生物发酵后的驼乳,大分子物质被降解,产生游离氨基酸、多肽、游离脂肪等,有利于机体消化吸收,乳糖被分解转化为乳酸、乙醇并生成醛、酮、酯类等风味物质,赋予发酵乳特有的风味和口感[6]。此外,驼乳在微生物的作用下也能产生一系列具有增强免疫力、调节肠道菌群、降糖降脂的功能性物质[7]。Wang等[8]发现益生菌能显著改善糖尿病大鼠的胰岛抵抗,益生菌通过上调G蛋白偶联受体43/41,触发胰高血糖素样肽-1分泌增强胰岛素分泌,改善肠道屏障功能,降低大鼠的血糖水平。糖尿病长期发展会产生多种并发症,造成多种器官、系统的损伤,而肝脏组织的受损会导致抗氧化酶活性降低,使机体产生氧化应激[9]。有研究报道,发酵驼乳能极显著提高小鼠血清、脑组织和骨骼肌中超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和总抗氧化活力,降低小鼠的氧化应激反应[10]。目前对于发酵驼乳的研究多集中于发酵驼乳中微生物的多样性、免疫活性肽的分离鉴定等,较少有对发酵驼乳体外降糖活性指标α-淀粉酶和α-葡萄糖苷酶抑制率的测定及与抗氧化活性相关指标的测定。
因此本研究将实验室前期从驼乳中分离纯化得到的副干酪乳杆菌和乳明串珠菌混合发酵驼乳,通过正交试验优化发酵驼乳的最优工艺参数,得到发酵乳对α-淀粉酶和α-葡萄糖苷酶的最大抑制率,通过测定发酵驼乳和牛乳在储藏期间的一系列指标,比较不同发酵乳的发酵性能和体外降糖活性,为将驼乳开发成具有辅助降血糖作用的发酵乳制品提供一定的理论基础。
1 试验与方法
1.1 材料与试剂
乳明串珠菌、副干酪乳杆菌,前期实验室分离纯化所得;新鲜驼乳,阿勒泰吉木乃万驼园养驼户提供;西域春灭菌牛乳;MRS肉汤培养基、α-淀粉酶、可溶性淀粉、DNS试剂、α-葡萄糖苷酶、对硝基-α-D-吡喃葡萄糖苷、磷酸缓冲液,上海源叶生物科技有限公司;羟自由基清除能力试剂盒、超氧阴离子清除能力试剂盒,苏州科铭生物技术有限公司。
1.2 仪器与设备
pH计(METTLER TOLEDO型)、高速冷冻离心机(Presoo17型)、恒温培养箱(ZWY型),上海福玛实验设备有限公司;超净工作台(SW-CJ-2FD型),上海博讯实业有限公司医疗设备厂;电热恒温水浴锅(DK-8D型),上海齐欣科学仪器有限公司;紫外可见分光光度计(UV-6550型),日本自动化设备公司;酶标仪(SepectraMaxM5e型),MOLECULAR DEVICES,美谷分子仪器(上海)有限公司。
1.3 试验方法
1.3.1 发酵乳的制备
将乳酸菌发酵液按3%接种量接种到MRS肉汤培养基中活化传代,在37 ℃恒温培养箱中静置培养16~18 h,活化培养三代。新鲜驼乳经过4000 r/min,15 min离心后弃去脂肪层,95 ℃灭菌5 min,将灭菌驼乳冷却至42 ℃左右,在超净工作台中接入3%的发酵液,置于37 ℃恒温培养箱中发酵24 h,发酵完成后置于4 ℃冰箱中冷藏。
1.3.2 接种比例工艺优化
将乳明串珠菌和副干酪乳杆菌分别以1∶2、2∶3、1∶1、3∶2和2∶1的比例,按照2%的接种量将发酵剂接种到灭菌的脱脂驼奶中,置于37 ℃下发酵24 h。测定发酵驼乳对α-淀粉酶和α-葡萄糖苷酶的抑制活性,选择合适的接种比例。
1.3.3 接种量工艺优化
在接种比例1∶1、发酵温度37 ℃的条件下,接种量分别按照1%、2%、3%、4%和5%,待发酵24 h后测定发酵驼乳对α-淀粉酶和α-葡萄糖苷酶的抑制活性,选择合适的接种量。
1.3.4 发酵温度工艺优化
在接种比例1∶1、接种量2%的条件下,将发酵温度设置为35 ℃、37 ℃、39 ℃、41 ℃、43 ℃,待发酵24 h后测定发酵驼乳对α-淀粉酶和α-葡萄糖苷酶的抑制活性,选择合适的发酵温度。
1.4 正交试验
根据单因素试验结果,以接种比例(A)、接种量(B)、发酵温度(C)为正交试验的3 个因素,每个因素选择3 个水平,采用L9(34)正交试验确定发酵驼乳的最优工艺参数,正交试验因素与水平见表1。

表1 正交试验因素与水平表L9(34)
1.5 发酵乳指标测定
根据正交试验所得最优参数制备发酵驼乳作为试验组,同一条件下发酵牛乳作为CK1,嗜热链球菌和保加利亚乳杆菌发酵驼乳作为CK2,3 份样品发酵24 h后,取出后置于4 ℃下储藏,并在不同储藏时间(0 d、3 d、6 d、9 d、12 d)进行采样,测定以下指标。
1.5.1 发酵乳pH值的测定
采用pH计测定3 次取平均值
1.5.2 发酵乳滴定酸度的测定
滴定酸度用吉尔涅尔度(oT)表示,参考《GB 5009.239—2016 乳和乳制品酸度的测定》。用吸管量取10 mL的样品进入三角瓶内,用20 mL的蒸馏水稀释,加入0.5 mL 0.5%的酚酞溶液,将混合物小心地摇动均匀,用0.1 mol/L NaoH标准溶液滴定,边滴加边转动烧瓶,滴定至微红色,在2 min内不消失即达到滴定终点。
酸度(oT)=A×10
式中:A——到滴定终点时消耗0.1 mol/L NaoH溶液的用量(mL)
1.5.3 发酵乳活菌数的测定
称取25 mL发酵乳置于225 mL灭菌蒸馏水中,充分摇匀后形成稀释液,梯度稀释合适的倍数,取100 μL的稀释液涂布于MRS固体培养基中,37 ℃培养24~48 h,观察菌落生长情况记录菌落数,每个梯度重复3 次取平均值。
1.5.4 对α-淀粉酶抑制活性的测定
将制备的发酵乳取50 mL,在转速为10000 r/min温度为4 ℃的条件下离心30 min,取上清液于4 ℃冰箱中备用,用于后续指标的测定用。
125 μL样品溶液与1 mg /mL的α-淀粉酶溶液等体积混合,于37 ℃恒温水浴锅中孵育10 min,然后将反应液加入至37 ℃的250 μL的1.5%的可溶性淀粉溶液中,于37 ℃反应15 min,再加入500 μL DNS溶液,沸水浴中反应5 min后迅速冷却至室温,稀释20 倍后静置30 min,并于540 nm 处测定吸光值。用PBS溶液(0.1 mol /L,pH = 6.8)作为α-淀粉酶溶液和待测样品的空白对照。
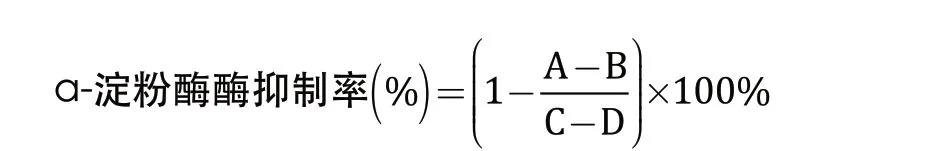
式中:A为样品组,含有样品溶液和α-淀粉酶溶液;B为样品空白组,含有样品溶液、不含α-淀粉酶溶液;C为对照组,不含样品溶液、含α-淀粉酶溶液;D为空白组,不含样品溶液、不含α-淀粉酶溶液。
1.5.5 对α-葡萄糖苷酶抑制活性的测定
在50 μL的样液中加入100 μL浓度为0.125 U/mL的α-葡萄糖苷酶溶液,将混合物于37 ℃孵化10 min,继续加入50 μL 浓度为5 mmol/L的PNPG溶液,在37 ℃水浴锅中反应20 min,最后加入50 μL浓度为0.2 mol/L Na2CO3作为反应终止液终止反应,将全部反应液于405 nm处测定吸光度值。用PBS 溶液(0.1 mol /L,pH = 6.8)作为α-葡萄糖苷酶溶液和待测样品的空白对照。

式中:A为样品组,含有样品溶液和α-葡萄糖苷酶溶液;B为样品空白组,含有样品溶液、不含α-葡萄糖苷酶溶液;C为对照组,不含样品溶液、含α-葡萄糖苷酶溶液;D为空白组,不含样品溶液、不含α-葡萄糖苷酶溶液。
1.5.6 羟自由基清除能力的测定
羟自由基是活性氧自由基的一种,体内自由基的积累会破坏细胞的完整结构、造成细胞功能丧失、基因突变引发人体高血压、癌症等一系列疾病[11],因此清除过量自由基,可有效提高机体的免疫功能,加快机体新陈代谢。H2O2和Fe2+通过Fenton反应产生羟自由基,水杨酸与产生的羟自由基反应生成有色物质2,3-二羟基苯甲酸,在510 nm处有最大吸收峰,加入具有清除能力的物质后,有色物质便会减少,从而根据吸光值的数值判断样品清除羟自由基的能力。

1.5.7 超氧阴离子自由基清除能力的测定
AP-TEMED系统[12]产生超氧阴离子,与盐酸羟胺反应生成NO2-,NO2-与对氨基苯磺酸和α-萘胺的作用生成红色的偶氮化合物,在530 nm处有特征峰,样品对超氧阴离子的清除能力与530 nm的吸光值呈负相关。

1.6 数据处理
所得数据均用SPSS 22、Microsoft Excel 2016进行数据处理、统计分析,Origin2021软件绘制作图。
2 试验结果
2.1 单因素结果
2.1.1 接种比例对发酵乳抑制α-淀粉酶和α-葡萄糖苷酶活性的影响
图1为接种比例对发酵乳α-淀粉酶和α-葡萄糖苷酶抑制活性的影响,由图可以看出,当发酵温度为37 ℃,接种量为2%,接种比例为1∶1、1∶2、2∶3、2∶1、3∶2时,随着接种比例的变化,发酵乳对α-淀粉酶和α-葡萄糖苷酶的抑制活性呈先升高再降低的趋势,当接种比例为2∶3时抑制活性最高,因此选择1∶1、1∶2、2∶3作为后续正交优化条件。
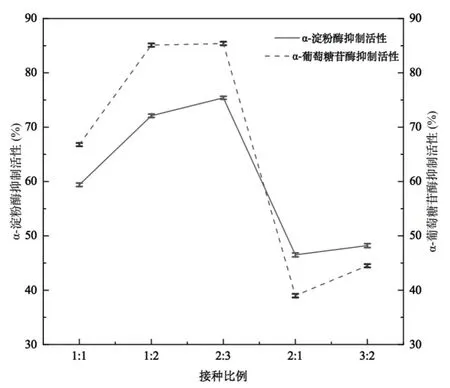
图1 接种比例对发酵乳抑制α-淀粉酶和α-葡萄糖苷酶活性的影响
2.1.2 接种量对发酵乳抑制α-淀粉酶和α-葡萄糖苷酶活性的影响
图2为发酵剂接种量对发酵乳α-淀粉酶和α-葡萄糖苷酶抑制活性的影响,由图可以看出,当发酵剂的接种比为2∶3、发酵温度为37 ℃、接种量为1%、2%、3%、4%、5%时,随着接种量的增大,发酵乳对α-淀粉酶和α-葡萄糖苷酶的抑制活性呈现先升高再降低的趋势,当发酵剂的接种量为3%时,发酵乳对两种酶的抑制活性最高,因此选择2%、3%、4%作为后续正交优化条件。

图2 接种量对发酵乳抑制α-淀粉酶和α-葡萄糖苷酶活性的影响
2.1.3 发酵温度对发酵乳抑制α-淀粉酶和α-葡萄糖苷酶活性的影响
图3 为发酵温度对发酵乳α-淀粉酶和α-葡萄糖苷酶抑制活性的影响,由图可以看出,当接种比例为2∶3、接种量为2%、发酵温度为35 ℃、37 ℃、39 ℃、41 ℃、43 ℃时,随着温度的升高,对α-淀粉酶和α-葡萄糖苷酶的抑制活性呈现先升高再降低的趋势,当发酵温度为39 ℃时,发酵乳对两种酶的抑制活性最高,因此选择37 ℃、39 ℃、41 ℃作为正交优化条件。
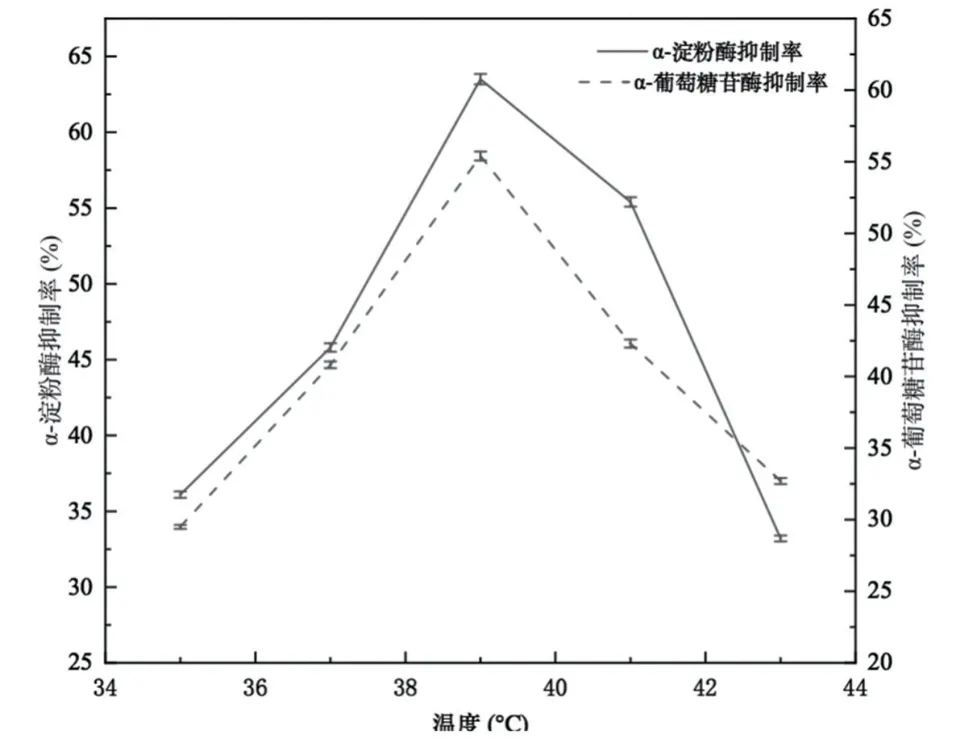
图3 发酵温度对发酵乳抑制α-淀粉酶和α-葡萄糖苷酶活性的影响
2.2 正交试验结果
根据单因素试验结果,选取接种比例(A)、发酵剂接种量(B)、发酵温度(C)3 个因素进行L9(34)正交试验,试验设计及试验结果见表2。
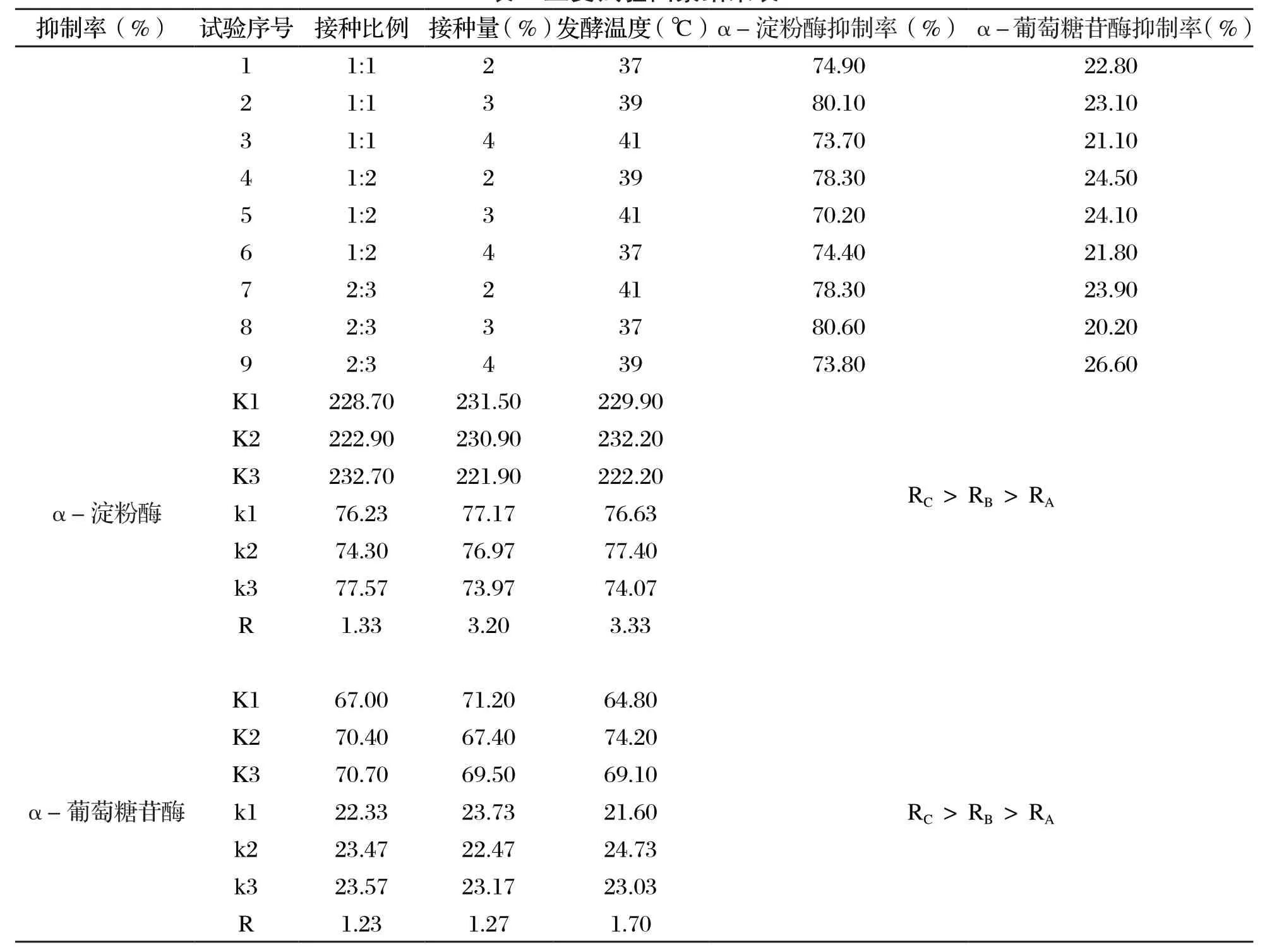
表2 正交试验因素结果表
分别以α-淀粉酶和α-葡萄糖苷酶抑制率为指标,由极差分析得到各因素对两种酶抑制率影响的主次顺序为C>B>A,即发酵温度对α-淀粉酶和α-葡萄糖苷酶抑制率的影响最大,其次是接种量,接种比例的影响最小。发酵乳中通过微生物的代谢作用产生各种活性因子达到抑制α-淀粉酶和α-葡萄糖苷酶的作用,适宜的温度有利于促进微生物新陈代谢,因此发酵温度对抑制α-淀粉酶和α-葡萄糖苷酶活性影响较大。通过正交试验结果可知,最优水平组合为A3B1C2,即接种比例2∶3、接种量2%、发酵温度39 ℃,按照最佳参数得到的发酵驼乳对α-淀粉酶和α-葡萄糖苷酶的抑制率分别达到87.20%和23.85%,与未优化前相比,α-淀粉酶的抑制率提高14.10%,α-葡萄糖苷酶抑制率提高4.4%。
2.3 发酵乳指标测定结果
2.3.1 发酵乳pH值的变化
由图4可知,随着储藏时间的延长,三组发酵乳的pH值呈下降趋势,且发酵驼乳的pH值显著低于发酵牛乳,试验组的pH由第0d的4.90下降到第12 d的4.20,下降了14.28%;CK1组pH值由起始的4.92下降到4.30,下降12.60%;CK2的pH值从发酵起始的4.91下降到第12 d时的4.22,下降了14.05%。三组发酵乳前期pH值降低较为缓慢,其原因可能是乳酸菌活菌数较少,活力相对较弱,随着发酵时间的增加乳酸菌利用乳中的营养物质不断分解乳糖产生乳酸,生长活力旺盛,开始大量繁殖,降低发酵乳的pH值。
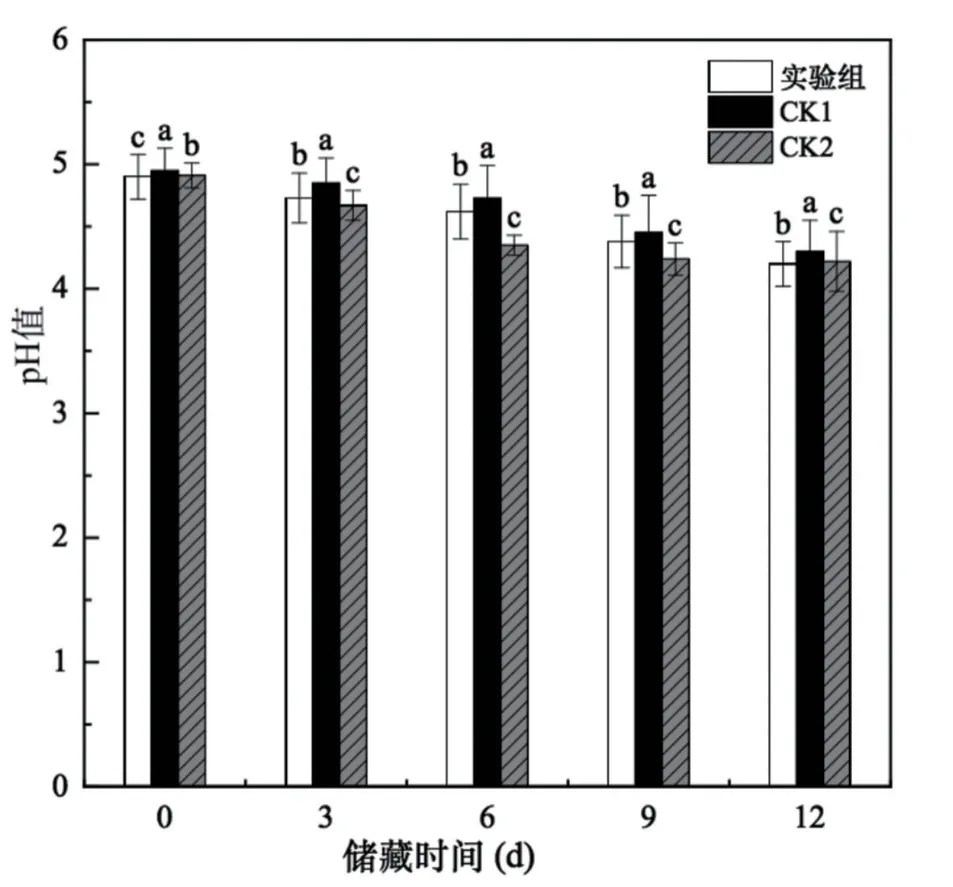
图4 不同储藏时间发酵乳的pH值变化
2.3.2 发酵乳滴定酸度的变化
滴定酸度是发酵乳发酵过程中重要的理化指标之一,从图4和图5可以看出,随着储藏时间的延长,三种发酵乳的滴定酸度均逐渐升高,与pH值变化趋势相反。试验组、CK1、CK2的起始发酵酸度分别为81oT、89oT、83oT,符合发酵乳的国标规定数值≥70oT,随着储藏时间的延长,微生物数量逐渐增多,发酵酸度也逐渐增大。到发酵第12d时,试验组和CK2发酵驼乳的酸度分别达到128oT和127oT,CK1发酵牛乳组的酸度为109oT。到储藏第12 d时实验组、CK1和CK2的酸度值同第0 d时分别增加了33.59%、25.68%、34.64%。酸度和pH值呈负相关,酸度值越大pH值越低,在冷藏期间乳酸菌不断分解乳糖产生乳酸,导致发酵乳的酸度不断降低。
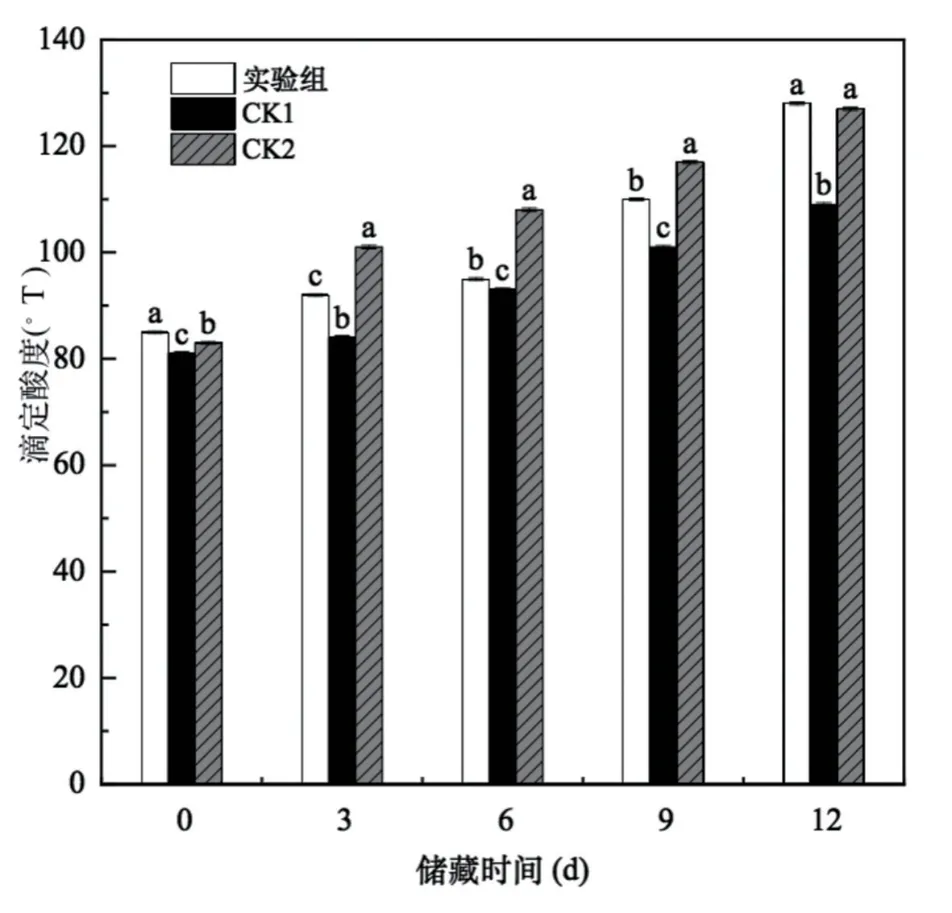
图5 不同储藏时间发酵乳的酸度变化
2.3.3 发酵乳活菌数变化
由图6可以看出,三组发酵乳的活菌数均呈现先升高后降低的趋势,发酵起始试验组的活菌数为8.8×107CFU/mL,CK1和CK2的活菌数分别为1.23×108CFU/mL和8.2×107CFU/mL,均高于发酵驼乳行业标准中规定的1×106CFU/mL。从图6中可以看出,随着发酵时间的延长,三组发酵乳的活菌数呈先升高后降低的趋势,试验组和CK2在第3 d时,活菌数最高分别达到2.71×108CFU/mL和1.41×108CFU/mL,到发酵第12 d,两组发酵乳活菌数逐渐降低为9.8×107CFU/mL和7.6×107CFU/mL,但试验组活菌数仍然高于发酵起始活菌数。CK1发酵乳最高活菌数在第9d时达到最大3.82×108CFU/mL,随后降低为1.94×108CFU/mL,到发酵后期随着发酵乳的酸度升高,过酸的环境不适合乳酸菌的生长,导致发酵乳的活菌数开始下降。

图6 不同储藏时间发酵乳的活菌数变化
2.3.4 对α-淀粉酶抑制率的变化
从图7可以看出三组发酵乳对α-淀粉酶的抑制率随着发酵时间的延长呈现先升高后降低的趋势,试验组对α-淀粉酶抑制率从87.20%降低到78.37%,在第6d时,试验组对α-淀粉酶抑制率达到最大90.39%,且试验组对α-淀粉酶抑制率显著高于对照组(P<0.05)。在第3d时,CK1对α-淀粉酶抑制率最大为68.28%,随着储藏时间的延长,逐渐降低为20.84%,CK2对α-淀粉酶抑制率的最大值为75.72%,在第12 d时降低为18.71%。试验组总体都保持较高的α-淀粉酶抑制率,是由于驼乳本身就含有降糖活性因子,经过益生菌的发酵产生更多的降糖活性肽等。

图7 不同储藏时间发酵乳对α-淀粉酶抑制率的变化
2.3.5 对α-葡萄糖苷酶抑制率的变化
从图8中可以看出,试验组对α-葡萄糖苷酶的抑制率随着储藏时间的延长抑制率逐渐升高,而对照组对α-葡萄糖苷酶的抑制率呈现先升高后降低的趋势,试验组对α-葡萄糖苷酶的抑制率显著均高于对组(P<0.05)。整个储藏期间试验组对α-葡萄糖苷酶的抑制率从20.85%升高至36.32%,提升了42.49%,CK1对α-葡萄糖苷酶的抑制率在第6 d时达到最高为24.45%,CK2对α-葡萄糖苷酶的抑制率在第9 d时达到最高30.97%。储藏后期抑制率降低可能与发酵后期活菌数数量下降有关,由于发酵乳pH值降低,产生过多的乳酸影响菌体的生长,次级代谢产物的合成受到影响,对α-葡萄糖苷酶的抑制率降低。
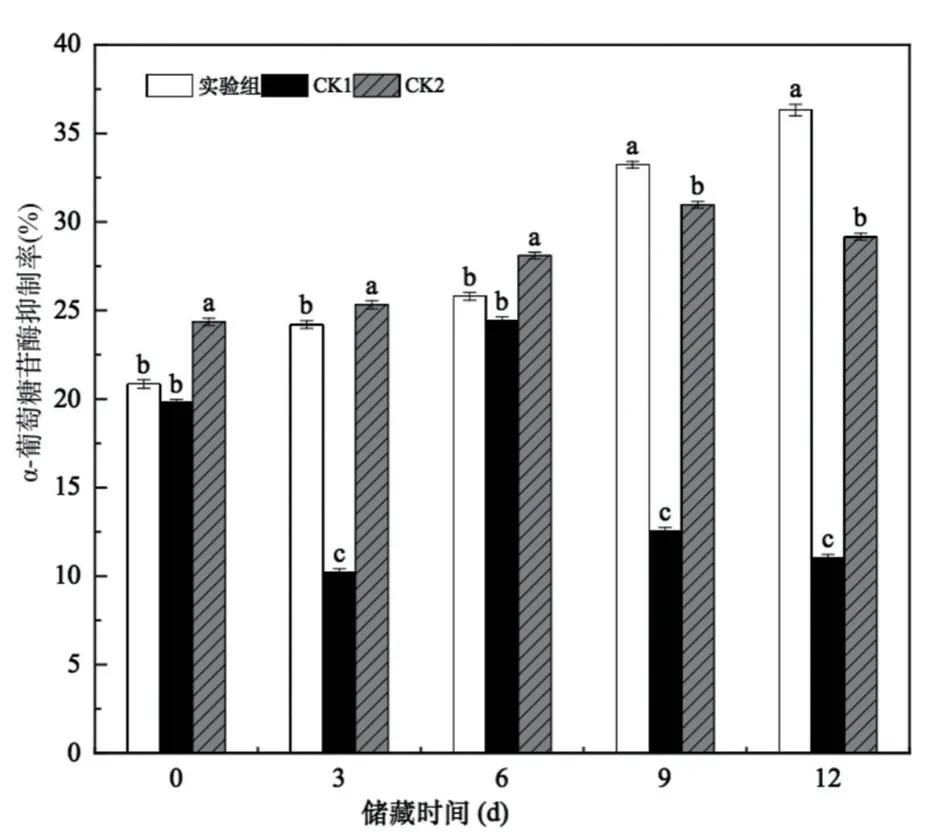
图8 不同储藏时间发酵乳对α-葡萄糖苷酶抑制率的变化
2.3.6 对羟自由基清除率的变化
三组发酵乳对羟自由基清除率的变化,由图9可以看出,试验组和CK2组对羟自由基的清除率呈现先升高后降低的趋势,试验组对羟自由基清除率显著高于对照组(P<0.05)。CK1对羟自由基的清除率随着储藏时间的延长逐渐升高,但始终低于试验组对羟自由基的清除率。在第9d时,试验组对羟自由基的清除率达到最大值94.41%,与第0d相比增加了16.2%,到发酵第12d,试验组对羟自由基的清除率为87.61%,仍然保持较高的清除率。CK1对羟自由基的清除率从60.74%增加到73.23%,CK2对羟自由基的清除率最高为86.55%,在第12d降低为66.29%。

图9 不同储藏时间发酵乳对羟自由基清除率的变化
2.3.7 对超氧阴离子清除率的变化
发酵乳对超氧阴离子清除率的变化如图10所示,从图中可以看出,试验组和CK2对超氧阴离子的清除率随着储藏时间的延长逐渐升高,试验组从第0d的65.56%的清除率升高至第1 d的77.47%,增加了15.4%。CK1对超氧阴离子的清除率先升高后降低,最高清除率为68.88%,在第12d时,降低60.09%。CK2对超氧阴离子的清除率从54.01%升高到71.13%。试验组在整个储藏时期内对超氧阴离子自由基的清除率显著高于对照组(P<0.05)。

图10 不同储藏时间发酵乳对超氧阴离子自由基清除率的变化
3 讨论与结论
随着人们对乳酸菌益生功能的深入认识,越来越多乳酸菌被用于发酵乳制品、饮料、保健食品等,发酵乳制品作为益生菌的载体,能充分发挥乳酸菌的益生作用[13]。通过添加功能性成分制作发酵乳制品,如富含寡糖的乳制品有助于维持血脂健康,乳中添加维生素D、胶原蛋白肽、牛初乳碱性蛋白等开发减缓中老年人骨质流失及骨质疏松症的功能性乳制品[14]。因此在发酵乳中添加具有降血糖功能的功能物质,不仅增加发酵乳制品的营养价值,也为糖尿病患者提供一种新型、有辅助治疗疾病的乳制品。
α-淀粉酶和α-葡萄糖苷酶抑制率被认为是研究体外降糖活性的间接指标,两种酶抑制剂通过延缓体内碳水化合物的消化吸收,降低餐后血糖水平的升高,因此抑制α-淀粉酶和α-葡萄糖苷酶活性在防治糖尿病方面有巨大潜力[15]。发酵驼乳中益生菌通过分泌蛋白水解酶水解驼乳中的蛋白质产生更多的生物活性肽、活性因子等,对α-淀粉酶和α-葡萄糖苷酶具有普遍抑制作用[16]。Ayyash[17]等比较了发酵驼乳和牛乳对α-淀粉酶和α-葡萄糖苷酶抑制率,发现发酵驼乳对α-淀粉酶和α-葡萄糖苷酶的抑制率均高于发酵牛乳与本试验的研究结果相一致,学者们认为有两种原因:一是发酵使用的益生菌本身分离自驼奶,因此对驼奶有更高的适应性;二是驼奶中富含的胰岛素、降糖活性因子等高于牛乳,因此发酵驼乳与牛乳相比表现出较高的抑制率和抗氧化活性[18]。
抗氧化活性是发酵乳制品重要的营养特性,乳制品经过微生物的发酵作用生成各种生物活性肽,对机体的免疫调节和抗氧化活性产生积极影响[19]。Hamed等[20]研究发现乳酸乳球菌发酵驼乳可通过清除体内自由基和抑制活性氧的积累来防止体内的氧化损伤,提高机体的抗氧化活性。Patel等[21]用植物乳杆菌发酵驼乳测定发酵乳的抗氧化活性,在37 ℃发酵48 h后,发酵乳对羟自由基和超氧阴离子自由基清除率分别达到61.52%和52.26%。EI-Sayed等[22]以不同的乳酸菌发酵驼乳,测定发酵驼乳在储藏期间的抗氧化活性,研究发现与市售的商业发酵剂相比益生菌发酵驼乳具有更高的抗氧化活性,与本试验的研究结果相一致,试验组的自由基清除率显著高于对照组,他们认为发酵菌株的来源、数量、蛋白质的水解活性等因素都会影响发酵乳的抗氧化活性。
本试验通过乳明串珠菌和副干酪乳杆菌发酵驼乳以α-淀粉酶和α-葡萄糖苷酶抑制率为指标,优化发酵驼乳的参数条件,通过正交试验得到发酵驼乳的最佳工艺参数为乳明串珠菌:副干酪乳杆菌比例2∶3、接种量2%、发酵温度39 ℃,发酵时间24 h,在此条件下测得发酵驼乳对α-淀粉酶和α-葡萄糖苷酶的抑制率分别达到87.20%和23.85 %,与未优化前相比,α-淀粉酶的抑制率提高14.10%,α-葡萄糖苷酶抑制率提高4.4%。在4 ℃储藏期间发酵驼乳对α-淀粉酶抑制率在第6d时最高为90.39%,对α-葡萄糖苷酶的抑制率最高为36.32%,抑制率显著高于对照组。对羟自由基、超氧阴离子自由基清除率最高达到94.91 %和78.10%,均显著高于对照组(P<0.05)。
