卵巢癌患者肿瘤细胞减灭术后复发的影响因素
2022-09-03陈燕荣武明娟
陈燕荣, 武明娟, 刘 冰, 赵 敏
(1. 中国航天科技集团公司七三八疗养院 妇科, 江苏 无锡, 214000;2. 江苏省无锡市妇幼保健院 妇科, 江苏 无锡, 214000;3. 黑龙江省哈尔滨市第一医院 妇科, 黑龙江 哈尔滨, 150010)
肿瘤细胞减灭术(CRS)作为卵巢癌(OC)的常用治疗方式,切除较大部分的肿瘤组织可减轻瘤体负荷,有利于后续化疗,提高患者生存率[1]。晚期OC多伴有腹腔积液,腹腔肿瘤细胞扩散风险高,术后可能会出现肿瘤复发情况,增大临床治疗难度,影响患者术后[2]。目前,临床评估OC复发多依靠影像学手段,虽然可以明确病灶变化,但无法评估肿瘤复发风险[3]。因此,明确可能导致OC患者CRS术后复发的相关因素对临床制订干预方案,降低肿瘤复发率有重要意义。陈天敏[4]指出,术前腹水、淋巴结清除率低等可能是OC患者复发的高危因素,此项研究采用的是OC根治术与放化疗治疗,但影响因素与OC患者CRS术后复发是否有关尚未明确。本研究重点分析OC患者CRS术后复发的影响因素,为降低OC患者复发风险,改善OC患者预后提供一定参考依据。
1 资料与方法
1.1 一般资料
根据样本量计算公式计算得到纳入的研究对象至少为88例,考虑失访率为15%,应纳入的研究对象≥104例,最后本研究共纳入107例OC患者为研究对象。回顾性收集107例OC患者的临床资料,所有患者均完成CRS治疗,并随访2年。所有患者病例资料、相关检查资料、随访资料等均完整。纳入标准: ① 符合《妇科肿瘤诊疗指南》[5]中相关标准,且经手术病理检查证实为OC者; ② 上皮性原发肿瘤者; ③ 初次接受CRS治疗,且术后接受6~8个疗程紫杉醇/紫杉醇脂质体联合卡铂/奈达铂化疗者; ④ 卡氏(KPS)[6]评分≥70分,体力活动状态(PS)[7]评分≤2分者。排除标准: ① 合并其他部位恶性肿瘤者; ② 合并肠梗阻或腹腔粘连者; ③ 合并重要脏器疾病者; ④ 合并感染性疾病者; ⑤ 合并其他妇科疾病者; ⑥ 术前接受放化疗者; ⑦ 既往有卵巢、盆腔手术史者。
1.2 方法
1.2.1 肿瘤复发评估: 统计患者术后2年内肿瘤复发情况,根据影像学检查、血清肿瘤标志物检查情况对复发情况进行评估。影像学检查可见卵巢原有病灶增大或出现新病灶,并根据宫腔镜及穿刺针取活组织标本的病理检查确诊为肿瘤复发。将肿瘤复发患者纳入复发组,未复发患者纳入未复发组。
1.2.2 基线资料收集: 设计基线资料填写表,阅读患者相关基线资料并记录所需数据。① 一般资料: 年龄、肿瘤直径、国际妇产科联合会(FIGO)分期(Ⅲ期、Ⅳ期)[8]、组织分型(浆液性、黏液性、其他)、残瘤直径(≤1 cm、>1 cm)、产次、术前绝经、淋巴结转移(有、无)、术中淋巴结清扫(由主治医生根据患者治疗情况评估)、肿瘤细胞分化程度(高分化、中分化、低分化)等; ② 实验室指标: 糖类抗原125(CA125)、糖类抗原199(CA199)、癌胚抗原(CEA)、人附睾分泌蛋白4(HE4)水平等。采集患者术前空腹肘静脉血5 mL, 采用低速离心机(济南欧莱博科学仪器有限公司,型号DDL-6R)以4 000转/min离心10 min, 离心半径为10 cm, 采用化学发光免疫分析法测定血清CA125、CA199、CEA、HE4水平,检测试剂盒购自上海西格生物科技有限公司,检验流程严格按照试剂盒说明书进行。③ 免疫组织化学法: 采用美国Dako公司EnVisionTM二步法检测系统及鼠抗人乳腺癌易感基因-1(BRCA-1)克隆抗体、兔抗人聚腺苷二磷酸核糖聚合酶-1(PARP-1)克隆抗体、免疫组织化学试剂盒检测BRCA-1、PARP-1蛋白表达。结果判断: BRCA-1蛋白为核蛋白, BRCA-1蛋白阳性染色者细胞核有棕黄色颗粒沉着。PARP-1阳性染色标准为细胞核或细胞浆出现棕黄色或棕褐色颗粒。① 在高倍显微镜下500~1 000个细胞中阳性细胞数,计算阳性细胞占比。参考MarkKelley实验室标准进行肿瘤细胞阳性计分, <10%的细胞阳性率为Ⅰ级(0分), 10%~25%为Ⅱ级(1分),>25%~50%为Ⅲ级(2分), 50%以上为Ⅳ级(3分)。② 据肿瘤组织细胞的染色程度以及染色细胞占比计算免疫反应评分(IRS): 无着色细胞为0分,着色细胞占计数细胞百分率≤10%为1分, >10%~50%为2分, >50%~80%为3分, >80%为4分。③ 两项分值相加得到免疫组织化学阳性分数, 0~1分为阴性,2~8分为阳性。
1.3 统计学方法

2 结 果
2.1 OC患者CRS术后复发情况
随访至术后2年,以术后肿瘤复发作为终点事件,随访时间为3~24个月,平均随访时间17.00(13.00, 24.00)个月。107例OC患者CRS术后68例复发,复发率为63.55%(68/107)。见图1。

图1 OC患者CRS术后复发情况
2.2 复发组和未复发组OC患者相关基线资料比较
复发组患者BRCA-1、PARP-1表达和残瘤直径、术中淋巴结清扫、CA125水平、HE4水平与未复发组比较,差异有统计学意义(P<0.05); 复发、未复发OC患者年龄、肿瘤直径、FIGO分期、组织分型、产次、术前绝经、淋巴结转移、不同分化程度肿瘤细胞占比、血清CA199、CEA比较,差异无统计学意义(P>0.05),见表1。
表1 复发组和未复发组OC患者相关基线资料比较
2.3 OC患者CRS术后复发的危险因素分析
将差异有统计学意义的变量作为自变量,将OC患者CRS术后复发情况作为因变量(1=复发, 0=未复发),经单项Logistic回归分析后,将P值放宽至<0.1, 将符合条件的影响因素同时纳入作为自变量,建立多元Logistic回归模型。结果显示,残瘤直径>1 cm、术中未清扫淋巴结、CA125水平升高、HE4水平升高可能是OC患者CRS术后复发的危险因素(OR>1,P<0.05), 见表2、表3。

表2 影响因素赋值情况
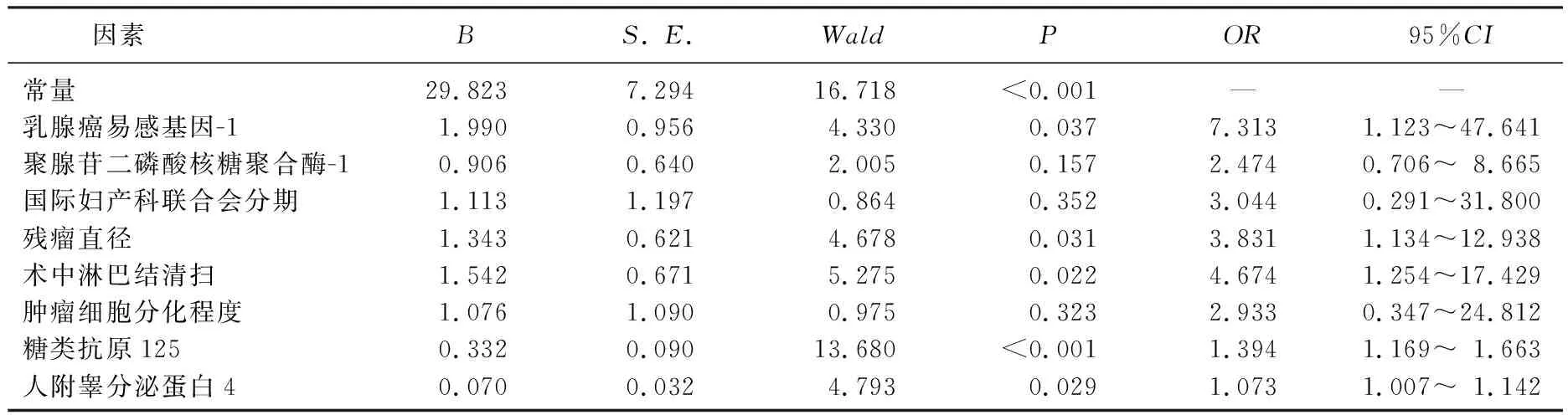
表3 OC患者CRS术后复发的危险因素分析
2.4 OC患者CRS术后各因素对患者术后复发的预测价值
将Logistic回归分析中BRCA-1、PARP-1、FIGO分期、残瘤直径、术中淋巴结清扫、肿瘤细胞分化程度、CA125、HE4获得的预测概率作为检验变量,将OC患者CRS术后复发情况作为状态变量(1=复发, 0=未复发),绘制ROC曲线(见图2)。结果显示, BRCA-1、PARP-1、FIGO分期、残瘤直径、术中淋巴结清扫、肿瘤细胞分化程度、CA125、HE4联合预测OC患者CRS术后复发的AUC>0.80, 有一定预测价值,见表4。

图2 OC患者CRS术后各因素预测患者术后复发的ROC曲线

表4 BCRS术后各因素对OC患者CRS术后复发的预测价值
3 讨 论
OC是一种病死率较高的妇科肿瘤,大部分患者就诊时病情已进展至晚期,错失最佳手术时期。据研究[9]报道, OC患者5年生存率低于50%。目前,临床多采用CRS联合化疗治疗晚期OC, 以缩小肿瘤体积,提高整体干预效果,延长患者生存期[10]。CRS联合化疗后,仍有60%以上的OC患者可能会出现复发,影响预后[11]。本研究结果显示, 107例OC患者中, 63.55%的患者复发,复发率较高。因此,积极探讨可能导致OC患者CRS术后复发的影响因素对指导未来早期干预尤为重要,临床应引起高度重视。
本研究结果显示, BRCA-1阳性表达、PARP-1阳性表达、残瘤直径>1 cm、术中未清扫淋巴结、CA125水平升高、HE4水平升高可能是OC患者CRS术后复发的危险因素。① BRCA-1阳性表达: BRCA-1蛋白是一种核蛋白,常在正常卵巢发生上皮的细胞核中表达,参与基因稳定和细胞周期的调控,能调节细胞生长、DNA 损伤修复等细胞活动[12]。BRCA-1阳性表达会修复对等DNA,影响细胞周期及转录因子,进而影响细胞的增殖和分化,促进肿瘤生长、侵袭,引起OC患者术后肿瘤复发[13]。此外, BRCA-1阳性表达还会增强肿瘤细胞对阿奇霉素等药物的抵抗作用,影响患者术后化疗效果,增大OC患者术后复发风险。② PARP-1阳性表达: PARP-1是一种蛋白翻译后修饰酶,存在于多数真核细胞中,参与OC、结直肠癌等肿瘤的发生过程。PARP-1可修复DNA损伤,在细胞增殖、凋亡等方面具有调节作用,促进OC细胞增殖分化,加重肿瘤的恶性程度,进而引起OC患者术后复发[14]。PARP-1通过调控转录调控因子,参与肿瘤细胞的上皮间质转化,引起肿瘤细胞的侵袭、转移,减少肿瘤细胞凋亡,进而增高肿瘤术后复发的风险。PARP-1抑制剂目前已应用于OC的治疗,且相关研究表明,对BRCA-1异常的OC患者应用PARP-1抑制剂,可增加患者治疗的敏感度[15]。③ 残瘤直径>1 cm: 实施CRS目的在于最大限度缩减肿瘤病灶体积,提高后续化疗效果,理想病灶体积为≤1 cm[16]。但部分OC患者肿瘤病灶较大,无法切除至理想体积,而残留病灶直径较大,引起CRS术后切缘阳性,残余的肿瘤细胞可能会进一步增殖、生长,继而导致肿瘤复发[17]。④ 术中未清扫淋巴结: 伴有淋巴结转移的OC患者,肿瘤细胞可随淋巴转移至全身各个器官,即使手术彻底清除原发肿瘤组织,转移细胞仍可能会再次生长增殖,导致肿瘤复发[18]。王秋宇等[19]研究也表明,术中未清扫淋巴结是OC患者初次CRS术后复发的独立危险因素,本研究结果与上述研究一致。⑤ CA125水平升高: CA125是OC诊断和预后评估首选标志物。研究[20-22]指出,连续检测OC患者血清CA125水平可预测复发风险,且敏感度高于90%。CA125的高度糖基化串联重复结构域通过结合半乳糖凝集素-1促使肿瘤细胞逃脱免疫反应,且其可结合间皮素,促进肿瘤细胞侵袭,进而引起术后肿瘤复发[23]。此外, CA125表达升高还可降低肿瘤细胞对化疗药物敏感性[24]。⑥ HE4水平升高: HE4是近年来新发现的OC标志物,是上皮细胞分泌的酸性蛋白,正常血清中含量较低,但当卵巢上皮细胞恶变为癌细胞后,上皮细胞会大量分泌HE4,导致血清HE4高表达[25]。HE4高表达可结合膜联蛋白Ⅱ激活MAPK通路,增强肿瘤细胞侵袭、转移能力,且可促使肿瘤细胞分裂,促进细胞生长,抑制肿瘤细胞凋亡,进而增加OC患者术后复发风险[26]。同时,HE4还可激活ERK与AKT的信号通路,诱导肿瘤组织耐药,降低化疗敏感性,从而影响治疗效果,增加复发风险[27]。
针对上述危险因素应提出合理化建议如下。① 残留直径: 对于残瘤直径>1 cm的患者,手术结束前应做好细致化检查,即使发现细微病灶,明确病灶是否清理彻底,以避免病灶复发。② 术中未清扫淋巴结: 术中应对周围淋巴结进行清扫,防止肿瘤细胞侵犯周围淋巴结而导致病情复发。BRCA-1阳性、PARP-1阳性、CA125水平升高、HE4水平升高的OC患者在CRS术中应尽量切除肿瘤组织,清扫淋巴结,同时术后放化疗干预期间需动态观察BRCA-1、PARP-1、CA125、HE4的变化,合理调整治疗方案,以提高整体治疗效果,预防肿瘤复发。除本研究发现的残瘤直径、淋巴结清扫等因素外,还有更多因素可能会影响OC患者CRS术后复发,如BRCA、HRD等免疫组化指标。本研究未绘制预测模型明确各因素是否可预测OC患者CRS术后复发风险,且为病例对照研究,因此OC患者CRS术后复发中的作用机制尚未阐明,仍需要大量动物试验或体外试验对以上结论进行验证,进一步分析OC患者CRS术后复发的危险因素。
综上所述,OC患者CRS术后复发可能受BRCA-1阳性表达、PARP-1阳性表达、残瘤直径>1 cm、术中未清扫淋巴结、CA125水平升高、HE4水平升高的影响,未来可根据以上因素提出针对性干预方案,可能对降低OC患者CRS术后复发率有积极意义。
