2020—2021 年市售马立克病疫苗的效价测定及质量评估
2022-09-03郑鹿平刘金玲楚钰淑王伟东张文凯
郑鹿平,滕 蔓,刘金玲,罗 琴,3,楚钰淑,王伟东,4,张文凯,5,罗 俊,5
(1. 河南省农业科学院 动物免疫学重点实验室/农业农村部动物免疫学重点实验室/河南省动物免疫学重点实验室,河南 郑州 450002;2. 河南省农业科学院 中英禽病国际研究中心,河南 郑州 450002;3. 河南牧业经济学院动物医药学院,河南 郑州 450046;4. 郑州大学 公共卫生学院,河南 郑州 450001;5. 河南科技大学 动物科技学院,河南 洛阳 471003)
马立克病(Marek’s disease,MD)是一种导致鸡免疫抑制、神经系统麻痹和淋巴组织增生的肿瘤性疾病,临床发病率为10%~60%,对耐过存活鸡仍具有极强的免疫抑制性,通常造成生长发育迟缓、生产性能下降或丧失,给世界养禽业带来了巨大的危害[1]。该病的病原是马立克病病毒(Marek’s disease virus,MDV),在过去的几十年中,随着病毒进化,MDV 毒力不断增强[2]。MDV 有3 个血清型,血清Ⅰ型(MDV-1)为具有致病性或致瘤性的分离株及其减毒疫苗株,代表株有GA、Md5、GX0101、CVI988/Rispens、814 等;血清Ⅱ型(MDV-2)和Ⅲ型(MDV-3)均不致病[3],其中MDV-2 的代表毒株为SB1、Z4和HRPS-16,MDV-3 也被称为火鸡疱疹病毒(Herpesvirus of turkeys,HVT),代表株只有FC-126。
作为最早被研制成功且能有效预防肿瘤发生的病毒疫苗,MD 疫苗的问世对该病的有效防控发挥了巨大作用。从20 世纪70 年代的HVT[4],到80年代的SB-1[5]、SB-1+HVT、Z4+FC-126,再到90 年代开始使用的CVI988/Rispens[6]和814[7],MD 疫苗不断得以改进。这些疫苗的广泛应用,在很大程度上降低了MD的发病率,在一定时期内有效控制了MD的流行和发生[8]。但是,近年来鸡群中MD 免疫失败的案例频有报道[9-12]。导致MD 免疫失败的因素很多,长期疫苗免疫压力下MDV毒力增强或变异并突破现有疫苗保护可能是其中最重要的因素,但MD 疫苗本身的质量控制、保存运输及合理使用也是不容忽视的重要因素。
用于MD 商品疫苗生产的病毒株,多数增殖于原代鸡胚成纤维细胞(Chicken embryo fibroblasts,CEF)。相关研究数据显示,我国SPF 鸡胚数量有限,难以满足生产需求,生产中存在使用普通鸡胚替代SPF 鸡胚生产疫苗的现象[13]。普通鸡胚未经严格检测认证,多数不达标且易导致疫苗产品外源性病毒污染,其中较为常见的是禽白血病病毒(Avian leucosis virus,ALV)和禽网状内皮组织增生症病毒(Reticuloendotheliosis virus,REV)的污染。关于MD疫苗中存在ALV和REV污染的情况,国内外已有大量研究报道[14-19]。为了解和评估当前MD 疫苗的产品质量,对2020—2021 年间市场销售的大部分MD疫苗的不同批次产品随机进行了病毒效价测定和对比分析,同时检测外源病毒ALV和REV的污染情况,旨在为今后MD 疫苗选用及MD 有效防控提供重要参考依据。
1 材料和方法
1.1 细胞、疫苗和毒株
CEF 细胞分离自9~10 日龄鸡胚,SPF 种蛋由北京勃林格殷格翰维通生物技术有限公司提供;9家不同生物企业生产的11 个批次MD 疫苗产品(编号为V1—V11),购自河南省兽药市场或疫苗经销商,相关产品背景及信息详见表1。MDV 和REV 共感染分离株HNGS206 和HNXZ103,由本实验室分离保存[20]。
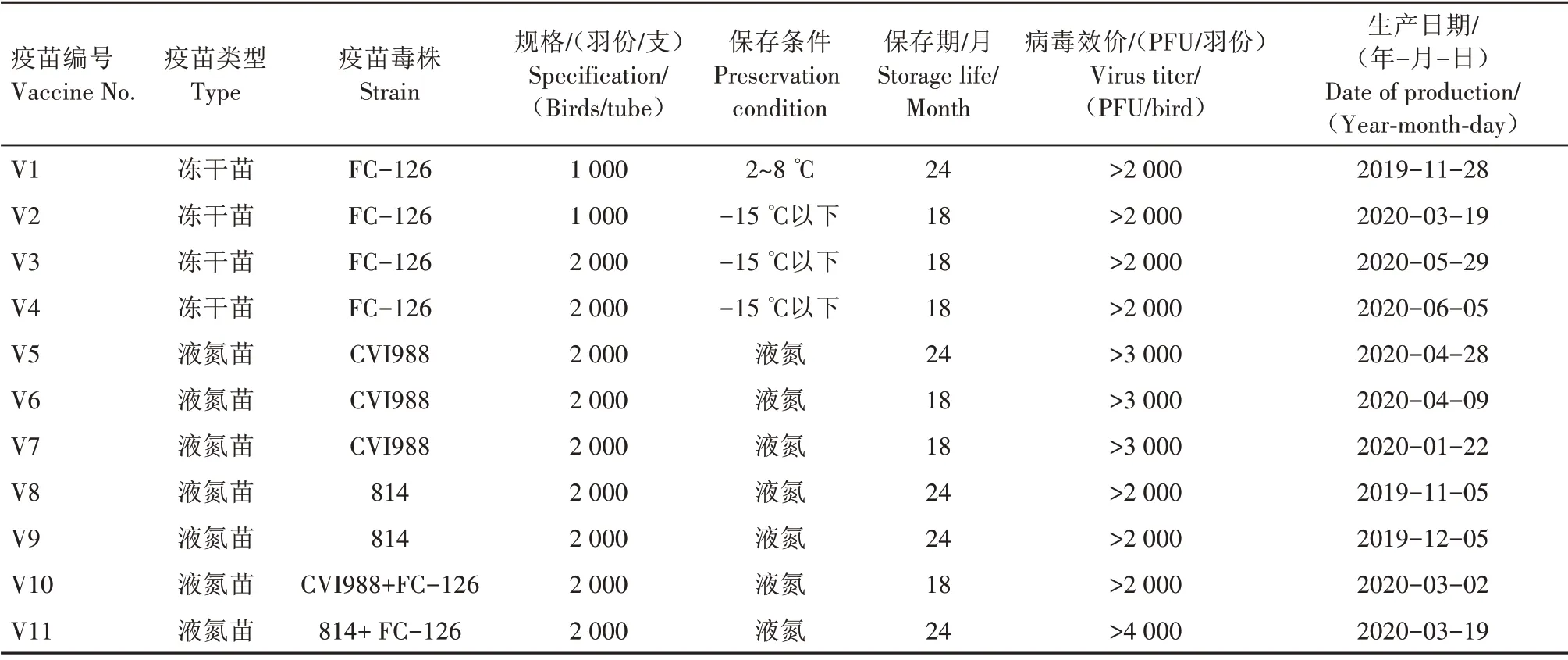
表1 MD疫苗产品及背景信息Tab.1 Background of the MD vaccines used in this study
1.2 主要试剂
M199 培养基和胎牛血清(FBS)购自Gibco 公司;0.25%胰酶和青链霉素双抗购自Solarbio 公司;TPB(Tryptone phosphate broth)培养基购自BD公司;MDV pp38 和gB 单克隆抗体,均为英国Pirbright 研究所Venugopal Nair 教授馈赠;DyLight 594 Goat Anti-Mouse IgG 和DyLight 488 Goat Anti-Mouse IgG购自Abbkine 公司;去除基因组DNA 及反转录试剂盒和EasyTaq 聚合酶购自北京全式金生物技术有限公司;3 种不同品牌的ALV ELISA 抗原检测试剂盒[国生生物(NECVB)、荷兰Biochek、美国IDEXX]分别购自哈尔滨国生生物科技有限公司、河南梅迪安牧业有限公司和爱德士缅因生物制品贸易(上海)有限公司;ALV ELISA 特异性抗原检测试纸条购自哈尔滨国生生物科技有限公司。
1.3 CEF制备
常规方法制备CEF 细胞悬液,计数之后按照1.5×105个/孔的初始量,将CEF 铺至24孔细胞板中,37 ℃、5%CO2培养箱培养12~24 h,待CEF长至细胞单层备用。
1.4 疫苗接种
MD 冻 干 苗 用 含2% FBS 的M199(2% FBS/M199)定容至10 mL/支,反复吹打混匀备用;MD 液氮苗取出后立即置于37 ℃水浴,1 min 内融化,用2% FBS/M199 定容至10 mL/支,反复吹打混匀。取一块新的24 孔板,每孔加入400 µL 2% FBS/M199培养基。向第1 孔中加入上述已10 倍稀释好的待检疫苗(400µL/份),反复吹打混匀5~10 次,等量取出400 µL 转入下一孔,依次倍比稀释,第1 孔标记为21,连续稀释至218。待所有疫苗均稀释完毕后,从26—218稀释孔依次重悬后平行转接至提前制备好的24 孔板CEF 单层中(100 µL/孔),每个疫苗稀释度均设置3 个重复孔,37 ℃、5% CO2培养箱培养96 h。
1.5 间接免疫荧光试验(IFA)
显微镜下观察出现典型病毒噬斑后,优先挑选噬斑量为10~30个/孔的稀释度及其前后2个稀释度(共15个细胞孔)进行IFA检测。步骤:弃去24孔板细胞维持液,每孔加入200 µL 预冷的细胞固定液(V甲醇∶V丙酮=1∶1),室温静置10 min;用PBST 溶液(含0.05% Tween-20 的PBS)洗3 遍、甩干,加入含5%脱脂奶粉的PBST 封闭液,37℃孵育30 min;弃去封闭液,用PBST 洗3 遍、甩干,加入MDV gB 单克隆抗体(1∶200),200µL/孔,置37 ℃温箱孵育30 min;弃去gB 单克隆抗体,用PBST 洗3 遍、甩干,分别加入DyLight 488 Goat Anti-Mouse IgG(1∶1000),200µL/孔,置37 ℃温箱孵育30 min;弃去二抗,用PBST 洗3 遍、甩干。对于MD 单价苗接种的CEF 细胞板,每孔各加入200µL PBST,即可置于倒置荧光显微镜下观察噬斑并计数。对于MD 双价苗接种的CEF 细胞板,每孔分别再次加入100 µL MDV pp38单克隆抗体(1∶200),置37 ℃温箱孵育30 min;弃去pp38 单克隆抗体,用PBST 洗3 遍、甩干,分别加入DyLight 594 Goat Anti-Mouse IgG(1∶500),200µL/孔,置37 ℃孵育30 min;弃去二抗,用PBST洗3遍、甩干,每孔加入200µL PBST,倒置荧光显微镜下观察噬斑并计数。
1.6 噬斑计数及数据分析
选取每孔出现10~30 个病毒噬斑的连续3 个稀释度细胞孔进行计数。每个稀释度统计3 个重复,分别用x、y和z表示。以噬斑数量平均值为10~30个/孔的疫苗稀释度(2n)为最佳依据,按照公式∑=(x+y+z)/3×2n进行计算,获得每100µL疫苗原液的效价∑,用∑除以每100µL疫苗原液所含的羽份数,即为每羽份的病毒效价(PFU/羽)。不同批次的每种疫苗产品均各取3 支,按照上述方法重复测定3 次并计数。根据3 次重复测定的病毒效价,应用GraphPad Prism 6.0 软件,统计分析不同来源、不同类型及不同批次疫苗之间的病毒效价差异显著性。
1.7 ALV和REV检测
每种疫苗各取3支进行稀释,按照50 PFU/孔的初始量分别接种24 孔板CEF 单层,37 ℃、5%CO2培养箱培养96 h后分别收集细胞和上清。-20 ℃反复冻融3 次,8 000 r/min 离心10 min,上清即可用于ALV 或REV 检测。各取400 µL 离心上清,分别用3种不同的ALV ELISA 抗原检测试剂盒和ALV 抗原检测试纸条,按照产品说明书进行ALV 检测。另外各取200 µL 离心上清,按照参考文献[20]中的RTPCR 方法,以HNGS206 和HNXZ103 病毒株为阳性对照,对REV 的潜在污染进行检测。用于扩增REV的LTR、gag和pol基因的特异性引物,均由生工生物工程(上海)股份有限公司合成。
2 结果与分析
2.1 MD疫苗感染CEF的IFA染色结果
将不同来源的MD疫苗(表1)稀释后,分别接种CEF 单层,感染96 h 后镜下观察均可看到典型的病毒噬斑形成。用MDV 特异性的gB 和pp38 单克隆抗体分别进行IFA染色,结果如图1所示。从图1可以看出,所有被检的MD 液氮苗(单价苗或双价苗)和HVT 冻干苗(FC-126)感染的CEF 中,均可观察到gB 单克隆抗体特异性染色的绿色病毒噬斑;而pp38 单克隆抗体特异性染色的红色病毒噬斑仅在含有MDV-1 疫苗株(CVI988 或814)的液氮苗感染的CEF 中出现,HVT 疫苗接种的CEF 则均未发现。通过2 种单克隆抗体对病毒噬斑染色的重叠分析,在MD 双价苗感染的CEF 中可同时观察到CVI988和HVT(或814 和HVT)共感染的病毒噬斑,其中CVI988和814病毒呈现为相似的橘红色,而HVT 主要呈现绿色的病毒噬斑。上述结果表明,IFA 染色的病毒噬斑特异性强,可用于下一步MD 疫苗的病毒效价测定。
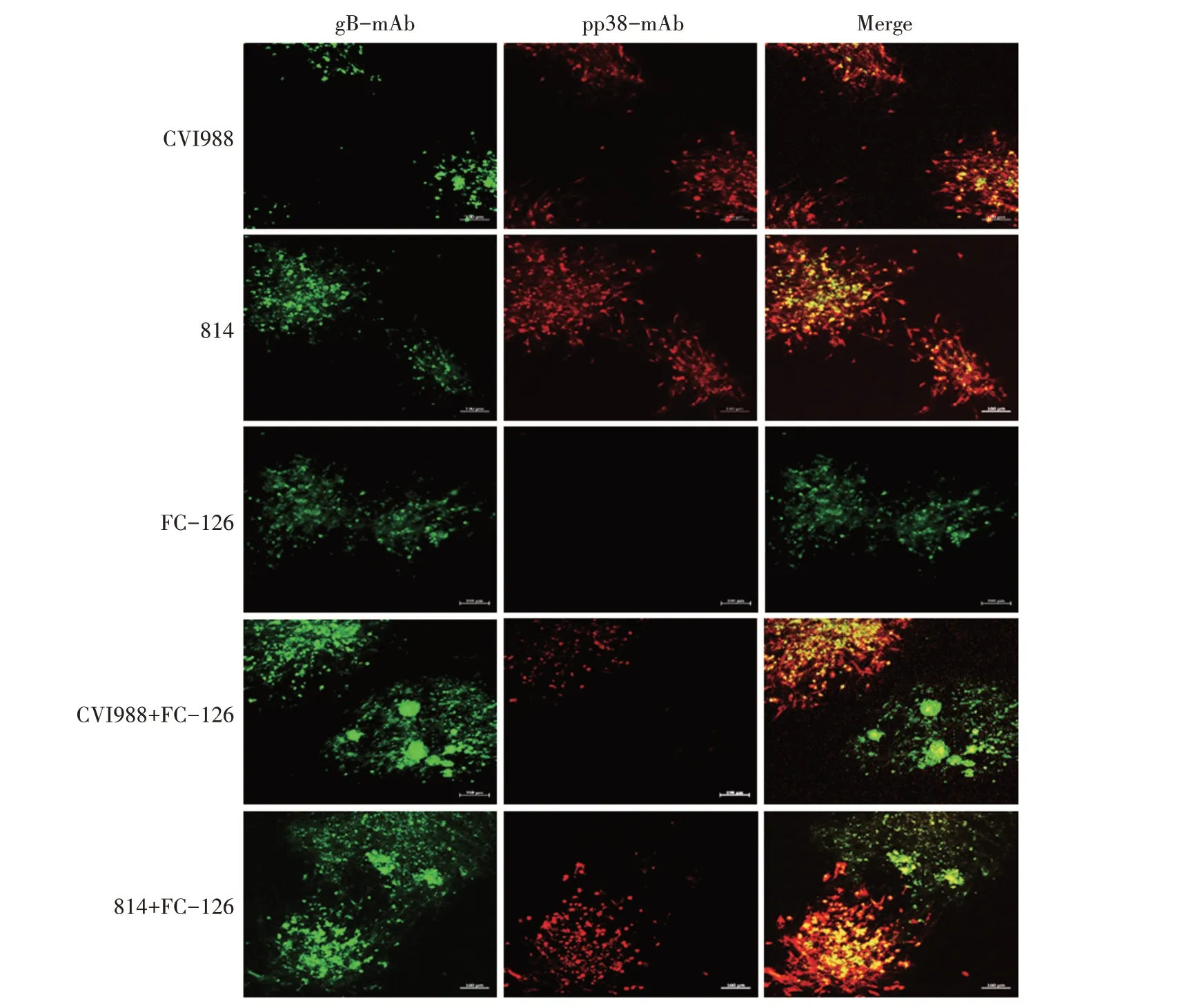
图1 MD疫苗感染CEF的IFA染色结果Fig.1 IFA staining results of CEF infected with MD vaccine
2.2 MD疫苗病毒效价测定结果
利用IFA 染色和病毒噬斑计数,对9 家不同企业生产的11 个批次MD 疫苗产品随机进行病毒效价测定,结果如表2 所示。编号为V1—V4 的4 批不同品牌HVT 冻干苗的病毒效价仅为83.90~109.50 PFU/羽份,均远低于产品说明书标注的2 000 PFU/羽份(表1);在所检测编号为V5—V11 的全部液氮苗中,所有类型的MD 液氮苗效价均高于5 500 PFU/羽份(表2),远高于其产品说明书标注值和国家标准规定值。对不同品牌的同类MD 疫苗产品之间进行对比分析(图2),发现3 批进口或国产的CVI988 单价液氮苗(V5—V7)之间的病毒效价无显著差异,2批不同品牌的814国产单价液氮苗(V8和V9)之间病毒效价差异显著(P<0.05),而2批不同品牌的国产双价液氮苗(V10 和V11)之间病毒效价差异极显著(P<0.01)。
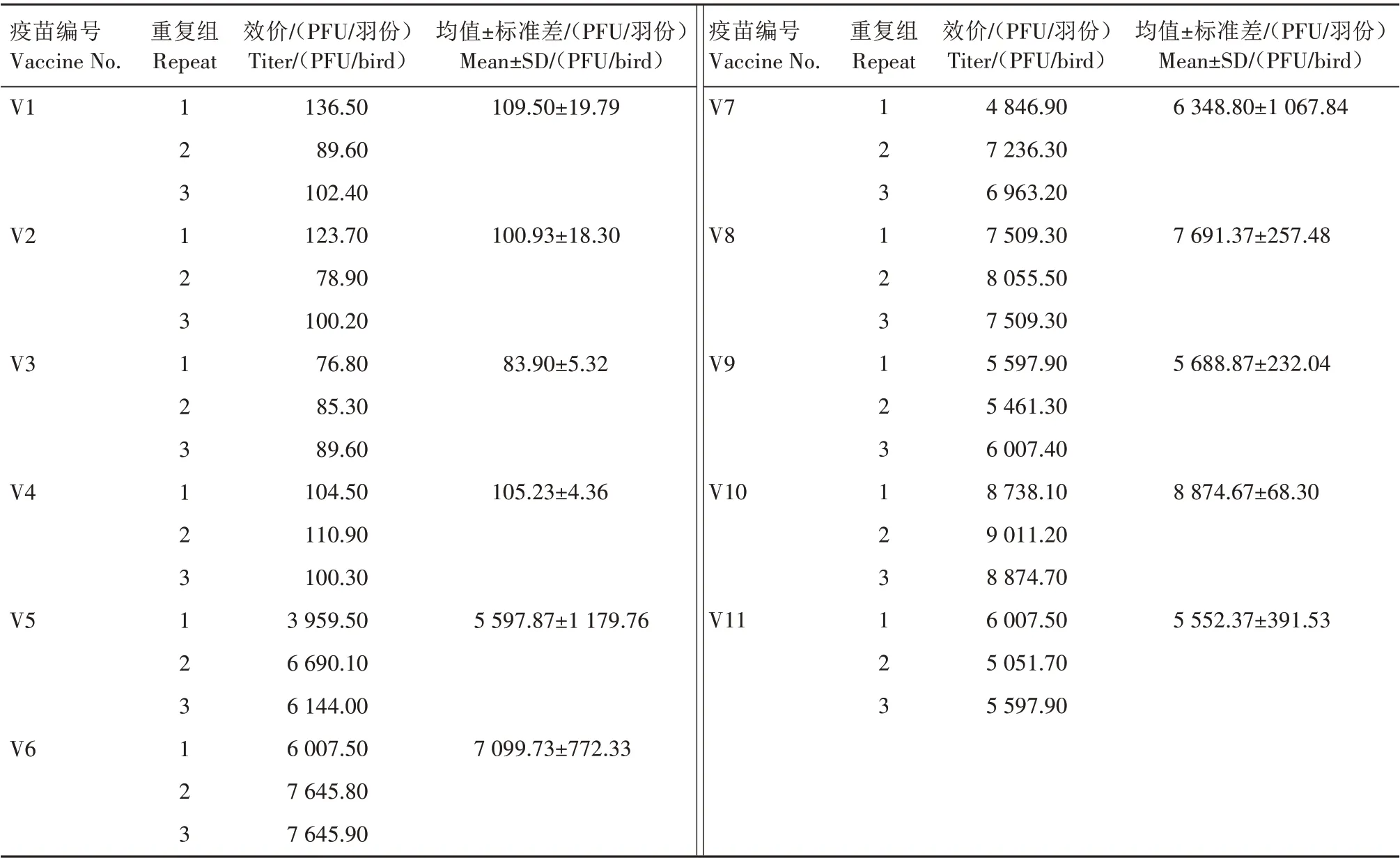
表2 2020—2021年部分市售MD商品疫苗效价Tab.2 Virus titers of the commercial MD vaccines sold in 2020—2021
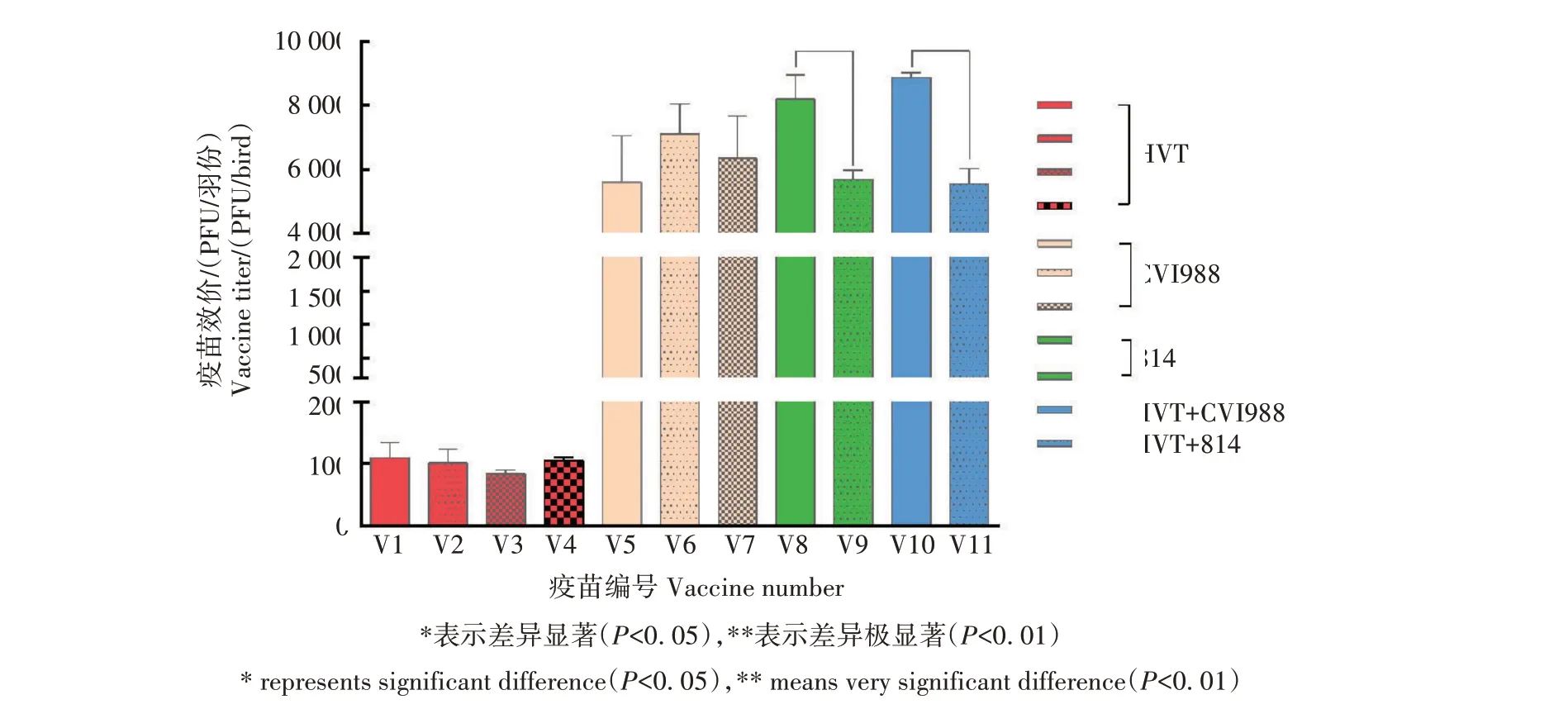
图2 2020—2021年市售MD疫苗效价对比及差异显著性分析Fig.2 Analysis of the virus titer difference of different MD vaccines sold in 2020—2021
2.3 MD疫苗外源病毒污染检测结果
用商品ELISA 试剂盒、胶体金试纸条或RTPCR方法分别对MD疫苗中可能存在的ALV和REV外源污染进行了检测。结果显示,采用ALV 抗原试纸条和3 种ALV 抗原检测ELISA 试剂盒检测的11批次MD疫苗产品及其CEF培养物中的ALV均为阴性,而试剂盒对照样品检测均为阳性(表3)。采用RT-PCR 方法对上述样品进行REV 检测,虽然阳性对照毒株HNGS206 和HNXZ103 感染细胞样品中均扩增出了REV 的LTR、gag和pol基因预期的阳性产物,PCR 产 物 条 带 大 小 分 别 为367 bp、309 bp 和475 bp,但待检的MD 疫苗产品及其CEF 培养物均为阴性(图3)。
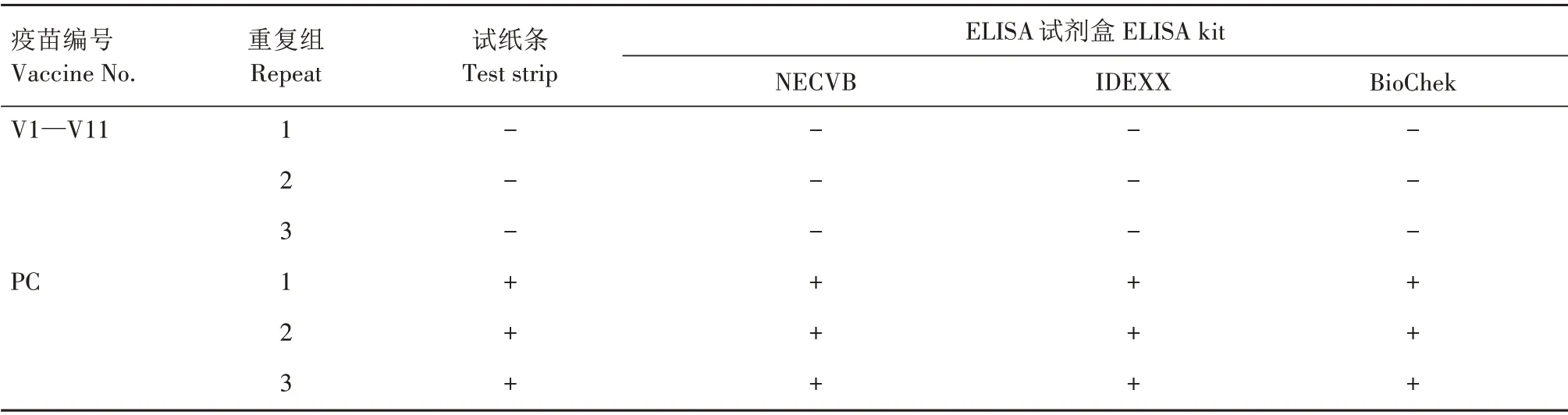
表3 MD疫苗及细胞培养物中ALV的检测结果Tab.3 Detection results of ALV contaminated in MD vaccine and cell cultures
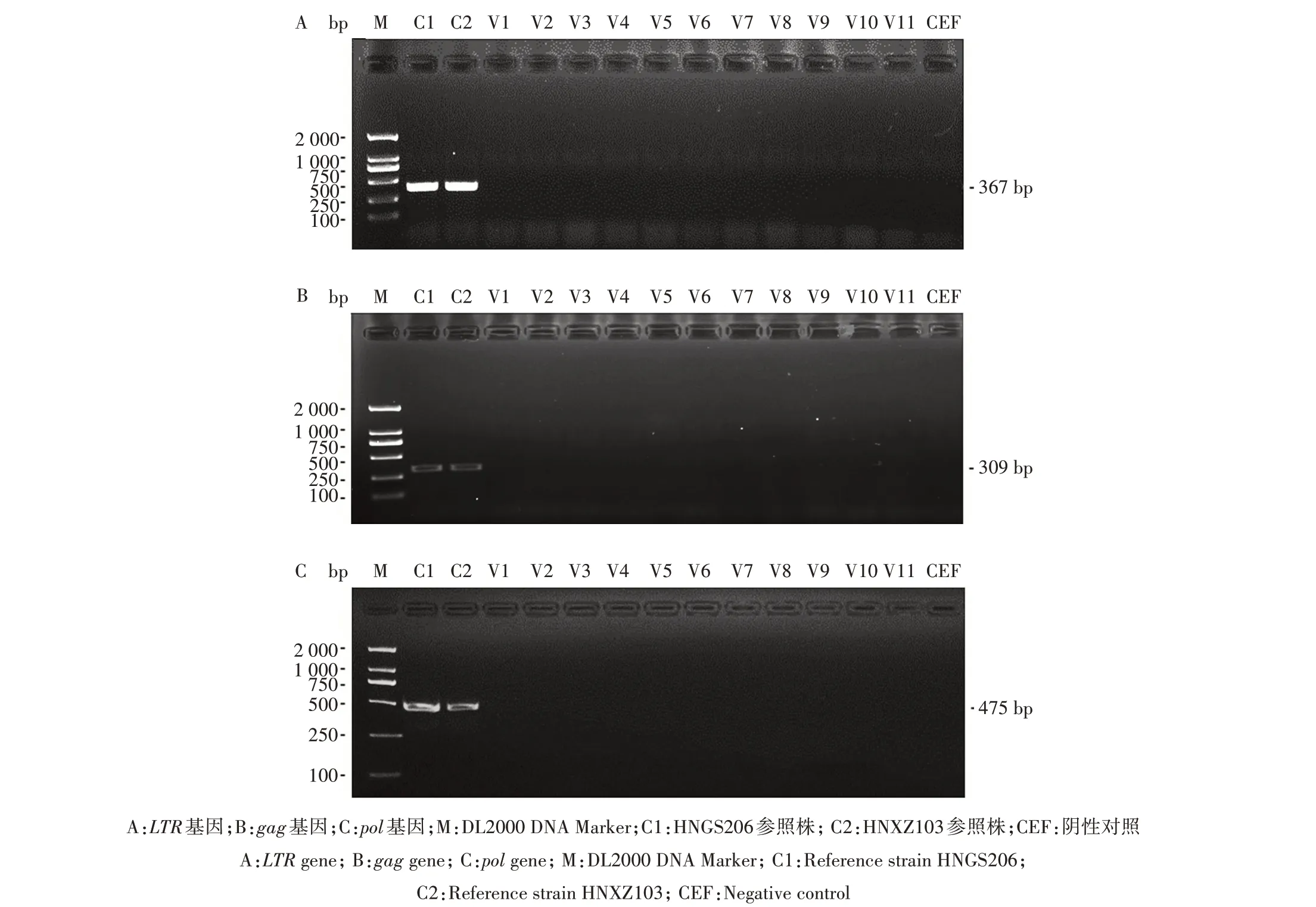
图3 MD疫苗中REV LTR、gag和pol基因的PCR扩增结果Fig.3 PCR amplification of REV LTR,gag and pol genes from MD vaccines
3 结论与讨论
来自国家兽药基础数据库的数据显示,2014 年以来,包括新型的MD 基因工程疫苗在内,国内共有57 种具有生产批号的MD 疫苗产品,并且27 个生产企业多数可同时生产2~3 类MD 疫苗。如此众多的MD 疫苗种类和生产企业,给养殖企业的技术人员合理选择和有效使用疫苗带来极大困扰。疫苗质量是否达标是能否被选用的首要条件。当前国内市场常用的MD 疫苗株主要有HVT、CVI988 和814,但MD 免疫鸡群仍时有疫情暴发,说明疫苗质量可能是值得关注的重要因素之一。因此,本研究随机挑选了来自9 家不同生物企业生产的11 个批次MD疫苗,进行了病毒效价测定和对比分析,同时对可能存在的ALV 和REV 外源污染进行了评估。根据2020 年版《中华人民共和国兽药典》[21]规定,MD 疫苗效价测定的方法是通过琼脂糖固定噬斑进行计数。但该方法不及IFA 敏感性高,且后者可以通过使用不同的一抗和荧光标记二抗,同时区分不同血清型的MDV 噬斑,尤其适用于双价苗的效价测定。基于上述优点,IFA 已越来越多应用于MDV 的定性和定量检测[22-24]。因此,利用MDV-1 和HVT 保守的gB 单克隆抗体和MDV-1 特异的pp38 单克隆抗体,本研究在不同类型的MD 疫苗接种的CEF 中,成功地对相应血清型的MDV噬斑进行了染色,尤其是在MD 双价苗(CVI988+HVT 和814+HVT)感染的CEF中同时观察到2 种不同血清型的病毒噬斑,说明IFA 染色进行MD 病毒效价测定的有效性和准确性。
在已检测的MD疫苗产品中,7批液氮苗的病毒效价均在5 500 PFU/羽份以上,远远超出产品说明书标注值,也是国标2 000 PFU/羽份的2 倍以上,与此前研究报道基本一致[25]。该结果充分表明,MD液氮苗具有病毒效价稳定性强的优势。对比发现,被检的国产或进口CVI988 单价液氮苗之间效价并无明显差异,但不同企业生产的双价液氮苗和814液氮苗产品之间存在显著差异。对于病毒效价已达标的MD 液氮苗而言,这种差异基本不会影响疫苗质量,可以忽略不计。然而,被检的4 种HVT 冻干苗病毒效价仅为83.90~109.50 PFU/羽份,均不及国标规定值的1/10,这与预期结果相差甚远。根据本研究同批试验测定的MD 液氮苗效价结果,完全可以确定IFA 用于MD 疫苗效价测定的可靠性。因此,根据对4批HVT冻干疫苗3次重复检测的结果,可以判定本次抽检的HVT 冻干苗效价不合格率为100%。国家兽药基础数据库数据显示,2020—2021年国内有批号的HVT 冻干疫苗共25 批,分别来自17 家企业。本研究检测的HVT 冻干苗为随机购买产品,HVT 冻干苗效价偏低可能不是偶然现象。近期,在临床上已多次确诊15~30 日龄肉鸡群在使用HVT 冻干苗免疫之后仍急性感染,并大批发病死亡的MD 病例,这极可能与疫苗效价不达标有关。鉴于除生产环节之外,冻干苗产品质量还与疫苗保存、运输、配送、使用等多种因素密切相关,今后有必要对更多同类产品进行质量监测。
ALV 和REV 均能引起家禽肿瘤和免疫抑制,临床上经常与MDV 发生混合感染[26-29]。MD 疫苗中ALV 的污染不仅严重影响鸡的生产性能[30-32],而且会给已采取ALV 净化措施的养殖企业带来新风险。REV 部分基因可通过重组插入MDV 基因组形成新的变异毒株,引起更大危害[33-37],给MD 的防控带来新的挑战。因此,对现有MD 疫苗是否存在ALV 和REV 的外源污染进行监测,对鸡群肿瘤性疾病的防控具有重要现实意义。本研究中,同时使用了3 种ALV群特异性抗原检测ELISA试剂盒和1种ALV抗原检测试纸条,分别对同批MD 疫苗产品进行了检测。对于REV 的检测,采用RT-PCR 方法分别对LTR、gag和pol等3 个基因同时进行了检测,在增加试验重复性的同时也提高了检测结果的可靠性,使判定结果更具有说服力。最终的检测结果表明,被检的9种不同品牌11批次MD 疫苗产品中均不存在ALV 和REV 污染,说明相关疫苗产品洁净无污染。由于MD 疫苗种类多样,市场销售复杂,不同时间不同批次的MD 疫苗污染情况的检测结果也各不相同。中国兽医药品监察所2014 年对国内10 家企业生产的43 批MD 疫苗进行的监测结果表明,其中2个企业生产的4批疫苗污染了REV[38]。2015年,毕玉彧[39]对广西和广东已开展ALV 净化的4家种鸡场常用的由14 家企业生产的45 份疫苗进行了外源性ALV 检测,结果在2 份疫苗中检测到了ALV-J。2018 年,中国兽医药品监察所抽检的MD 疫苗中未检到REV和ALV污染[40]。然而,2019年湖北等地则又报道了ALV 污染疫苗的情况[41]。上述研究结果说明,要严把疫苗质量关,并定期开展疫苗监测。本研究结果填补了2020—2021 市售MD 疫苗污染状况监测的空白,为MD 疫苗的合理选择和使用提供了重要参考,类似研究在今后的MD 防控中仍需要不断加强和持续开展。
