超高压处理对复合山药泥贮藏期间品质变化的影响
2022-09-02王智颖李钦陈云吴燕赵靓王永涛廖小军
王智颖,李钦,陈云,吴燕,赵靓,王永涛,廖小军
(中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心,农业农村部果蔬加工重点实验室,食品非热加工北京市重点实验室,北京 100083)
果蔬泥产品具有天然果蔬的特有风味,口感醇厚,营养丰富,可不经咀嚼直接吞咽食用,是一类重要的方便即食果蔬制品,非常适合儿童、老人、病人等人群食用。但目前市面上的复合果蔬泥的原料多采用浓缩还原果汁/浆,容易造成果蔬泥原有的风味、营养、品质及口感的不足,产品质量不高。因此,选用新鲜果蔬汁/浆代替浓缩汁来进行加工能有效保证果蔬泥产品品质。
此外,目前市场上果蔬泥杀菌为热杀菌,但热处理会造成产品品质的劣变。超高压(High hydrostatic pressure,HHP)是非热加工技术中研究最多、商业化程度最高的一种技术,其只作用于非共价键,对共价键没有影响,因此它可以最大限度保留食品的色、香、味等品质[1]已经成为替代热杀菌非常重要的技术。
果蔬类原料中,山药系薯蓣科植物薯蓣的根茎[2],是一种常见的蔬菜植物,具有可口的风味品质,其中淮山药还是一种中药材,兼有药用保健功效。秋葵也是一种营养价值较高的药食同源蔬菜,具有抗氧化、抗疲劳、抗肿瘤等多种功效[3],并且富含组氨酸和精氨酸,这两种是维持老年人和婴幼儿正常生理功能所必需的氨基酸。猕猴桃营养成分包括了糖类、果胶、有机酸、单宁、色素等矿物质,因为其丰富Vc含量,被誉为水果当中的中“Vc之王”,也是重要的营养补充来源。
因此,本文以山药、猕猴桃和秋葵为原料,立足于山药、猕猴桃和秋葵的药膳和营养价值开发一款药食同源的复合山药泥,并研究超高压处理对山药泥在贮藏期间微生物和各项品质变化的影响,以期为超高压技术应用于天然果蔬泥制品提供数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 试验原料
新鲜成熟山药(Dioscorea opposita):外观新鲜、无外伤、无腐烂,品种为“怀山药”,产地河南;新鲜成熟秋葵(Abelmoschus esculentusL.):外观新鲜、色泽明亮、无外伤、无腐烂,品种为“浓绿五角”,产地山东;新鲜成熟猕猴桃(Actinidia chinensis):外观新鲜、软硬适中、无外伤,品种为“徐香猕猴桃”,产地陕西。
1.1.2 主要试剂
平板计数培养基、孟加拉红培养基和Tirs-HCl,购自于北京索莱宝科技有限公司;氯化钠、无水甲醇、乙酸、盐酸、三水乙酸钠、二水磷酸二氢钠和十二水磷酸氢二钠,购自于北京化工厂;没食子酸、Na2CO3和FeCl6·H2O,购自于北京化学试剂公司;福林酚、DPPH·、TPTZ和Trolox,购自于上海源叶生物科技有限公司;果胶购自于上海阿拉丁生化科技有限公司;氢氧化钠和邻苯二酚,购自于北京蓝弋化学试剂公司。以上试剂无特别说明均为分析纯。
1.1.3 仪器与设备
SW-CJ-2D超净工作台,苏州净化设备有限公司;HWS-70B电热恒温培养箱,天津市泰斯特仪器有限公司;Spx-0288低温生化培养箱,宁波江南仪器厂;ColorQuestXE色差仪,美国Hunterlab公司;Orion 868 pH计,美国Thermo Orion公司;DR-A1阿贝折射仪,ATGO.Co., Ltd;EY-300A分析天平,日本松下电器公司;S-HH-W21-Cr600恒温水浴箱,北京长安科技仪器厂;V1800可见分光光度计,尤尼科(上海)仪器有限公司;UV-762紫外分光光度计,上海精密科学仪器有限公司;CR21GⅢ高速冷冻离心机,日本日立公司;842自动电位滴定仪,瑞士万通公司;CLXXUVFM2超纯水器,ELGA LabWater (U.K.);JYL-C051九阳打浆机,九阳股份有限公司;DZQ400/500/600热封机,上海佳河包装机械有限公司;AR-1000流变仪,美国TA仪器有限公司;LS 230激光粒度仪,美国贝克曼公司。
1.2 方法
1.2.1 复合山药泥的制备
选取新鲜的山药清洗、去皮、切块,在沸水中预煮15 min后备用;选取新鲜的秋葵清洗,在沸水中漂烫1 min后切段;猕猴桃清洗、去皮、切块。根据预实验感官分析的结果,将山药、秋葵和猕猴桃按质量比6:2:2、5:2:3、4:2:4、3:2:5混合,室温下榨汁机打浆3 min,将制备的山药泥立即分装到6×9 cm高温蒸煮袋中,20 g/袋。
制备好复合山药泥后,立即进行感官评价。对样品的口感、组织状态、风味、色泽各项指标进行评分。将不同比例的山药泥分装到品尝杯中并随机编号提供给12名经过培训的感官评价员进行品评。综合感官评价的结果,选择复配比例山药:秋葵:猕猴桃为4:2:4为最佳配比进行后续试验。
1.2.2 HHP处理与热处理
HHP处理:将袋装的山药泥置于超高压处理釜中,根据预实验结果,选定400 MPa/5 min、400 MPa/10 min和500 MPa/2 min进行HHP处理,处理温度为室温20 ℃;热处理(Thermal processing,TP):根据预实验结果,将样品置于水浴锅中,在样品中心温度达到97 ℃后维持2 min。处理后的样品放入4 ℃冷库进行贮藏。
1.2.3 微生物的检测
选取菌落总数、霉菌和酵母菌作为微生物检测指标,分别选用平板计数琼脂培养基和孟加拉红培养基,根据GB 4789.2-2016的相关操作进行微生物菌落计数。试验结果为两平行、两重复数据平均所得。
1.2.4 pH值的测定
将待测果蔬泥倒入烧杯并搅拌均匀,在常温20 ℃下用pH计进行测定,待示数稳定后进行读数。
1.2.5 可溶性固形物(TSS)的测定
使用阿贝折射仪测定。先用蒸馏水对仪器进行校零,每次测量后均使用蒸馏水清洗。
1.2.6 色差测定
用色差仪进行测定。首先连接并校正仪器,参数设置为RSIN-镜面反射,面积为0.375英寸。测定样品的L*、a*、b*值,ΔE计算公式为:
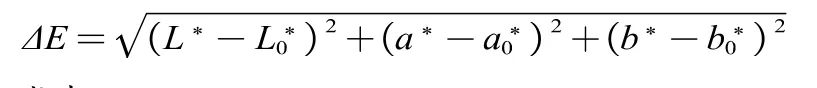
式中:
ΔE——总色差;
L*——处理后样品亮度值;
L0*——处理前样品亮度值;
a*——处理后样品红色值;
a0*——处理前样品红色值;
b*——处理后样品黄色值;
b0*——处理前样品黄色值。
1.2.7 总酚含量测定
采用Folin-ciocalteu法测定总酚含量,略作修改。称取10 g果蔬泥于20 mL的无水甲醇中,混匀后放置在4 ℃下静置提取30 min,然后在4 ℃、10250 r/min下离心10 min,取上清液备用。将0.1 mL上清液稀释至0.4 mL,与2 mL用超纯水稀释十倍的福林酚混合。室温下避光反应1 h后,加入1.8 mL质量分数为7.5%的Na2CO3溶液。避光反应30 min后,在765 nm处测定其吸光值。总酚含量以每100 g样品含有相当于没食子酸(GAE)的毫克数表示。每个样品重复测定3次。
没食子酸标准曲线的制作:配置10、20、40、60、80和100 μg/mL的没食子酸溶液,其吸光值的测定方法与样品相同。得到标准曲线:y=0.0108x+0.0538(R²=0.9991)。
1.2.8 抗氧化能力的测定
1.2.8.1 清除DPPH·能力
参照Miller等[4]的方法并略作修改。吸取100 μL上清液和4 mL 0.14 mmol/L的DPPH·溶液(使用无水甲醇配制),混匀后在常温下避光反应45 min。用蒸馏水调零,在517 nm处测定其吸光值。以等量的无水甲醇加DPPH·溶液为对照。DPPH·清除能力用Trolox当量表示,单位为mmol/kg。
Trolox标准曲线的制作:用甲醇配制浓度为0.1、0.2、0.4、0.6、0.8和1.0 mmol/L Trolox标准溶液,其测定方法与样品相同。得到标准曲线:y=0.9352x+ 0.5945(R2=0.9981)。
1.2.8.2 FRAP铁还原能力测定
参照Aljadi等[5]的方法并略做修改。将样品上清液稀释十倍,取100 µL稀释液加入到4 mL TPTZ工作液中,于37 ℃反应10 min后,测定其在593 nm处的吸光值。
TPTZ工作液配置:将pH为3.6的醋酸盐缓冲液、10 mmol/L TPTZ溶液(用盐酸配制)、20 mmol/L FeCl3按体积比10:1:1配制而成。
Trolox标准曲线的制作:用甲醇配制浓度为0.1、0.2、0.4、0.6、0.8和1.0 mmol/L Trolox标准溶液,其吸光值测定方法同样品。得到标准曲线:y=0.9325x+ 0.5945(R2=0.9953)。
1.2.9 流变特性的测定
参照Liu等[6]的方法,并略做修改。采用AR-1000型流变仪,选择直径为40 mm的平板夹具,并用循环水系统将测定温度控制在25 ℃,设置间隙为1 mm。测定剪切速率从10 s-1上升到100 s-1的过程中剪切应力、黏度随剪切速率的变化情况[7]。
1.2.10 粒径分布
选用廖红梅等[8]方法并略作修改。采用激光粒度分析仪测定样品的粒径分布(Paticle Size Distribution,PSD)。LS 230激光粒度仪选大粒径模式测定粒径为0.4 μm到2000 μm的颗粒带下及分布,同时记录样品体积平均粒径D4,3和表面积平均粒径D3,2[9]。
1.2.11 残余酶活测定
1.2.11.1 多酚氧化酶(PPO)的测定
参照Mcinerney等[10]的方法,并略作修改。将5 g样品与30 g磷酸缓冲液(pH=6.50、2 mol/L),混合均匀,在4 ℃下静置1 h后,离心15 min(10250 r/min,4 ℃),取上清液为PPO酶粗提液。反应底物为2 mL邻苯二酚溶液(0.2 mol/L)和1 mL PPO粗酶液,立即在420 nm处测定吸光值随时间的变化曲线,测定60 s,扫描时间间隔为1 s,曲线直线部分的斜率即为PPO酶活性。残余酶活计算公式如下:

1.2.11.2 果胶甲酯酶(PME)的测定
采用Rouse和Atkins[11]的方法并略作修改,使用自动电位滴定仪对山药泥的PME活性进行测定。按照质量比1:2称取样品和缓冲液(pH=6.5、0.2 mol/L Hirs-HCl),混合均匀在4 ℃放置24 h后,离心15 min(10250 r/min,4 ℃),取上清液为PME酶粗提液。
用Timao软件设置SET 1的pH为7.0,用0.01 mol/L NaOH溶液滴定50 mL的1%(m/V)果胶底物溶液(含0.01 mol/L NaCl)将pH调节至7.0,系统提示之后SET 2,在30 s内取5 mL PME酶提取液加入其中,并用NaOH(0.01 mol/L)溶液重新自动调节pH至7.0。此时开始,在30 min内,每隔1 s记录滴定所消耗的NaOH(0.01 mol/L)溶液的量。以NaOH溶液的消耗量随时间的变化做出反应曲线,取后段线性部分斜率作为PME酶活性。残余酶活计算公式如下:

1.2.12 数据分析
试验结果以“均值±标准误差”(Mean±S.E)表示。为了保证实验结果的可靠性所有试验均进行4次重复。应用 IBM SPSS STASTISTICS 25统计软件,对数据进行one-way ANOVA分析,p<0.05表示差异显著,p>0.05表示差异不显著,用Origin 2021软件画图。
2 结果与分析
2.1 贮藏期间微生物的变化
4 /24℃ d贮藏期内不同处理样品的微生物变化情况如表1所示。未处理样品中菌落总数达到了5.65 log10CFU/g,但经HHP和热处理后显著下降(p<0.05),其中热处理和400 MPa/10 min处理后没有检出菌落;400 MPa/5 min和500 MPa/2 min处理后菌落总数均小于0.20 lg CFU/g。贮藏过程中,HHP和热处理样品的菌落总数存在小幅波动,但均小于1.00 lg CFU/g。此外,HHP和热处理样品中霉菌和酵母菌在处理后及贮藏期间均没有检出,说明HHP和热处理都对霉菌和酵母菌具有良好的杀灭效果,这与Arroyo等[12]研究发现在350 MPa下可杀死绝大多数霉菌和酵母菌的结论一致。以上结果说明HHP和热处理均能很好保证4 /24℃ d贮藏期内复合山药泥的微生物安全性。
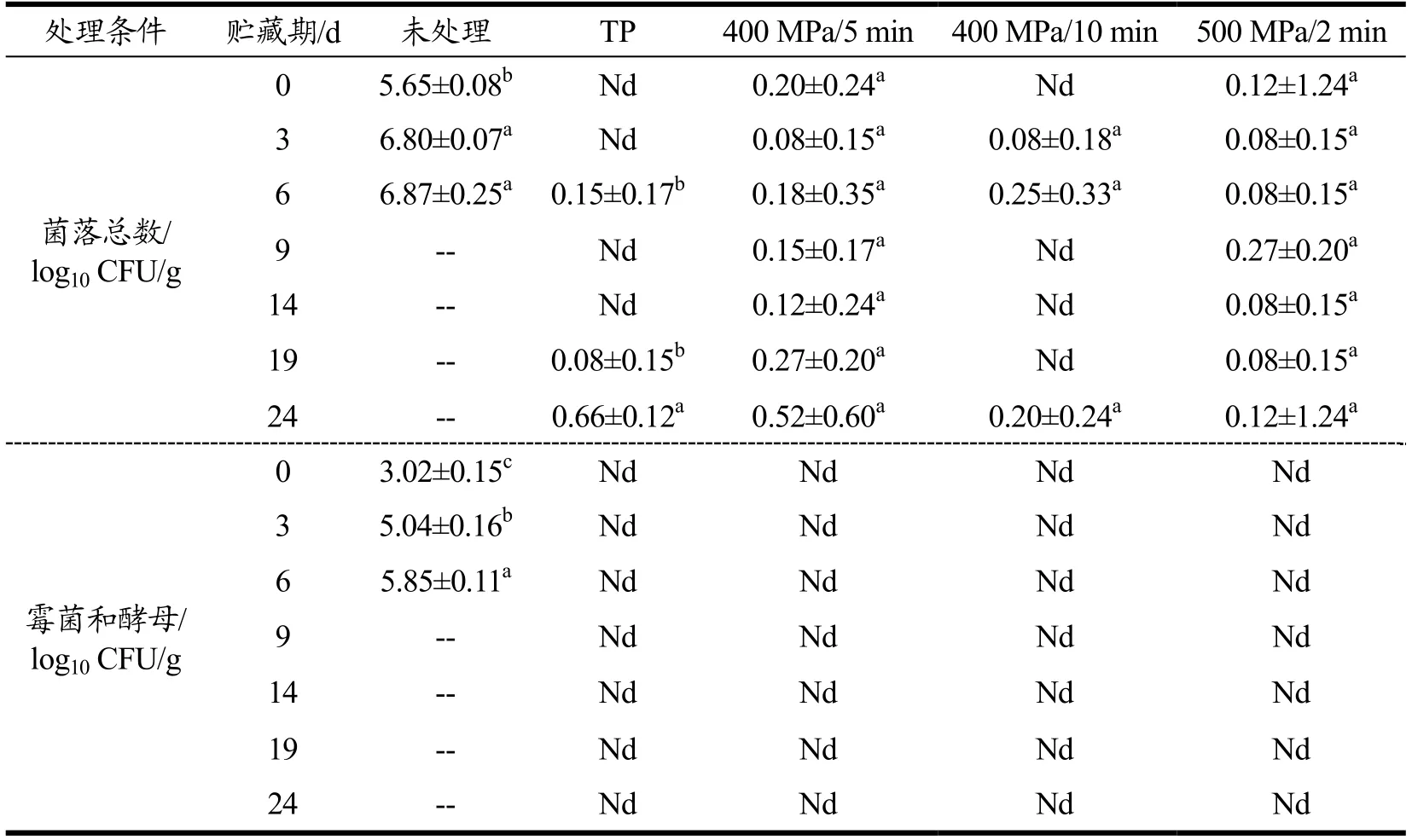
表1 HHP和热处理复合山药泥在贮藏期间微生物的变化 Table 1 Microbial changes of the mixed yam puree treated by HHP and TP during storage
HHP的杀菌效果与食品的微生物种类、体系pH值等有关。结果表明霉菌和酵母的耐压能力比细菌差,霉菌和酵母在400 MPa/5 min、400 MPa/10 min、500 MPa/2 min处理及97 ℃/2 min处理条件下均可以被完全杀灭,贮藏期间也未有霉菌和酵母菌落检出,但菌落总数有检出。这与Pulido等[13]和Picouet等[14]的研究结果一致。
同时,从表1中也能看出,在贮藏期中热处理和400 MPa/10 min处理样品虽然在处理后没有检出菌落,但在贮藏期中却又检出,这可能是由于样品中存在损伤的细菌(亚致死状态),而这类细菌在部分恢复后使得菌落总数上升,但由于样品pH<4且贮藏温度为4 ℃,使得微生物生长得到了有效抑制,菌落总数一直没有超过1.00 lg CFU/g。Yuan等[15]分析了pH对大肠杆菌耐压性的影响,结果证实低pH值可显著促进HHP对大肠杆菌的灭活作用;Michelle等[16]将经过600 MPa/1 min杀菌的脐橙汁分别在4 ℃和10 ℃下贮存12周,发现橙汁体系的高酸性(pH=3.7)能够将HHP处理样品的微生物数量抑制在2.00 lg CFU/g以下。
2.2 贮藏期间pH、TSS和色泽的变化
由表2可知,HHP和热处理前后,样品pH值维持在3.53左右,没有显著性变化。但在4 ℃/24 d贮藏期间,HHP和热处理样品的pH值都显著升高,贮藏14 d后,各处理组的pH值都超过了4,这可能是由于贮藏期间有机酸类物质降解所引起的,其降解速度大于微生物生产繁殖产酸的速度,导致贮藏期间pH上升。贮藏结束时,与热处理组相比,HHP组的pH更小,这可能与果蔬泥组织细胞在高压条件下的通透性改变有关。苏世彦[17]发现,高压处理后果肉细胞成分都有渗出现象,甚至比未处理高出10倍左右。因此,细胞内有机酸等物质溶出导致的pH比热处理的低。另外,Kaushik等[18]研究发现高压会使食物中的水分子电离,从而增加H+的浓度。
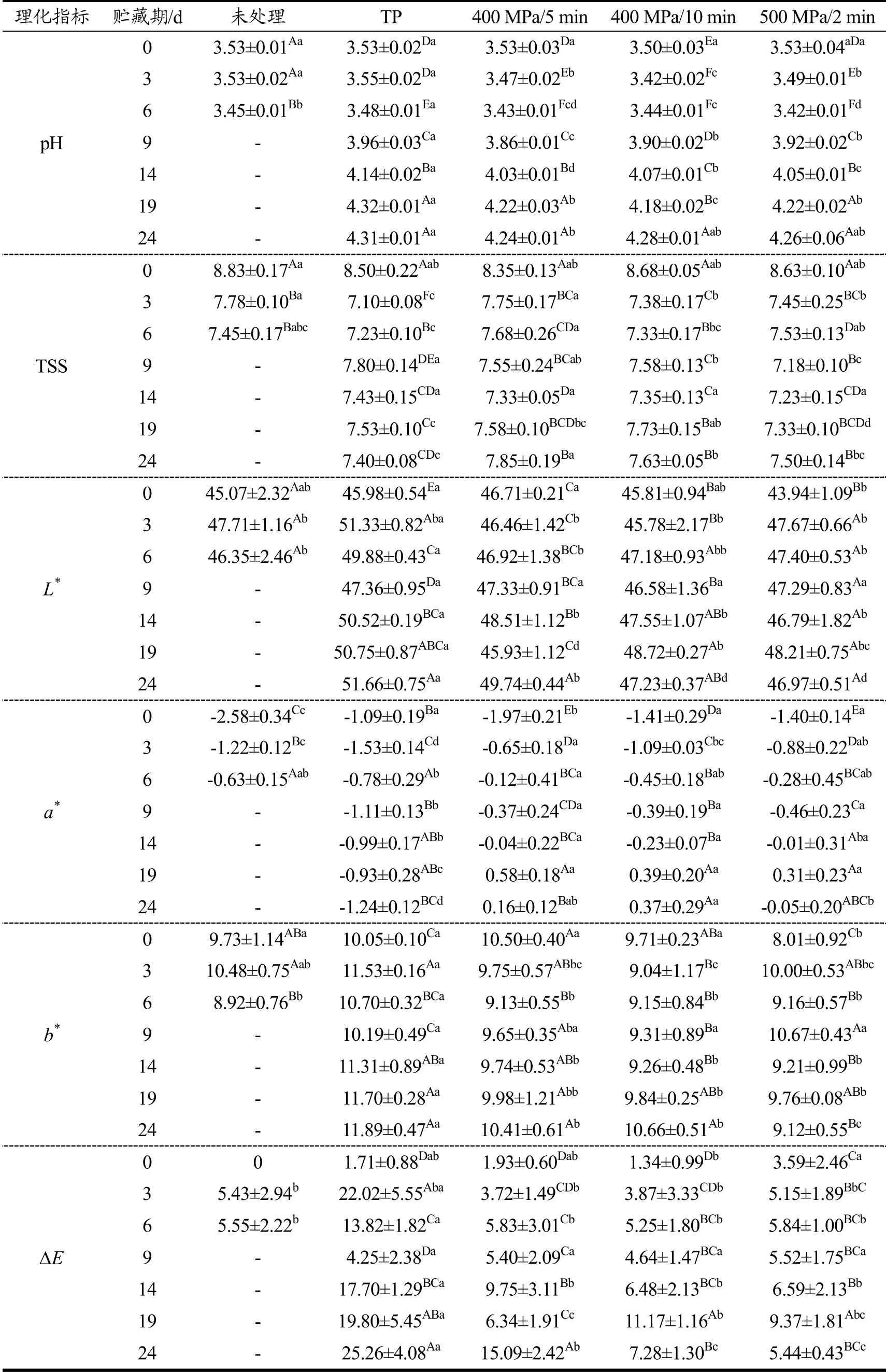
表2 HHP和热处理在贮藏期对复合山药泥理化性质的影响 Table 2 Effects of HHP and TP on physicochemical properties of the mixed yam puree during storage
未处理组样品的TSS为8.83 ◦Brix,经过热处理和不同HHP杀菌条件处理后,复合山药泥的TSS变化均不显著,这与前人的研究结果一致[14,19]。在4 ℃/24 d贮藏后,各处理组均呈现减小的变化趋势,但HHP处理对可溶性固形物有更好的保留作用。这可能是因为在贮藏过程中残留的少量微生物消耗山药泥中的糖类物质来供给自身生长繁殖导致样品中TSS的含量下降[20]。丁克芳等[21]也发现,经过HHP和热处理之后的胡萝卜汁TSS都降低,但热处理降低得更快。
经热处理和HHP处理后样品的L*值和b*值与未处理组没有显著性区别,说明两种处理方式对复合山药泥色泽的亮度和黄值不产生影响,而a*值均有不同程度地升高,复合山药泥更偏向于红色,可能是处理过程中发生了酶促褐变,Chen等[22]和Maskan[23]在对芒果汁和猕猴桃汁的研究中也发现有类似的褐变现象。在4 /24℃ d贮藏后,HHP处理组的L*、a*值均增大,b*值无显著性变化,热处理组L*、b*值增大,a*值减小,并且热处理与HHP相比L*值有显著性升高。一般认为,当ΔE≥2时,样品色泽的差异可以被人的视觉分辨;当ΔE<2时,样品的色泽变化用肉眼不可分辨[24]。贮藏过程中各处理组的ΔE都在上升,但HHP组其ΔE值在贮藏24 d后显著小于热处理组,结果说明HHP相较于热处理能更好的保持复合山药泥贮藏期间的色泽。
2.3 贮藏期间总酚含量的变化
贮藏期HHP和热处理的复合山药泥总酚含量的变化如图1所示。处理后,HHP样品的总酚含量上升了60.66%~227.54%,显著高于热处理样品。这可能是因为HHP处理使组织细胞的通透性增大,同时使部分结合酚转变为游离酚,溶出酚类物质的增加导致总酚含量上升[25]。
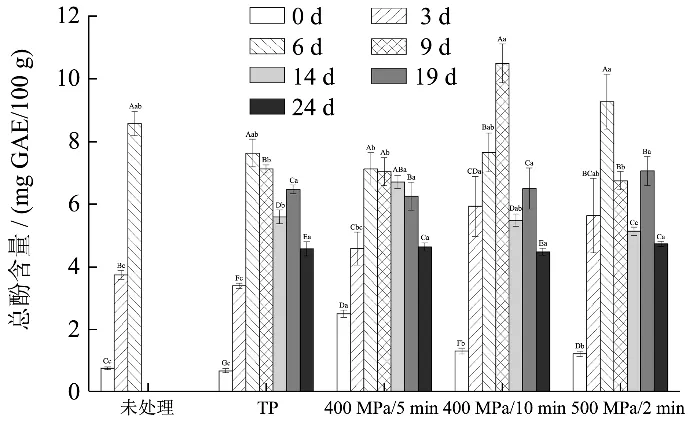
图1 HHP和热处理复合山药泥在贮藏期总酚含量的变化 Fig.1 Changes of total phenol content of the mixed yam puree treatedby HHP and TP during storage
在贮藏过程中,样品总酚含量表现为先上升后下降的变化趋势,这可能是由于样品中酚类物质的溶出与降解之间存在一个动态平衡。其中,总酚含量的增加可能与细胞内酚类物质溶出有关,而由于热处理和HHP处理后PPO并未完全灭活(图4a),PPO催化酚类物质的降解也在持续进行。贮藏期间总体来看,HHP处理样品总酚含量在14 d之前高于热处理样品,但贮藏后期无显著性差异。
2.4 贮藏期间抗氧化能力的变化
图2是不同方式处理复合山药泥在贮藏期间清除DPPH·能力和FRAP铁还原能力的变化情况。与未处理样品相比,热处理后样品清除DPPH·能力显著下降了33.67%,而400 MPa/5 min处理后清除DPPH·能力并没有显著变化。整个贮藏期间样品的DPPH·清除能力总体呈现下降趋势,这可能是样品中酚类、抗坏血酸等抗氧化物质降解导致的[26],在贮藏24 d后,各处理组之间的清除DPPH·能力没有显著性差异。以上结果说明,HHP处理对清除DPPH·能力的保留效果优于热处理,但这一效果在贮藏期间逐渐失去。
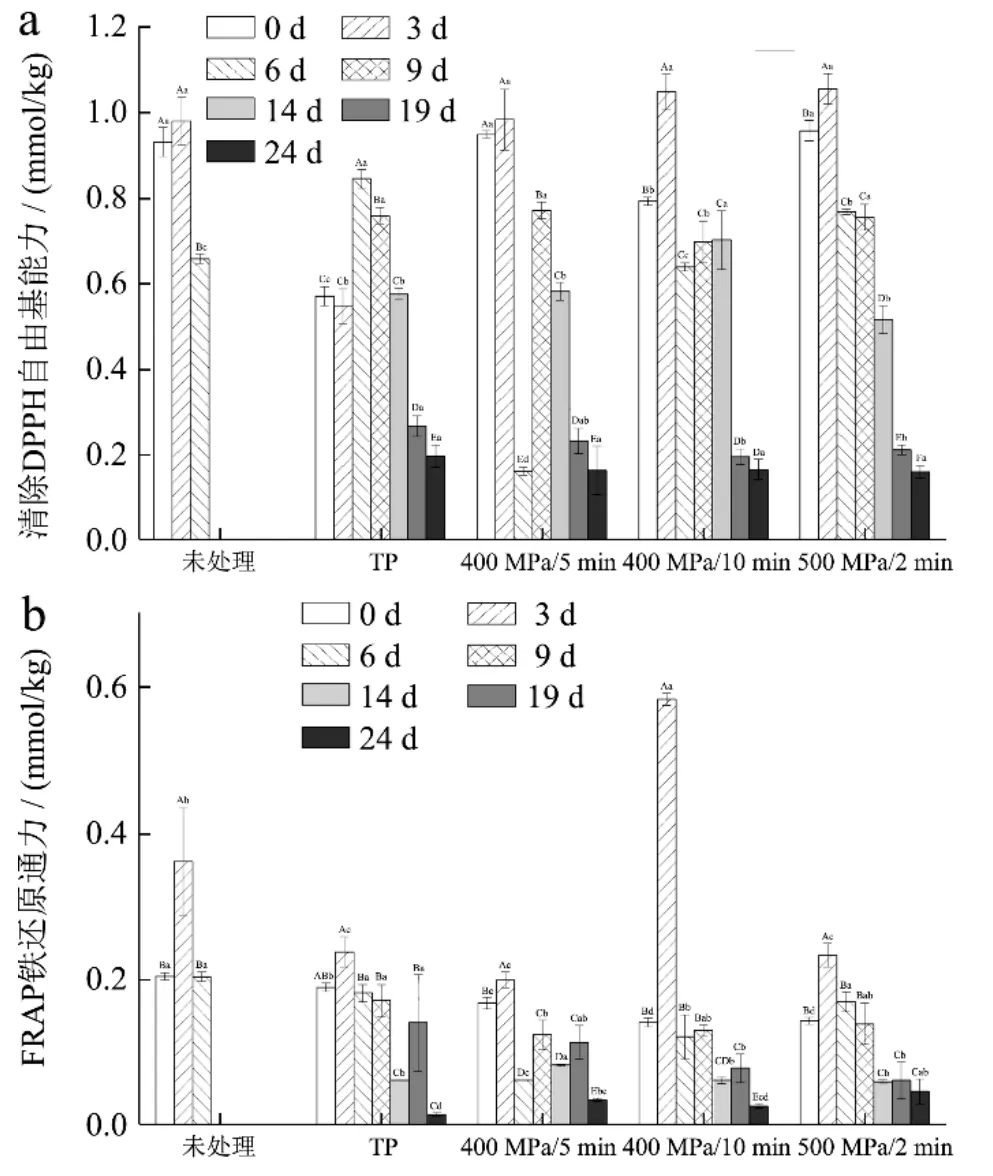
图2 HHP和热处理对贮藏期复合山药泥清除DPPH·能力(a)和FRAP铁还原能力(b)的影响 Fig.2 Effects of HHP and TP on antioxidant capacity (DPPH·, a; FRAP, b) of the mixed yam puree during storage
与未处理样品相比,处理后复合山药泥FRAP铁还原能力均显著下降,其中热处理后复合山药泥FRAP铁还原能力降低了7.31%,而HHP处理后降低了17.75%~30.81%,并且随着压力提高和处理时间延长降低效果越明显。4 ℃/24 d贮藏后,所有样品的FRAP铁还原能力均降低,但HHP组明显高于热处理组。从这个角度看,相比热处理,HHP处理对贮藏期间样品FRAP铁还原能力有更好的保持效果。
2.5 贮藏期间流变特性的变化
图3为HHP和热处理对复合山药泥表观黏度的影响。用不同方式处理的复合山药泥均表现为剪切稀化特性,即随剪切速率的升高,其黏度不断降低。这可能是由于复合山药泥中的多糖分子和果胶分子链与其他物质相互缠绕重叠,彼此交联在一起,随着剪切速率增大,互相缠绕的形式受到破坏的程度增大[27],宏观上呈现黏度降低表现出剪切稀化的现象。方亮等[28]发现超高压处理的猕猴桃汁也表现出类似的剪切稀化现象。
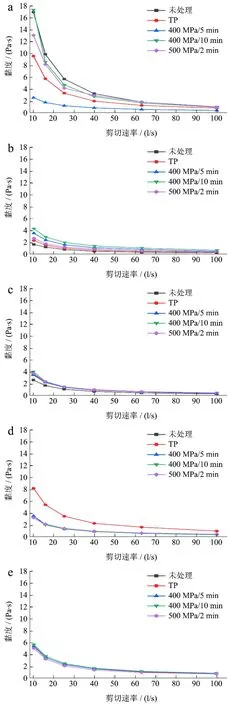
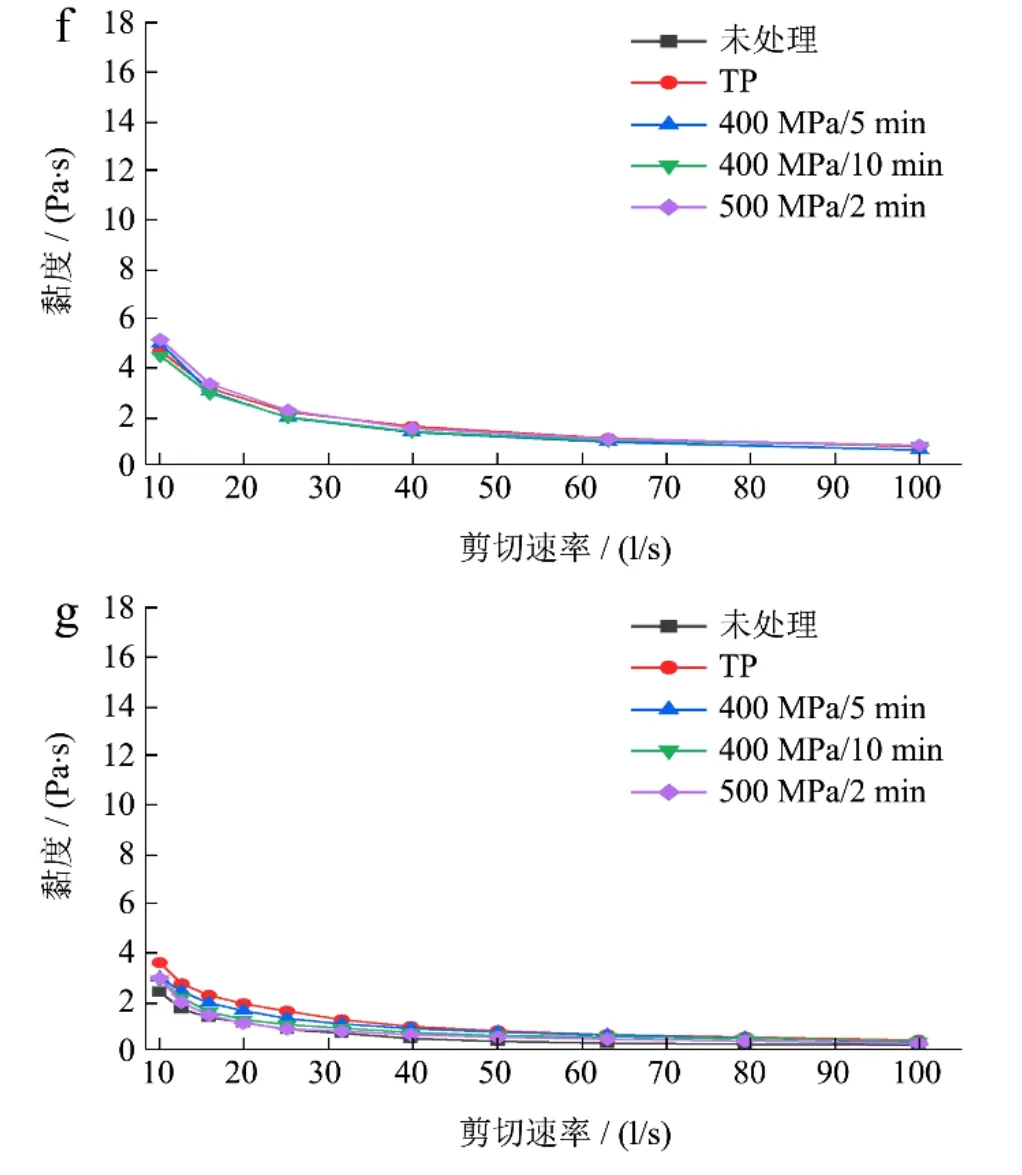
图3 HHP和热处理对复合山药泥表观黏度的影响 Fig.3 Effect of HHP and TP on apparent viscosity of the mixed yam puree
处理后各组黏度大小为400 MPa/5 min<TP<500 MPa/2 min<400 MPa/10 min<未处理。HHP和热处理均使复合山药泥的黏度下降。加热促进了分子的运动,果肉颗粒的能量增大,颗粒间的凝聚和聚合的机会降低,胶体粒子之间的网状结构减弱,并使有效容积率降低[29],黏度下降;而HHP破坏了复合山药泥中多糖中的氢键和立体化学键从而减低了黏弹性[30]。另外,增大HHP保压时间和压力强度使复合山药泥的黏度上升,可能是由于高强度长时间的HHP处理促进了PME的作用使原果胶脱去甲氧基,在低pH下与钙离子结合产生凝胶[31],增大了黏度。
4 /24℃ d贮藏后,各组的粘度大幅度下降,可能是复合山药泥粒度减小,果肉颗粒间的范德华力弱,不易形成网状结构,黏度下降;此外,PME酶并未完全失活(图4b),长时间作用催化降解了可溶性果胶[32],破坏了果肉颗粒间的网状结构,黏度下降。

图4 HHP和热处理复合山药泥在贮藏期PPO(a)和PME(b)活性的变化 Fig.4 Changes of PPO (a) and PME (b) activities of the mixed yam puree treated by HHP and TP during storage
2.6 贮藏期间粒径的变化
HHP和热处理对复合山药泥表面积平均粒径D[3,2]和体积平均粒径D[4,3]影响如表3所示。HHP和热处理对样品D[4,3]没有显著性的影响,但HHP处理后D[3,2]增大了6.4%~14.43%,而热处理对D[3,2]没有显著影响。D[4,3]受大颗粒影响较大,而D[3,2]受小颗粒影响较大,所以结果表明HHP处理对复合果蔬泥的小颗粒影响较大[33]。
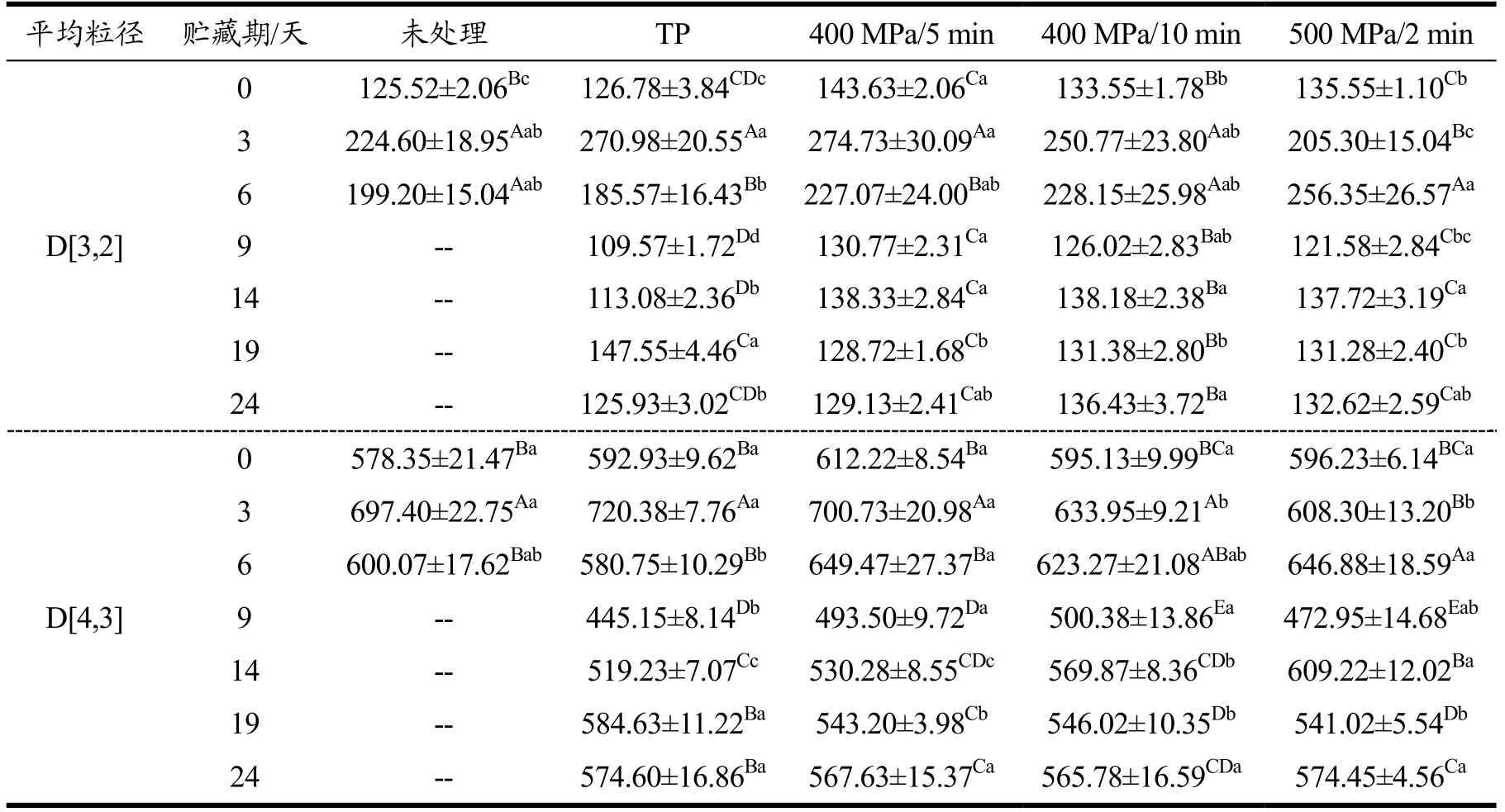
表3 HHP和热处理复合山药泥在贮藏期间粒径的变化 Table 3 Changes of particle size of the mixed yam puree treated by HHP and TP during storage
贮藏期间,HHP和热处理的复合山药泥粒径表现为先上升后下降的变化趋势。高压处理使复合山药泥中的颗粒聚集[34]导致粒径增大,热处理后布朗运动加剧增大了颗粒之间的撞击使颗粒聚集[35];随着贮藏时间的延长,小粒径颗粒逐渐增多,复合山药泥的稳定性增大[33],可能是由于在贮藏过程中少量微生物的生长繁殖消耗了复合山药泥中的糖类物质,而糖类物质的破坏了其形成的网络结构,导致彼此的交联程度降低粒径减小,这与表观黏度下降的结果相印证。与热处理相比,HHP处理的样品在贮藏期间其D[3,2]较大,赵蓓蓓[36]也发现用60~120 MPa的HHP处理后莲子淀粉膨胀,颗粒尺寸增大。贮藏24 d后,热处理与HHP处理的样品粒径没有显著差异。
2.7 贮藏期间PPO和PME残余酶活的变化
PPO会引起酶促褐变,改变色泽,甚至对某些营养物质造成破坏,影响最终的品质,因此需要对产品贮藏期间的残余酶活进行测定。由图4a可以看出,处理后复合山药泥的PPO残余酶活率显著下降。热处理后,复合山药泥的PPO残余酶活降低至8.82%,400 MPa/5 min、400 MPa/10 min和500 MPa/2 min处理后分别降低至3.92%、2.65%、7.84%。因此,HHP对PPO的钝化效果比TP好,该结论与Krystian等[37]的研究一致,并且HHP保压时间比压力强度对其PPO活性的影响更大。贮藏期间,热处理残余酶活降低后保持稳定,而HHP组存在一个先升高后下降的过程。可能原因是HHP使PPO结构发生变化部分活性位点封闭[38],贮藏期间被封闭的区域恢复,活性位点再次暴露,PPO活性上升;随着贮藏时间增加,PPO逐渐降解,导致PPO活性下降。韩永斌等[39]对超高压处理的山药泥进行了PPO活性研究,结果表明,压力为400 MPa、20 ℃时,PPO活性有一个峰值。
图4b反映了HHP和热处理对PME残余酶活的影响。PME参与甲氧基化果胶的脱酯化,在脱甲基化果胶过程中,钙离子与果胶发生反应,形成不溶性果胶,易产生结块现象[38]。热处理后PME的残余酶活显著性下降,但HHP处理后没有显著性降低。因此,热处理对PME有更好的钝化作用,而HHP的钝化作用不明显。柳青[40]也发现600 MPa的中高压处理后草莓汁中的PME残余酶活才降低到47%。贮藏期间,仅热处理组的残余酶活基本维持稳定,而HHP的PME残余酶活先下降后上升,24 d后升高了20%~60%。Baron等[41]分别探究了超高压压力、保压时间和温度对苹果汁中PME酶活性的影响,也发现PME的耐压性很高。
3 结论
HHP和热处理均能显著降低复合山药泥中微生物的数量,并保持在贮藏期中符合国家标准对微生物数量的要求。贮藏期间,与传统热处理相比,HHP处理能够增加复合山药泥的总酚含量,抗氧化活性相对较高,并且能够更好地维持产品的色泽,但对PME和PPO的灭活能力不如热处理。综上所述,HHP处理能够满足复合果汁的商业应用需求,但是存在难以有效抑制内源酶活的短板。因此,后续建议探索强化HHP抑制内源酶活性的研究,期望贮藏期内尽可能多地保留产品中营养物质含量和抗氧化能力以及保持新鲜感官品质的稳定。
