巴音布鲁克高寒湿地土壤真菌群落对不同程度退化的响应
2022-09-02买迪努尔阿不来孜陈末杨再磊愚广灵胡洋贾宏涛
买迪努尔·阿不来孜,陈末,杨再磊,3,愚广灵,胡洋,贾宏涛,3*
(1.新疆农业大学资源与环境学院,乌鲁木齐 830052;2.新疆农业大学草业学院,乌鲁木齐 830052;3.新疆土壤与植物生态过程重点实验室,乌鲁木齐 830052)

湿地被定义为陆地生态系统和水生生态系统之间的过渡区域,同时具有生产和生态功能,在维持水平衡、碳封存和保护生物多样性方面发挥着重要作用。近年来全球气候变化和人为干扰使湿地生态系统的稳定性受到了威胁,全球已有超过一半的湿地消失,这已成为全球性热点问题。尽管人们认识到了湿地的重要性,但由于土地开垦和过度放牧等人为因素的干扰,湿地的退化形势日益严峻。
在湿地退化过程中,植被类型和数量会发生变化,土壤趋于干旱化、贫瘠化,导致湿地土壤有机质逐渐减少、养分含量下降。湿地退化影响植物和土壤,进而对土壤微生物群落的多样性及结构产生直接或潜在的影响。微生物是土壤中最活跃的组分,积极参与植物凋落物等有机物质的分解、养分矿化、团聚体形成等过程,在碳、氮生物地球化学循环中发挥至关重要的作用。土壤微生物群落多样性和结构的变化能够反映微生物对生境变化的适应机制。土壤pH通过影响土壤基质的化学性质和利用效率来干扰土壤真菌群落的多样性,且真菌群落结构会受到土壤含水量和养分的显著影响。张雪等对艾比湖湿地的研究表明土壤真菌群落多样性及结构在不同退化区间有显著差异;林春英等发现黄河源湿地的退化会降低细菌、真菌群落的多样性;YANG等的研究表明若尔盖湿地退化可直接改变细菌群落和古细菌群落的组成。然而,当前对于对全球变化极敏感的高寒湿地的退化机制研究较为匮乏,仍缺乏大量数据资料,其中真菌群落结构(尤其是在低分类水平)对高寒湿地退化的响应机制研究亟待加强。
巴音布鲁克高寒湿地是中亚干旱区典型的“空中湿岛”,在维持新疆南疆地区农牧业生产及陆地生态系统功能方面发挥着重要作用。近几十年来,巴音布鲁克高寒湿地受气候变暖和人为干扰等因素综合影响而出现的不同程度的退化,对高寒湿地土壤养分循环及微生物群落产生了深刻影响。因此,研究土壤真菌群落对高寒湿地退化的响应机制,揭示微生物群落与生境共变化的耦合关系,可为高寒湿地生态功能过程研究提供科学数据参考,对阐明高寒湿地退化机制具有重要意义。为此,本研究借助高通量测序技术分析巴音布鲁克不同程度退化高寒湿地土壤真菌群落特征的差异,旨在明确高寒湿地不同程度退化区域土壤理化性质的差异;鉴别不同程度退化湿地土壤真菌群落结构,并初步探究可作为高寒湿地退化的潜在生物标志物;阐明高寒湿地土壤真菌群落多样性和结构对退化区域土壤理化性质变化的响应机制。
1 材料与方法
1.1 研究区概况
本研究于2019 年8 月在新疆巴音郭楞蒙古自治州巴音布鲁克国家级自然保护区(83°40′~84°40′E,42°35′~43°00′N)内进行。保护区面积约为770 km,海拔2 300~3 042 m;夏短冬长,年平均气温约-4.6 ℃;年平均降水量和蒸发量分别为273 mm和1 250 mm。
1.2 试验设计和样品采集
在保护区选取地势相对平缓,且坡向、海拔等自然因素相对一致的地段,以刘育红等和马维伟等对高寒地区退化的划分为依据(主要依据湿地植物特征,包括地上植物种类、盖度、高度和生物量等),将研究区划分为3 个不同程度的退化区域,即未退化区(沼泽土壤,ND 区)、轻度退化区(沼泽化草甸土壤,SD 区)和重度退化区(沙质土壤,HD 区)。各退化区基本信息见表1。
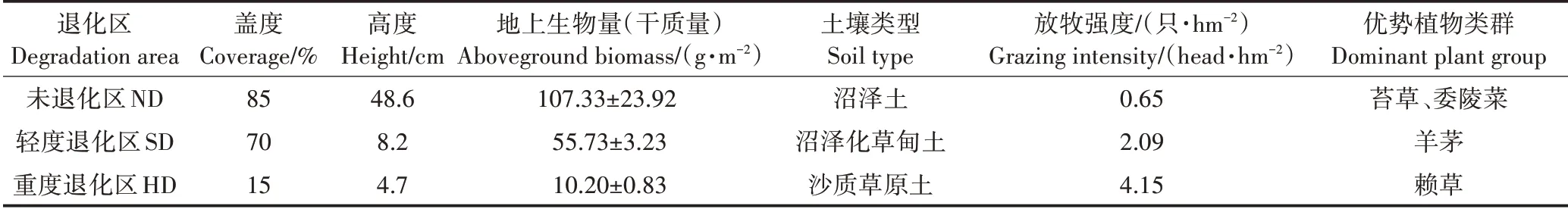
表1 研究区基本信息Table 1 General information of study area
于2019 年8 月在ND 区、SD 区和HD 区分别设置3 个样方(50 m×50 m,间距>100 m),每个样方内再随机设置3 个小样方(1 m×1 m,样方间距>10 m)。调查并记录各样方内植物的物种、盖度、高度、密度和生物量。去除地上植物,用灭菌后的土钻在样方内采用五点法(在样方对角线上选择4 个与中心样点距离相等的点,样点间距>0.5 m)采集表层土壤(0~10 cm)样品,去除土壤样品中可见的根系和植物残体,使用四分法均分土壤样品,其中3 份用于土壤理化性质的测定,1份用于高通量测序分析。
1.3 土壤理化性质的测定
土壤总有机碳(Total organic carbon,TOC)采用重铬酸钾-浓硫酸外加热法测定;土壤全氮(Total nitrogen,TN)使用元素分析仪(Vario El III,Elementar,Germany)测定;土壤全磷(Total phosphorus,TP)采用钼锑抗比色法测定;土壤全钾(Total potassium,TK)使用火焰光度计(M420,Sherwood,British)测定;土壤含水量(Soil moisture,SM)和容重(Bulk density,BD)采用环刀法测定;土壤pH 采用pH 计(FE28-Standard,Switzerland)测定。
1.4 DNA提取及测序
使用Power Soil DNA Isolation Kit 强力DNA 提取试剂盒(PowerMag™Soil DNA isolation Kit,MO BIO)进行微生物总DNA 的提取。使用基因引物对ITS1(5′-CTGTCATTAGGGAGAGAGA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGA-3′)结合适配器序列和条形码序列进行扩增。样品在北京百迈克公司Illumina HiSeq 2500平台完成测序。
1.5 生信分析
使用FLASH 1.2.11软件对原始数据进行拼接,使用Trimmomatic 0.33 软件进行过滤,得到高质量的数据;使用UCHIME 8.1软件,得到最终有效数据。使用Unite 8.0分类学数据库对OTU进行分类学注释;使用RDP 分类器2.2 对分类群进行分类,最小置信度为80%。借助Mothur 1.30 分析微生物群落多样性。通过LEfSe 方法获得潜在的生物标志种,lg LDA 阈值为4.0。
1.6 统计分析
用R 4.0.2 对数据进行分析及制图,用agricolae 1.3.3 ANOVA 检验差异显著性;用ggalluvial软件包绘制真菌群落丰度图。用vegan 2.5.6进行RDA分析;用蒙特卡罗置换检验分析土壤理化性质的显著性(permu=999)。
2 结果与分析
2.1 不同程度退化湿地土壤理化性质的变化特征
由表2 可见,土壤pH 和BD 在ND 区和SD 区中的含量无显著差异(>0.05),且均显著低于HD 区(<0.05)。SM 和TOC 随退化加剧表现为显著降低趋势(<0.05),其最大值均出现在ND 区(SM:124.19%,TOC:90.58 g·kg)。TN 含量在ND 区(8.74 g·kg)和SD区(10.22 g·kg)中无显著差异(>0.05),但显著高于HD 区(2.25 g·kg)(<0.05)。总体上,土壤TP 和TK 含量随退化程度增加呈降低趋势。ND 和SD 区土壤TP含量无显著差异(>0.05),但显著高于HD区(0.05)。ND 区土壤TK 含量显著高于SD 和HD 区(0.05)。
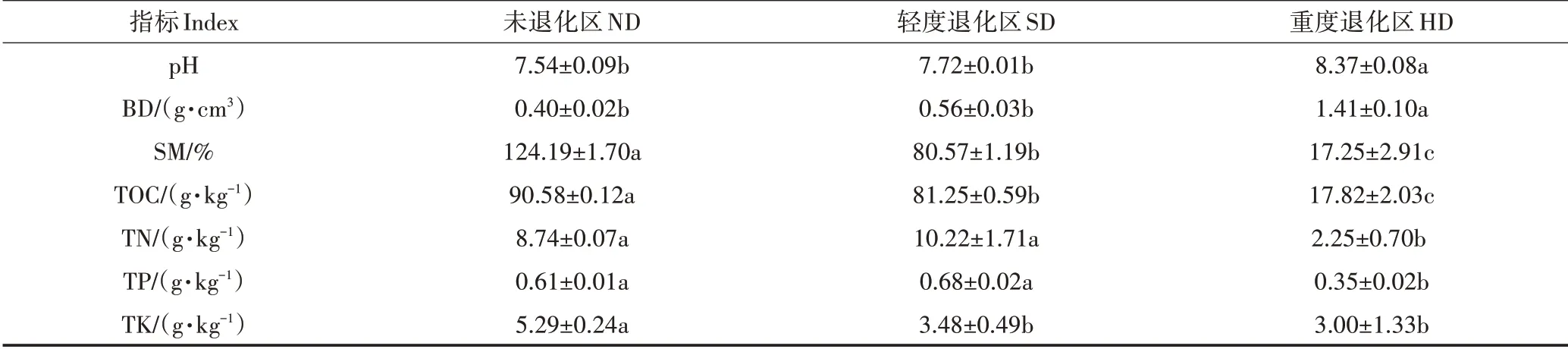
表2 湿地土壤理化性质Table 2 Physicochemical properties of wetland soil
2.2 退化对湿地土壤真菌群落多样性的影响
如表3所示,ACE指数和Chao1指数在3个退化区中表现为随退化程度加剧而降低的趋势。ACE指数在ND和SD区间无显著差异(>0.05),但均显著高于HD区(<0.05)。Chao1指数在不同程度退化区之间无显著差异(>0.05)。SD 区的Simpson 指数显著高于ND区和HD 区(<0.05)。Shannon 指数在ND 区和HD 区之间无显著差异(>0.05),但均显著高于SD 区(<0.05)。
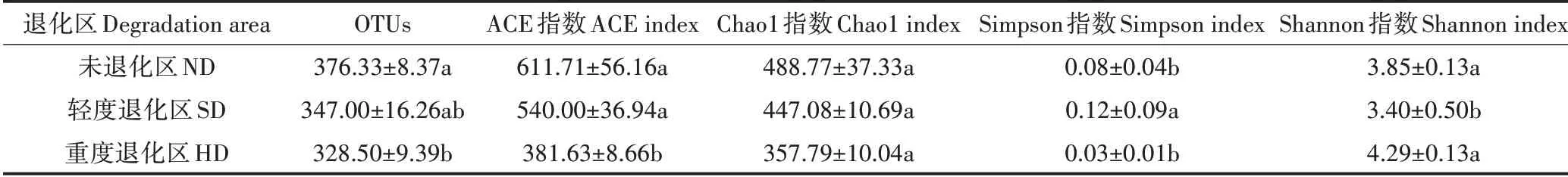
表3 高寒湿地不同退化区土壤真菌群落多样性Table 3 Diversity of soil fungi community in different degraded areas of alpine wetland
2.3 不同程度退化湿地土壤真菌群落分布特征
2.3.1 真菌群落在门分类水平上的组成
在门分类水平上共得到12 个真菌类群(图1a)。不同程度退化湿地土壤均以子囊菌门(Ascomycota)为主导菌门,其平均丰度分别为ND 区24.99%、SD 区39.18%、HD 区62.99%。此外,担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、隐真菌门(Rozellomycota)的相对丰度均>1.00%。随着湿地退化加剧,子囊菌门和被孢霉门的相对丰度呈逐渐增加的趋势,担子菌门、隐真菌门、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)的相对丰度呈现先增加后减少的趋势。
2.3.2 真菌类群在纲、目、属分类水平上的组成
纲水平上,粪壳菌纲(Sordariomycetes)和担子菌纲(Agaricomycetes)为主导菌纲(图1b)。目水平上,肉座菌目(Hypocreales)、Pleosporales 菌目、被孢霉目(Mortierellales)、碳角菌目(Xylariales)、屎壳菌目(Sordariales)的相对丰度随退化加剧而增加(图1c)。属水平上(图1d),的相对丰度随湿地退化加剧呈降低趋势,在不同退化区土壤中为ND 区11.32%、SD 区0.01%、HD 区0.03%。此外,、、等7种菌属在ND和SD区中的平均相对丰度均不足0.50%,且低于HD区。
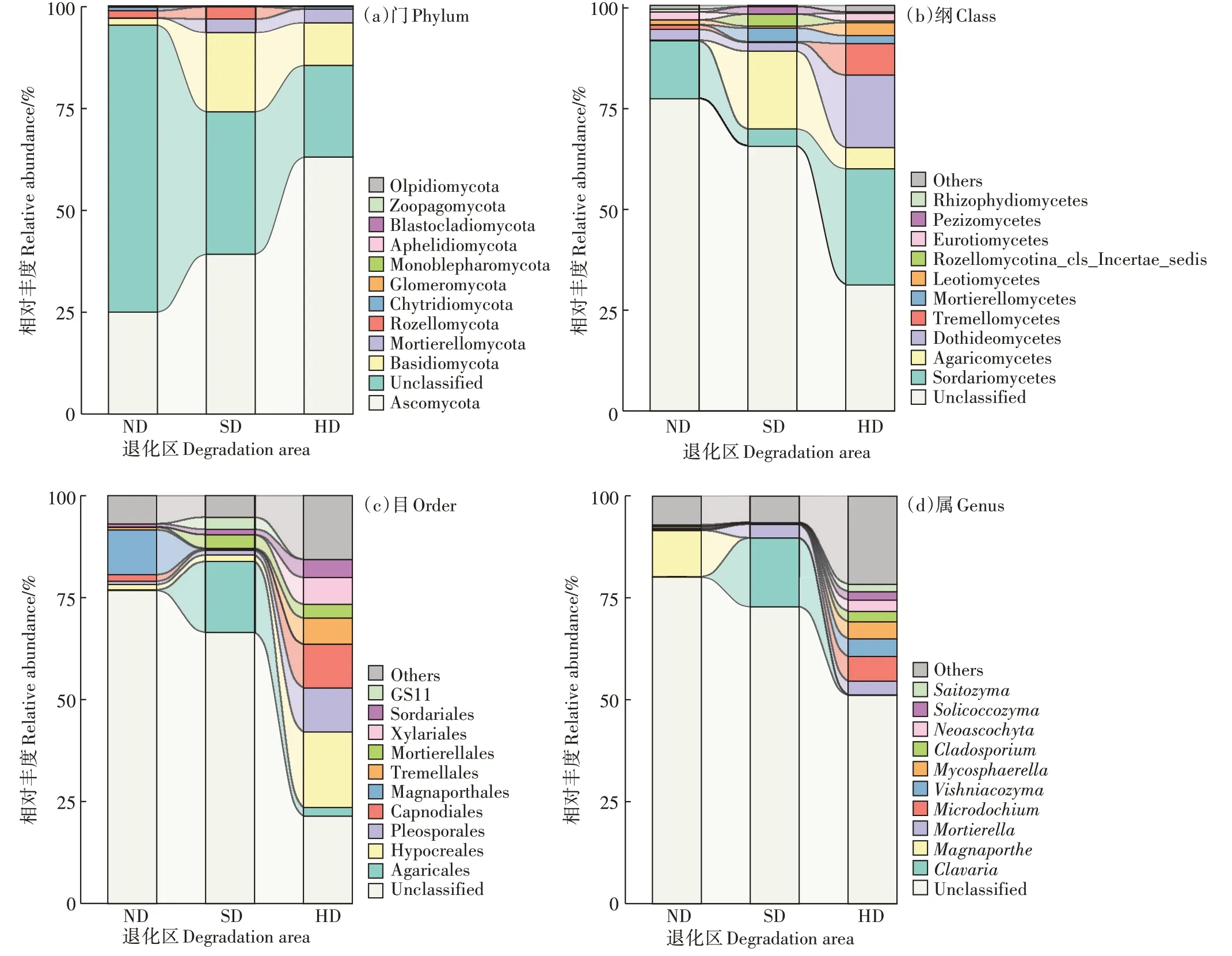
图1 不同程度退化高寒湿地土壤真菌群落相对丰度Figure 1 Relative abundance of soil fungal communities under different degradation degrees on alpine wetland
2.3.3 不同程度退化高寒湿地土壤真菌群落间的LEfSe分析
LEfSe分析可鉴别出不同程度退化高寒湿地真菌群落中差异显著的物种。图2 显示,在lg LDA=4.0时,11 个真菌的相对丰度存在显著差异。其中,ND区中没有出现显著差异的物种。SD 区仅存在一种生物标志物,为伞菌纲(Agaricomycetes),属于担子菌门。HD区中煤炱目(Capnodiales)、丛赤壳科()等10 类真菌的丰度显著高于ND 区和SD 区(<0.05)。

图2 巴音布鲁克不同程度退化高寒湿地土壤真菌群落间的LEfSe分析Figure 2 The LEfSe analysis of fungal communities at different degradation degrees in Bayinbuluk alpine wetland
2.4 退化高寒湿地真菌群落多样性与环境因子的相关性分析
对不同程度退化湿地环境因子和多样性指数进行相关性分析,发现环境因子对真菌Simpson、Shannon 多样性指数无显著影响(表4)。ACE 指数与TP无显著相关性(>0.05),但与TK 呈显著正相关(<0.05),与pH、BD 均呈极显著负相关(<0.01),与SM、TOC 和TN 均呈极显著正相关(<0.01)。Chao1 指数与TOC、TN呈显著正相关(<0.05)。

表4 环境因子对土壤真菌群落多样性的影响Table 4 Effects of environmental factors on soil fungal communities diversity
2.5 退化高寒湿地真菌群落结构变化与环境因子间的相关性分析
为揭示土壤理化因子对真菌群落结构变化的影响,在门分类水平上对土壤理化因子和4 个优势真菌门进行冗余分析(图3a)和蒙特卡罗检验(表5)。结果显示,土壤pH 和BD 与被孢霉门呈正相关。土壤TN、TOC、SM、TP 和TK 与隐真菌门的相对丰度变化呈正相关,但影响不显著(>0.05)。

表5 门分类水平上真菌群落变化与土壤环境因子的蒙特卡罗检验Table 5 Monte Carlo test of fungal communities at phylum level and soil environmental factors
在属分类水平上,对环境因子和相对丰度前10的真菌属进行了RDA 分析(图3b)和蒙特卡罗检验(表6)。结果显示,菌属与TP、TN、TOC 和SM 呈正相关,菌属与TP、TN、TOC、SM 和TK 呈正相关。而BD 和pH 均与其他8 种真菌属呈正相关。蒙特卡罗检验结果表明,TOC是影响真菌群落属分类水平结构变化的主要驱动因子。
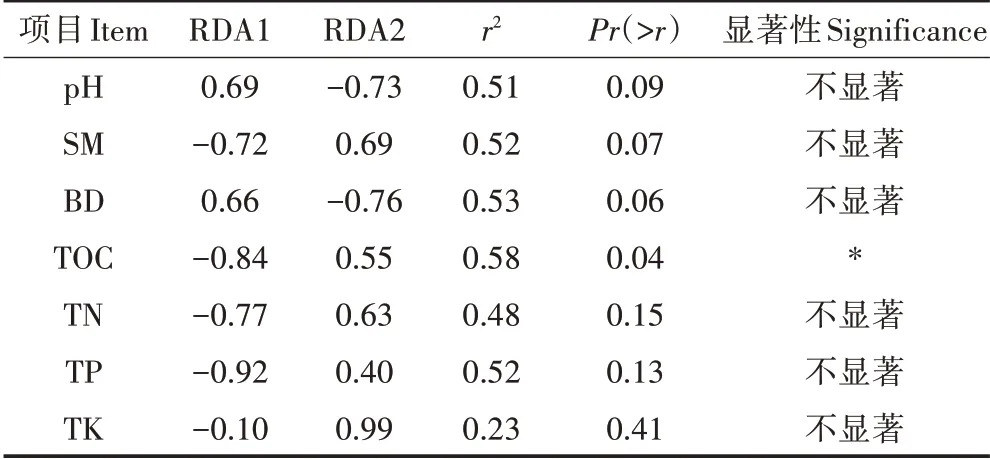
表6 属分类水平上真菌群落变化与土壤环境因子的蒙特卡罗检验Table 6 Monte Carlo test of fungal communities at genus level and soil environmental factors
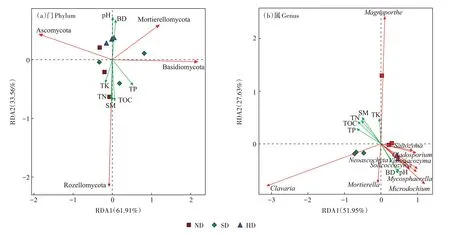
图3 土壤真菌群落在门和属水平上与环境因子的RDA分析Figure 3 RDA analysis of soil fungal communities with environmental factors at phylum and genus levels
3 讨论
3.1 退化对高寒湿地土壤理化性质的影响
湿地对气候和人类活动响应极敏感,其土壤理化性质是影响土壤微生物群落结构变化的关键因素。气候变化和人为干扰导致高寒湿地退化,直接表现为土壤水分减少。此外,不合理的土地利用会使表层土壤受到影响,从而加大地表裸露面积,增强地表蒸腾作用,降低SM,最终加剧土壤侵蚀。相关研究表明,湿地的退化会影响土壤理化性质。本研究中,土壤pH、BD 会随退化加剧逐渐升高,而土壤SM、TOC、TN 等理化指标表现出降低的趋势,这与林春英等对黄河源区高寒沼泽湿地土壤的研究结果基本一致。土壤TK 在轻度和重度退化区中无显著差异(>0.05),与ZHOU 等在青藏高原高寒草地的研究结果一致。GU 等在若尔盖湿地的研究中发现,pH和土壤TK随退化程度加剧表现出先增加后降低的趋势,而本研究表现为pH 升高、TK 含量降低的趋势。这些差异可能由当地气候、放牧强度以及土壤本身条件的不同所导致。随着湿地退化加剧,土壤SM 和pH发生显著变化(表2),进而显著影响了土壤真菌群落多样性(表3)。
3.2 退化对高寒湿地土壤真菌群落多样性和结构的影响
真菌是湿地土壤环境的重要组成部分之一,其多样性和群落结构受到土地管理措施和养分状况的影响。在本研究中,真菌群落丰富度指数随退化程度加剧呈逐渐降低的趋势,而Shannon 多样性指数呈现出先降低后升高的趋势(表3),这可能是由于湿地受到退化影响后导致植被覆盖度降低,枯落物输入量减少,地表的光辐射增强,使温度升高,土壤表层含水量减少,进而影响真菌群落的存活,使真菌群落的丰富度降低。未退化区土壤真菌群落的多样性和丰富度指数均较高,其原因可能是苔草等植物的根系发达、茎粗且结实,能够通过充分吸收水分和养分适应湿地环境,有利于维持真菌群落的稳定。重度退化区真菌群落Shannon 指数最高,这是因为沙土间隙大、通气性好,为真菌群落创造了良好的微环境,故具有较高的多样性。
不同程度退化高寒湿地优势真菌类群为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。有研究表明,子囊菌门和担子菌门是不同退化程度高寒湿地、南泥湾湿地、鄱阳湖典型湿地、古大湖湿地等其他类型湿地土壤中的优势菌群。这说明真菌类群在湿地环境中的分布具有一定的相似性。本研究中,子囊菌门随着湿地退化加剧呈逐渐增加趋势,担子菌门则呈降低趋势,这与子囊菌门降解复杂有机质功能和担子菌门可以限制木质素分解的功能有关。土壤TOC 也随退化的加剧呈降低趋势(表2),这是因为过度放牧降低了植被生物量,植物凋落物归还量减少,减少了向土壤输入的有机碳含量,进一步影响了子囊菌门和担子菌门的相对丰度。同时,在本研究中随退化程度加剧土壤含水量显著降低,通气性有所改善,给子囊菌门的快速繁殖创造了有利条件,其中的Leotiomycetes 纲在长期干旱引起的低水分土壤中的相对丰度高于含水量高的未退化和轻度退化土壤(图1),在干旱条件中成为竞争的优势者。此外,子囊菌门可以利用氮素快速生长繁殖,因此可在氮含量较高的环境中累积。但本研究中发现子囊菌门在氮含量最低的重度退化区中的相对丰度最高,这可能是因为水分的影响远大于氮含量的影响。
不同程度退化区域土壤真菌群落结构存在一定的相似性,可通过LEfSe 分析筛选不同程度退化区域的潜在生物标志物。在重度退化区中,煤炱目(Capnodiales)相对丰度迅速增加(图1c),说明该真菌目在退化湿地中能较好地生存。轻度退化区仅存在伞菌纲(Agaricomycetes)一种潜在标志物,属于担子菌门(图2)。一般认为,干扰较小的稳定群落有利于一些竞争力较高的物种繁殖,从而使少数物种主宰群落。真菌群落的结构在不同程度退化湿地土壤中具有显著差异,这表明真菌群落对湿地退化具有较高的敏感性。
3.3 环境因子对湿地土壤真菌群落的影响
不同程度退化湿地土壤真菌多样性及其丰富度的差异可能是由植物和土壤性质的间接影响导致的。本研究中,相关性分析结果表明,真菌群落Shannon 和Simpson 多样性指数与土壤因子变化无显著相关性,而Chao1和ACE 丰富度指数与土壤因子的变化显著相关。这说明,高寒湿地退化导致的养分变化更多地影响土壤真菌群落的丰富度,尤其是稀有类群,而对物种均匀度的影响较小。这一结果与WU等对三江平原不同类型退化湿地的研究结果不完全一致,即真菌群落Chao1 指数和Shannon 指数与环境因子均无显著相关性,这可能与湿地退化的主要驱动因子有关。
土壤理化性质是微生物群落的重要驱动因素。通过对真菌群落(门分类水平)与环境因子进行RDA分析,发现第一轴和第二轴的解释量分别为61.91%、33.56%。不同程度退化湿地土壤样品在第一、第二轴上分布散乱,说明真菌群落在不同程度退化湿地土壤间具有一定的差异。在属水平上,第一和第二轴总解释量为79.58%。除和外,其他真菌属均与TP、TN、TOC 呈负相关。已有研究表明,土壤物理和化学性质是微生物群落结构的重要驱动因素。土壤微生物群落多样性主要受pH、SM、BD、TN、TOC 等理化因子的影响。高寒湿地重度退化后BD 显著增大(表2),从而通过影响土壤孔隙度直接影响土壤微生物的生存;而pH 可以通过影响碳和氮元素的利用率来改变土壤环境,进而影响微生物群落的结构。本文中子囊菌门和被孢霉门(Mortierellomycota)分别与pH 和BD 呈正相关,说明这些真菌有较强的适应性,能在养分含量较低的碱性土壤中生存,子囊菌门丰度随退化程度加剧而增加也验证了这一点(图1a)。然而隐真菌门(Rozellomycota)相对丰度的变化与大部分土壤养分相关指标(TOC、SM、TP、TN、TK)呈正相关,说明此类真菌对外界环境的适应性较差,适合在养分充足的环境中生存。土壤真菌群落与理化性质间的联系与其自身的生境偏好性密切相关。本研究对高寒湿地在退化过程中真菌群落的结构和多样性进行了相关研究,今后还需进一步从“植物-土壤-微生物”的角度解析真菌群落对退化的响应机制。
4 结论
(1)高寒湿地退化显著改变了土壤理化性质,进而推动真菌群落多样性及其结构的变化。
(2)高寒湿地退化区优势菌为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),并存在潜在生物标志物,可作为湿地退化的指示物种。
(3)土壤总有机碳是影响高寒湿地退化土壤真菌群落的最重要驱动因子。土壤真菌群落与环境因子之间的协同关系需要持续关注。
感谢巴音布鲁克草原监测站仁钦老师,新疆农业大学高文伟教授,同门王旭阳、丛孟菲、申志博、胡云鹏、唐涛、苗旭晨等在采样和实验方面的帮助与支持!