姜黄素对犬骨髓间充质干细胞迁移能力的影响
2022-09-01李韦瑶邓嘉强赵芳芳朱雪瑞曹随忠沈留红余树民
李韦瑶,邓嘉强,赵芳芳,朱雪瑞,曹随忠,沈留红,余树民
(四川农业大学动物医学院,成都 611130)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是哺乳动物骨髓基质中的一种能自我更新的干细胞,具有多向分化潜能和免疫调控能力[1],在治疗退行性疾病和组织创伤中具有广阔的应用潜力[2]。当机体受到损伤时,MSCs通过迁移/生成生长因子、趋化因子、基质金属蛋白酶和表面黏附分子向靶器官靶组织介导损伤修复和再生。MSCs应用于临床需要经过体外扩增达到一定数量,然而MSCs在体外扩增一段时间后不可避免呈现老化,增殖活力和迁移能力下降,严重阻碍MSCs在临床治疗中的应用[3],因此采取一系列措施如天然活性成分,迟滞MSCs老化,增强细胞活力和迁移归巢能力,成为MSCs临床应用研究的焦点。
姜黄素(curcumin,Cur)是从姜科及天南星科等植物根茎中提取的一种脂溶性天然活性物质,已有研究显示姜黄素具有抗氧化、抗炎、抗肿瘤和抗纤维化等生物活性,并应用于伤口愈合[4],以及在消化系统[5]、心血管系统[6]和皮肤[7]等系统疾病的预防和治疗中也表现出巨大的潜力。研究发现在抗肺癌治疗中,姜黄素通过上调miR-206表达抑制癌细胞入侵和迁移[8]。近年来,发现Cur处理可通过降低氧化应激,重塑细胞骨架,提高人脐带血、人脂肪来源MSC的细胞活力[9-10]。本试验旨在以犬骨髓来源MSCs(cBMSCs)为材料,研究Cur处理对cBMSCs迁移能力的影响,进而为cBMSCs应用于临床治疗犬相关疾病提供理论依据。
1 材料和方法
1.1 样品来源
健康中华田园犬(6~12月龄),体质量(10±1)kg,由四川省雅安市流浪狗救助中心提供。
1.2 试剂
LG-DMEM干粉(GIBICO公司);胎牛血清FBS(北京全式金生物技术有限公司);青霉素、链霉素、胰岛素、茜素红、油红O染液、1%结晶紫染色液、二甲基亚砜DMSO(Solarbio公司);β-甘油磷酸钠、吲哚美辛(MCE公司);维生素C、3-异丁基-1-甲基黄嘌呤IBMX、地塞米松(Sigma公司);TRAPeze®Kit RT Telomerase Detection Kit与引物(上海生工生物工程股份有限公司);反转录试剂盒、SYBR Premix Ex TaqTM试剂盒(TaKaRa公司);胰蛋白酶(Biofroxx公司)姜黄素(HPLC≥98%,Solarbio公司);DAPI染液、微丝绿色荧光探针(Actin-Tracker Green-488,碧云天生物技术有限公司);24孔板Transwell-膜嵌套(Corning公司);细胞凋亡与坏死检测试剂盒(碧云天生物技术有限公司)。
1.3 犬骨髓间充质干细胞的分离培养与鉴定
取6~12月龄犬全身麻醉后,采用肱骨股骨头穿刺收集骨髓液[11]。加等量的PBS与肝素钠配制的抗凝液混匀,1 500 r/min离心5 min,重复洗涤2次。将细胞沉淀直接用完全培养液进行悬浮,经血球计数板计数,按1×108~109cells/mL的密度接种,置37℃、5%CO2细胞培养箱内培养,3 d后半量换液,此后每3~4 d换液一次。待原代细胞培养在多个视野内细胞达至80%~90%融合,弃去培养液,PBS洗涤后加入适量用胰酶消化液于37℃下消化2~3 min,在显微镜下观察到细胞变圆漂浮,加入基础培养液终止消化,轻柔吹打使细胞充分脱落,转移至15 mL离心管,1 200 r/min离心8 min,重悬后按1∶3比例传代,3 d换液1次,隔1 d观察细胞生长状态,每5~7 d传代1次。
接种细胞(P3)至6孔培养板(3×104cells/mL),待细胞长至90%~100%融合时,分别更换成骨和成脂分化诱导液进行分化诱导,3 d换液1次。成脂诱导14 d后,采用油红O染色观橘红色脂肪颗粒;成骨诱导21 d后,采用茜素红染色观察钙化结节。
1.4 细胞分组与姜黄素处理
取同批次的第3代(P3)cBMSCs和第6代(P6)cBMSCs进行接种培养,待细胞贴壁后对P6-cBM⁃SCs添加Cur(0、0.1、1和10 μmol/L)预处理24 h,分别设置 P3-cBMSCs为P3组和P6-cBMSCs+Cur(0、0.1、1和10 μmol/L)为姜黄素处理组。
1.4.1 细胞划痕实验
按2×105cells/孔接种细胞,每孔设置3个重复,待细胞铺满板底后用10 μL枪头对同一批次来源P3-cBMSCs和P6-cBMSCs垂直划痕,采集初始划痕照片。按1.4处理细胞,细胞在37℃、5%CO2培养箱中培养,观察和评估划痕愈合情况后取样拍照,每孔按上下左右4个方向分别采集4个视野,应用Image Pro Plus 6.0(IPP)对细胞迁移面积进行定量分析,计算细胞划痕愈合率。划痕愈合率=[(0 h划痕面积-24 h划痕面积)/0 h划痕面积]×100%。
1.4.2 Transwell细胞迁移实验
取孔径为8 μm的24孔Transwell板,分别将上室与下室加入少许基础培养基,于37℃培养箱温育1 h,以充分浸润聚碳酸酯膜。按1.4处理cBMSCs后经胰酶消化后离心收集,PBS洗涤2次,用无血清的DMEM以1×105cells/mL悬浮细胞,取温育后的Transwell板,弃去培养液,上室加入200 μL细胞悬液,下室加入800 μL含10%FBS的培养基,每组设置3个复孔。置37℃、5%CO2细胞培养箱中培养16 h后,用DAPI法对小室外表面进行染色,于荧光显微镜下观察拍照(每孔随机4个视野),并通过Im⁃age J统计计数。
1.4.3 微丝绿色荧光探针(Actin-Tracker Green-488)观察细胞质骨架
细胞按1×104cells/孔的密度接种至12孔板,每组设置3个复孔,按1.4处理cBMSCs,PBS洗涤细胞2次后用4%多聚甲醛固定液固定15 min,再用含0.1%Triton X-100的PBS洗涤细胞3次,每次3~5 min,加入现配的染色工作液(250 μL/孔),室温避光孵育45 min,0.1%的Triton X-100的PBS洗涤2次,每次3~5 min,再加入DAPI染色液染色15 min,经PBS洗涤,于荧光显微镜下观察到细胞被绿色荧光探针标记染色后拍照记录。
1.4.4 RT-qPCR检测细胞迁移相关基因表达
基于上述试验,采用Trizol法提取细胞总RNA,将已获取的RNA逆转录为cDNA。以反转录后的cDNA为模板,由生工生物工程(上海)股份有限公司合成引物(引物序列及参数见表1),进行荧光定量PCR反应。

表1 RT-qPCR引物序列Table 1 The primer sequences used for RT-qPCR
1.4.5 细胞坏死与凋亡检测
分别收集姜黄素处理组细胞约1×105cells于1.5 mL离心管内,离心弃上清。细胞沉淀用细胞染色缓冲液重悬。分别加入5 μL Hoechst染色液和PI染色液,混匀,4℃孵育20~30 min。用PBS洗涤1次,在荧光显微镜下观察红色荧光和蓝色荧光,拍照记录。
1.4.6 细胞相对端粒长度检测
提取姜黄素处理组细胞基因组DNA,核酸蛋白分析仪测定所提取DNA的纯度和浓度,将DNA梯度稀释,制作标准曲线。通过RT-qPCR获取端粒(Tel)和36B4的Ct值。以log(ng DNA)为横坐标,Ct值为纵坐标,分别制作端粒和36B4的标准曲线。将待测样品DNA以相同反应体系和反应条件进行RTq-PCR反应。将所测样品端粒的Ct值代入到端粒标准曲线方程中,得出相应Ct值对应的ng DNA值,即T值。将所测样品36B4基因的Ct值代入到36B4标准曲线方程中,得出相应Ct值对应的ngDNA值,即S值。同一个样品的T值与S值的比值(T/S)即为该样品的相对端粒长度,36B4和Tel引物序列见表1[12]。
1.5 数据分析
试验数据利用SPSS 24.0软件进行单因素方差分析(ANOVA)和配对t检验,数据表示为均值±标准差(±s),插图通过GraphPad Prism 7.0软件进行排版和整理,P<0.05表示差异显著(用“*”表示),P<0.01表示差异极显著(用“**”表示)。
2 结果与分析
2.1 犬骨髓间充质干细胞的传代培养与鉴定
将cBSMCs体外培养,细胞传至第3代在倒置显微镜下呈梭形、纺锤状,轮廓清晰,折光性强,具有良好的增殖特性;相比于第3代,细胞传至第6代时部分出现衰老变形、细胞轮廓不清晰,胞浆逐渐出现细微颗粒,增殖速度减慢的现象;传至第9代,几乎所有细胞均呈现老化特征,且细胞处于生长停滞状态(图1)。

图1 体外传代细胞形态学特征Figure 1 The morphology of BMSCs in vitro expansion(scale bar=100 μm).
对cBMSCs分别进行成脂和成骨分化诱导,14 d后采用油红O染色后观察到细胞内的橘红色的脂肪颗粒(图2A),成骨诱导21 d后茜素红染色观察到红色钙化结节(图2B),表明cBMSCs能够向脂肪细胞和成骨细胞分化,具有MSCs的特性。

图2 cBMSCs成脂和成骨分化特性Figure 2 Adipogenic and osteogenic differentiation characteristics of cBMSCs.(scale bar=100 μm)
2.2 姜黄素对犬骨髓间充质干细胞迁移、侵袭的影响
细胞划痕实验结果显示(图3A),相比P3组,P6-cBMSCs的划痕愈合率显著下降[(49.48±13.00)%vs(69.54±6.33)%,P<0.01],cBMSCs迁移能力在传代过程中受损。姜黄素处理后,P6-cBMSCs的愈合率显著提高[(65.85±11.16)%vs(49.5±13.0)%,P<0.01;(71.44±8.66)%vs(49.5±13.0)% ,P<0.01;(60.92±10.87)%vs(49.5±13.0)%,P<0.05],其中添加1 μmol/L浓度的Cur细胞愈合效果最佳。

图3 姜黄素对犬骨髓间充质干细胞迁移、侵袭的影响Figure 3 Effects of curcumin on migration and invasion of cBMSCs.(scale bar=100 μm)
Transwell细胞迁移实验结果显示(图3B),相比于P3组,P6-cBMSCs穿透至下层的数量cBMSCs明显减少(61.75±8.67 vs 115.58±14.11,P<0.01)。姜黄素处理后,P6-cBMSCs迁移数量均极显著增多(88.75±10.18 vs 61.75±8.67;106.42±6.99 vs 61.75±8.67;78.58±6.75 vs 61.75±8.67,P<0.01),其 中1 μmol/L浓度的Cur作用效果为最佳。
细胞形态维持、内部结构合理以及迁移运动都与细胞质骨架密切相关。微丝绿色荧光探针染色结果显示,P3组cBMSCs充分贴壁铺展,可以观察到形态挺直的应力纤维和丝状伪足结构,P6-cBMSCs圆合度较高,应力纤维弯曲且稀少,姜黄素处理后cBMSCs可见应力纤维增多(图3C)。
RT-qPCR检测3种与cBMSCs迁移相关的因子(MMP-2、MMP-9和CXCL8)的转录水平。结果显示,相比P3组,P6-cBMSCs的MMP-2和MMP-9基因转录水平极显著下调(P<0.01),而CXCL8的表达没有显著差异。经姜黄素处理后,MMP-2和CXCL8的表达均极显著上调(P<0.01),MMP-9的表达上调,但差异不显著(图3D)。综上,Cur的处理能显著提高cBMSCs的迁移能力。
2.3 姜黄素对犬骨髓间充质干细胞坏死与凋亡和相对端粒长度的影响
细胞坏死与凋亡检测结果显示,P6-cBMSCs经姜黄素处理后凋亡和坏死细胞比例有所下降,表明Cur一定程度上维持cBMSCs的细胞活力,延缓凋亡和坏死(图4A)。细胞相对端粒长度检测结果显示,姜黄素能延缓相对端粒长度的缩短,其中1 μmol/L浓度的Cur作用显著(P<0.05)(图4B)。综上,Cur处理能抑制cBMSCs凋亡,迟滞相对端粒长度缩短。
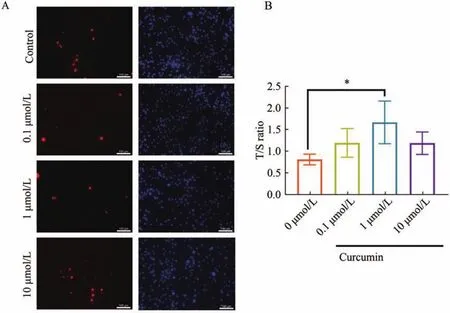
图4 姜黄素对犬骨髓间充质干细胞凋亡和相对端粒长度的影响Figure 4 Effects of curcumin on necrosis,apoptosis and relative telomere length of cBMSCs
3 讨论与结论
本试验采集犬骨髓通过细胞贴壁法分离cBM⁃SCs,根据细胞形态和分化试验,显示所分离细胞具有文献报道的cBMSCs特点[11]。大量研究发现MSCs随着传代次数的增加而衰老,表现细胞活力、迁移能力和分化潜能下降,更倾向于分化为脂肪细胞,成骨分化潜能减弱,免疫调节功能异常[13],而老化MSCs移植后绝大多数在24 h即死亡[14]。同样,本试验所分离cBMSCs培养至P6代就呈现体积增大,扁平轮廓不清,细胞活力降低等老化表型,其迁移能力相应减弱。
细胞的迁移能力是MSCs活力和归巢能力的重要体现,为MSCs介导组织修复再生所必需,目前在移植前多采用低氧和一些活性物质等进行预处理提高MSCs活力和迁移能力,进而提高临床治疗的效力[15]。最近的研究显示,1 μg/mL Cur处理使人脐带血来源MSCs(HUMSCs)迁移能力显著增强,尤其纳米负载的Cur其生物学作用大大增强,并证实其促迁移作用与细胞骨架重塑密切相关[9];同样,H.Ghufran[10]等在研究用姜黄素预处理人脂肪干细胞(hASCs)在抗高血糖应激的作用中发现,Cur(5 μmol/L)预处理24 h可以改善hASCs的迁移能力。本试验以呈现衰老表型的P6代cBMSCs为材料,细胞划痕实验、Transwell实验均显示1 μmol/L姜黄素处理显著增强cBMSCs迁移能力,即划痕愈合率显著上升,而迁移至Transwell小室外表面的细胞数量显著增加,细胞应力纤维数量和排列得到改善。已有研究证实,基质金属蛋白酶(MMP-2、MMP-9)和趋化因子CXCL-8参与细胞迁移过程[16-17],王俊等[18]发现川芎嗪上调MSCs的MMP-2、MMP-9表达,促进BMSCs迁移。本研究同样显示,Cur能上调迁移相关因子(MMP-2、MMP-9和CXCL8)的基因表达水平,促进cBMSCs的迁移。
MSCs作为有丝分裂细胞,端粒长度随着细胞扩增培养逐渐缩短,逐渐失去细胞活力,最终进入到不可逆转的衰老状态[19]。Deng J.等[20]发现Cur(1 μmol/L)能够有效维持细胞活力,改善体外复制性衰老cBMSCs的衰老表型和迁移能力损伤。本研究中,我们通过凋亡与坏死试剂盒以及相对端粒长短检测来进一步评估Cur对cBMSCs活力的影响。结果显示,Cur可以降低细胞凋亡和坏死程度,延缓端粒长度缩短,进而保持细胞活力和延缓细胞衰老,这可能是改善MSCs迁移能力的重要基础。
综上,1 μmol/L浓度Cur可以增加cBMSCs细胞微丝生成,上调基质金属蛋白酶(MMP-2、MMP-9)和趋化因子CXCL8的表达,延缓端粒长度缩短,改善衰老cBMSCs的迁移能力。
