绿豆果胶甲酯酶基因及其响应镉胁迫的分析
2022-09-01张创娟李师翁
杨 乐,张创娟,程 斌,冷 艳,李师翁
(兰州交通大学 生物与制药工程学院,兰州 730070)
果胶甲酯酶(PME)广泛存在于高等植物中,在植物的生长、发育和防御等过程中起着重要作用.在植物中,PME是一个由多基因组成的大基因家族,如拟南芥、水稻、番茄、油菜和棉花分别有66、43、79、110和80个PME基因[1-7].通常分为两种类型(Ⅰ型和Ⅱ型),Ⅰ型在N端含有Pro区,Ⅱ型不带Pro区[8-9].有学者研究了拟南芥幼苗PME的表达谱,仅有15%的PME高表达,其余基因在任何生长阶段均未表达[10].也有学者研究了亚麻和棉花中的PME表达模式,发现纤维发育特异性表达相关的PMEs[11-12].PMEs可能在植物非生物胁迫中起作用,例如,当植物受到Cd胁迫时,细胞壁纤维素含量降低,半纤维素含量升高,导致细胞壁孔隙度和厚度变小,可使Cd2+滞留在细胞壁间,果胶含量和PME酶活性在这一过程中起作用[13].然而,目前对于PME在植物重金属胁迫中的作用及其机制还缺乏系统研究,开展系统研究十分必要.
镉(Cd)是一种广泛存在且对环境造成严重污染的重金属,其高水溶性对生物具有严重的毒害作用.Cd会通过胞质间隙和管状纤维残留在植物体中[13],通过食物链和食物网进入动物体内,也会对人造成严重的危害.豆科植物因其能形成根瘤菌的特性,在土壤重金属污染植物修复方面具有独特的优势.绿豆是世界上广泛种植的重要的豆科作物,开展其重金属耐受性及其对重金属胁迫响应的研究具有理论和实践价值.本人所在课题组前期已开展了绿豆幼苗期对Cd胁迫响应的生理生化与分子机制研究[14-16],本研究聚焦于PMEs,对绿豆PMEs进行全基因组鉴定,采用生物信息学方法分析PMEs系统发育树、基因结构、保守基序、理化性质等.运用转录组技术对PMEs表达谱及其响应Cd胁迫的表达谱进行研究,并对Cd胁迫下PME酶活性进行了测定,结果将为PME基因在响应重金属的毒害作用层面和基因工程应用层面提供科学资料.
1 材料与方法
1.1 植物材料培养
用10%次氯酸钠溶液浸泡新鲜的绿豆种子15 min,无菌水冲洗,在培养箱中于25±1℃浸种36 h,播种于灭菌的珍珠岩:蛭石(1∶1)的育苗盘[14],25±1℃光照培养箱(PAR为0.1 mol·m-2·s-1)中14 h光周期培养5 d.
1.2 植物材料处理
将上述培养的幼苗分为两组,每组至少包括三个生物学重复,处理组施以终浓度0.1 mol/L CdCl2的1/2 Hoagland营养液[15],对照组施以1/2 Hoagland营养液,每皿分别施加营养液70 mL在相同的条件下继续培养.以施加营养液的时间为基准,分别于培养的1、5、9天取根、茎、叶各1 g组织,液氮速冻,保存在-80℃冷藏备用.
1.3 RNA分离和表达谱分析
总RNA提取和cDNA文库制备按照我们之前研究中描述的方法进行[7,17],转录组测序由上海美吉生物医药科技有限公司IlluminaHiseq 2000平台完成.基因表达谱用TBtools中的Heatmap Illustrator制作热图[18].基因表达量以基因表达量以TPM(transcripts per kilobase per million mapped reads)值表示.
1.4 果胶甲酯酶活性的测定
取1 g绿豆样品于预冷研钵中,加入等体积(w/v)提取缓冲液(0.1 mol/L Tris-HCl,pH=7.5,0.5 mol/L NaCl)研磨成匀浆,4℃12 000 rpm离心10 min,收集上清液用于所有酶测定.在试管中加入4 mL 0.5% (w/v)果胶溶液和0.3 mL 0.01% (w/v)溴酚蓝[19],然后加入300μL酶液.2 min后记录样品的吸光度并计算酶活性(ΔA620/min·g·FW)[2,18],每个样品重复3次.
1.5 绿豆PME基因家族的鉴定
从NCBI(https://www.ncbi.nlm.nih.gov/)下载绿豆全基因组及注释文件信息,筛选绿豆PME基因,从EnsemblPlant数据库(https://plants.ensembl.org/index.html)检索拟南芥(Arabidopsis thaliana)PME参考基因,从NCBI数据库得到大豆(Glycine max)基因组注释文件和蛋白质序列文件[20].
使用基于隐马尔可夫模型(HMMER)(https://www.ebi.ac.uk/Tools/hmmer/search/hmmsc an)的工具对得到的绿豆PME蛋白质序列进行检索,Pfam数据库(http://pfam.xfam.org)进行蛋白序列的结构域分析.
1.6 PMEs蛋白分析
使用PSROT(https://www.genscript.com/psort.html)软件的WoLFPSORTII(https://wolfpsort.hgc.jp/)预测PME蛋白的亚细胞定位[21],ProtParam(http://web.expasy.org/protparam)软件预测PME蛋白的分子量和等电点,MEME(http://meme-suite.org/tools/meme)在线工具获取基因结构数据[22],Pfam数据库进行结构域分析,TBtools软件[18]获取基因家族分析结果及可视化,参数设置最大motif 6,最小和最大宽度为50和100,其他参数设置为默认值[23].MEMESuite(5.0.5)进行PME的保守基序扫描,ExPASYPROTPARAM工具(http://web.expasy.org/protparam/)进行PME基因的基因表达谱分析及可视化[21].
2 结果
2.1 绿豆PMEs基因鉴定及蛋白特征
通过与拟南芥直系同源比对分析,从绿豆基因组中鉴定出80个PME基因家族成员,根据先前报道的命名规则[24],将其命名为VrPME01-VrPME80.对应的UniProt基因ID和蛋白质基本特征及亚细胞定位列于表1.绿豆PMEs蛋白序列长度介于131~634 aa,分子量为14 550~6 270 Da,等电点(PIs)为4.74~9.73.亚细胞预测将PMEs定位于细胞壁、细胞核、内质网、质膜和叶绿体中,其中定位于细胞质外基质的PMEs最多(39个).绿豆的PME基因包含两种类型,52个(VrPME01~VrPME53,除VrPME48外)为N端含有Pro区的Ⅰ型,26个(VrPME54~Vr-PME80,除VrPME75和VrPME78)属于Ⅱ型.
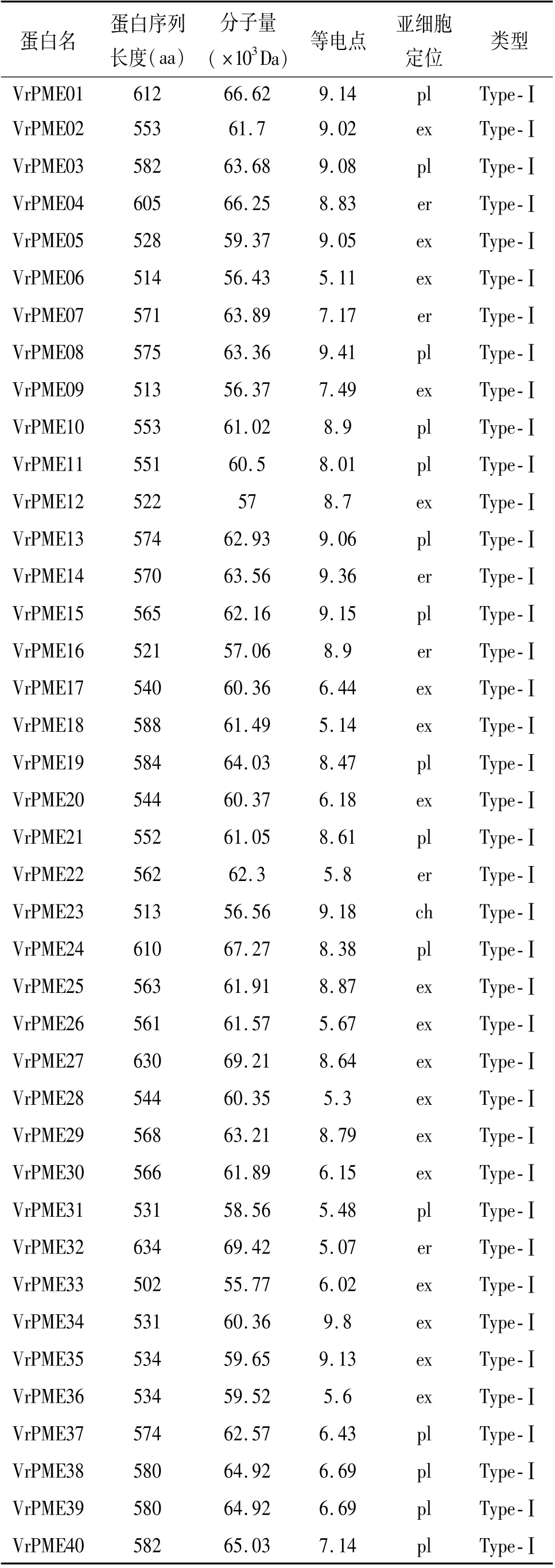
表1 绿豆PME蛋白质特征Tab.1 Characteristics of the PME protein of mung bean

续上表
2.2 绿豆PMEs基因结构
对3个物种PME的motif和基因结构进行比较分析,91%的PME包含相同的6个保守基序,同源关系较近的成员具有相似的外显子及内含子,其他PME基因的外显子之间大小存在一定差异,72.5%的VrPMEs含有2~3个内含子,其中VrPME45和VrPME79只有1个内含子,25%VrPME含有4~5个内含子(见图1(c)).保守结构域分析表明,Vr-PME01~VrPME53(VrPME48除外)具有PMEI域,而VrPME54~VrPME80(除VrPME75和VrPME78外)不包含PMEI域(见图2).

图1 绿豆PMEs亲缘关系(a)、保守motif(b)和基因结构(c)Fig.1 Phylogenetic relationship(a),conserved motif(b),and structure of mung bean PMEs(c)

图2 绿豆PME蛋白结构域Fig.2 Domains of mung bean PME proteins
2.3 绿豆PMEs基因表达谱
转录组测序结果显示80个绿豆PMEs中只有17个在根、茎和叶中表达,如图3所示,绿豆中Vr-PMEs的表达量基本呈现根>茎>叶.其中,Vr-PME16和VrPME11基因在根中的表达量最高,且在第1天VrPME16和VrPME11表达量TPM值分别高达444.9和197.8;在第9天分别为177.7和37.1;VrPME11和VrPME12在茎中的表达量最高,且在第1天VrPME11和VrPME12基因表达量分别为260.3和49.8;在叶中表达量最高的基因是VrPME06,在第5天表达量最高为94.16(TPM),其他基因的表达量均在10以下.此外,VrPME66在茎和叶中均表达,但在根中未表达.
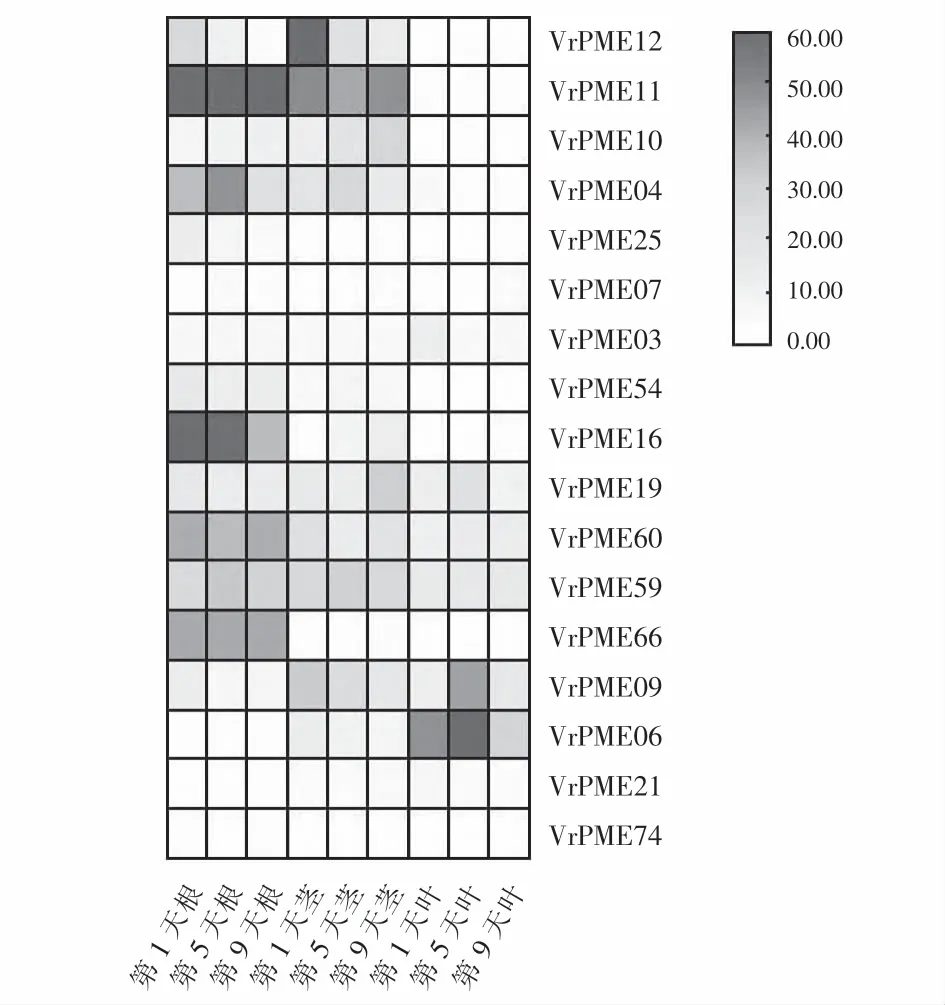
图3 绿豆PMEs在根、茎和叶中的表达谱Fig.3 Expression pattern of mung bean PMEs in root,stem,and leaf tissues
2.4 Cd胁迫对Vr PMEs表达的影响
转录组分析表明,100μmol/L Cd处理下,绿豆PME家族成员的表达存在较大差异(见图4).在根中,Cd处理显著上调了VrPME16、VrPME21和Vr-PME25,平均上调倍数为3.52;显著下调了14个基因,平均下调倍数为1.89倍,其中VrPME03、Vr-PME06、VrPME07、VrPME10和VrPME12显著下调表达,平均下调3.78倍;

图4 Cd胁迫下绿豆PMEs表达的变化Fig.4 Changes in expression level of mung bean PMEs in response to Cd stress
在茎中,Cd处理显著上调了VrPME11和Vr-PME16,平均上调倍数为2.69倍,其中VrPME16显著上调4.44倍;显著下调了14个基因,平均下调倍数为1.43.
在叶中,Cd处理上调了8个基因,平均上调倍数为0.37;下调了8基因,平均下倍数为0.91.其中,VrPME10在Cd胁迫叶中未表达.虽然叶片中上调基因的个数最多,但最大上调基因VrPME25在第1 d被上调2.32倍,其他基因的上调倍数均较小.上述结果表明,Cd胁迫对绿豆根和茎中PMEs表达影响最大,而对叶中PME表达影响最小.
2.5 Cd胁迫对绿豆幼苗PME酶活性的影响
为了进一步了解Cd胁迫下VrPMEs表达变化是否与酶活性变化相关,本文对PME酶活性进行了测定.结果表明,在根中,Cd处理组和对照组PME酶活性都随生长时间延长呈现显著下降趋势,Cd处理后的PME酶活性在3个时间点均升高,平均升高1.25倍.在第1 d、5 d、9 d PME酶活性分别比对照提高了的6%、32%倍和85%倍(见图5(a)).在茎中,Cd处理第1 d和5 d PME酶活性分别比对照降低了的0.5%和13%,第9 d比对照提高了18%(见图5(b)).在叶中,Cd处理第1 d、5 d PME酶活性分别比对照降低了的1%、23%和30% (见图5(c)).上述结果表明,Cd胁迫显著升高根中PME酶活性,而降低叶中PME活性,短期(1天)Cd胁迫几乎不改变茎和叶中PME活性,长期(9天)Cd胁迫升高根和茎中PME酶活性.根中PME酶活性参与了对Cd胁迫的响应,这一结果与Cd胁迫对Vr-PMEs表达的影响基本一致.
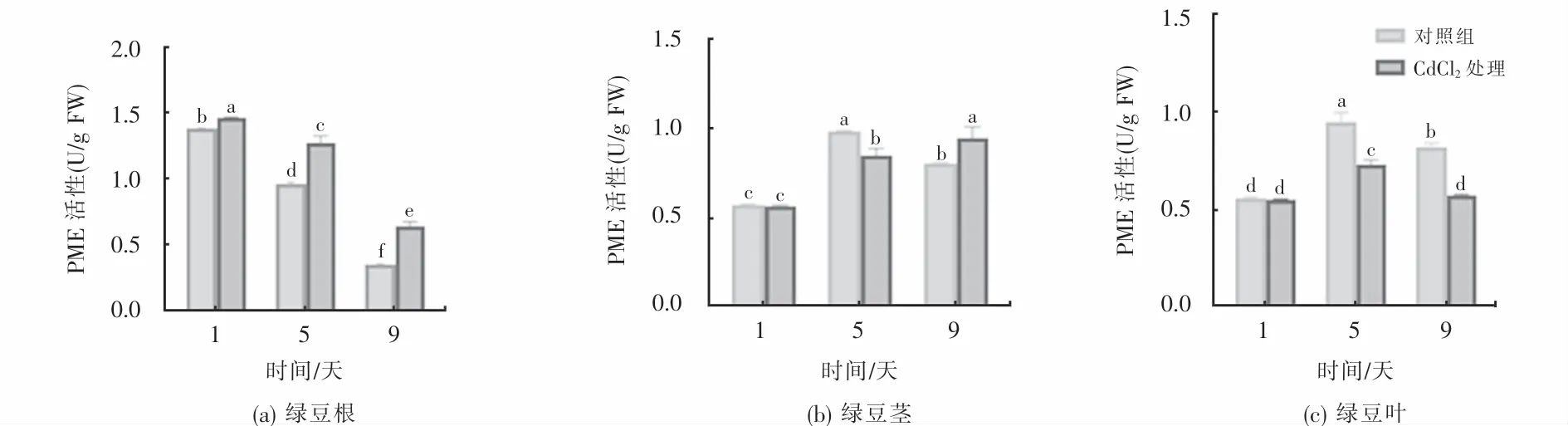
图5 Cd胁迫对绿豆根、茎和叶中PME酶活性的影响Fig.5 Effects of Cd stress on the activity of PME enzyme in root,stem,and leaf tissues
3 讨论
本次研究从绿豆基因组中鉴定了80个PME基因,已有研究在拟南芥[3-4]、大豆[25]、水稻[7]、番茄[4]和棉花[2]基因组中分别鉴定出66、124、59、79和80个PME基因.显然,不同物种PME家族基因数量差异较大,绿豆具有较多的PME家族基因数.PME蛋白的预测表明,VrPME蛋白的肽链长度、等电点和分子量等差异较大.亚细胞定位预测表明,绿豆PME蛋白分布于不同的细胞器中,包括细胞核、内质网、质膜、叶绿体等,这一结果与PME蛋白在葡萄中亚细胞定位预测结果有所不同,在葡萄中部分PME蛋白在线粒体中也有表达,但在叶绿体中未表达[26].这说明了PME蛋白在细胞核、内质网和质膜中能发挥稳定的生物学功能.
大多数VrPME是保守蛋白,且所有蛋白含有PMEI保守结构域.大部分VrPMEs含有2~3个外显子,只有少部分基因含有4~6个数外显子,这与棉花PME基因所呈现出的结果完全一致[27].综上,PME在基因结构和蛋白质结构均呈现出具有相对稳定的进化方向,其功能具有稳定性.
PME由高尔基体合成并释放到细胞壁中,催化甲基酯化及果胶脱甲酯化[28].PME在细胞壁的形成和果胶的重塑中起重要作用[8].研究发现PME基因在植物生长中起重要作用.在本研究中,转录组揭示17个VrPMEs在绿豆根、茎和叶中表达(见图3),其表达量呈现根>茎>叶.VrPME66具有组织特异性,在茎和叶中表达,但在根中未表达.在拟南芥的发育过程中,编码PME的At4g02330主要在花组织、柱头、微管组织和花粉粒中表达[3],编码PME的At2g47550可能参与花粉和花粉管的发育,而At4g02330可能参与细胞壁的果胶代谢,调节细胞分离和花瓣脱落[3];葡萄中,大多数PME存在于浆果和卷须中,并在花序中高度表达[29-30],PMEs呈现组织特异性表达模式,可能与PMEs的扩增、进化以及植物生长发育的复杂性有关[17].本文分析了17个VrPMEs对Cd胁迫的响应,结果表明,Cd胁迫下,在根、茎和叶中被显著上调的基因数量分别为3、3和8个,平均上调倍数分别为3.25、1.8和0.37.其中VrPME06、VrPME21和VrPME25在根中被强烈上调,在根中被显著上调的基因且都属于Type-1,Vr-PME16在茎中显著上调4.44倍(见图4).Hongo等[31]发现Ⅰ型PME AtPME35(At3g59010)通过介导皮层细胞和纤维束间的初级细胞壁去甲基酯化来加强拟南芥茎的功能,AtPME35的特异性表达是茎机械强度所必需的.VrPME16、VrPME21和VrPME25的pI为8.9、8.61和8.87,与AtPME35 pI 8.70相近,因此它们也可能具有类似于AtPME35的去甲基酯化活性.VrPME16、PtoPME35和AtPME35的氨基酸序列高度相似.杨树PtoPME35在干旱胁迫的茎中高度表达[32].这些证据表明组织特异性表达对于PME响应非生物胁迫功能多样性非常重要.这为果胶不仅在初级细胞壁中起作用,而且在次级细胞壁中起作用提供了新的证据.
Cd胁迫使绿豆根中PME酶活平均升高了25%(见图5(a)),而茎中酶活性平均只升高了0.5%(见图5),表明根中PME酶在响应Cd胁迫中起作用,而茎和叶中PME酶对Cd胁迫不响应.并且镉胁迫根中PME酶活性在第1天最大,随着Cd胁迫的时间推移,PME酶活性逐渐降低,这与盐胁迫对拟南芥PME酶活性影响一致[33].有研究发现一定浓度Al3+刺激水稻PME酶活性升高[34],低温胁迫导致拟南芥和油菜(Brassica napus L.)PME酶活性升高[35-36].此外,Al、Pb和Cu胁迫均导致水稻PME酶活性显著提高,果胶含量显著上升,果胶甲酯化程度显著降低的趋势[37].这些结果表明,重金属胁迫导致植物PME酶活性升高,强调PME基因及其酶在植物响应重金属中起重要作用.综上所述,PME在植物响应非生物胁迫中的功能及其机制仍有待揭示.
4 结论
基因组和转录组结果表明,PME基因不仅在植物的生长和发育中起重要功能,而且通过改变细胞壁的结构和功能植物响应非生物胁迫中起重要作用.在植物响应重金属Cd胁迫中,根PME基因及其酶具有更为直接的作用,而茎和叶PME基因及其酶仅为弱响应.
