异常威克汉姆酵母与酿酒酵母在混合发酵中的相互作用机制
2022-09-01赵剑雷邱树毅王晓丹周鸿翔
赵剑雷,邱树毅,王晓丹,袁 梦,周鸿翔
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
酵母菌是果酒酿造中主要的功能性微生物,根据其在酿造过程中功能不同而分为酿酒酵母(,)和非酿酒酵母。具有较高的产酒能力与耐受性,在发酵过程中大多会占据优势并完成发酵;非酿酒酵母则能产生更加复杂的风味成分以及胞外酶等代谢物,可以将原料中的物质充分释放,将其转化为高级醇、酯等香气物质,提升果酒的品质。因此,将和非酿酒酵母用于混合发酵果酒,能将原料中独特的风味更好地展示出来。
非酿酒酵母中有一类酵母菌在其生长过程中能产生较多的酯类香气成分及其前体,这类酵母菌可以叫做产酯酵母或产香酵母。产香酵母近年来被应用于很多食品的生产,如面食的发酵、酱油、食醋、白酒以及果酒的酿造中,使香气复杂化,具有提升产品品质的能力。但非酿酒酵母乙醇发酵能力较弱,常常不能将之用于纯种发酵。近年来很多研究将和产香酵母混合发酵,但在混合发酵时,需要研究混合发酵过程中的相互作用关系和规律,才能更好地控制发酵各个阶段的菌种特性和代谢,优化生产发酵工艺。
在前期研究中,筛选出2 株优良酵母菌株,其一是高产乙醇、发酵能力强的ZM-005,以及对香气成分有显著贡献的异常威克汉姆酵母(,)K-008,通过研究其相互作用,可以增加产品的功能特性。据文献报道,在混菌发酵时,会发生不同菌株对营养物质的竞争、产生具有毒性的代谢物抑制或者存在细胞接触的影响作用等。最有代表性的代谢物就是乙醇,因为发酵会产生大量的乙醇从而抑制非酿酒酵母的生长。除乙醇外,代谢物中也会产生短链、中链、长链脂肪酸、高级醇、寡聚肽或一些有毒蛋白等,会抑制其余菌种的生长。在混菌发酵中相互作用的影响因素较为复杂,影响机制也较为繁琐,不同的菌种之间也有着较大差异。
本实验以前期筛选出的2 种优良酵母菌株为研究对象,对其进行单菌种及混合培养,通过考察混合发酵时生长变化规律,分析相互作用中细胞凋亡、代谢物以及细胞接触作用,一方面旨在对酵母菌相互作用机理及发酵动力学有更加深入的认识,另一方面在混合发酵工艺提升产品风味的基础上,更加准确调控微生物的生长和代谢,使得生产更加系统化。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与培养基
ZM-005为从自然发酵蓝莓酒中筛选出来的1 株产酒能力优良且能在WL鉴别培养基呈现特有颜色和形态的酵母菌;K-008由贵州省发酵工程与生物制药重点实验室鉴定保藏。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母浸粉10 g/L,琼脂15 g/L,蒸馏水100 mL,115 ℃灭菌20 min;YPD液体培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母浸粉10 g/L,蒸馏水100 mL,115 ℃灭菌20 min;WL营养琼脂培养基:酵母粉5 g/L,酸水解酪蛋白5 g/L,葡萄糖50 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125 g/L,硫酸锰0.125 g/L,硫酸镁0.002 5 g/L,氯化铁0.002 5 g/L,溴甲酚绿0.022 g/L,琼脂15 g/L,蒸馏水100 mL,121 ℃灭菌15 min;发酵培养基:无水葡萄糖200 g/L,蛋白胨10 g/L,酵母粉10 g/L,蒸馏水100 mL,115 ℃灭菌15 min。
1.1.2 试剂
磷酸二氢钾、氯化钾、氯化钙、硫酸锰、硫酸镁、氯化铁、溴甲酚绿 上海博微生物科技有限公司;无水葡萄糖 天津市永大化学试剂有限公司;无水乙醇天津市富宇精细化工有限公司;蛋白胨、酵母粉 青岛高科技工业园海博生物技术有限公司;葡萄糖、乙醇、乳酸标准液 深圳市西尔曼科技有限公司;生物传感器酶膜缓冲液粉、乙醇酶膜、葡萄糖酶膜 深圳市西尔曼科技有限公司。
1.2 仪器与设备
SW-CJ-1FD超净工作台、SPX-250B-Z型生化培养箱、YXQ-75S11立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;ZQPL-200立式全温震荡培养箱 天津市莱玻特瑞仪器设备有限公司;HH-21-6电热恒温水浴锅 上海助蓝仪器科技有限公司;BSA124S-CW电子天平 赛多利斯科学仪器(北京)有限公司;JXFSTPRP-24细胞破碎仪 上海净信发展有限公司;NP-30S涡旋混合仪 常州恩培仪器制造商有限公司;LC-LX-H185C台式高速离心机 上海力辰邦西仪器科技有限公司;S-10生物传感器分析仪 深圳市西尔曼科技有限公司。
1.3 方法
1.3.1 菌种活化
将-80 ℃甘油管保藏菌株,划线于YPD固体平板上,30 ℃恒温培养48 h后,将平板上单菌落挑取至100 mL灭菌的YPD液体培养基中,30 ℃、120 r/min培养48 h,使得培养基中细胞数达到10CFU/mL,备于接种。
1.3.2 共同接种发酵
对照组:将和分别接种于发酵培养基中,接种量为5×10CFU/mL,30 ℃培养至发酵停止,发酵前2 d内每隔4 h取样,稀释涂布于WL鉴别培养基中,2 d后每隔24 h涂布一次,观察过程中生物量变化。
实验组:1)正常混合发酵:将和以1∶1(都为5×10CFU/mL)比例接种于发酵培养基中,计数方法与对照组一致;2)不同初始浓度的接种:梯度为5×10、2.5×10、1×10CFU/mL接种于发酵培养基中,每隔2 d涂布于WL固体平板计数;3)高浓度接种:以10CFU/mL接种量,以5×10CFU/mL同时接种于发酵培养基中,计数方法与对照组一致。
以上实验均在30 ℃下恒温培养。
1.3.3 酵母细胞对乙醇耐受性
活化好的两种菌按接种量5×10CFU/mL接种到100 mL YPD液体培养基(乙醇体积分数分别为1%、2%、3%、4%、5%、6%接入培养基中)中,30 ℃、120 r/min培养48 h,稀释涂平板,30 ℃恒温培养2 d,计算菌落总数。以上实验组均有3 组平行,取平均值。
1.3.4 发酵上清液制备
制备纯发酵、纯发酵以及混合发酵上清液,将培养2、4、6 d后的3 个时间段发酵液静置10 min,分别倒入50 mL已灭菌的离心管,8 000 r/min离心5 min,重复离心2 次,取上清液,再次倒入新的离心管,重复离心步骤,在超净台中过0.22 μm滤膜,去除剩余酵母细胞,得到无细胞的发酵上清液备用。
1.3.5 死细胞和破碎细胞处理
参考Nissen等实验,100 ℃煮沸等量的细胞10 min,得到死细胞,放入100 mL离心管中,8 000 r/min离心5 min,重复离心2 次后备用;将5 000 r/min离心10 min后的细胞沉淀放入冷冻细胞破碎机中破碎5 min,再次重复离心,取出破碎细胞备用。
1.3.6 透析袋实验
通过Renault等设计的一种新型模型,模仿其设计透析袋发酵罐实验,选择1 000 Da和12 kDa截留分子质量的透析袋,发酵罐内加入发酵培养基,将透析袋和发酵罐进行组合。透析袋100 ℃高温煮沸10 min备用,将煮好的透析袋放入发酵罐中,透析袋内外加入等量的发酵培养基,罐口封上封口膜,115 ℃灭菌20 min,发酵罐透气测温顶盖65 ℃下灭菌30 min取出,经过乙醇消毒后紫外线照射15 min,在超净台中组合,接菌后放入30 ℃恒温培养箱。
接种方式:将接种于透析袋内,接种于透析袋外,为验证透析袋实验准确性,作为对照将接种在透析袋内,接种在透析袋外,每4 h测定每组透析袋内外的生物量、葡萄糖、乙醇含量,测定至36 h。接种量均为5×10CFU/mL。
以上实验均重复3 次取平均值。
1.3.7 发酵动力学测定
3 组分别为纯接种、纯接种、与混合接种(1∶1)。其中发酵培养基为20%含糖量的液体YPD培养基,纯发酵以及混合发酵接种每种菌体接种量都为5×10CFU/mL。接种后,每隔1 d称质量一次,一直到发酵结束为1 个周期,以CO质量损失测定其发酵速率,计算如下式所示:
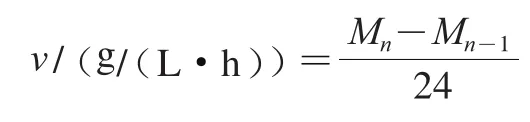
式中:M为发酵第天总质量损失;M为发酵第-1天总质量损失。
1.3.8 葡萄糖和乙醇测定
缓冲液准备:将缓冲液粉倒入缓冲液瓶,加入5 000 mL纯水充分溶解6 h后使用(必须一次性配完5 000 mL,不能拆分配制,否则会损坏酶膜)。
生物传感器测定:进行葡萄糖与乙醇标定,每次使用前,将葡萄糖(1 g/L)和乙醇(0.5 g/L)标准液从4 ℃取出,系统调至定标操作,将25 μL标准液注入感应器中,调整电极电量,定标3 次至系统显示通过,每测定10 次样品后需重新定标进样(乙醇量程0~1 g/L、葡萄糖量程0~2 g/L),样品条件:稀释倍数使得葡萄糖与乙醇都在量程范围内才能测定。
样品测定:将发酵培养基中的溶液混匀,在无菌超净台中取样,首先取1 mL样品放入离心管,2 000 r/min离心5 min,吸取离心清液中不同部分(上、中、下)溶液各100 μL,稀释于10 mL容量瓶中,用蒸馏水定容(稀释100 倍),再用标准溶液标定生物传感器,使得系统标定成功。测定时加入25 μL的样品稀释液,测定样品葡萄糖和乙醇含量,均测定3 次取平均值。
1.3.9 生物量测定
平板计数法:在混合培养条件下,由于和在电子显微镜下生长形态相似,肉眼难以区分,有研究发现,WL选择培养基能分辨不同的酵母菌,通过预实验发现在WL鉴别培养基中呈现黄色凸起状,而在WL鉴别培养基中呈现白色扁平状,故可以采用WL鉴别培养基进行计数。
血球计数板法:添加亚甲基蓝溶液对酵母活细胞进行染色再计数。
1.4 数据处理
利用OrginPro 2018C软件对数据进行作图分析、利用Adobe illustrator CS6进行优化作图和组合。
2 结果与分析
2.1 纯发酵和混合发酵2 种酵母菌发酵性能比较
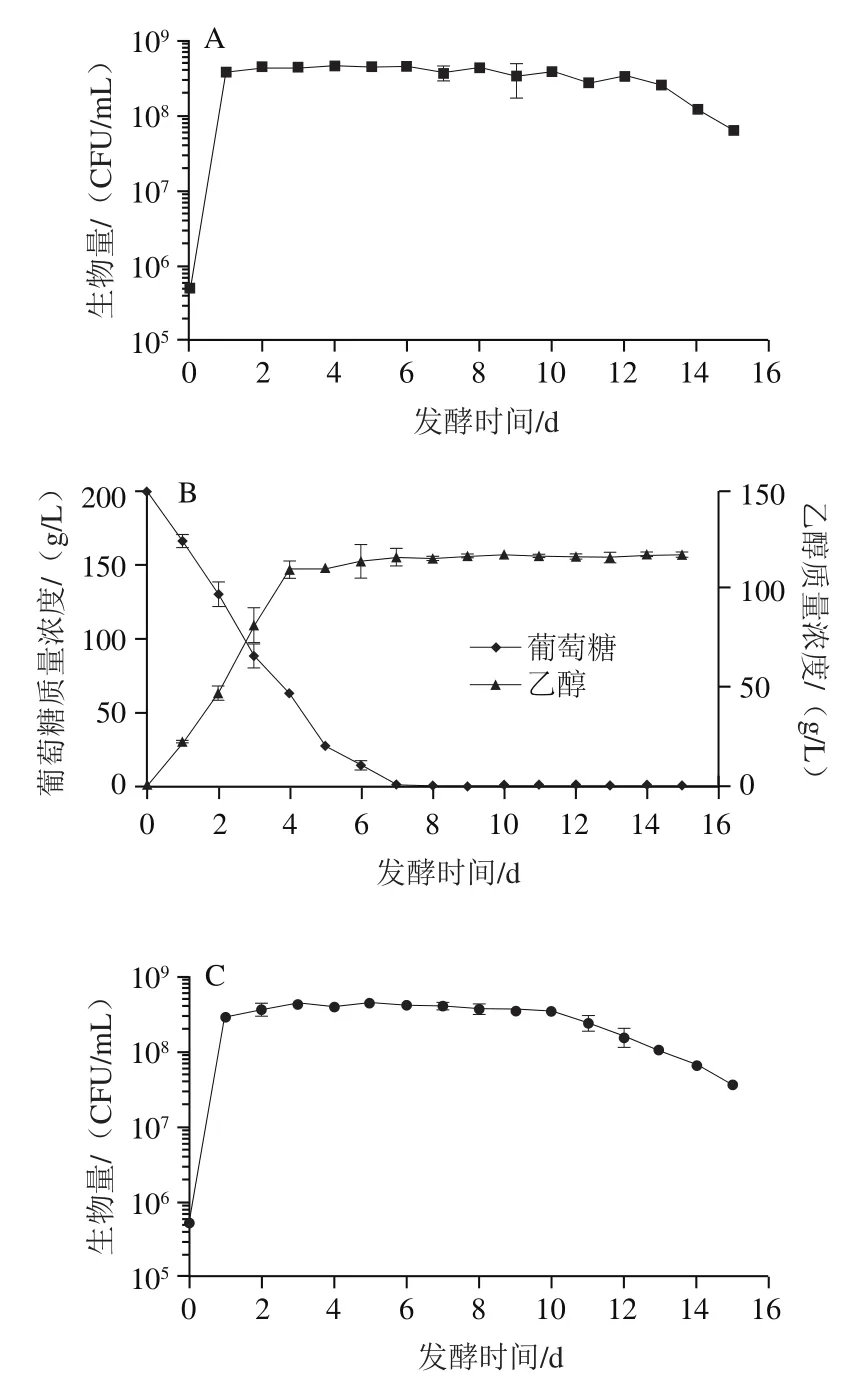

图1 纯发酵与混合发酵动态指标监测Fig. 1 Fermentation characteristics of pure and mixed cultures
由图1A、C可知,当发酵培养基中葡萄糖添加量为200 g/L时,纯培养和均能正常生长且在发酵2 d后能趋于稳定,此时的生物量为4.38×10CFU/mL,而的生物量为3.54×10CFU/mL。据文献报道,混合发酵时通常会在发酵早期影响非酿酒酵母的生长,或者产生负面影响,使非酿酒酵母提前停滞生长,得到低于的菌体浓度,由图1E可知,混合发酵1 d后,生物量达到2.75×10CFU/mL,但生物量仅为4.32×10CFU/mL,此时在体系中逐渐占据主导地位并生长到较高浓度。在初期生长量和生长速率均小于,在2~15 d发酵中生物量逐渐下降,第16天时生物量下降到4.53×10CFU/mL,因为发酵后期随着培养基中营养物质不断被消耗,乙醇质量浓度的上升以及大量酵母竞争生存空间,使不能正常生长。
由图1B、D、F可知,以葡萄糖的消耗为例,纯发酵约7 d后将发酵体系中的葡萄糖完全消耗,混合发酵9 d后也能将葡萄糖消耗殆尽,表明在混合发酵时同样可以完全发酵底物。纯发酵虽然速率较慢,直到13 d后才将糖消耗殆尽,但也可以完成发酵。对于乙醇生成量,纯发酵从2 d开始产生乙醇,7 d后乙醇发酵完成,质量浓度达到115 g/L,而纯发酵产生乙醇能力较弱,乙醇发酵从2 d开始到14 d才结束,最终乙醇产量仅有84 g/L。混合发酵中,乙醇发酵9 d才结束,此时乙醇质量浓度达到110 g/L,与纯发酵相似。相比下纯的发酵能力比纯发酵能力弱,混合发酵过程中生物量占比大,数量和纯发酵相近,所以混合发酵能力与纯发酵相似,对乙醇发酵过程没有较大影响。
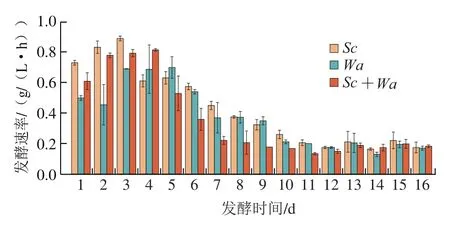
图2 发酵速率变化Fig. 2 Fermentation rate as a function of fermentation time
有研究表明通过发酵前300 h的CO产生量可以衡量菌种的发酵能力,从图2可知,实验通过计算每天生产CO的速率比较发酵性能,纯发酵在第3天达到最大速率(1.10±0.02)g/(L·h),同期纯发酵为(0.71±0.02)g/(L·h),混合发酵为(0.81±0.02)g/(L·h)。因此,纯发酵能力大于混合发酵和纯发酵能力,混合发酵的发酵能力也大于纯发酵。
2.2 混合发酵早期现象

图3 混合发酵酵母菌生物量变化Fig. 3 Yeast biomass in mixed culture fermentation as a function of fermentation time
由图3可知,在混合发酵前36 h,体系中的生长速率和生长量都与纯培养时相似,而在混合发酵24 h后呈下降趋势,生物量仅为4.30×10CFU/mL,未达到纯培养时最大生物量,生长受到影响,继而成为体系中优势菌种并大量生长。混合发酵早期出现生长停滞或抑制现象,可能是混合培养中存在细胞自身凋亡、酵母菌产生的代谢物影响生长或酵母中存在的间接细胞接触作用。
2.3 Wa前期死亡因素分析
2.3.1的自然死亡现象
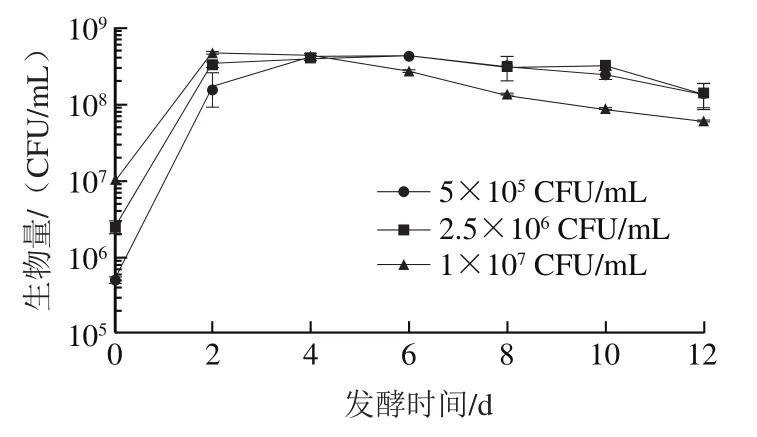
图4 酵母菌自身凋亡现象Fig. 4 Yeast apoptosis as a function of fermentation time
为判定混合培养中早期死亡机制是否和纯培养时死亡机制相同,将不同初始接种量的(5×10、2.5×10、1×10CFU/mL)分别接于发酵培养基中,监测其生长变化。由图4可知,不同接种量的均能正常生长,直到发酵后期才出现菌体死亡,是因为营养物质消耗殆尽,细胞出现自溶死亡。初始接种浓度越高,营养消耗越快,后期细胞死亡现象越早。实验发现的自溶凋亡现象出现在发酵后期而不是在发酵前期,由上可以初步排除混合发酵前期(图1E)生物量下降是细胞凋亡和自溶。
2.3.2 发酵上清液实验
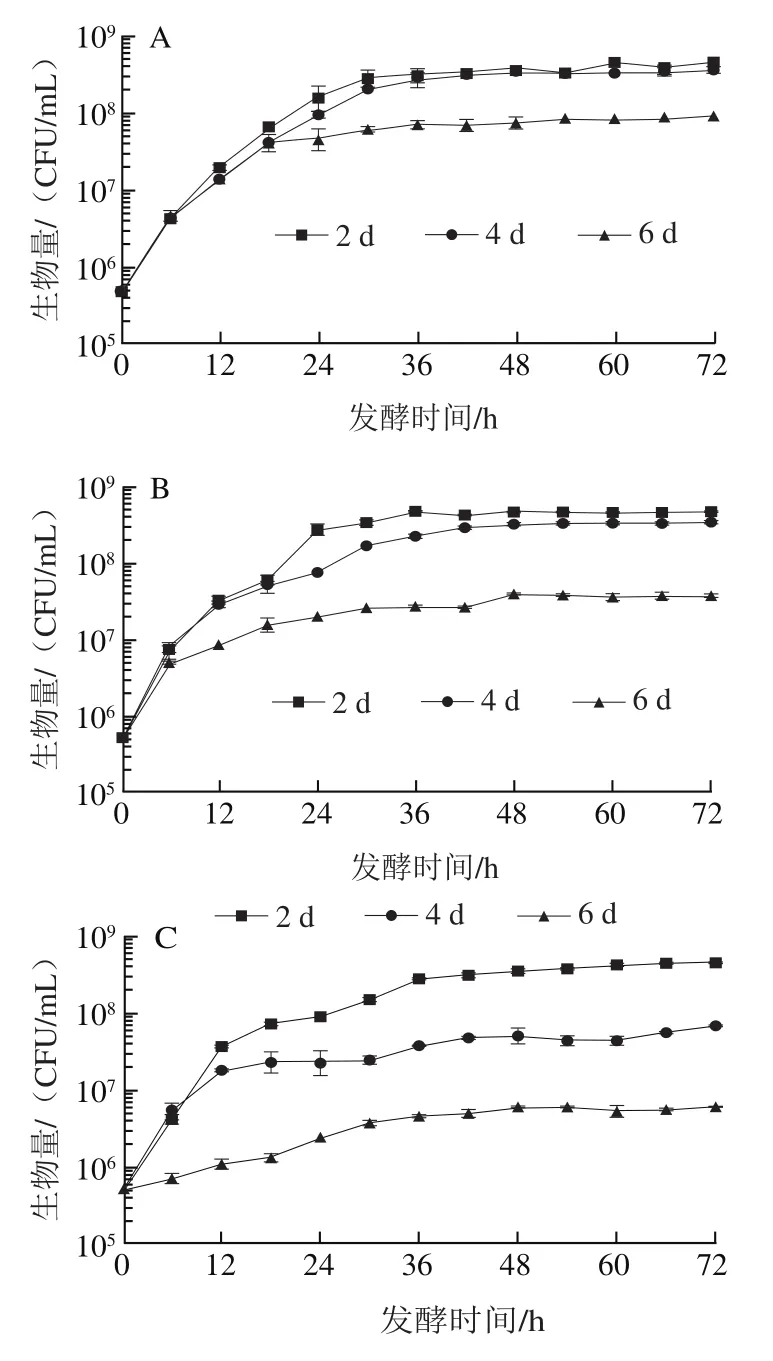
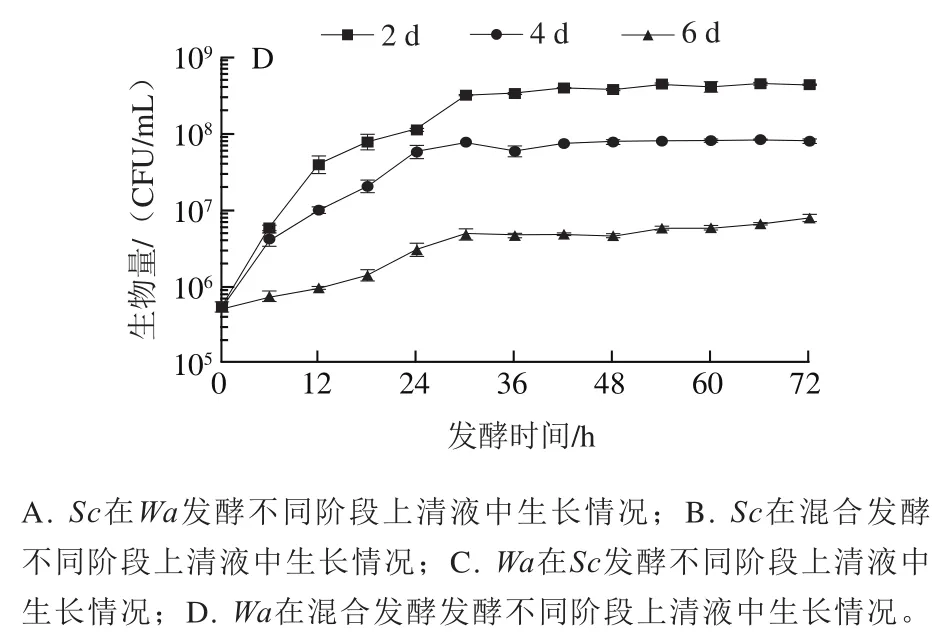
图5 不同阶段发酵上清液中酵母菌生长曲线图Fig. 5 Growth curves of yeast in supernatant at different fermentation stages
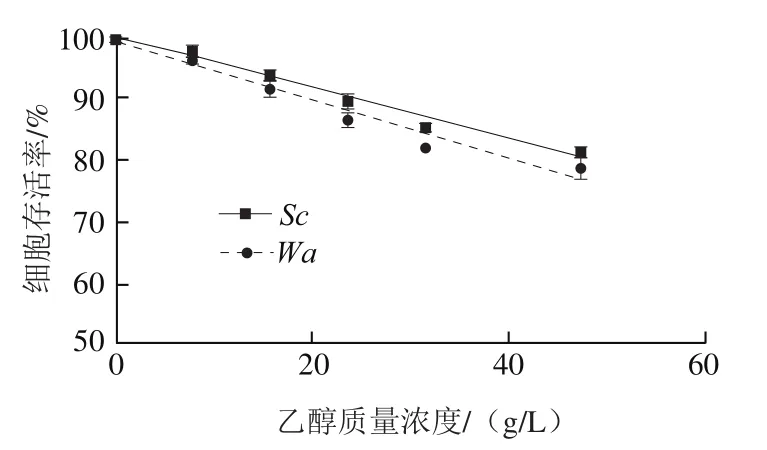
图6 两种酵母菌对乙醇的耐受能力Fig. 6 Ethanol tolerance of two yeasts
分别将与纯培养时不同发酵阶段的无细胞滤液当作培养体系,向其中分别加入两种酵母细胞,观察其生长变化。有研究表明,混合发酵时在生长过程中能产生抑制非酿酒酵母生长的物质(抗菌肽、有毒化合物等),使得非酿酒酵母不能正常生长。由图5A可知,在发酵2、4 d后上清液中生长情况与纯发酵时相似,这表明纯发酵前期几乎没有产生能抑制生长的物质。从图5B可以发现,在混合发酵4 d后上清液中生长量略小于在纯发酵4 d上清液中的生长量,通过图1D、F数据显示,发酵4 d上清液中糖含量剩余55%,而在混合发酵4 d的上清液中糖含量仅剩38%,同时由图6可知,两种酵母菌乙醇耐受能力相似,所以发酵前期乙醇含量没有明显抑制生长的现象,由此发现在混合发酵4 d上清液中生物量小于在发酵4 d上清液中的生物量是营养物质限制造成的。
从图5C可知,在发酵2 d上清液中,也能维持一个正常的生长状态,生物量可以达到10CFU/mL,所以在发酵前期生长几乎不受前期代谢物的影响。随着发酵和混合发酵时间的延长,生物量逐渐下降,例如在发酵4 d以及混合发酵上清液中只能生长在10CFU/mL左右,同时对比图5C、D,在混合发酵6 d和发酵6 d后的上清液中,最大生物量仅能生长到10CFU/mL。结合图1E和图5D,发酵后期生物量从10CFU/mL降到10CFU/mL,与在混合发酵6 d后的上清液中生长量相似,无论是在发酵6 d还是混合发酵6 d后的上清液中,乙醇质量浓度都高于100 g/L,而糖质量浓度都低于40 g/L,可以发现后期死亡现象是由于乙醇的大量积累导致微生物细胞破坏,使得酵母菌死亡。综上所述,在发酵后期起到抑制生长的主要原因是高浓度的乙醇和营养物缺乏,而在发酵前期,纯发酵上清液和混合发酵上清液都没有对的生长起到明显的抑制作用,可以初步排除发酵前期代谢物的影响。
2.4 高浓度活Sc细胞的影响
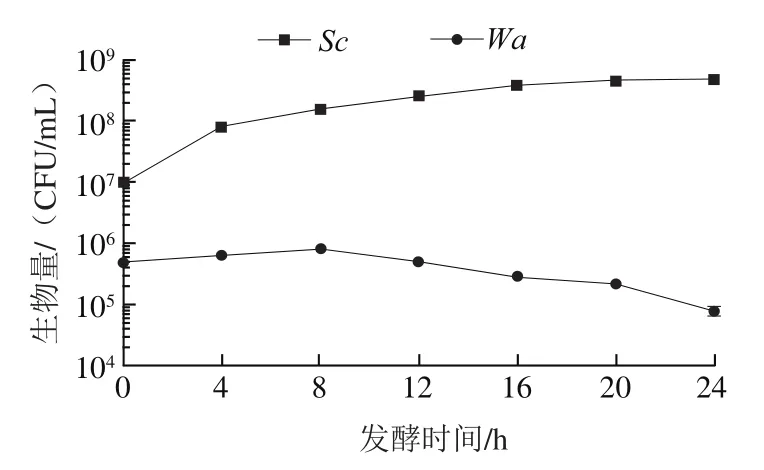
图7 高浓度Sc添加时酵母菌生长情况Fig. 7 Growth of yeast in the presence of high concentration of Sc

图8 添加死亡和破碎的Sc细胞条件下Wa的生长Fig. 8 Growth of Wa in the presence of dead or broken Sc cells
从Nissen等的研究中发现,高密度细胞的存在可能会通过细胞接触影响体系中其他酵母菌正常生长,当溶液中活细胞浓度达到1×10CFU/mL时,就会增加体系中高密度接触作用,从而出现抑制现象。为证实是高浓度细胞产生的影响,实验中同时添加1×10CFU/mL高浓度的和5×10CFU/mL的于同一体系中,由图7可知,当添加高浓度的时,在12 h生长到1.37×10CFU/mL就开始呈现下降趋势。由图8可知,将等量细胞进行高温煮沸灭活和冷冻破碎细胞两种方法处理后,再加入培养基中,依旧能正常生长繁殖并在12 h后达到10CFU/mL。所以在混合发酵前期,高浓度活细胞的存在导致生长受到抑制。
2.5 细胞-细胞接触机制
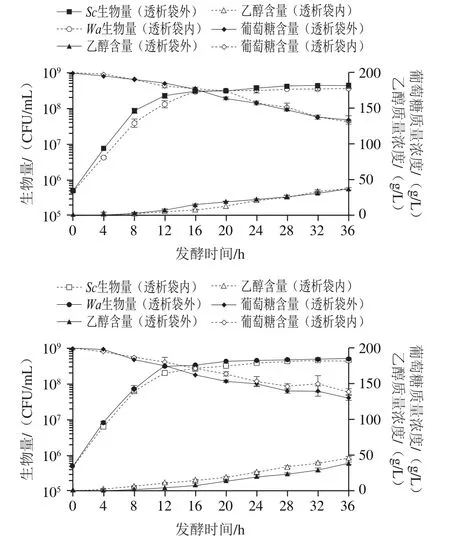
图9 透析袋内外变化监测(1 000 Da)Fig. 9 Biomass, ethanol concentration and glucose concentration inside and outside dialysis bag as a function of fermentation time (1 000 Da)
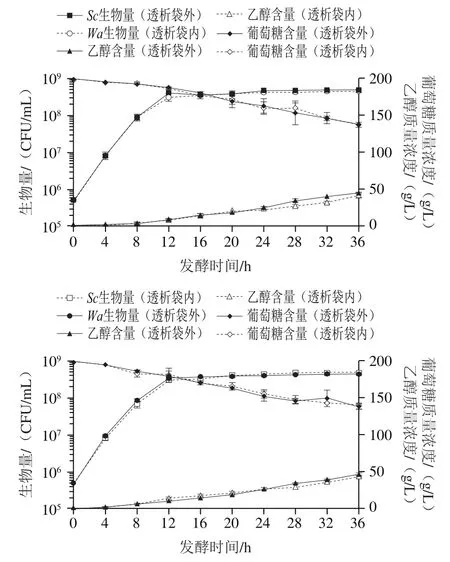
图10 透析袋内外变化监测(12 kDa)Fig. 10 Biomass, glucose concentration and ethanol concentration inside and outside dialysis bag as a function of fermentation time (12 kDa)
实验采用透析袋隔离不同酵母细胞,透析袋可以使得其余溶质自由出入和混合均匀,保证体系中的各种营养物质趋于平衡,酵母细胞这种较大分子质量的物质能有效被隔绝在两个体系内,使两种不同的生物细胞之间没有细胞接触作用。使用1 000 Da和12 kDa两种截流分子质量不同的透析袋将两种酵母细胞分为两个体系,初始接种5×10CFU/mL细胞量。由图9、10可知,在截留分子质量为1 000 Da和12 kDa的透析袋内外两个体系中,乙醇、葡萄糖的变化趋势和含量均无明显差异,由于葡萄糖是培养基中主要的营养成分且含量最多,乙醇是产生代表性的小分子物质,通过检测这两个指标,可以初步判定实验中所选择的两种透析袋对发酵中主要物质有着充分的渗透性,使得透析袋内外两种菌生长基础条件相同。可以观察到,发酵前期与生物量和生长趋势均与纯发酵近似,所以在透析袋体系中,排除发酵前期小分子代谢物的产生对两种酵母菌生长的影响。由图9可知,在1 000 Da的透析袋中,生物量经过36 h后为3.65×10CFU/mL,而透析袋外生物量为4.42×10CFU/mL,说明在营养物质充足的条件下两种酵母菌的生长情况与纯培养时几乎一致,同样的情况也出现在12 kDa透析袋实验中(图10)。但在1 000 Da中生物量略低于纯发酵组,分析可能是透析袋截留分子质量太小,两侧的浓度差不够大,一些小分子物质经过透析袋时动力不足,透析袋内小空间中营养物质流动较慢,交换较少,最终使透析袋内的菌种受到营养限制。以上实验中,和都可在其对应的无细胞发酵上清液中生长,也可以初步排除分子质量高于12 kDa的可溶性生长抑制化合物的潜在效应。结果表明,本实验使用的酵母菌在混合培养前期存在影响菌体生长的细胞-细胞接触机制,早期的死亡现象是在高浓度存在下,通过细胞-细胞接触机制实现。
3 结 论
与混合发酵前期,正常生长而出现生长抑制和死亡现象。在本实验体系中,首先接种不同初始浓度发酵后,初步排除在发酵前期细胞自身凋亡作用引起其生物量下降。再通过发酵性能和上清液实验,在早期死亡原因,初步排除是发酵前期产生乙醇等有毒物质抑制的作用。当已灭活细胞、破碎后细胞、高浓度活细胞分别与混合时,发现只有在高浓度活细胞存在的发酵体系中对生长有抑制作用。最后通过透析袋实验发现高浓度的活会通过细胞-细胞接触对生长起到抑制作用,使得在发酵前期,出现生长停滞和死亡现象。混合发酵研究中相互作用是复杂且多样的,在本实验体系中仅发现了细胞接触抑制作用,其余相互作用以及之间主次关系还有待更加深入的探讨,接下来可以运用代谢组学和蛋白组学对微生物之间不同的作用机制进行更深入的研究。
