内源多酚对松仁各组分蛋白理化性质、功能特性和结构的影响
2022-09-01李艳霞赵玉红
齐 奇,李艳霞,杨 凯,赵玉红,3,*
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江省林业科学研究所,黑龙江 哈尔滨 150081;3.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040)
红松(Sieb. et Zucc)是松科松属植物,主要分布在我国东北地区。红松仁是成熟的红松种子去壳皮后得到的种仁,蛋白质量分数在13%~20%之间,构成松仁蛋白的氨基酸种类齐全,是一种优质的植物蛋白质来源。关于松仁蛋白研究主要集中在性质、抗氧化、抗疲劳、降血糖、降血压以及松仁乳的制备等方面。
松仁粕(pine kernel meal,PKM)是由红松仁脱脂后得到的,含有大量蛋白质,通过碱溶酸沉法可以提取分离蛋白(protein isolates,PI),松仁PI中含有球蛋白(globulin,Glo)、清蛋白(albumin,Alb)和谷蛋白(gluten,Glu),这几种蛋白质在理化性质和功能特性上存在差异,在不同的pH值和温度下松仁蛋白的溶解性和乳化性变化趋势不同。偃松松仁蛋白具有较高的溶解性、乳化性、起泡性,不同的提取方法影响松仁蛋白功能特性。
多酚化合物对人体健康有促进作用,功能作用的表现与多酚-蛋白质之间的相互作用密切相关。在蛋白质的提取过程中,高活性的酚类物质在碱性条件下与蛋白质的巯基(—SH)和氨基(—NH)共价结合,或在低pH值条件下通过氢键非共价结合,使提取的蛋白产生较深的颜色和苦味。酚类物质可以通过诱导蛋白质之间发生交联,改变蛋白质表面净电荷。这种相互作用也会改变蛋白质的结构,影响蛋白质表面性质,使其在本质上具有亲水性,进而影响乳化、起泡等功能特性。Jiang Jiang等发现绿原酸通过非共价键与乳清蛋白和酪蛋白相互作用,蛋白质结构发生改变,总巯基和表面疏水性降低,但溶解性、起泡性和泡沫稳定性显著提高。Yan Shizhang等通过研究表没食子儿茶素没食子酸酯(epigall ocatechin gallate,EGCG)与大豆分离蛋白的相互作用,表明EGCG改变了蛋白质的三级构象和二级结构,使大豆蛋白表现出更佳的溶解性和乳化性。Li Changhong等向乳铁蛋白中加入原花青素,乳铁蛋白的表面疏水性降低,起泡性和起泡稳定性增加。加入外源酚类化合物对蛋白质结构和性质有影响,但关于植物中内源多酚对蛋白质影响的研究却比较有限。松仁中含有5%左右的多酚,是松仁中的主要生物活性成分,而内源多酚对松仁蛋白各组分的性质和结构的影响鲜见报道。
本研究通过对PKM和脱酚松仁粕(dephenolized pine kernel meal,DPKM)中PI、Glo、Alb和Glu的理化性质、功能特性以及结构进行研究,探讨内源多酚对松仁各组分蛋白性质影响的结构因素,旨在为红松PKM的综合利用以及相关产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
红松松籽由黑龙江省林科院提供。
三羟甲基氨基甲烷(trihydroxymethyl aminomethane,Tris)、甘氨酸、十二烷基硫酸钠、-巯基乙醇、考马斯亮蓝G-250、5,5-二巯基-2,2-二硝基苯甲酸(5,5-dimercapto-2,2-dinitrobenzoic acid,DTNB)、8-苯胺基-1-萘磺酸钠(8-anilino-1-naphthalenesulfonic acid,ANS)均为国产分析纯。
1.2 仪器与设备
TDL-40B-W型高速离心机 上海恒勤仪器设备有限公司;722型可见光分光光度计 上海光谱仪器有限公司;FD5-2.5E型冷冻干燥机 北京金西盟仪器有限公司;CM-5型色差仪 日本Konica Minolta公司;FTIR-650傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 天津港东科技发展股份有限公司;LS55荧光分光光度计 美国PE公司。
1.3 方法
1.3.1 原料预处理
PKM制备:将红松松籽手工去壳皮后粉碎机粉碎,索氏抽提法将PKM脱脂,放置在通风厨中室温风干,将干燥的PKM在粉碎机中粉碎,过60 目筛,4 ℃贮藏,备用。
DPKM制备:参考Yan Xianghui等的方法并略作改动。按照料液比1∶20(g/mL)将PKM与80%乙醇溶液溶解,室温下磁力搅拌2 h,4 000 r/min离心15 min,重复上述步骤3 次,收集沉淀并置于通风橱内24 h,待有机溶剂充分挥发后即得DPKM。
1.3.2 PKM和DPKM中成分测定
蛋白质含量测定:采用GB 5009.5—2016《食品中蛋白质的测定》;水分含量测定:采用GB 5009.3—2016《食品中水分的测定》;灰分含量测定:采用GB 5009.4—2016《食品中灰分的测定》;粗脂肪含量测定:采用GB 5009.6—2016《食品中脂肪的测定》。用100%减去粗蛋白质、水分、灰分和粗脂肪的总和估算碳水化合物含量。总酚含量采用福林-酚比色法,以没食子酸为标准,通过紫外分光光度法在765 nm波长处测量,结果以g/100 g(干质量)的没食子酸当量表示。
1.3.3 PKM和DPKM颜色测定
利用色差仪对PKM和DPKM进行颜色测定,并记录*、*和*值。
1.3.4 松仁各组分蛋白质的制备
松仁PI制备参考Tang Chuanhe等的方法并略作改动。PKM与蒸馏水按照1∶10(g/mL)的料液比溶解,用1 mol/L的NaOH溶液调节溶液pH 9.0,磁力搅拌1 h,4 000 r/min离心20 min,取上清液,在用1 mol/L的HCl溶液调节溶液pH 4.5,磁力搅拌1 h,4 000 r/min离心20 min,沉淀即为松仁PI,将沉淀调制中性,将蛋白样品冷冻干燥并在-20 ℃保存,备用。
Alb制备参考Gammoh等的方法并略作改动。PKM与蒸馏水以1∶10(g/mL)的比例用磁力搅拌器搅拌1 h,4 000 r/min离心20 min,分离上清液和残留物,上清液在-18 ℃冷冻,随后使用冷冻干燥机进行冻干。
Glo制备参考Gammoh等的方法并略作改动。将提取Alb后的残留物加入100 mL 10% NaCl溶液溶解,然后搅拌1 h,4 000 r/min离心20 min,将上清液冷冻干燥,冻干后在-18 ℃保存。
Glu制备参考Gammoh等的方法并略作改动。使用pH计将提取的Glo残留物溶解在100 mL 0.1 mol/L NaOH溶液中,调至pH 10.0,搅拌1 h,4 000 r/min离心20 min。所得上清液在-18 ℃冷冻后在冷冻干燥机中冻干。
同样的方法提取DPKM中各组分蛋白质。
1.3.5 松仁各组分蛋白性质测定
1.3.5.1 松仁各组分蛋白质含量和纯度的测定
采用凯氏定氮法测定蛋白质含量,按式(1)计算蛋白质纯度:
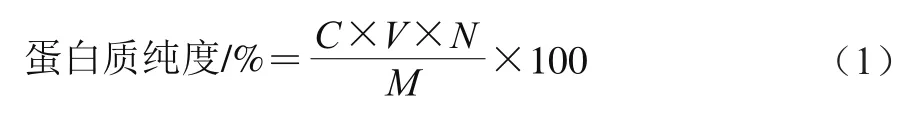
式中:为蛋白质的质量浓度/(mg/mL);为待测样品溶液的体积/mL;为稀释倍数;为蛋白质冻干粉的质量/mg。
1.3.5.2 巯基、二硫键含量测定
参考Beveridge等的方法。每个蛋白样品取75 mg充分溶解于10 mL 8 mol/L尿素-Tris-Gly缓冲液中。测定游离巯基的方法:1 mL上述蛋白溶液中加入4 mL Tris-Gly缓冲液、0.05 mL Ellman试剂(DTNB),反应5 min后于412 nm波长处测定吸光度。总巯基测定:1 mL蛋白溶液中加入0.05 mL-巯基乙醇、4 mL Tris-Gly缓冲液,室温反应1 h,加入10 mL 12%三氯乙酸溶液,继续反应1 h,4 000 r/min离心10 min,沉淀中加入5 mL 12%三氯乙酸溶液并再次以相同条件离心。收集沉淀,将其溶于10 mL Tris-Gly缓冲液,移取4 mL,加入0.04 mL Ellman试剂,反应5 min后于412 nm波长下测定吸光度。按式(2)、(3)计算游离巯基含量和二硫键含量:

式中:为样品质量浓度/(mg/mL);为稀释常数;73.53为摩尔吸光系数,由10/(1.36×10)计算得到。
1.3.5.3 表面疏水性含量测定
参考Malik等的方法并略作改动。利用0.01 mol/L的PBS(pH 7.0)配制0~2 mg/mL的样品溶液,将4 mL的样品溶液与20 μL 8 mmol/L ANS溶液混合。激发波长为390 nm,发射波长为470 nm,激发和发射狭缝宽度均为10 nm,记录荧光强度。
1.3.5.4 溶解性测定
配制各样品蛋白质量浓度1 mg/mL,溶解液为pH 7.0的磷酸盐缓冲溶液。用0.1 mol/L HCl或0.1 mol/L NaOH溶液将pH值分别调至3.0~11.0,室温磁力搅拌30 min,然后在4 000 r/min离心10 min,上清液采用Bradford法测定蛋白含量,用牛血清白蛋白作标准曲线,按照式(4)计算蛋白溶解性:

1.3.5.5 乳化性及乳化稳定性测定
参考刘昱迪等的方法并略作改动。配制1 g/100 mL蛋白溶液,加入5 mL大豆油,将溶液pH值调至9.0。以13 600 r/min的速率均质2 min。分别从每个容器底部取50 μL的乳剂,在第0和30分钟时分散于5 mL质量浓度为1 g/L的SDS溶液中,在500 nm波长处测定吸光度。记录立即测得的吸光度()和30 min后测得的吸光度()。利用式(5)、(6)计算乳化性和乳化稳定性:
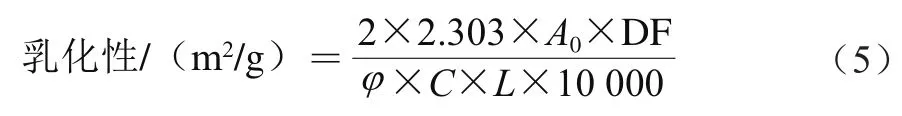

式中:DF为稀释倍数;为乳化液的油体积分数/%;为乳化前的蛋白质量浓度/(g/mL);为光程(1 cm);Δ为30 min。
1.3.5.6 起泡性及起泡稳定性测定
配制10 mg/mL的样品溶液30 mL,将溶液pH值调至9.0。以20 000 r/min的速率均质2 min,迅速倒入50 mL的量筒里,分别在第0()和30分钟()记录泡沫体积。利用式(7)、(8)计算起泡性和起泡稳定性:
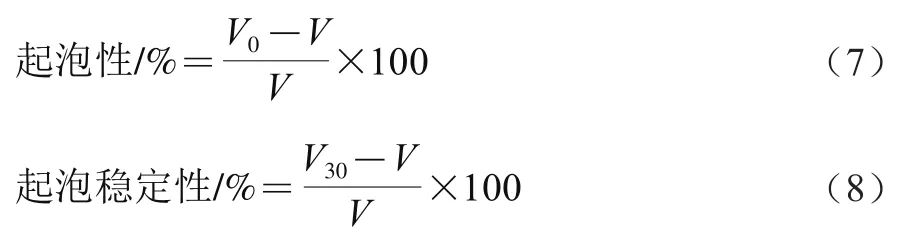
1.3.6 松仁各组分蛋白结构测定
参考Yan Cuijun等的方法并略作改动。将干燥的样品按1∶100的比例与KBr混合后研磨成粉末,压成薄片,使用FTIR仪进行扫描。扫描范围为400~4 000 cm,以4 cm的分辨率共扫描16 次。
1.3.6.2 内源荧光光谱分析
参考王晨等的方法并略作改动。将各组分蛋白样品用10 mmol/L磷酸盐缓冲液(pH 7.0)稀释到2 mg/mL进行测定,设定激发波长为280 nm,发射波长范围为300~450 nm,狭缝宽度均为10 nm,进行荧光光谱扫描。
1.4 数据处理
2 结果与分析
2.1 PKM和DPKM中主要成分和颜色分析

表1 PKM和DPKM主要成分和颜色Table 1 Major components and color parameters of PKM and DPKM
由表1可知,PKM和DPKM的蛋白质量分数分别为66.84%、73.29%,DPKM的粗蛋白含量显著增加(<0.05),这可能是因为多酚脱除后导致多酚与蛋白质相互作用减弱,使得更多的蛋白质暴露出来。与PKM相比,DPKM的灰分、碳水化合物以及总酚含量显著降低,该结果与Malik等研究的酚类物质对葵花籽蛋白基础成分影响的趋势相同。而PKM和DPKM的水分和脂肪含量并没有显著差异,两种样品的脂肪质量分数都在1.9%左右。
PKM和DPKM的*、*和*值如表1所示。相比于PKM,DPKM的*值降低,*和*值升高,因此经乙醇脱多酚后会导致DPKM亮度降低并偏向褐色。
2.2 各组分蛋白质量分数以及多酚含量分析

表2 PKM和DPKM各组分蛋白和多酚含量测定Table 2 Protein and polyphenol contents in protein fractions from PKM and DPKM
由表2可知,与PKM相比,DPKM的蛋白质含量显著增高,其中PI和Glu的含量相对较高。这可能是由于在碱性条件下,多酚与蛋白质相互作用导致蛋白质含量降低。通过80%乙醇溶液进行脱酚处理,使松仁各组分蛋白的多酚含量分别降低了89.34%、83.98%、86.71%、91.49%,说明脱酚效果显著。
首先,能推进财务人员加强岗位工作再认识,做到依法理财;可以促进财务人员深入思考本职岗位工作职责,自觉提高依法理财意识;促进财务人员自觉地调节自己的行为,形成正确的财务道德观,确保国有资产安全,防范经营风险。
2.3 表面疏水性以及巯基、二硫键含量分析
表面疏水性决定了蛋白质的乳化、发泡等功能特性。如表3所示,与DPKM相比,PKM的各组分蛋白的表面疏水性显著增加。原因可能是松仁蛋白与内源多酚的相互作用,引起蛋白质的构象变化,使得蛋白结构展开,疏水性基团增加。也可能与溶解性相关,溶解性越低,蛋白表面疏水性基团越多,表面疏水性值越大。PKM的溶解性显著低于DPKM,所以PKM的表面疏水性较大。因此,可以推断脱酚处理抑制了多酚-蛋白相互作用,使蛋白质的结构发生改变。其中PKM和DPKM疏水性最大的蛋白质都为Alb,分别是970.20、655.40,疏水性最弱的都为Glo,分别是295.03、147.60,可以认为PKM的表面疏水性主要是由于Alb表面疏水性基团的作用所致。
测定游离巯基和二硫键的含量,可以评价蛋白质的三级结构。蛋白质的巯基,尤其是半胱氨酸的游离巯基,具有较高的化学活性,易受多酚的作用,从而影响蛋白质的功能特性。如表3所示,相对于DPKM,PKM各组分蛋白的总巯基及游离巯基明显降低,二硫键含量增加。这些结果表明,在氧和碱性条件下,蛋白质溶液中酚类化合物与半胱氨酸残基具有较强的反应活性,诱导蛋白质结构部分展开,有助于巯基转化为二硫键。酚类化合物也可以被氧化成醌,从而催化巯基向二硫键的转化,导致巯基的进一步丢失。PKM各组分蛋白的二硫键含量显著高于DPKM。二硫键是天然存在于蛋白质中唯一的共价侧链交联,有利于蛋白质空间结构的稳定,因此推断PKM的结构更稳定,热稳定也更好。

表3 PKM和DPKM各组分蛋白的表面疏水性、巯基及二硫键含量Table 3 Surface hydrophobicity and sulfydryl and disulfide bond contents in protein fractions from PKM and DPKM
2.4 溶解性分析
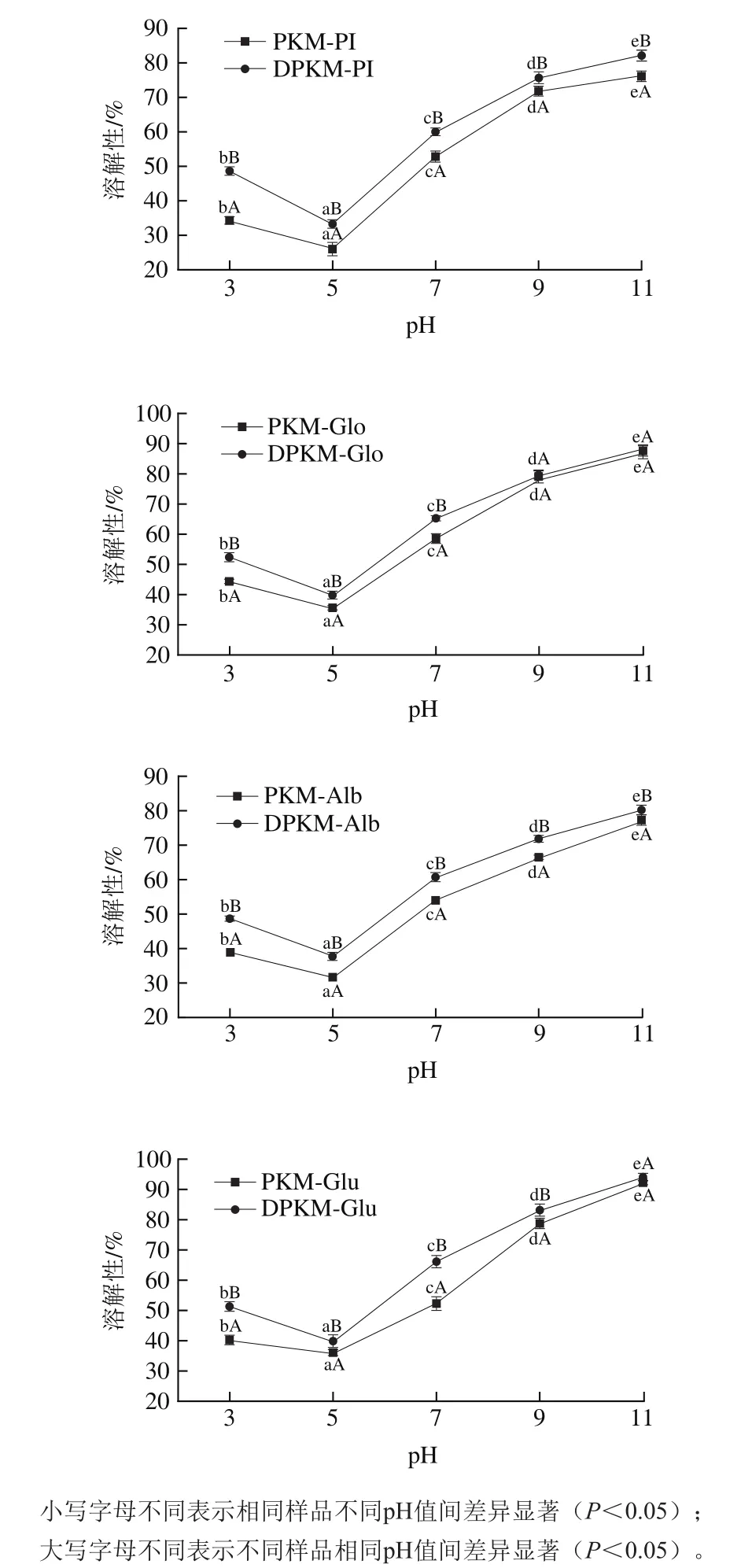
图1 PKM和DPKM各组分蛋白的溶解性Fig. 1 Solubility of protein fractions from PKM and DPKM
如图1所示,PKM和DPKM各组分蛋白的溶解性都呈现出先下降后上升的趋势。可以推断酚类化合物在碱性条件下易被氧化形成共价键和氢键。其中在pH 5.0时溶解性最小,pH 11.0时溶解性最大,这与之前报道过香樟籽PI溶解性的趋势相同。这是因为蛋白质在等电点处不带净电荷,使蛋白质之间不存在排斥力,而这种相互作用不利于蛋白质溶解性。但在碱性环境下可能会增强蛋白质与水的相互作用,从而增加其溶解性。
在相同pH值下,相对于DPKM,PKM各组分蛋白质的溶解性降低。Malik等在研究多酚对葵花籽粕溶解性的影响时也出现相似的结果。Rawel等也报道过类似结论,认为蛋白质与酚类化合物反应伴随着相应亲水基团的封闭和芳香环结构的引入,有利于蛋白质疏水性的提高,进而降低溶解性。
2.5 乳化性和乳化稳定性分析
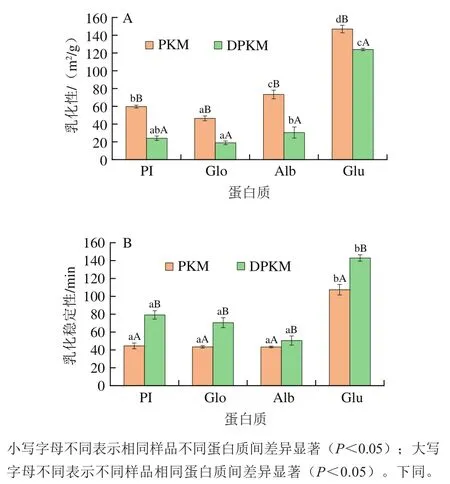
图2 PKM和DPKM各组分蛋白的乳化性(A)和乳化稳定性(B)Fig. 2 Emulsifying capacity (A) and emulsion stability (B) of proteins from of PKM and DPKM
如图2A所示,pH 9.0时PKM各组分蛋白的乳化性显著高于DPKM的各组分蛋白。Yan Shizhang等研究EGCG与大豆分离蛋白相互作用也出现相似结果。可能是酚类化合物与蛋白质的共价复合物提供了更多的羧基,使蛋白质的乳化性得以改善。也可能是因为表面疏水性和溶解性可以相互或单独影响乳化性能,表面疏水性越大越能增强蛋白质在油水界面的吸附能力。PKM各组分蛋白的表面疏水性显著高于DPKM,因此PKM各组分蛋白的乳化性更强。其中PKM和DPKM的乳化性能为Glu>Alb>PI>Glo,Glu的乳化性最强,这可能与蛋白质的提取方法和蛋白质含量有关,碱性环境下提取的Glu可以有效地增大蛋白质的溶解性,使得乳化性增大。
如图2B所示,与PKM相比,DPKM的乳化稳定性普遍增加,说明多酚的存在明显使乳液稳定性降低。Malik等对葵花籽粕和脱酚后葵花籽粕乳化稳定性测定也出现相似结果。可以推断脱除酚类物质后更能增强蛋白质在油-水界面的表面张力,使其形成的乳液粒径更小,从而有效地稳定水/油界面。其中Glu和PI乳化稳定性普遍高于Glo和Alb,而Glu的乳化稳定性依旧最强。
2.6 起泡性和起泡稳定性分析
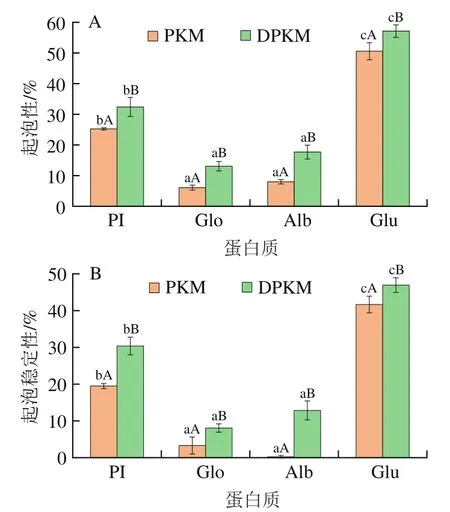
图3 PKM和DPKM各组分蛋白的起泡性(A)和起泡稳定性(B)Fig. 3 Foaming capacity (A) and foam stability (B) of protein components from PKM and DPKM
蛋白质的起泡性是决定其在食品系统中应用的功能特性,在食品加工过程中具有重要作用,而起泡性的存在受到酚类化合物的影响较大。如图3所示,pH 9.0时,DPKM各组分蛋白质的起泡性和起泡稳定性都比PKM高,该结果与Subaşl等研究葵花籽蛋白质以及去除酚类物质后蛋白质的起泡性以及起泡稳定性趋势相同。这可能与蛋白质溶解性和疏水性的影响有关,由于酚类物质的存在,使蛋白质的溶解性下降,从而降低了起泡性和起泡稳定性。
其中PKM和DPKM的起泡性均为Glu>PI>Alb>Glo,PKM的起泡稳定性Glu>PI>Glo>Alb,DPKM的起泡稳定性Glu>PI>Alb>Glo。如图3B所示,可以观察到PKM-Alb的泡沫几乎消失,说明极易展开。而Glu的起泡性和起泡稳定性均最强,该结果与Liu Chengmei等研究的腰果蛋白的起泡性和起泡稳定性趋势相似。可能是由于Glu含有大量的疏水氨基酸,通过更强的蛋白质-蛋白质相互作用,容易在空气-水界面之间形成更强的界面膜。因此,Glu是食品生产中重要的发泡成分,而DPKM更适用于不同食品的发泡剂。
2.7 FTIR分析
如图4所示,得到了PKM和DPKM各组分蛋白在4 000~400 cm的光谱。观察到酰胺I带(1 600~1 700 cm,与C=O键结合)、酰胺II带(1 480~1 580 cm,对应N—H弯曲和C—N伸缩)和酰胺III带(1 220~1 300 cm,对应C—O和C—O—C振动)。而与多酚的相互作用可以通过监测酰胺I带和酰胺II带的光谱位移和强度变化,这与蛋白的二级结构有关。如图4A~D所示,PKM与DPKM各组分蛋白的FTIR谱图相似,表明没有产生新的共价键,Jiang Jiang等在研究绿原酸对乳清蛋白和酪蛋白的作用时也报道了类似的结果。PKM和DPKM各组分蛋白在3 300 cm峰附近的变化主要是多酚与蛋白质形成氢键。如图4E~H所示,PKM和DPKM各组分蛋白在酰胺I带和酰胺II带的位置发生了偏移,可以推断蛋白质通过C=O、C—N和N—H与酚类化合物结合。从图4可知,PKM与DPKM各组分蛋白均具有具有较强的酰胺I带吸收峰,其中PKM的PI、Glo和Alb的波数较小,相比于PKM,DPKM的各组分蛋白分别发生2、4 cm和2 cm的红移。而酰胺I的特征吸收峰与蛋白肽链骨架的有序程度密切相关,有序度越高,则酰胺I吸收峰波数越大,因此PKM的有序度较低。而酰胺带的变化被认为是酚类化合物的广泛影响,证明酚类化合物可以改变蛋白质的二级结构。
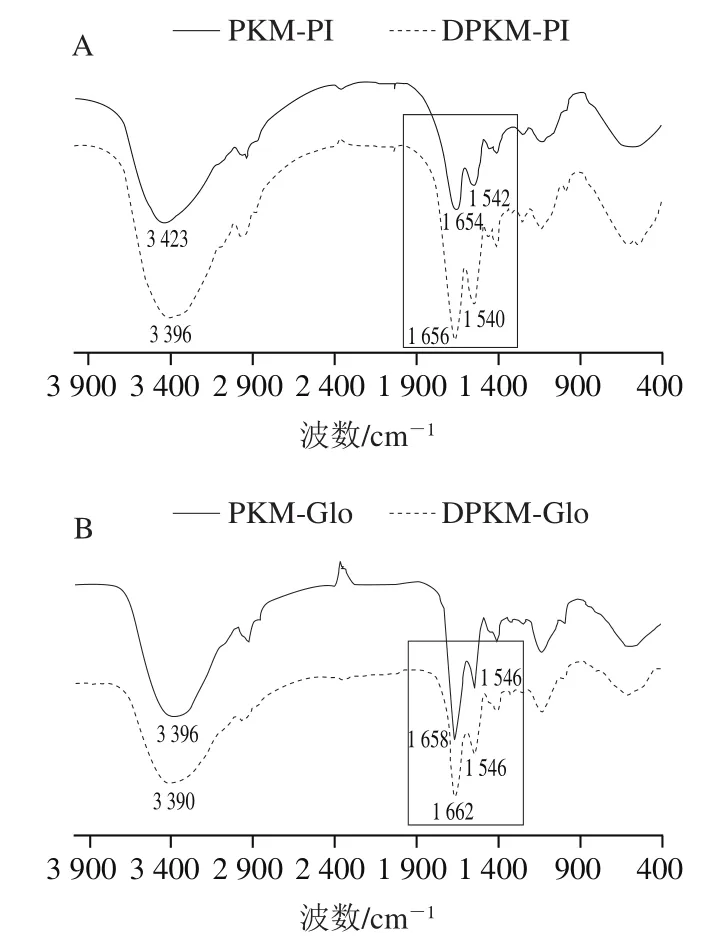
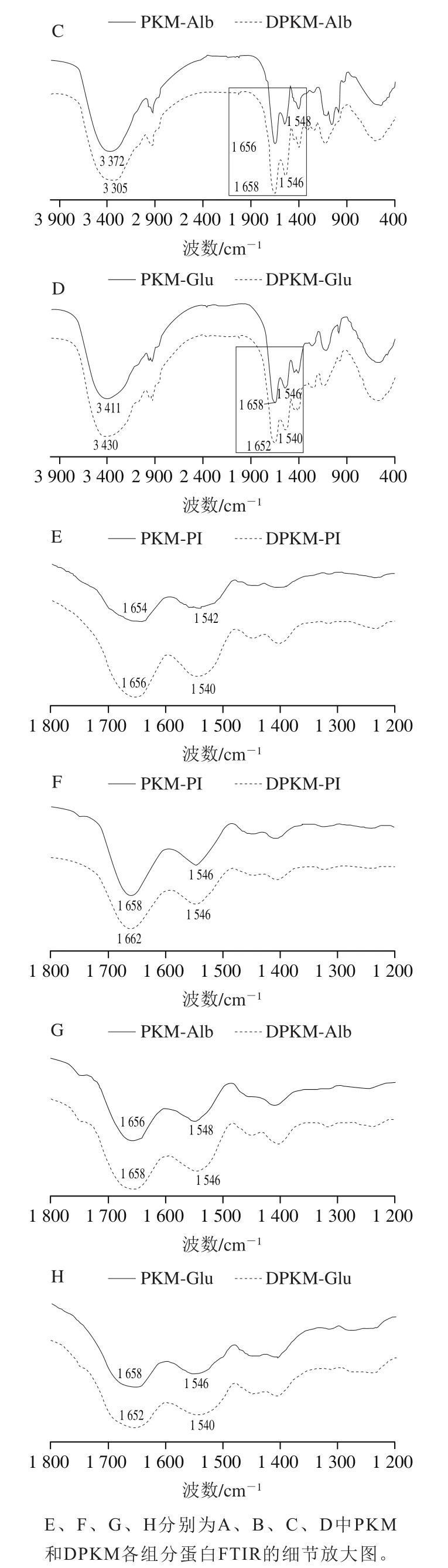
图4 PKM和DPKM各组分蛋白的FTIR光谱图Fig. 4 Fourier transform infrared spectra of protein fractions from PKM and DPKM
PKM和DPKM各组分蛋白质二级结构的定量分析结果见图5。1 615~1 637 cm和1 682~1 700 cm分别为-折叠,1 637~1 648 cm为无规卷曲,1 648~1 664 cm为-螺旋,1 664~1 682 cm为-转角。这些二级结构的形成与氢键相互作用密切相关。如图5所示,PKM与DPKM各组分蛋白的二级结构相对含量略有变化,大约50%的二级结构被-折叠所占据,其次是-螺旋和-转角结构。与DPKM相比,PKM的各组分蛋白的-螺旋、-转角和无规卷曲相对含量增加,-折叠相对含量降低,与Yan Cuijun等研究的核桃蛋白结构相似。据报道,二硫键可以促进蛋白质结构的形成,而这些结构更容易形成-折叠,因此推断酚类化合物可以促使二硫键的断裂,引起-折叠相对含量的减少。这些构象变化可能直接改变蛋白质的柔韧性,并可能对其功能特性产生特殊影响。
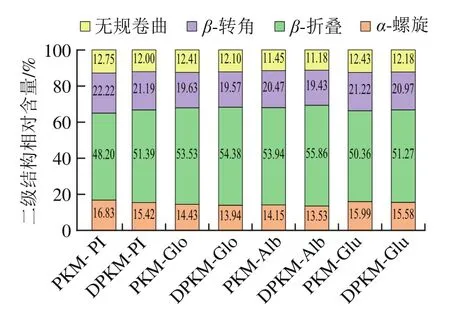
图5 PKM和DPKM各组分蛋白的二级结构相对含量Fig. 5 Secondary structure contents of proteins from PKM and DPKM
2.8 荧光光谱分析
蛋白质的固有荧光对极性微环境较为敏感,已被广泛用于检测蛋白质三级结构的变化。芳香族氨基酸(色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),含有共轭双键的苯环结构可以在特定激发波长下产生固有荧光。由于Tyr极易被猝灭,Phe量子产率过小,研究小分子物质与蛋白质相互作用常用Trp的荧光信息。
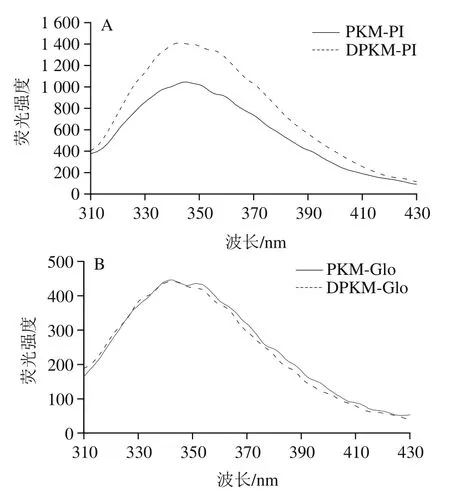
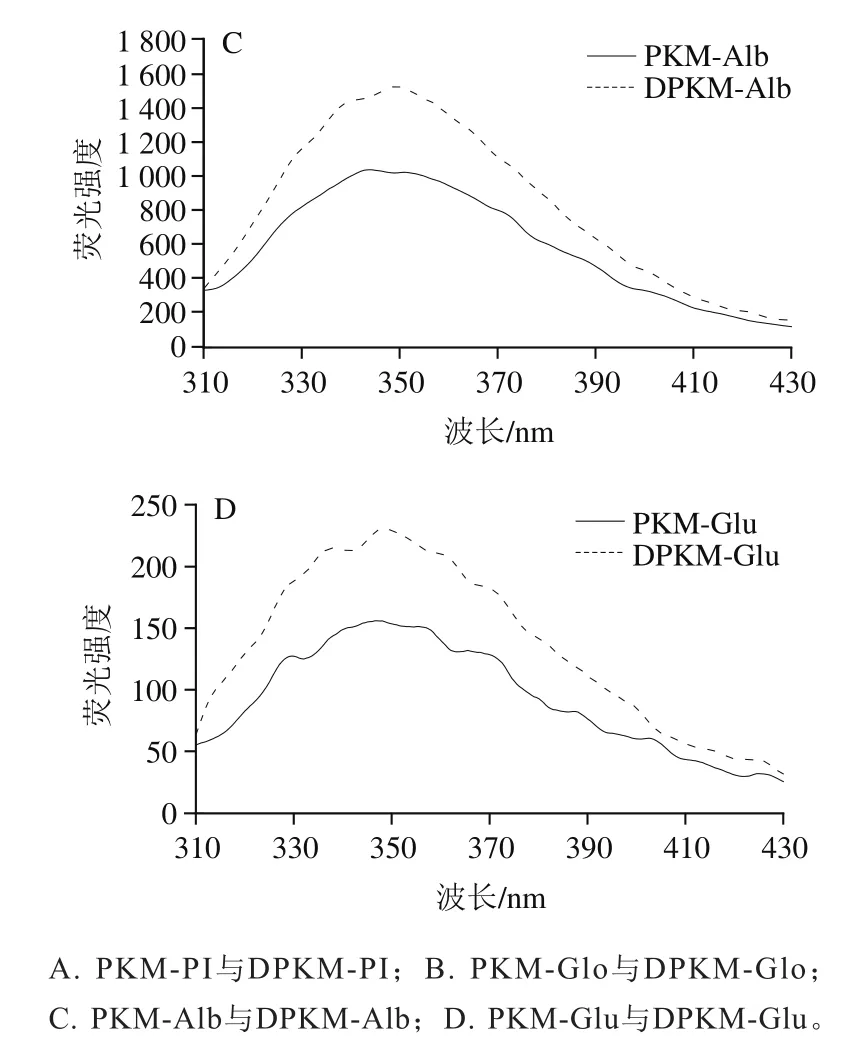
图6 PKM和DPKM各组分蛋白的荧光光谱图Fig. 6 Fluorescence spectra of proteins from PKM and DPKM
如图6所示,是典型的Trp发射光谱,最大荧光吸收峰在348 nm附近,接近于Trp残基(或其氨基化合物)在亲水环境中的特征荧光峰。如图6A、C和D所示,在发射光谱范围为300~400 nm时,相对于DPKM,PKM的蛋白质样品的荧光强度降低。可能是多酚的芳环与芳香族氨基酸(如Trp、Tyr)发生共价作用,诱导蛋白质的三级结构展开,生色团暴露于亲水环境中,导致在此光谱范围内荧光猝灭,进而荧光强度减弱。如图6B所示,与DPKM相比,PKM的最大荧光发射光谱未发生明显变化,表明Glo发色团微环境受酚类化合物的影响不大。PI的荧光强度更接近Alb,说明在松仁PI提取过程中,Alb的结构变化较大,而Alb本身松散的结构更易与多酚发生相互作用,因此,这可能是导致PI结构发生明显变化的重要原因之一。鉴于PKM与DPKM各组分蛋白荧光强弱仍存在差异,可以推断酚类化合物只是影响荧光强度变化的原因之一。
3 结 论
内源多酚对松仁蛋白的结构和性质具有显著影响。脱酚处理有效降低了多酚含量(<0.05)。脱酚后松仁各组分蛋白总巯基含量和游离巯基含量显著升高,但二硫键含量和表面疏水性降低(<0.05)。脱酚后蛋白质的溶解性、乳化稳定性、起泡性和起泡稳定性显著提高(<0.05),而乳化性降低。脱酚改变了松仁各组分蛋白的二级结构和三级结构。多酚脱除有利于将PKM中蛋白质应用到不同领域。
