哀牢山常绿阔叶林常见兼性附生植物的化学计量特征
2022-08-31张婷婷刘文耀
张婷婷,刘文耀,胡 涛
1 中国科学院西双版纳热带植物园热带森林生态学重点实验室,昆明 650223 2 中国科学院大学,北京 100049
附生植物是山地森林生态系统中重要的结构性组分之一,在维系生态系统生物多样性、生态功能及其过程发挥着重要的作用[1—2],兼性附生植物是一类重要而特殊的植物类群,它能同时在树皮、岩石表面和林地土壤中生长,是生长于不同基质上的同一物种的不同生态型[3]。同种植物不同生态型分布方式的差异可能反映了植物对环境变化的特殊适应策略,导致其生态化学计量特征与养分利用策略有所不同[3]。研究生态过程中生物与环境间能量以及多种化学元素交互作用是生态化学计量学的主要研究内容[4]。碳(C)、氮(N)、磷(P)是植物生长发育所需的主要元素,也是生物体有机体的组成基础。C、N和P这3种元素相互作用,共同调节植物的生长发育[4—5],其元素比值可以用来指示植物的养分利用率以及养分限制状况[5—6]。植物叶片的N∶P比通常用来判断植物的养分受限情况,具有较高的N∶P比的植物易受P限制,反之则受N限制[5, 7]。植物叶片中C∶N与C∶P可在一定程度上反映其养分利用效率,当C∶N和C∶P比值较高时,表明植物的养分利用效率较高,反之则较低[6, 8]。生态化学计内稳性表征生物有机体在变化的环境中维持其自身元素组成相对稳定的能力[4, 9],其强弱与生物有机体的生态策略和适应性有关[10]。有关研究表明:植物通过调节不同器官间的化学计量内稳性来适应环境的变化[10]。在内蒙古草原,不同植物叶片和根之间的内稳性呈负相关关系,其中羊草(Leymuschinensis)叶片内稳性指数最大,而其根中内稳性为最弱,灰绿藜(Chenopodiumglaucum)叶片内稳性最弱,根中内稳性最强[10]。Schreeg等认为,灌木植物的新叶内稳性较强,而茎和根等对环境变化更敏感,即其内稳性较弱[11]。Wu等人研究发现,在西双版纳地区不同生境下兰科植物叶片表现出较强的化学计量可塑性,以此来应对生境转变[3]。目前对于森林生态系统中兼性附生植物的化学计量特征,以及它们如何通过调节其化学计量内稳性来应对生境变化的了解甚少。
地处云贵高原、横断山和青藏高原南缘三大地理区域结合部的哀牢山国家级保护区, 是生物多样性较丰富及植物区系地理成分荟萃之地,该保护区内分布着我国目前保存最完整、面积最大的亚热带山地湿性常绿阔叶林,林内附生植物非常丰富[12],其中长叶粗筒苣苔(Briggsialongifolia)是哀牢山山地森林中一种常见的兼性附生植物[13],它分布于树干、树根际部及林地土壤不同基质中,表现出独特的适应能力。但目前关于兼性附生植物这一特殊植物类群生态化学计量特征与养分利用策略鲜有研究报道。长叶粗筒苣苔属于苦苣苔科(Gesneriaceae)物种,该科植物主要分布于亚洲和非洲热带及亚热带地区,我国苦苣苔科植物的生物多样性十分丰富,其中滇黔桂及其邻近地区是我国苦苣苔亚科植物分布和分化的中心,苦苣苔科很多种类是药用植物,一些种类具有较高的园艺观赏价值,有相当一部分为濒危植物[14]。苦苣苔科植物除少数类群适应力比较强外,绝大多数是完全依赖于特殊的优良小生境来维持生存[15],且同种不同居群间存在形态变异[16]。因此,苦苣苔科植物具有很高的研究价值[15, 17]。本研究以哀牢山山地湿性常绿阔叶林中常见的兼性附生植物长叶粗筒苣苔为对象,通过研究其地生植株与林冠不同高度上附生植株不同器官化学计量的差异,分析兼性附生植物化学计量的垂直空间分布特征及其与生长基质的关系,探讨不同生境下兼性附生植物的养分利用与生态适应策略,为深入研究山地森林生态系统生物多样性与养分循环,以及山地森林资源的保护与管理提供科学依据。
1 材料与方法
1.1 研究区概况
哀牢山位于云南省中部,为云岭向南的延伸,是云贵高原和横断山脉的分界线。该地区受到西南季风的影响,具有干、湿季分明的特点。哀牢山国家自然保护区至今分布着我国目前保存最完整、面积最大的亚热带原生山地湿性常绿阔叶林[13, 18]。该研究位于其核心区徐家坝地区(23.35°—24.44°N, 100.54°—101.30°E),根据中国科学院哀牢山生态站长期气象观测结果显示,区年均降水量1947 mm, 年均蒸发量1192 mm, 干季(11月—次年4月)、雨季(5月—10月)分明, 雨季降水量约占全年降水量的85%;年平均相对湿度85%, 年平均气温11.3 ℃,月平均最高气温为15.8 ℃, 月平均最低气温为4.5 ℃[19—20]。
徐家坝地区山地湿性常绿阔叶林分布于海拔 2400—2600 m 间,其群落上层的优势乔木主要包括木果柯(Lithocarpusxylocarpus)、变色锥(Castanopsiswattii)等[18]。该区森林附生植物物种丰富,根据前期的调查结果,附生地衣有183种,附生苔藓植物176种,附生蕨类117种和附生种子植物113种[21]。兼性附生植物是一类重要而特殊的附生植物,其中长叶粗筒苣苔(Briggsialongifolia)是该区森林中常见的兼性附生种子植物[13],它是苦苣苔科粗筒苣苔属多年生无茎草本,多附生于木果柯(L.xylocarpus)、变色锥(C.wattii)等高大的乔木树干及树木根际处,也有部分植株生长在林地土壤中,具有明显的垂直分布特征,是研究同一物种在不同生境下化学计量特征与养分利用策略的理想材料。
1.2 样品采集
已有的研究表明,林冠腐殖质与林地土壤的养分条件差异较大,且林冠层与林地的小气候也存在一定差异[22]。而环境因子的变化,尤其是土壤中养分的变化会引起植物各组织内元素组成的改变[23]。其次,高大乔木的根部,即附生、地生生境交界处的土壤养分等环境因子可能与林地以及林冠生境存在一定差异,因此,为了研究同一物种在不同生境下的化学计量特征与养分利用策略,依据长叶粗筒苣生长及其空间分布特性,我们对林地、宿主乔木的根部、树干等不同生境下的植株进行调查采样。
2018年4月对哀牢山徐家坝地区山地湿性常绿阔叶林内长叶粗筒苣苔的分布进行调查和采样。在生态站通往爱山亭、蟾蜍洼以及马鹿坝的道路旁,因林冠较为开阔,长叶粗筒苣苔能同时生长在乔木树干及根部、以及宿主根部附近林地土壤中。在附生植物研究中,单株树木通常被描述为附生植物的最小生境单元[24]。因此,本研究将林内树干、树干基部以及树根周围林地土壤均生长有长叶粗筒苣苔的单株宿主乔木作为一个样树。本研究在上述区域设置20 m × 2000 m的样带进行样品采集,选择7株胸径>30 cm、附生有长叶粗筒苣苔的优势宿主乔木木果柯、变色锥作为附生植株调查与样品采集的宿主样树,共有7个重复。对每株样树根部周围的地生植株,以及树干基部和1.3 m树高处的附生植株通过整株收获法进行采样,同时也采集3种生境下长叶粗筒苣苔生长基质(林地土壤、树干基部土和树干1.3 m处树皮附着的腐殖质)的样品。将各植株的叶片、根系和生长基质样品分别装入样品袋,带回实验室。而后对所收集的植物样品用自来水和蒸馏水冲洗,装入信封进行烘干处理。
1.3 样品处理及测定
将野外采集的植物及基质样品,置于烘箱内在65 ℃条件下烘干48 h至恒重。烘干后的生长基质放入研钵研磨,过60目筛,装入自封袋;烘干的植物样品用植物粉碎机粉碎至粉末状态,装袋编号以待进一步分析。处理好的生长基质和植物样品C、N含量用碳氮分析仪(Vario MAX CN, Elementar Analysensysteme GmbH, Hanau, Germany)测定;P含量采用电感耦合等离子体原子发射光谱仪进行测定(iCAP6300, Thermo Fisher Scientific, Waltham, USA)。
1.4 数据处理
数据主要通过SPSS 19.0进行统计分析,插图通过SigmaPlot 12.5绘制。数据分析前均进行正态性和方差齐性检验。不同生境下的生长基质以及植物的化学计量组成、不同生境下植物的化学计量内稳性的差异,以及植物不同元素的内稳性差异的比较均采用单因素方差分析法(one-way ANOVA)和最小显著差异法(LSD) (α=0.05)。用成对t检验比较各生境中长叶粗筒苣苔不同器官间化学计量组成以及化学计量内稳性的差异,用双因素方差分析(two-way ANOVA)分析生境、器官以及生境和器官的交互作用对植物化学计量特征的影响。
关于植物化学计量内稳性的强弱,本研究采用Sterner和Elser提出的化学计量内稳性计算模型[4]:y=cx1/H进行计算,其中x为生长基质的元素(N、P)含量以及化学计量比(N∶P),y为植物不同器官的元素(N、P)含量以及化学计量比(N∶P),c为常数,H为内稳性指数。依据所测得的植物和不同生长基质的N、P元素含量及化学计量比,分别计算出各元素及元素比率的内稳性指数。
2 结果与分析
2.1 不同生境下长叶粗筒苣苔生长基质的C、N、P含量及化学计量比
根据测试结果表明,生长基质中C、N、P元素含量在不同生境间的差异不显著,其分布范围分别为292.1—379.73 g/kg、15.16—20.23 g/kg、1—1.17 g/kg,其中附生植株生长基质中的全C、全N和全P含量要高于地生植株生长的林地土壤(图1)。在林地、树干基部及树干1.3 m处3种生境的基质中,C∶N、C∶P和N∶P比值存在一定差异,但其差异均未达到显著水平。不同生境基质的C∶N∶P比也有所不同,其中林地土壤的C∶N∶P比为294∶15∶1,树干基部土及树干1.3 m处树皮腐殖质的C∶N∶P比分别为313∶17∶1和348∶19∶1。
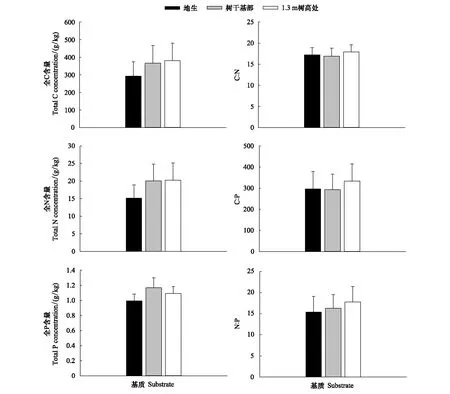
图1 不同生境下长叶粗筒苣苔生长基质C、N、P化学计量特征Fig.1 Stoichiometric characteristics of C, N, and P in substrate of Briggsia longifolia among different habitats
2.2 不同生境下长叶粗筒苣苔叶片和根系的C、N、P含量及化学计量比
双因素方差分析结果表明,生境变化对长叶粗筒苣苔的P含量以及N∶P比值具有显著影响,器官对植物的N含量、C∶N以及N∶P比值具有显著影响,而生境和器官的交互作用对植物的元素含量及化学计量比的影响均不显著(表1)。
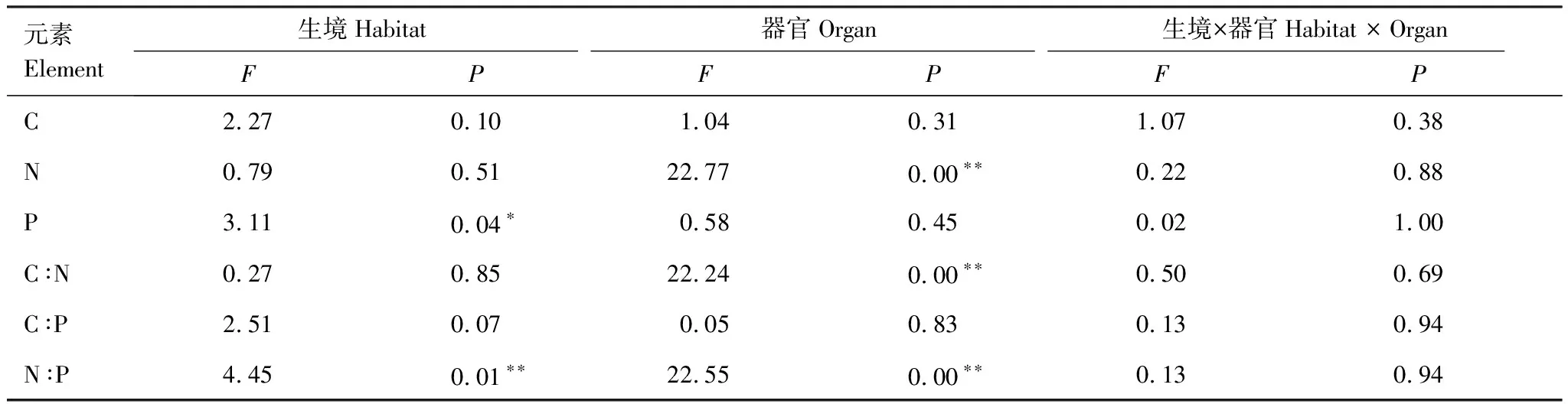
表1 生境、器官以及其交互作用对长叶粗筒苣苔的化学计量特征的影响
长叶粗筒苣苔叶片和根中C、N、P元素含量以及C∶N、C∶P及N∶P比值在不同生境间的差异均未达到显著水平(图2)。不同生境下长叶粗筒苣苔叶片的C、N、P元素含量范围分别为440.86—448.50 g/kg、14.24—14.98 g/kg、1.33—1.83 g/kg,根系中C、N、P元素含量范围分别为427.42—461.50 g/kg、18.04—20.37 g/kg、1.26—1.75 g/kg。地生植株叶片中的C∶N、C∶P及N∶P、根系中的C∶P和N∶P均高于树干基部处和1.3 m树高处的附生植株。地生植株叶片及根系的C∶N∶P比均高于附生植株,其中叶片的C∶N∶P比高于根系。在3种生境下长叶粗筒苣苔叶片的N含量、N∶P比值均显著低于根系 (P<0.05),C∶N则显著高于根系 (P<0.05)。

图2 不同生境下长叶粗筒苣苔叶片和根系的C、N、P化学计量特征Fig.2 Stoichiometric characteristics of C, N, and P in leaf and root of Briggsia longifolia in different habitats “*”和“**”指示同一生境中叶片和根间差异的显著性水平(P<0.05,P<0.01)
2.3 长叶粗筒苣苔叶片和根系的化学计量内稳性特征
长叶粗筒苣苔叶片N含量以及N∶P比值的化学计量内稳性指数均大于根系,但两器官间的内稳性指数的差异未达到显著水平(表2)。长叶粗筒苣苔叶片与根系中化学计量内稳性指数的大小排序均表现为:HN∶P>HN>HP。根据化学计量内稳性强弱的界定范围(H> 4:稳态型;2 表2 长叶粗筒苣苔叶片和根系C、N、P化学计量内稳型模型统计与内稳性指数(H) 本研究结果表明,长叶粗筒苣苔叶片的C、N和P的平均含量分别为445.81 g/kg、15 g/kg和1.59 g/kg,其中C含量低于全球 492 种陆生植物的叶片C平均含量(464 g/kg),也低于本研究区哀牢山森林群落优势乔木幼苗C含量[26],但高于中国草原生态系统213种植物的C平均含量(438 g/kg)[27]。 N含量低于全球陆生植物和中国陆生植物,而P含量则较陆生植物高[28—29],这表明此研究区内长叶粗筒苣苔的生长可能受N元素限制。 植物的叶片N∶P值在一定程度可用来判断其生长环境中的N、P元素的受限状况[5]。有学者认为当植物叶片N∶P<14 时,植物的生长主要受N元素限制;当N∶P>16 时,植物的生长主要受P元素限制;当 14 植物叶片的C∶N和C∶P比值的大小在一定程度上也能反映出其对N、P元素利用效率的高低,较高的叶面C∶N养分比可以增加单位养分的C储量,即较高的C∶N和C∶P比代表植物对N和P的高度利用[6]。如,Pang等认为针叶树的C∶N和C∶P比值较阔叶树高说明针叶树具有较高的N和P养分利用效率[31]。在附生生境中,养分供应有限且不稳定,水分变化剧烈,当附生生境养分充足时,附生植株通过对养分奢侈的吸收,并将多余的养分贮存在组织内,以此应对附生生境中的养分短缺和养分供应波动[24, 32]。而林地土壤养分供应较为充足,土壤含水量变化较为平缓,地生植株养分利用相对保守,受养分和水分胁迫的影响相对较附生植株要小。在本研究中长叶粗筒苣苔的附生植株叶片P含量高于地生植株,较高的P含量有利于缓解干旱胁迫对植物的生长造成的伤害[32—33]。附生植株叶片的C∶N和C∶P比均低于地生植株,表明附生植株对N、P元素利用效率较低。 由于植物不同器官的结构与组成以及功能的不同,植物不同器官的元素含量存在一定差异[34—35]。叶片作为多种生理功能(如光合作用、蒸腾作用和呼吸作用)的行使器官,需要较多的N和P来完成各种生化过程[36]。对3种湿地植物的研究结果表明,根系的N、P含量低于地上部分[36]。青藏高原窄叶鲜卑花地上部分的N、P元素含量高于根系[37]。本研究中,不同生境下长叶粗筒苣苔叶片与根系之间C、N和P元素含量及元素计量比的差异基本一致,双因素方差分析的结果也表明生境和器官的交互作用对植物的化学计量特征的影响不显著,这说明生境变化对植物叶片与根系之间的元素分配的影响较小[38]。长叶粗筒苣苔地生与附生植株叶片的N含量和N∶P均显著低于根系,而C∶N则显著高于根系。叶片中较低的N含量与植物的营养物质在非生长季向地下部分转移有关,而较高的C∶N则可能由其较低的N含量导致,植物中C元素含量较为稳定,C∶N的变化主要受N元素影响[39]。此外,本研究区内长叶粗筒苣苔的生长受P元素限制不明显,叶片和根系中P元素含量的差异不显著,叶片中较低的N含量导致其N∶P显著低于根。 不同功能群通过生理生态过程调整其自身对不同元素的吸收、运输、分配、利用和释放,以不同的生态适应策略来适应其各自的环境[40];而且同种植物的不同器官通过对环境变化的适应而表现出不同的内稳性特征[10]。因此,植物不同功能群及不同器官的化学计量内稳性特征可能存在一定差异。在草原生态系统,优势物种羊草地上部分的N、P以及N∶P的内稳性指数均高于地下部分,其通过内稳性较低的地下部分贮存养分以保证地上部分的养分供给[10]。湿地植物根系的内稳性指数HN与叶片差异不显著,但显著高于茎[41]。哀牢山森林群落优势乔木幼苗叶片和根系的N元素的内稳性指数HN分别为4.71、2.58[30]。在本研究中,长叶粗筒苣苔叶片N元素内稳指数HN为7.25,大于其根系HN(为5. 85),两者均高于同一森林群落内优势乔木幼苗。长叶粗筒苣苔较高的化学计量内稳性指数,且叶片内稳定指数大于根系,表明其对多变的环境适应性更强[42—43],它们主要通过调节根系的元素组成来维持叶片代谢活动的相对稳定,以此来适应生境的转变[10]。 N、P在植物体的生长发育过程中行使不同的功能,导致其含量以及内稳性特征具有一定的差异[5]。生物体内含量较高的元素的内稳性较含量低的元素高,如N的内稳性高于P[44]。内蒙古草原维管植物的N元素的内稳性均高于P元素[45];湿地草本植物N元素的内稳性也较P高[41]。本研究中,长叶粗筒苣苔的N、P元素内稳性指数也表现出类似的规律[41, 44],表明植物对N元素的调控能力较强。根据养分限制性假说,即植物对易受限制的元素的控制能力较强,兼性附生植物对组织内N元素较强的控制能力也说明其生长更易受N元素限制[41]。此外,长叶粗筒苣苔叶片和根系的N∶P的内稳性HN∶P均强于N、P元素,这可能与植物中N、P元素含量具有较强的协同性[46],因而其元素比值的变异性较小[10]有关。 兼性附生植物长叶粗筒苣苔既能生长在树皮上,又能根植于林地土壤中,具有独特的生态适应能力。与地生植株相比,附生植株叶片的N、P含量较高,而C∶N、C∶P和N∶P比值均较低,说明其养分利用率较低;叶片的N、P以及N∶P比的内稳性指数高于根系。长叶粗筒苣苔通过调整其在不同生境间的养分吸收与利用策略,以此来适应生境的变化。因此,探讨兼性附生植物在不同生境下的化学计量特征及其生态适应策略,丰富了植物生态化学计量学研究的理论和方法,也为深入研究森林生态系统生物多样性形成及其维持机制、以及山地森林资源的保护与管理提供了科学依据。 致谢:感谢哀牢山生态站提供的帮助,感谢西双版纳热带植物园昆明分部地球化学实验室在样品元素含量分析中提供的帮助。
3 讨论
3.1 不同生境下兼性附生植物的生态化学计量特征
3.2 兼性附生植物化学计量的内稳性特征
4 结论
