异养硝化-好氧反硝化菌株的分离、鉴定及其氨氮降解过程初探
2022-08-31张泽锟胡青平
张泽锟,闫 勇,郭 静,胡青平
(山西师范大学 生命科学学院,山西 太原 030031)
汾河是黄河的第二大支流,其受煤矿开采和工业排放等的影响,水体污染比较严重,尤其是氨氮(NH4+-N)含量过高,富营养化严重,加上水体自身的自净能力较差,河流的生态环境面临着严重威胁[1-2]。目前,氨氮的去除方法主要包括物理法、化学法和生物(微生物)法等[3-5],其中微生物法应用于污水氨氮去除已成为目前的研究热点[6-7]。但硝化细菌为自养好氧型微生物,反硝化细菌为异养厌氧型微生物,因此,硝化、反硝化过程无法同步进行[8]。近年来,部分学者聚焦研究一种新型的氨氮去除微生物—异养硝化-好氧反硝化菌,如副球菌(Paracoccusdavis)、贪铜菌(Cupriavidus)、芽孢杆菌(Bacillus)、阴沟肠杆菌(Enterobacter cloacae)、假单胞菌(Pseudomonadaceae)等细菌都具有好的异养硝化—好氧反硝化功能[9-12],该类菌解决了传统生物模式下硝化、反硝化过程不能在同一时空内进行的问题,无疑拥有巨大的潜力。
目前研究发现,异养硝化-好氧反硝化菌降解氨氮的途径主要有两种,第一种是NH4+-N氧化为NH2OH后,再经NO3--N、NO2--N两种中间产物,最后经反硝化作用生成N2的主要途径;另一种是NH4+-N氧化为NH2OH后直接经反硝化作用生成N2的候补途径[13]。其中,氨单加氧酶(ammonia monooxygenase,Amo)可以将NH4+-N氧化为NH2OH,这是两种代谢过程的共同途径,在第一种途径中,还有硝酸盐还原酶(nitrate and periplasmic nitrate reductases,Nap)和亚硝酸盐还原酶(nitrite reductase,Nir)在异养硝化-好氧反硝化的过程中发挥着关键作用。Nap可将NO3--N还原为NO2--N,Nir可将NO2--N还原为NO[14-15]。可见,不同的菌种资源会选择不同的氨氮降解途径,且菌种资源开发仍较少,尤其是立足于汾河土著微生物的菌种资源开发更少。
因此,本研究聚焦汾河土著微生物,采用选择性培养基从汾河底泥中分离筛选具有氨氮降解功能的异养硝化-好氧反硝化菌株,对其氨氮的降解过程进行初步研究,以期为土著微生物的菌种资源开发及其在汾河污水氨氮去除中的应用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
底泥样品:取自汾河,取样位置在临汾市尧都区沙桥村汾河坝附近(111°29'24"E,36°4'17"N)。
1.1.2 化学试剂
丁二酸钠、硫酸铵、硝酸钾、三羟甲基氨基甲烷(均为分析纯):国药集团化学试剂有限公司;氯化钠、酒石酸钾钠、氨基磺酸、对氨基苯磺酰胺(均为分析纯):天津市光复精细化工研究所;盐酸、磷酸、体积分数50%戊二醛、无水乙醇(均为分析纯):洛阳市化学试剂厂;烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、亚硝酸钠、纳氏试剂、盐酸萘乙二胺(均为分析纯):上海阿拉丁生化科技股份有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(通用型)、1×TSE101金牌mix、琼脂糖、DNA凝胶回收试剂盒、DL5 000 DNA Marker:北京擎科生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
营养肉汤培养基[16]:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、蒸馏水1 000 mL,pH7.0。营养琼脂培养基中添加琼脂粉18 g。
异养硝化培养基[17]:丁二酸钠4.052 g、硫酸铵0.472 g、维氏溶液50 mL、蒸馏水950 mL,pH7.0。异养硝化固体培养基中添加琼脂粉18 g。
好氧反硝化培养基[17]:硝酸钾0.72 g、磷酸二氢钾1 g、硫酸镁1 g、丁二酸钠2.8 g、蒸馏水1 000 mL、pH7.0。好氧反硝化固体培养基中添加琼脂粉18 g。
以上培养基均在121 ℃条件下高压蒸汽灭菌20 min。
1.2 仪器与设备
YXQ-LS-SⅡ型全自动高压蒸汽灭菌锅:上海博迅实业有限公司;T6新世纪紫外可见光分光光度计:上海菁华科技仪器有限公司;YHZ-98AB数显振荡培养箱:上海一恒科技有限公司;JY92-ⅡDN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;Z36HK高速冷冻离心机:德国贺默公司;JSM-7500F冷场发射扫描电子显微镜:日本株式会社;2720 thermal cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司;JY300C电泳仪、JY04S-3C凝胶成像仪:北京君意东方电泳设备有限公司。
1.3 方法
1.3.1 异养硝化-好氧反硝化菌株的分离及筛选
初筛:取10 g底泥样品加入100 mL无菌水(含有玻璃球)中,在30 ℃、150 r/min条件下培养1 h。取2 mL底泥悬液加入营养肉汤培养基中,30 ℃、150 r/min条件下扩大培养24 h。取2 mL菌悬液加入异养硝化培养基中,30 ℃、150 r/min条件下富集培养24 h,重复3次,然后对菌悬液进行梯度稀释并涂布至好氧反硝化固体培养基上,于30 ℃恒温培养箱中培养至长出单菌落,挑选不同形态的菌株,在好氧反硝化固体培养基上反复划线纯化,将初步分离筛选获得的菌株4 ℃保存。
复筛:将初步分离筛选得到的菌株分别接种至营养肉汤培养基中,30 ℃、150 r/min条件下扩大培养24 h,培养结束后将菌液在5 000 r/min条件下离心10 min,弃上清,用无菌水洗涤重悬,重复3次,将菌液的OD600nm值调至0.8,分别接入异养硝化培养基和好氧反硝化培养基中,30 ℃、150 r/min条件下培养72 h,测定发酵液中NH4+-N和NO3--N的含量,并计算降解率,其计算公式如下:
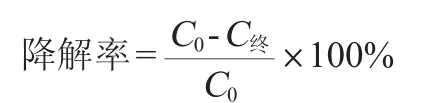
式中:C0为NH4+-N或NO3--N的初始含量,mg/L;C终为发酵后发酵液中NH4+-N或NO3--N的含量,mg/L。
1.3.2 异养硝化-好氧反硝化菌株的鉴定
形态观察:菌株经营养琼脂培养基培养后,参考王永刚等[18]的方法制备扫描电镜样品,使用扫描电镜观察菌株个体形态,并观察菌株群体形态。对菌株进行革兰氏染色,显微镜下观察结果。
生理生化试验:参考《伯杰氏手册》对菌株进行氧化酶、接触酶、糖类利用等生理生化实验[19]。
分子生物学鉴定:使用通用型DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板,采用通用引物对27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rDNA基因序列。PCR扩增产物经0.8%琼脂糖凝胶电泳检测合格后,委托西安擎科生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索对比,选取同源性较高的模式菌株的16S rDNA基因序列,使用MEGA7软件中的邻接(neighbor joining,NJ)法构建系统发育树,确定菌种分类定位。
1.3.3 异养硝化-好氧反硝化菌株生长曲线测定及氨氮降解动态监测
将筛选菌株接种于营养肉汤培养基,30 ℃、150 r/min条件下活化并培养至对数期(12 h)后,5 000 r/min离心10 min,弃上清,用无菌水重悬,重复3次,调节OD600nm值至0.8,以2%(V/V)的接种量接种至100 mL异养硝化培养基中,30 ℃,150 r/min下培养,每2 h取样,采用分光光度计在波长600 nm处测定吸光度值(OD600nm值)[20],同时分别使用纳氏试剂分光光度法、紫外分光光度法、N-(1-萘基)-乙二胺分光光度法测定NH4+-N、NO3--N、NO2--N的含量[21],以发酵液中NH4+-N、NO3--N、NO2--N的含量变化来检测氨氮的降解动态过程。
1.3.4 关键酶基因的PCR扩增
参考杨垒等[22-23]的方法合成Amo、Nap、Nir 3种关键酶基因的PCR扩增引物,Amo基因的引物为amoA-1F(5'-GGGGTTTCTACTGGTGGT-3')/amoA-2R(5'-CCCCTCKGSAAAGCCTTCTTC-3'),Nap基因的引物为Nap-1F(5'-TCTGGACCATGGGCTTCAACCA-3')/Nap-2R(5'-ACGACGACCGGCCAGCGCAG-3'),Nir基因的引物为NirS-1F(5'-CCTAYTGGCCGCCRCART-3')/NirS-6R(5'-CGTTGAACTTRCCGGT-3'),引物委托西安擎科生物科技有限公司合成。以培养至对数期筛选菌株的基因组DNA为模板对3种关键酶的基因进行PCR扩增。PCR扩增体系(50μL):1×TSE101金牌mix 45 μL,上下游引物(10 pmol/L)各2 μL,纯化菌液1 μL。PCR扩增条件:98 ℃预变性2 min;98 ℃变性10 s,56 ℃退火10 s,72 ℃延伸10 s,共35个循环;72 ℃再延伸5 min。采用1%琼脂糖凝胶电泳对PCR扩增产物进行检测。
1.3.5 关键酶活性的测定
将筛选菌株接种于营养肉汤培养基,30 ℃、150 r/min条件下活化并培养至对数期(12 h)后,接种至异养硝化培养基中,30℃、150r/min条件下培养至对数期(12 h),5000r/min条件下离心菌液,用磷酸盐缓冲液(phosphate buffer saline,PBS)重悬菌体,重复3次,取重悬菌液,使用超声波细胞粉碎机破碎菌体后,10 000 r/min、4 ℃条件下离心15 min,取上清液为粗酶液。参考张峰峰等[24-25]的方法测定Amo、Nap、Nir酶活性。
酶活定义[26]:每分钟催化1 μmol反应物所用的酶量定义为一个酶活单位(U),比酶活力定义[26]:每毫克蛋白质所包含的酶活力单位定义为比酶活力(U/mg)。
1.3.6 数据处理
采用SPSS 17.0软件对数据进行统计分析,使用邓肯氏单因素方差分析,采用Excel 2019进行绘图。
2 结果与分析
2.1 异养硝化-好氧反硝化菌株的分离筛选
在底泥样品中共分离筛选得到8株具有氨氮降解功能的异养硝化-好氧反硝化菌株,其对NH4+-N和NO3--N的降解率见图1。由图1可知,8株菌株对NH4+-N均具有较强的降解能力,其中菌株ZH-2对NH4+-N的降解率最高,为83.13%,显著高于其他7株菌(P<0.05)。8株菌株对NO3--N的降解能力均相对较弱,降解率均<20%,其中菌株ZH-2对NO3--N的降解率最高,为17.87%。8株菌株对NH4+-N的降解能力均高于对NO3--N的降解能力,推测可能是由于NH4+-N相较于NO3--N更容易被菌株利用,此外,碳源的用量也是限制菌株降解NO3--N的重要因素[27]。综上,确定菌株ZH-2为优良的具有氨氮降解功能的异养硝化-好氧反硝化菌。
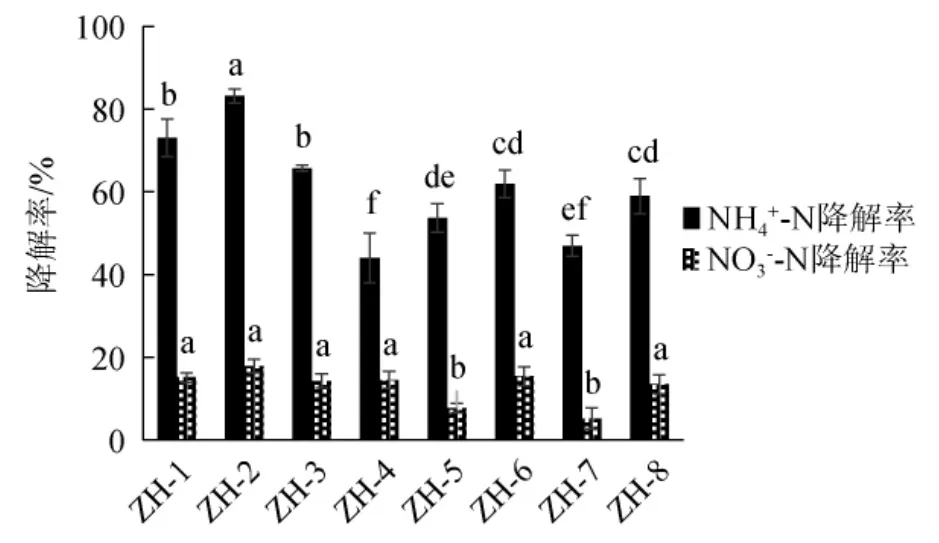
图1 不同菌株对NH4+-N和NO3--N的降解率Fig. 1 Degradation rate of NH4+-N and NO3--N by different strains
2.2 菌株ZH-2的鉴定
2.2.1 形态观察
菌株ZH-2的革兰氏染色结果显示该菌株为革兰氏阴性菌,其个体及群体形态见图2。由图2a可知,菌株ZH-2的个体长度约为0.5 μm×(1.0~1.3)μm,形状为短杆状,无鞭毛。由图2b可知,菌株ZH-2的菌落呈乳白色且不透明,表面光滑,边缘平整。

图2 菌株ZH-2的扫描电镜(a)及菌落形态(b)Fig. 2 Scanning electron microscope (a) and colony morphology (b)of strain ZH-2
2.2.2 生理生化试验
菌株ZH-2的生理生化试验结果见表1。由表1可知,菌株ZH-2的氧化酶试验、吲哚试验、甲基红试验和VP试验结果均为阴性,不能利用柠檬酸盐和明胶,而接触酶试验、淀粉水解试验结果均为阳性,且能利用葡萄糖、乳糖、果糖。结合形态观察,根据《伯杰氏手册》初步鉴定菌株ZH-2为不动杆菌属(Acinetobactersp.)。

表1 菌株ZH-2的生理生化试验结果Table 1 Results of physiological and biochemical tests of strain ZH-2
2.2.3 分子生物学鉴定
基于16S rDNA菌株ZH-2的系统发育树见图3。由图3可知,菌株ZH-2与醋酸钙不动杆菌(Acinetobacter calcoaceticus)KF358257.1聚于一支,亲缘关系最近,同源性达到99%。
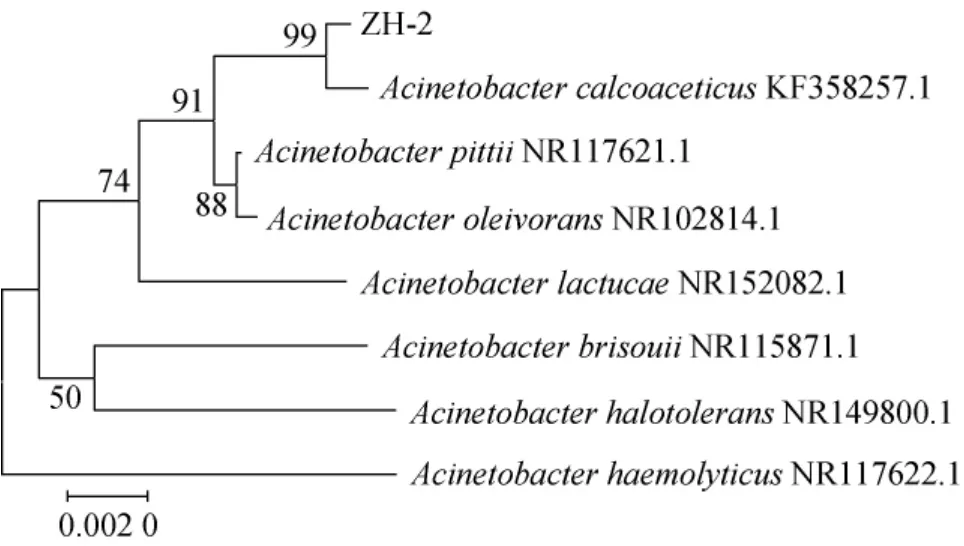
图3 基于16S rDNA基因序列菌株ZH-2的系统发育树Fig. 3 Phylogenetic tree of strain ZH-2 based on 16S rDNA gene sequence
综上所述,结合菌株ZH-2的个体形态、群体形态、生理生化试验结果和16S rDNA基因序列分析结果,最终将菌株ZH-2鉴定为醋酸钙不动杆菌(Acinetobacter calcoaceticus)。
2.3 醋酸钙不动杆菌ZH-2氨氮降解过程初探
2.3.1 醋酸钙不动杆菌ZH-2生长曲线及氨氮降解的动态监测
菌株ZH-2在24 h内的生长曲线及氨氮降解过程见图4。
由图4可知,在整个发酵过程中,NH4+-N含量的变化与菌株ZH-2的生长量变化呈现出明显的负相关关系。发酵0~6 h时,菌株ZH-2的生长处于延滞期,对NH4+-N的降解速率较慢,发酵6 h时,菌株ZH-2对NH4+-N的降解率仅为19.75%;发酵6~16 h时,菌株ZH-2的生长处于对数生长期,同时对NH4+-N的降解速率最快,发酵12 h时对NH4+-N的降解率达到71.14%,发酵16 h时菌株的生长量达到最高1.30;发酵16 h后,菌株ZH-2的生长处于平缓期,NH4+-N的含量也不再降低,最终NH4+-N的降解率达到82.77%。
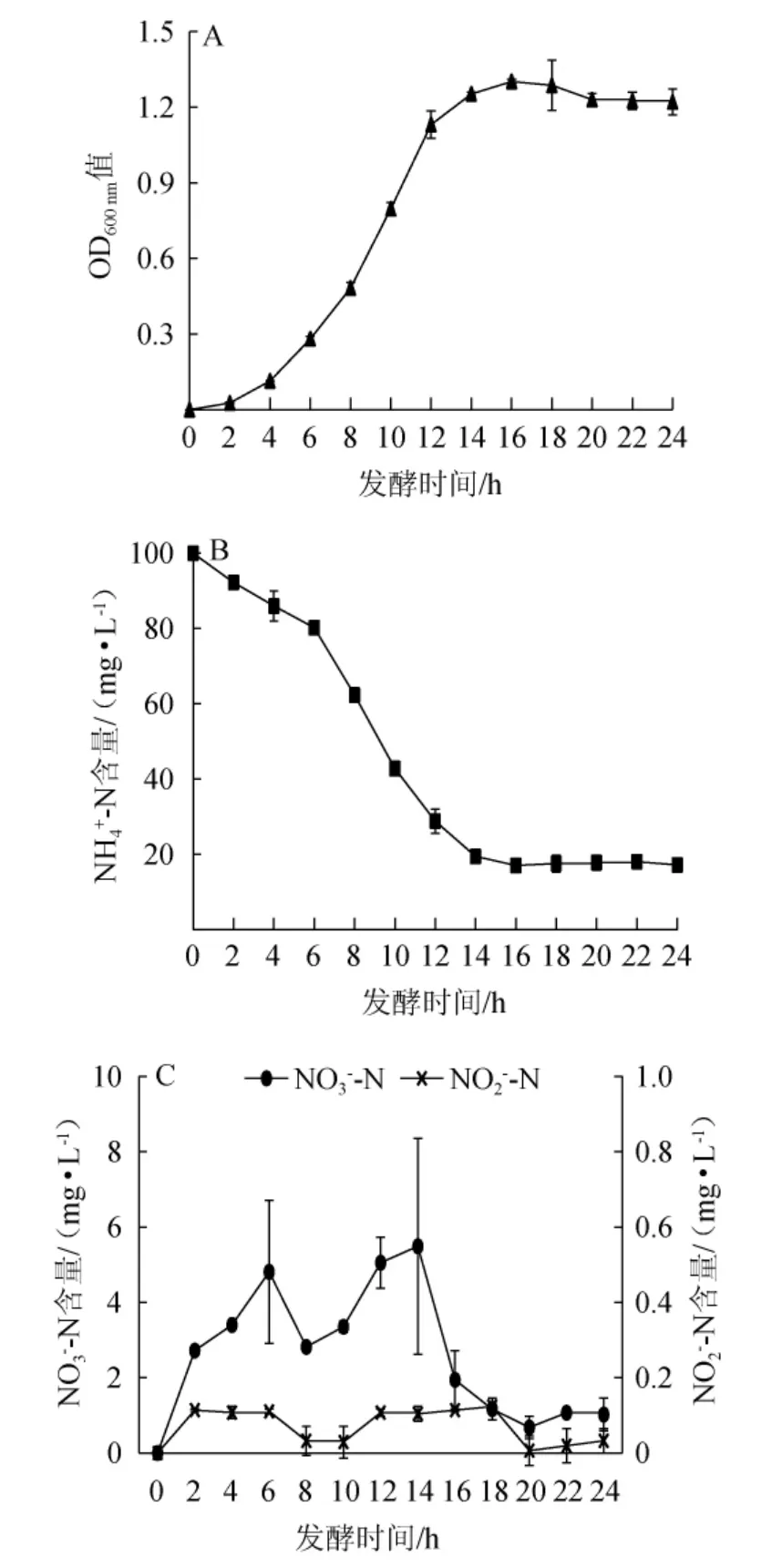
图4 醋酸钙不动杆菌ZH-2的生长曲线(A)及氨氮降解过程(B,C)Fig. 4 Growth curve (A) and ammonia nitrogen degradation process(B,C) of Acinetobacter calcoaceticus ZH-2
由图4亦可知,在A.calcoaceticusZH-2降解NH4+-N过程中监测到了NO3--N和NO2--N两种中间产物的存在。在NH4+-N开始降解后,NO3--N的含量开始上升,在整个NH4+-N降解过程中NO3--N含量基本保持在1.00~5.50 mg/L;同时,NO2--N含量基本保持在0.03~0.11 mg/L。结果表明,A.calcoaceticusZH-2对NH4+-N的降解过程中可能经过了NO3--N和NO2--N两种中间产物。
2.3.2 醋酸钙不动杆菌ZH-2基因组中关键酶基因的检测
A.calcoaceticusZH-2基因组中3种关键酶(Amo、Nap和Nir)基因的PCR扩增结果见图5。由图5可知,三种关键酶Amo、Nap和Nir基因的碱基长度分别为2 000 bp、900 bp、900 bp左右,与预期结果相符,说明PCR扩增成功,结果表明,菌株ZH-2基因组中含有氨氮降解过程中的3种关键酶(Amo、Nap和Nir)基因,与氨氮降解途径中有NO3--N和NO2--N两种中间产物存在的结果相符。
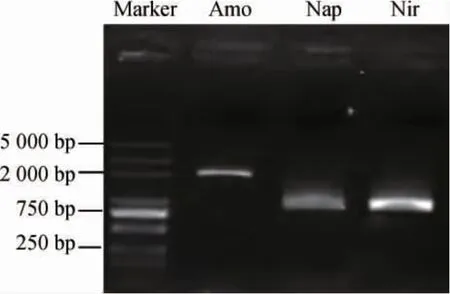
图5 醋酸钙不动杆菌ZH-2基因组中3种关键酶基因PCR扩增产物的琼脂糖凝胶电泳结果Fig. 5 Agarose gel electrophoresis results of PCR amplification products of 3 key enzyme genes in Acinetobacter calcoaceticus ZH-2 genome
2.3.3 醋酸钙不动杆菌ZH-2氨氮降解过程中关键酶活性的检测
3种关键酶Amo、Nap和Nir的酶活见图6。由图6可知,醋酸钙不动杆菌ZH-2降解氨氮过程中检测到3种关键酶,其中,Amo的比酶活最高达45.69 mU/mg,显著高于Nap(3.54 mU/mg)与Nir(6.91 mU/mg)(P<0.05),魏冉[28]研究发现,在氨氮降解过程中,Amo作用的过程是降解过程的关键步骤,其首先将NH4+-N降解为NH2OH。本实验结果表明,Amo在氨氮降解过程中发挥重要作用,其在对数生长期(12 h)的比酶活较高,这与图4A中的结果一致,此时培养基中的NH4+-N被快速降解,降解率达到71.14%。
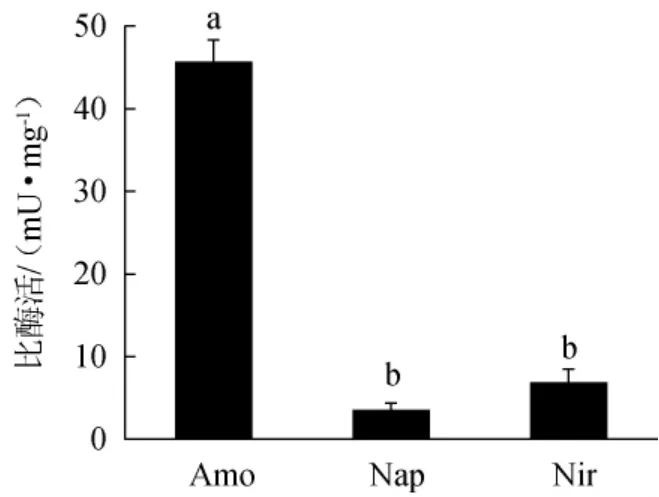
图6 醋酸钙不动杆菌ZH-2氨氮降解过程中3种关键酶酶活的测定结果Fig. 6 Determination results of 3 key enzymes activity during ammonia nitrogen degradation of Acinetobacter cinetobacter ZH-2
综上,A.calcoaceticusZH-2的Amo基因被成功扩增,且具有较高的酶活,充分说明菌株ZH-2的氨氮降解过程中存在着由Amo催化的NH4+-N→NH2OH的通用途径。Nap与Nir基因被成功扩增且具有一定的酶活,并在NH4+-N降解过程中监测到了中间产物NO3--N和NO2--N,说明A.calcoaceticusZH-2降解氨氮过程中存在着由Nap催化的NO3--N→NO2--N与Nir催化的NO2--N→NO过程。因此,初步判定菌株ZH-2对氨氮的降解是先经NO3--N和NO2--N等中间产物的硝化作用,再经反硝化作用生成N2的经典降解途径。
3 结论
本研究从汾河底泥中筛选获得一株具有氨氮降解功能的异养硝化-好氧反硝化菌株ZH-2,其对NH4+-N和NO3--N的降解率分别达到83.13%和17.87%;通过形态观察、生理生化试验和16S rDNA基因序列分析,鉴定该菌为醋酸钙不动杆菌(Acinetobacter calcoaceticus);通过对菌株ZH-2降解氨氮过程中中间产物的动态监测、关键酶基因的扩增和酶活的测定,初步判定A.calcoaceticusZH-2降解氨氮的途径可能为NH4+-N→NH2OH→NO2--N→NO3--N→NO2--N→NO→N2O→N2的经典降解途径。本研究可为A.calcoaceticusZH-2菌在汾河水的氨氮治理中奠定良好的理论基础。
