清香型小曲白酒酒醅中乳酸菌的筛选鉴定及其发酵特性研究
2022-08-31王路瑶张宗杰朱丽萍陈申习
江 威,王路瑶,张宗杰,林 斌,唐 洁,李 群,朱丽萍,杨 强,陈申习
(1.劲牌有限公司 劲牌研究院 中药保健食品质量与安全湖北省重点实验室,湖北 大冶 435100;2.湖北师范大学 生命科学学院,湖北 黄石 435000)
乳酸菌作为发酵中常见的微生物,可以产生多种代谢产物,如有机酸类和酶类(葡萄糖苷酶、酯酶和蛋白酶等),在酶类作用下,有机酸与醇类进一步生成酯类物质[1]。除乳酸外,植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)、戊糖片球菌(Pediococcus pentosaceus)和副干酪乳杆菌(Lactobacillus paracasei)可产乙酸;植物乳杆菌、布氏乳杆菌(Lactobacillus buchneri)和类布氏乳杆菌(Lactobacillus parabuchneri)可产丁酸[2]。乳酸在掩盖酒精的刺激性的同时还能使酒体协调柔和,乙酸则具有爽口微甜的特征,适量乙酸可提升白酒口感[3-4]。此外,乳酸菌还可产生一定的醇类、醛类、酮类、吡嗪类、芳香族类和烷烃类化合物等白酒呈香、呈味物质[5-7]。
吕锡斌等[8]研究发现,乳酸菌作为优势细菌贯穿了酱香型白酒下沙、造沙堆积发酵、窖内发酵过程。堆积发酵过程中,类肠膜魏斯氏菌(Weissella paramesenteroides)、乳酸片球菌(Pediococcus acidilactici)和面包乳杆菌(Lacto bacillus panis)占比高达80%以上。窖内发酵结束,面包乳杆菌、乳杆菌属和耐酸乳杆菌(Lactobacillus acetotolerans)占比达到90%。王晖等[5]从白酒窖泥中分离到短乳杆菌、鼠李糖乳杆菌(Lactobacillus rhamnosus)、干酪乳杆菌(Lactobacillus casei)和铅黄肠球菌(Enterococcus casseliflavus)。熊亚等[9]利用微生物菌群多样性分析技术聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE),发现乳杆菌属和耐酸乳杆菌属为浓香型白酒窖泥中的优势种群。乔宗伟[10]研究发现,耐酸乳杆菌是糟醅发酵过程中的优势细菌。张松等[11]从浓酱兼香型不同轮次的酒醅中分离到布氏乳杆菌、植物乳杆菌、粪肠球菌(Enterococcus faecalis)、乳酸片球菌和戊糖片球菌。乳酸菌也是米香型小曲白酒中主要的细菌,主要有食窦魏斯氏菌(Weissella cibaria)、巴黎链球菌(Streptococcus lutetiensis)和卡氏肠球菌(Enterococcus casseliflavus)[12]。乳酸菌在清香型白酒发酵过程中也发挥着重要作用,是发酵后期的优势菌株。刘雪婷等[13]从酒醅中分离得到乳酸片球菌、副干酪乳杆菌、短乳杆菌、希氏乳杆菌(Lactobacillus hilgardii)和粪肠球菌。陈申习等[14]从清香型小曲酒机械化酿造车间发酵过程中的酒醅中分离鉴定到干酪乳杆菌、短乳杆菌、希式乳杆菌和瑞士乳杆菌(Lactobacillus helveticus)。李锐等[15]从清香型小曲酒醅中分离到植物乳杆菌、副干酪乳杆菌、短乳杆菌、戊糖片球菌、发酵乳杆菌(Lactobacillus fermentum)、布氏乳杆菌和类布氏乳杆菌共7种乳杆菌。PANG X N等[16]研究发现,耐酸乳杆菌能够促进乙酸乙酯、乳酸乙酯、乙醇、乙酸和2,4-二叔丁基苯酚的形成,感官分析显示用希氏乳杆菌和耐酸乳杆菌发酵的样品更和谐,植物乳杆菌发酵的样品具有更高的酯香味。除此之外,乳酸菌在酿造过程中还具有抑制腐败微生物和杂菌的生长;维持酿酒环境的偏酸性,促进酿酒酶系的糖化与发酵能力等作用[17-19]。
白酒中乳酸菌资源丰富,目前,在白酒中强化乳酸菌研究十分有限,细菌强化进行发酵在黄酒和白醋应用较多,刘彩霞等[20]利用强化乳酸菌有效降低了黄酒浸米过程中的生物胺含量;钱桢文等[21]强化乳酸菌酿造高酸黄酒用于调节黄酒酸度,提高黄酒产品品质和安全水平;洪家丽等[22]研究发现,乳酸菌均能促进黄酒酿造过程中酵母的生长,且都能显著提高黄酒中有机酸含量;邓永建等[23]研究发现,乳酸菌发酵可以改变麸皮浸出液中的有机酸组成;添加乳酸菌发酵的麸皮浸出液能够增加液态发酵米醋中乳酸的质量浓度,强化乳酸菌能增加米醋的挥发性风味物质种类和含量,提升产品风味品质。因此,在清香型小曲白酒中强化乳酸菌,将有可能提高产品中风味物质的含量,进而提升白酒质量。本研究从不同季节的清香型小曲白酒酒醅中分离鉴定乳酸菌,研究不同季节酒醅中乳酸菌种类和数量的差异,筛选可用于提升乙酸乙酯、乳酸乙酯、降低杂醇油和正丙醇的乳酸菌,以期在今后可强化制曲用于车间生产,进一步提升清香型小曲白酒的品质。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
夏季酒醅(8月,发酵周期14 d)、秋季酒醅(11月,发酵周期21 d)、冬季酒醅(1月,发酵周期16 d)和春季酒醅(4月,发酵周期14 d):劲牌有限公司枫林酒厂酿造一车间;桂花曲:劲牌有限公司枫林制曲车间配制。
1.1.2 试剂
土壤基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)提取试剂盒:天根生化科技有限公司;PremixTaq:宝日医生物技术(北京)有限公司;正丙醇、乙酸乙酯等标准品(色谱纯):中国医药集团有限公司;β-淀粉酶(50 000 U/g)、糖化酶(100 000 U/g):无锡雪梅酶制剂科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
MRS培养基、孟加拉红培养基:海博生物技术有限公司。
高粱汁培养基:高粱粉碎后按照高粱和水质量比为1∶4的比例混匀,添加β-淀粉酶和糖化酶各10 g,60 ℃恒温糖化24 h,过滤后调整糖度为8°Bx。115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
AL204电子分析天平:梅特勒-托利多仪器(上海)有限公司;MBT11-10气体采集袋:大连海德科技有限公司;QYC-200全温空气摇床:上海福玛实验设备有限公司;YXQLS-75S蒸汽灭菌锅、SPX-100B-Z生化培养箱:上海博讯实业有限公司;Agilent 7890A型气相色谱(gas chromatography,GC)仪:美国安捷伦公司;YQX-Ⅱ型厌氧培养箱:上海皓庄仪器有限公司;HWS-250 J恒温恒湿培养箱:上海精宏实验设备有限公司;Biometra Tone 96G聚合酶链式反应(polymerase chain reaction,PCR)仪:德国耶拿公司。
1.3 方法
1.3.1 乳酸菌计数
分别对夏季、秋季、冬季和春季酒醅进行取样。每个季节跟踪相同发酵批次3个发酵槽车,取发酵0 d、1 d、2 d、3 d、4 d、5 d、7 d、9 d、11 d、14 d的酒醅各2份。在无菌条件下,取10 g发酵酒醅于装有90 mL无菌生理盐水中,30 ℃、150 r/min条件下培养30 min后取出进行梯度稀释,取200 μL适宜梯度稀释液置于空平板内,倾注MRS固体培养基,凝固后于37 ℃厌氧培养1~2 d至单菌落长出,采用菌落记号方式对单菌落进行计数[24]。
1.3.2 乳酸菌的分离及形态观察
将单菌落挑取划线至MRS固体培养基平板,37 ℃培养1~2 d后待单菌落长出,观察菌落形态[25-26]。
1.3.3 分子生物学鉴定
按照土壤基因组DNA提取试剂盒说明书提取乳酸菌的基因组DNA,以其为模板,采用细菌16S rRNA通用引物27F和1492R进行PCR扩增[27],PCR扩增体系:PremixTaq15 μL,引物27F和引物1492R各0.5 μL,双蒸水(ddH2O)12 μL,DNA模板2 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火50 s,72 ℃延伸50 s,35个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,将检测合格的PCR扩增产物送到武汉华大基因公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)网站的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析[28],选取同源性较高的模式菌株的16S rRNA基因序列,使用MEGA 6.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 乳酸菌代谢产物分析
将分离纯化后的乳酸菌单菌落分别接入含10 mL MRS液体培养基的试管中,37 ℃、150 r/min培养16 h,制成乳酸菌种子液。将种子液按3%的接种量接种于糖度为8°Bx的高粱汁培养基中,37 ℃培养7 d,发酵液在4 ℃、8 000 r/min条件下离心10 min,采用针头式滤器过滤后,采用气相色谱检测代谢物质(乳酸、乙酸、丙酸、乙酸乙酯、乳酸乙酯)的含量[29]。
1.3.5 乳酸菌清香型白酒固态发酵小试
模拟清香型白酒发酵工艺[30],称取280 g糯高粱于65 ℃热水中浸泡过夜,次日115 ℃蒸粮10 min后于开水中闷粮5 min,再111 ℃复蒸10 min。称取熟粮1 kg,摊晾至30 ℃左右,对照组加入5.0 g桂花曲,实验组加入等量桂花曲后再加入10 mL乳酸菌种子液,拌匀后于30 ℃糖化24 h。糖化完成后每500 g与灭菌后的500 g酒糟进行混合,放入密封袋,30 ℃发酵7 d后进行蒸酒,小火慢蒸,取前100 mL酒样,测定出酒率[31],同时采用气相色谱检测乙酸乙酯、乳酸乙酯、杂醇油、正丙醇含量[29],并计算增减幅度,具体计算公式为:

1.3.6 乳酸菌麸皮种最佳添加比例、添加时间及固态发酵小试周期探究
实际生产中麸皮种相比液体种更加方便使用,因此,制备乳酸菌麸皮种,并应用于固态发酵小试。乳酸菌麸皮种的制作:50 g麸皮灭菌,加入15 mL乳酸菌种子液,37 ℃培养24 h后于30 ℃烘干,检测其中乳酸菌数量达到1×108CFU/g,备用。泡粮及糖化步骤同1.3.5,对照组仅加入5.0 g桂花曲,实验组在添加5.0 g桂花曲的基础上添加一定比例的麸皮种,糖化完成后置于恒温培养箱中30 ℃发酵7 d,发酵完毕后取出酒醅蒸酒,并检测各项指标。
(1)乳酸菌麸皮种添加比例优化
实验组在添加5.0 g桂花曲的基础上,再分别添加桂花曲质量的5%、10%、20%、30%、40%的麸皮种。
(2)乳酸菌麸皮种不同添加时间及不同发酵周期探究
实验组1中乳酸菌在糖化前添加,即糖化时加入5.0 g桂花曲以及1.0 g 乳酸菌麸皮种,发酵7 d;实验组2中桂花曲糖化完成后加入1.0 g乳酸菌麸皮种,发酵7 d。以菌株X29为例,取入池时(第0天)、发酵第2、4、7天的酒醅样品,适当稀释后涂布于孟加拉红培养基,进行酵母计数,倾注MRS固体培养基进行乳酸菌计数。延长发酵组为在实验组1的基础上,发酵12 d后再进行蒸酒,检测各项指标。
2 结果与分析
2.1 不同季节酒醅中乳酸菌数量的变化趋势
为了解不同季节不同发酵时间点样品中乳酸菌含量的变化,为后期取样及菌株应用提供指导,对不同节点取样样品中的乳酸菌进行计数,结果见图1。由图1可知,四个季节酒醅中的乳酸菌数量在发酵过程中生长趋势较为一致,均呈现先增加后下降的趋势,其中夏季酒醅中的乳酸菌数量在发酵后期高于其他三季。夏季酒醅中的乳酸菌数量在发酵10 d左右达到峰值,秋季酒醅中的乳酸菌数量在发酵18 d左右达到峰值,冬季和春季酒醅中的乳酸菌数量在发酵5 d左右达到峰值。从乳酸菌数量的峰值看,夏季>秋季>春季>冬季,说明乳酸菌数量和生长趋势与所处季节(温度)有较大的关系,数量表现为夏季及秋季乳酸菌数量高于冬季和春季的数量。
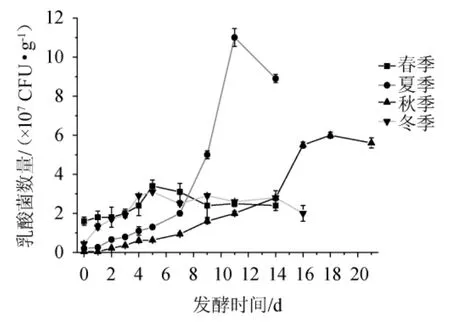
图1 不同季节酒醅中乳酸菌数量的变化趋势Fig. 1 Change trends of lactic acid bacteria number of fermented grains in different seasons
2.2 各季节酒醅中乳酸菌菌株的分离及鉴定
通过单菌落培养从各季节酒醅中共分离得到225株乳酸菌,通过形态观察初步分为15种,15种乳酸菌的典型代表菌株的菌落形态见图2,系统发育树见图3,具体分离及鉴定结果见表1。

图2 15种乳酸菌代表菌株的菌落形态Fig. 2 Colony morphologies of 15 representative lactic acid bacteria strains
由图2、图3及表1可知,分离得到的乳酸菌菌株归属于3个属的15个种,分别为植物乳杆菌(Lactobacillus plantarum)、发酵乳杆菌(Lactobacillus fermentum)、类布氏乳杆菌(Lactobacillus parabuchneri)、短乳杆菌(Lactobacillus brevis)、纳格里乳杆菌(Lactobacillus nagelii)、马里乳杆菌(Lactobacillus mali)、类干酪乳酪杆菌(Lacticaseibacillus paracasei)、肠膜明串珠菌(Leuconostoc mesenteroides)、希氏乳杆菌(Lactobacillus hilgardii)、布氏乳杆菌(Lactobacil lus buchneri)、融合魏斯氏菌(Weissella confusa)、斯比氏乳杆菌(Lactobacillus spicheri)、戊糖片球菌(Pediococcus pentosaceus)、干酪乳杆菌(Lactobacillus casei)、美洲虎乳杆菌(Lactobacillus pantheris),其中夏、秋、冬三季酒醅中分离得到的乳酸菌种类略多于春季,各季节酒醅中植物乳杆菌占绝大多数,其他以短乳杆菌和发酵乳杆菌居多。
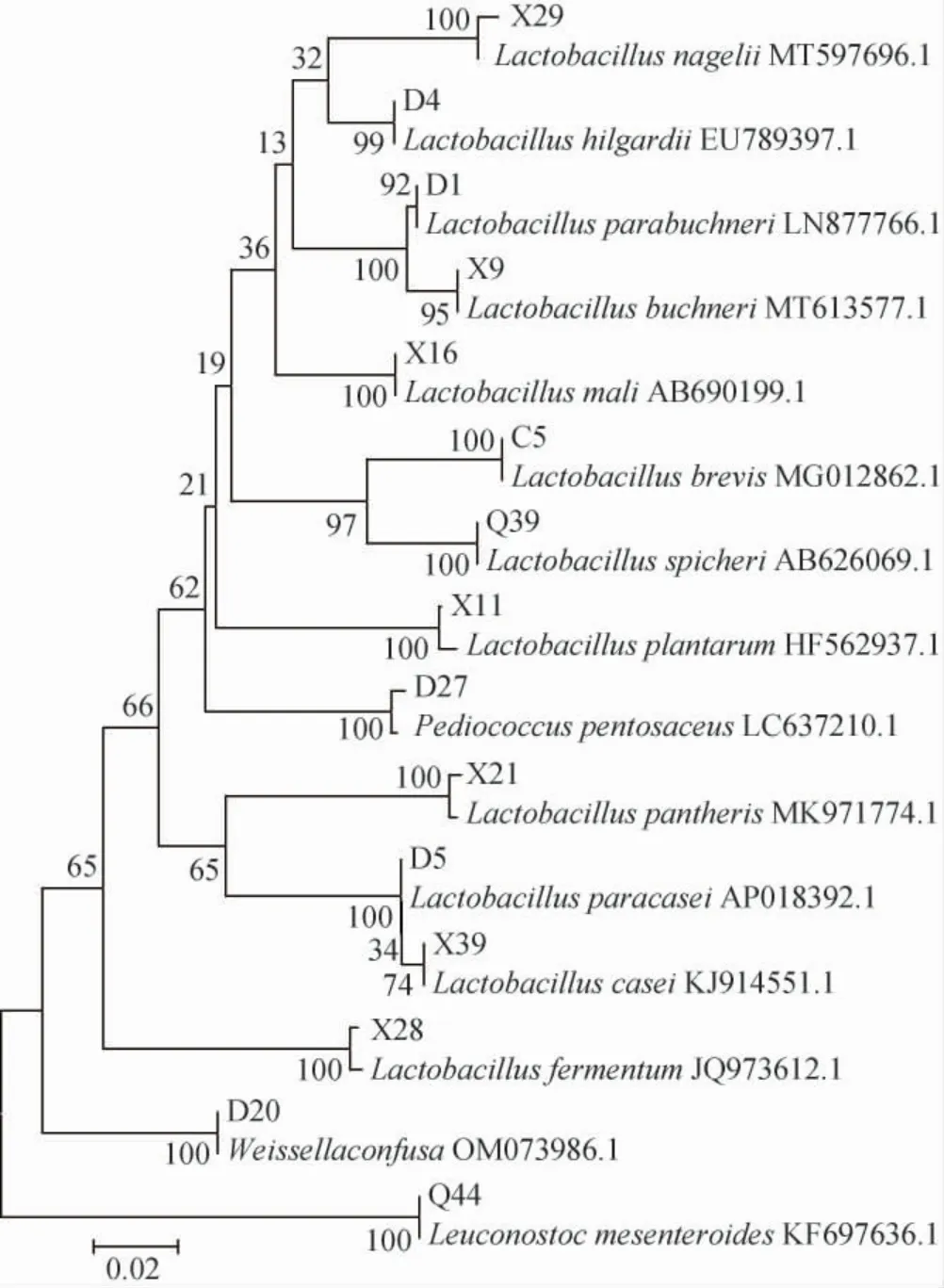
图3 基于16S rRNA基因序列15种乳酸菌代表菌株的系统发育树Fig. 3 Phylogenetic tree of representative lactic acid bacteria strains based on 16S rRNA gene sequences

表1 不同季节酒醅中乳酸菌菌株的分离及鉴定结果Table 1 Isolation and identification results of lactic acid bacteria strains of fermented grains in different seasons

续表
2.3 乳酸菌主要代谢产物的分析
乳酸菌作为代谢酸类物质的重要微生物,广泛存在于白酒酿造中,是发酵过程中的优势微生物[8-15]。接种225株分离得到的乳酸菌菌株于高粱汁培养基中,分析主要代谢产物(乳酸、乙酸、丙酸、乙酸乙酯、乳酸乙酯)的含量,结果见图4。
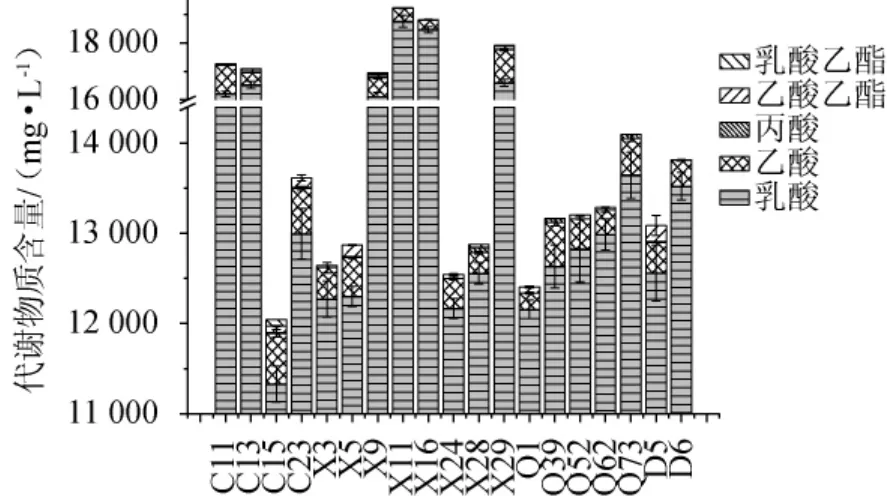
图4 19株不同乳酸菌主要代谢产物含量分析结果Fig. 4 Analysis results of main metabolites content of 19 strains of different lactic acid bacteria
由图4可知,植物乳杆菌X11、马里乳杆菌X16、纳格里乳杆菌X29、副干酪乳杆菌C11和植物乳杆菌C13产乳酸含量较高,达15 000 mg/L以上。菌株C11和X29产乙酸含量较高,达1 000 mg/L以上。部分菌株检测到代谢产物丙酸,含量较少,均<50 mg/L。有部分菌株检测到少量的乙酸乙酯和乳酸乙酯,其中副干酪乳杆菌D5、肠膜明串珠菌X5、植物乳杆菌C23和X29代谢乙酸乙酯相对较多,植物乳杆菌C13和C15则代谢产生较多的乳酸乙酯。
根据国标GB/T 10781.2—2006《清香型白酒标准》及实际生产经验,乙酸乙酯、乳酸乙酯、杂醇油、正丙醇对清香型白酒酒质影响较大,乙酸乙酯和乳酸乙酯是主要的风味物质成分,尤其乙酸乙酯的含量影响白酒的分级[32]。根据代谢产物结果,为进一步筛选可应用于清香型白酒中的乳酸菌,选取菌株C11、C13、C23、X9、X11、X16、X29、Q39、Q52、Q62、Q73、D5、D6共13株乳酸菌进行清香型白酒固态发酵小试,探究其对发酵质量的影响。
2.4 乳酸菌清香型白酒固态发酵小试结果
杂醇油含量过高容易导致酒后“上头”,其中正丙醇含量过高还能导致酒体辛辣,出酒率则是反应发酵转化是否完全的重要指标[33]。因此,发酵后的原酒主要关注乙酸乙酯、乳酸乙酯、杂醇油、正丙醇、出酒率5项指标,来分析乳酸菌的强化对酒质的影响。乳酸菌添加对清香型白酒固态发酵小试酒样质量的影响见图5。
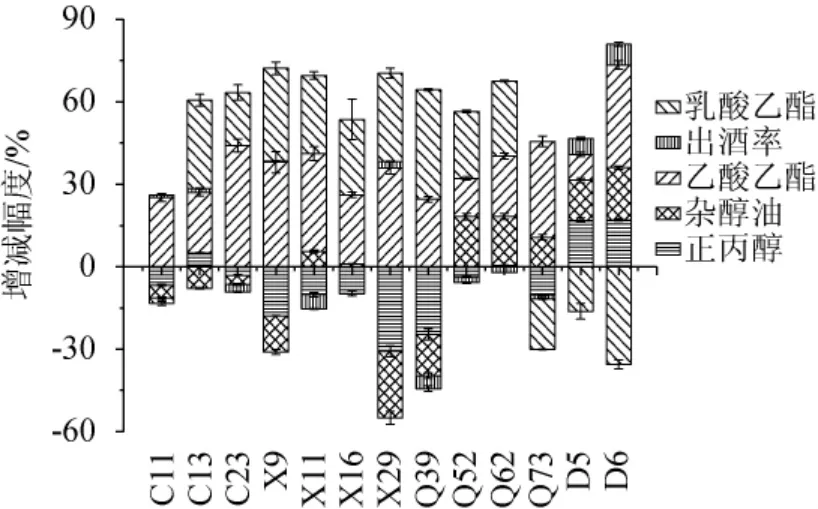
图5 不同乳酸菌添加对清香型白酒发酵主要指标的影响Fig. 5 Effect of different addition of lactic acid bacteria on main indexes of light-flavor Baijiu fermentation
由图5可知,所有乳酸菌的加入,都对乙酸乙酯的提升有一定的作用,部分乳酸菌的加入可在一定程度上提高乳酸乙酯含量,降低杂醇油以及正丙醇含量。此外,研究发现乳酸菌的加入对出酒率没有较大负面影响。其中,菌株X29和X9的加入对乙酸乙酯、乳酸乙酯的提升幅度较大,对杂醇油和正丙醇的降低幅度较大,乙酸乙酯含量分别提升36.00%和38.03%,乳酸乙酯含量分别提升33.62%和32.14%,杂醇油含量分别降低24.23%和13.22%,正丙醇含量分别降低30.77%和17.84%。综上,选择布氏乳杆菌X9和纳格里乳杆菌X29进行后续验证实验。
2.5 乳酸菌麸皮种在清香型白酒固态发酵应用中的研究
2.5.1 乳酸菌麸皮种不同添加比例的探究
为探究筛选乳酸菌应用于白酒酿造在酒曲中的最佳添加比例,以期为后续更大规模应用提供参考,考察乳酸菌X9和X29麸皮种不同添加比例对固态发酵小试酒样主要指标的影响,结果见图6。
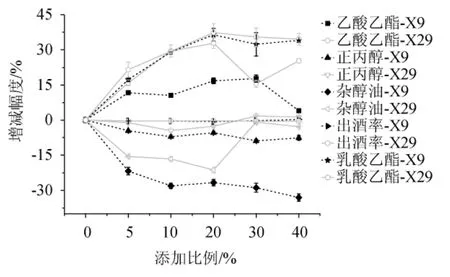
图6 乳酸菌强化麸皮种不同添加比例对固态发酵小试酒样主要指标的影响Fig. 6 Effect of different addition ratio of fortified bran seeds with lactic acid bacteria on main indexes of Baijiu samples with solid-state fermentation by small test
由图6可知,乙酸乙酯含量随两株乳酸菌麸皮种添加量的增加呈先增加后降低的趋势,其中,乳酸菌X9麸皮种添加量为30%时,乙酸乙酯含量提升17.74%,而乳酸菌X29麸皮种添加量为20%时,乙酸乙酯含量提升32.84%。乳酸乙酯提升量随两株乳酸菌麸皮种添加量的增加呈先增加后逐渐降低的趋势,当乳酸菌X29和X9麸皮种添加量为20%时,乳酸乙酯提升量最高,分别为36.44%和37.38%。乳酸菌X29和X9麸皮种的添加能在一定程度上降低正丙醇和杂醇油含量,且菌株X9降正丙醇及杂醇油效果优于菌株X29。两株菌对出酒率没有明显影响。综合5项指标,当乳酸菌X29和X9麸皮种的添加量都为20%时,发酵效果综合较好,为最佳添加比例,可分别提升乙酸乙酯含量32.84%和16.79%,提升乳酸乙酯含量37.38%和36.44%,另外,分别降低正丙醇含量2.61%和5.40%,降低杂醇油含量21.33%和26.71%。
2.5.2 乳酸菌麸皮种不同添加时间及发酵周期的探究
探究乳酸菌麸皮种不同添加时间及发酵周期对固态发酵小试酒样主要指标的影响,结果见图7。
由图7A可知,针对正丙醇和杂醇油含量,实验组1<实验组2<对照组,推测乳酸菌参与糖化可以较好的减少正丙醇和杂醇油的含量。针对乙酸乙酯含量,实验组2的乙酸乙酯含量与对照组接近,但均低于实验组1,说明糖化前添加乳酸菌可使乙酸乙酯含量得到大幅提高。针对出酒率,实验组2>实验组1>对照组,针对乳酸乙酯含量,实验组1>对照组。说明在糖化后加入乳酸菌则可以更显著提升乳酸乙酯的含量以及提高出酒率。由图7B可知,发酵12 d与发酵7 d相比,正丙醇含量略有上升,杂醇油无较大变化。延长发酵时长至12 d使乙酸乙酯和乳酸乙酯的含量均有明显提升。因此,延长发酵时间对正丙醇、杂醇油和出酒率影响不明显,对乙酸乙酯和乳酸乙酯含量有提升作用。
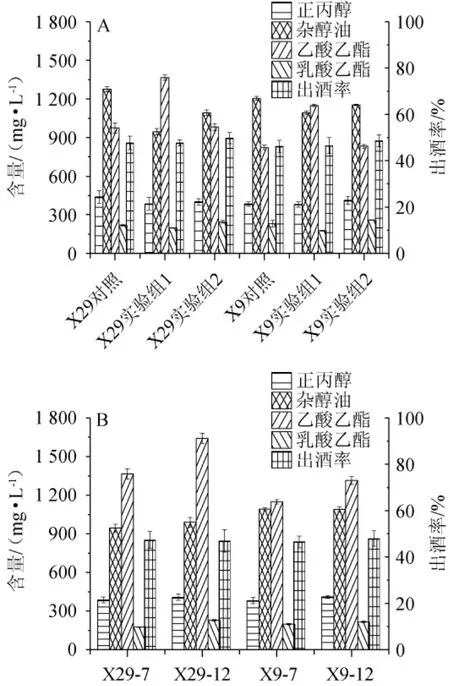
图7 乳酸菌X29和X9强化麸皮种不同添加时间(A)及发酵时间(B)对固态发酵小试酒样主要指标的影响Fig. 7 Effect of different addition time (A) and fermentation time (B)of fortified bran seeds with lactic acid bacteria X29 and X9 on main indexes of Baijiu samples with solid-state fermentation by small test
综上,乳酸菌糖化前添加可显著增加乙酸乙酯含量,并在一定程度上降低杂醇油和正丙醇含量。而糖化后加入乳酸菌能较大程度提高乳酸乙酯含量和出酒率。延长发酵时间至12 d可提升原酒中乙酸乙酯和乳酸乙酯的含量。
3 结论
从四个季节清香型小曲发酵酒醅中共分离鉴定得到3属15种共计225株乳酸菌,经高粱汁培养基初筛、固态发酵小试实验复筛,得到两株提升乙酸乙酯、乳酸乙酯含量和降低杂醇油、正丙醇含量效果较好的乳酸菌,分别为纳格里乳杆菌X29和布氏乳杆菌X9,通过对两株乳酸菌麸皮种与酒曲不同配比发酵优化,确定乳酸菌麸皮种最佳添加量为20%,此时,酒样中乙酸乙酯含量分别提升32.84%和16.79%,乳酸乙酯含量分别提升37.38%和36.44%,正丙醇含量分别降低2.61%和5.40%,杂醇油含量分别降低21.33%和26.71%。同时,在小试实验中探究乳酸菌麸皮种添加时间发现,乳酸菌糖化前强化能在后期明显提升酒体中乙酸乙酯含量,糖化后强化则可提升乳酸乙酯的含量,并提高出酒率。延长发酵时间至12 d对提升乙酸乙酯和乳酸乙酯也具有一定的作用。本研究对清香型小曲白酒四季发酵中的乳酸菌种类、数量、功能及其在酒曲发酵中作用进行了研究,为进一步挖掘乳酸菌在白酒酿造中的功能,提供了大量菌株资源。
