一例鸡传染性法氏囊病毒新型变异株的分离与鉴定
2022-08-31邹潍力黄添祥欧阳志良张险朋
邹潍力,黄添祥,欧阳志良,温 蕾,张险朋★
(1.东莞市动物疫病预防控制中心,广东 东莞 523086;2.东莞市厚街镇农业技术服务中心,广东 东莞 523960)
鸡传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的一种严重危害雏鸡的免疫抑制性、急性、高度接触传染病。IBD的发病率高、病程短,主要侵害鸡的中枢免疫器官法氏囊,导致其不同程度的损伤,并可诱导多种疾病或使多种疫苗的免疫失败。病鸡临床表现不一,3~6周龄的鸡易感,感染后法氏囊先肿胀后萎缩,严重者会出血,脾脏肿大等。IBDV属于双RNA病毒科的禽双RNA病毒属,由5种结构蛋白组成,分别为VP1、VP2、VP3、VP4和VP5,其中VP2能诱导具有保护性的中和活性抗体产生,是IBDV的衣壳蛋白和主要保护性抗原,其编码基因是IBDV最重要的毒力基因,决定着IBDV的细胞嗜性。此外,VP2蛋白高变区(第206~350位氨基酸)易发生突变,是A节段基因特征的代表区段,常被用于IBDV的遗传演化分析。IBDV主要分为两个型,血清I型和血清II型,其中仅有血清I型有致病性,根据致病性和毒力血清I型IBDV又可分为经典株、变异株、超强毒株和弱毒株。
疫苗免疫是生产上控制IBD的有效措施,市场上IBD疫苗种类繁多,包括全病毒灭活疫苗、亚单位疫苗、HVT载体疫苗、弱毒疫苗及抗原抗体复合物疫苗等。针对不同毒力的毒株,目前已经有成熟的商品化疫苗并大规模应用于生产中,可有效免疫鸡群,有较高的保护率。随着疫苗的合理使用和饲养水平的不断提高,IBDV超强毒株感染在我国逐渐被控制,但近年来,我国在部分免疫鸡群中不断检出IBDV阳性,虽然不会造成鸡的大量死亡,却导致了雏鸡法氏囊迅速萎缩及严重的免疫抑制,但不引起法氏囊炎性水肿及出血性病变。2019年,Fan等首次报道了在中国6个省份(河北、山东、山西、安徽、江苏和福建等省)的76个已免疫IBD疫苗的肉鸡群中检出IBDV新型变异株。日本、韩国、马来西亚也相继发现了IBDV新型变异株,表明现有疫苗不能有效保护IBDV新型变异株的感染且目前无有效的疫苗免疫IBDV新型变异株,IBDV新型变异株流行范围在不断扩大。近期,在广东某鸡养殖场的免疫鸡群中发现了临床疑似鸡传染性法氏囊病病例,对采集的病料进行病毒分离、鉴定,对分离的毒株进行基因测序分析,以期为鸡传染性法氏囊病的防控提供参考。
1 材料与方法
1.1材 料
1.1.1 临床样品 2021年4月,广东某养鸡场鸡群中出现疑似非典型IBD症状,发病鸡精神萎靡,生长迟缓,剖检可见法氏囊明显萎缩,脾脏稍肿大,其他脏器未见明显病变。采集发病鸡的法氏囊、脾脏等组织,剪取适量置于无菌研磨管中,按1:3的比例加入8000U的双抗,置于研磨机中研磨成匀浆。于-80℃反复冻融3次后,4℃6000r/min离心8 min。取上清,经0.22μm滤膜过滤后经绒毛尿囊膜途径接种10~12d龄鸡胚,置37℃培养箱内孵育,每12h照胚一次,弃去24h内死亡的胚。孵育5d后,从人工气室端剥去卵壳,观察膜上有无增厚或痘斑病变,并收集绒毛尿囊膜和少量尿囊液,继续盲传至第3代,收获F3代尿囊膜和尿囊液液,分装后置于-80℃保存以备下一步的病毒鉴定。
1.1.2 主要试剂 总RNA提取试剂盒购自QIAGEN公司;PrimeScriptR One-Step RT-PCR试剂盒、DNA Marker购自TaKaRa公司。
1.1.3 仪器设备 PCR仪购自美国Bio-Rad公司;凝胶成像系统购自美国MVP公司。
1.2方法
1.2.1 引物设计与合成 根据GenBank登录的IBDV VP2基因设计了1对引物进行VP2高变区基因扩增,上游引物:5′-GCCGATGATTACCAATTCTCATC-3′;下游引物:5′-CCGGATTATGTCTTTGAAGC-3′,预期扩增片段的长度为674bp,由上海生工生物工程公司合成。
1.2.2 RT-PCR检测和测序 取1.1.1中收集的绒毛尿囊膜和尿囊液混合研磨液,离心后取上清,按照Takara病毒核酸抽提试剂盒说明书提取总RNA。一步法RT-PCR反应体系为:PrimeScript1StepEnzyme Mix 1μL,2×1StepBuffer12.5μL,上游引物和下游引物各1μL,RNA模板1μL,加入无核酸酶水至25μL。RT-PCR反应条件为:50℃30min;95℃5min;95℃40s,56℃40s,72℃50s,共进行32个循环;72℃10 min。反应结束后,用1%琼脂糖电泳检测PCR产物,阳性样品的扩增产物送广州华大基因进行测序。
1.2.3 VP2基因核苷酸同源性及遗传演化分析
用DNAStar软件对分离株与参考毒株VP2基因核苷酸序列进行同源性分析;使用软件MAGA7.0中的最大似然法构建进化树。相关参考毒株及其GenBank登录号(见表1)。
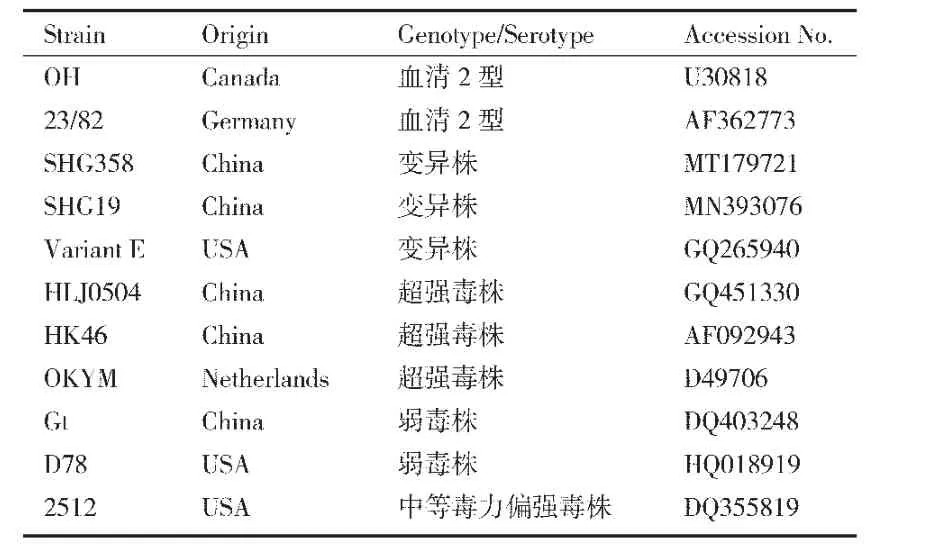
表1 相关参考毒株及其Gen Bank登录号
2 结果
2.1 病毒分离与鉴定临床病料接种SPF鸡胚后,培养5d未出现死胚。从人工气室端剥去卵壳观察绒毛尿囊膜,发现膜变白增厚。绒毛尿囊膜、尿囊液混合研磨液经RT-PCR检测和基因测序,结果为IBDV阳性,将该分离毒株命名为GDJRBTC2021株。
2.2 RT-PCR检测和基因测序结果对培养鸡胚绒毛尿囊膜、尿囊液进行RT-PCR检测,在约为674bp处有一个扩增条带,扩增产物与预期大小一致(见图1)。对扩增产物进行测序,与公布的IBV株的同源性性100%,证实为IBDV VP2基因。
2.2 同源性分析结果基因测序获得位于VP2基因663~1337 nt(aa 221~445)的674bp长度的序列。对所获得的进行同源性分析,GDJRBTC2021株与新型变异参考株(SHG358和SHG19)的同源性较高,为98.5%~98.7%,而与美国早期变异株Variant E的同源性仅为94.8%(见图2)。
2.3 遗传演化分析
2.3.1 遗传进化树分析 基于VP2代表片段的核苷酸序列构建系统进化树,GDJRBTC2021株和11株IBDV参考序列主要分成5个分支,分别为血清II型超强毒株、中等毒力偏强毒株、变异株和弱毒株。值得注意的是,在IBDV变异株的分支中,GDJRBTC2021株所在的新型变异株和美国变异株又形成了2个不同的分支(见图3)。这说明新型变异株和美国变异株虽同属变异株,但亲缘关系较远。
2.3.2 氨基酸序列变异分析 通过对GDJRBTC2021株和参考株进行氨基酸位点比较,结果发现GDJRBTC2021株与参考变异株E具有相同的特征氨基酸序列,包括213N、222T、242V、249K、253Q、279N、284A、286I、294L、318D、323E和330S,而222T、249K、286I和318D是IBDV变异株的典型氨基酸残基。值得注意的是,新型变异株和美国变异株存在位点差异,与美国变异株E相比,221K、252I和299S仅出现在新型变异株中(见表2)。
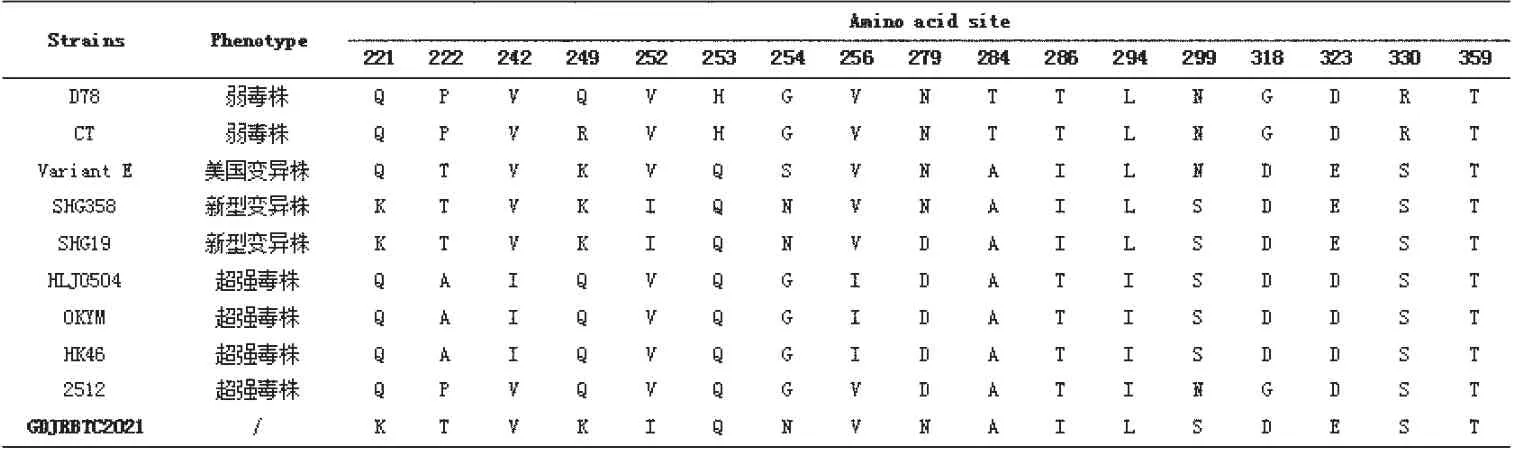
表2 IBDV VIP基因高变区关键氨基酸比对结果
3 讨论
IBD是危害养禽业的重要疫病之一,该病造成的危害不可估量。1957年,经典型IBD首次暴发于美国,20世纪80年代末,变异型IBDV首次出现于美国,随后其在美国流行,造成了严重的经济损失。目前依然主要依赖接种疫苗来预防IBD,针对不同毒力的毒株,目前已经有成熟的商品化疫苗并大规模应用于生产中,可有效免疫鸡群,有较高的保护率。但近两年来,IBDV新型变异株不断暴发在我国、日本、韩国、马来西亚等主要养禽地区免疫鸡群中,其基因组结构的改变、毒力的变化和宿主的免疫应答的改变使得传统疫苗无法对IBDV变异株提供较为有效的保护,造成鸡群的免疫失败,导致一定的经济损失,因而IBD仍是养禽业防控的重要对象。
本研究从广东某养鸡场免疫鸡群中检测到IBDV新型变异株,发病鸡法氏囊萎缩、精神萎靡。发病鸡群虽免疫过法氏囊病疫苗,但对IBDV新型变异株保护效果不佳。Fan等人研究也发现,IBDV新型变异株与vvIBDV抗原性不匹配是导致IBDV新型变异株免疫逃匿并蔓延的重要原因。通过进化树分析表明,GDJRBTC2021株虽与美国早期变异株属于同一分支,但在IBDV变异株的分支中,GDJRBTC2021株所在的新型变异株与美国变异株形成了两个亚分支,有明显差异。进一步通过氨基酸位点比较,本研究所分离的毒株和新型变异株含有IBDV变异株的特征性氨基酸(222T、249K、286I和318D),也具有IBDV新型变异株的独特氨基酸(221K、252I、299S)。其中氨基酸222T、249K、286I和318D已被证明与IBDV抗原变异密切相关。本研究所分离的毒株和早期变异株相比,发生了3个氨基酸突变,221Q→K、252A→I和299N→S,其中252A和299S是超强毒株的特征氨基酸,这表明IBDV新型变异株可能是早期变异株和经典超强毒株的重组病毒。
到目前为止,IBDV新型变异株流行在我国、日本、韩国、马来西亚等,流行范围不断扩大,且无有效的疫苗保护,成为养禽业的重要威胁。因此,监测IBDV流行情况、密切关注IBDV毒株的进化和变异等对当前IBDV的防控有重要意义。
