O2/N2和O2/CO2氛围下丙烷层流扩散火焰中碳烟生成数值模拟
2022-08-31梁博文王城景张引弟龚焕文郭欣泽
梁博文,王城景,张引弟,龚焕文,辛 玥,郭欣泽,蔺 乔
(1.长江大学石油工程学院,湖北 武汉 430100;2.油气钻采工程湖北省重点实验室,湖北 武汉 430100)
据《BP世界能源统计年鉴》[1],2019年全球由能源排放的CO2约341.69亿t,较2018年增长0.5%。富氧燃烧作为极具潜力的碳捕集技术受到广泛重视,如废气再循环(EGR)和烟气再循环(FGR)等技术已广泛应用于许多行业[2-3]。最近的一些研究表明,O2/CO2氛围下的燃烧碳烟生成特性与空气氛围下有较大差异[4-7]。
Park等人[8]研究了CH4/空气逆流扩散火焰中H2O、CO2和N2的稀释效应,发现气流中CO2的加入通过热效应和化学效应降低了火焰温度,而加入H2O则通过化学效应促进了反应。Wang等人[9]通过数值模拟结合实验的方法研究了CO2对逆流C2H4/空气扩散火焰中碳烟生成的影响,发现CO2的添加降低了H自由基、甲基、炔丙基和乙炔的摩尔分数,从而导致碳烟成核速率和表面生长速率的下降。Chen等人[10]通过实验研究了CO2对层流同流乙烯扩散火焰高度、碳烟粒径和碳烟颗粒吸收性能的影响,发现CO2的添加压缩了碳烟颗粒的成核直径,改变了火焰表面生长区域和氧化区域之间的边界。此外,在合成气的氧化剂侧添加CO2对碳烟生成的影响也有一定的研究。Xie等人[11]对CO/H2/空气预混火焰进行了研究,发现添加CO2和H2O会引起OH消耗峰值的基元反应从OH+H2<=>H+H2O转移到HO2+H<=>OH+OH,且CO2的化学效应比H2O更强。Xu等人[12]对氧化剂中添加30%CO2的层流合成气体扩散火焰开展了实验工作和数值研究,结果表明,CO2的热和化学作用都是通过抑制OH摩尔分数来改变燃烧强度。
以丙烷(C3H8)为主要成分的液化石油气在诸多燃烧装置中均有应用,其碳烟颗粒物排放水平值得关注,前人研究主要集中在多种燃料结构如天然气、乙烯、合成气中碳烟的生成,关于丙烷层流扩散火焰中碳烟的形成机制有待进一步研究。本文利用气相化学反应机理GRI-Mech3.0,结合详细的热力学和输运特性参数,数值模拟研究了丙烷同向流动扩散火焰在O2/N2和O2/CO2氛围下的火焰结构与碳烟生成,并在计算中引入了虚拟物种FCO2,以分离CO2的热效应和化学效应对丙烷火焰结构及碳烟生成的影响。
1 模型建立
1.1 计算域及边界条件
本文计算域网格根据实际Gülder燃烧器划分,实物建模和计算域网格如图1所示,为减少计算量,模拟采用二维轴对称计算域,计算域为118 mm(轴向)×45 mm(径向),划分为194(轴向)×88(径向)个控制体,网格划分采用结构化的非均匀方式,在主要反应区进行加密。在轴向上,30 mm以内采用间距为0.2 mm的统一细网格,然后网格间距逐渐变大,划分94个节点,扩展因子为1.020 5;在径向上,0.8 mm以内采用间距为0.2 mm的统一细网格,0.80~5.45 mm区间,等距划分19个节点;5.45~6.45 mm区间内等距划分4个节点,伴流气侧网格间距逐渐变大,等距划分61个节点,扩展因子为1.025,共划分20 052个网格,经网格无关性验证,满足计算精度需求。本文计算域向燃料喷口上游延伸10 mm,并将燃料喷口包含在计算域内,以便得出较合理的燃料出口速度分布[13]。

图1 实物建模及计算域网格Fig.1 Physical modeling and computing domain grid division
燃料入口和伴流气入口边界条件均选用速度入口,丙烷进口流速为1.96 cm/s,不同工况下伴流气进口流速不同,侧边界设置为壁面边界条件,等温300 K,考虑燃料的预热,喷口管壁温度设为400 K,出口温度设为300 K,采用压力出口边界条件,允许出口边界回流。
1.2 工况设计
模拟计算的所有工况(表1)下丙烷流量均为109.8 mL/min,伴流气中的O2流量均为20 L /min。
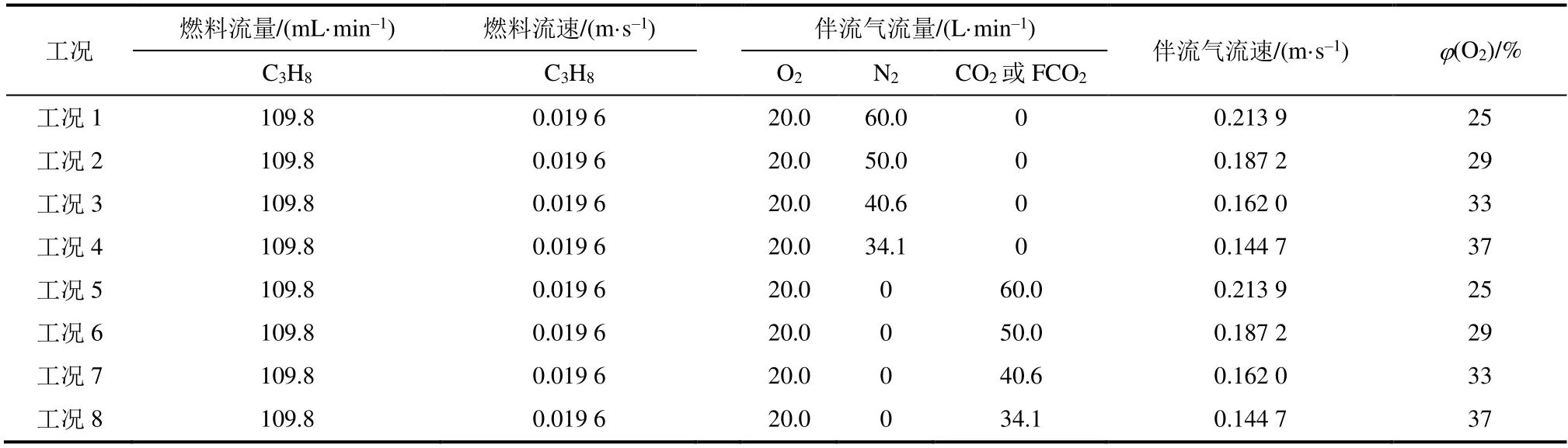
表1 模拟计算工况Tab.1 Simulated calculation conditions
为分离和描述CO2的化学效应,本文引入一种虚拟物种FCO2,它与CO2具有相同的热物理性质,但在化学上是惰性的。因此,O2/CO2和O2/FCO2之间的结果差异是由CO2的化学效应造成的,而FCO2稀释剂和N2稀释剂之间的差异代表了CO2相对于N2的热效应。
1.3 数值方法
燃烧模型采用基于Arrhenius公式的层流有限速率模型,气相化学反应机理采用适用于模拟C1-C3碳氢燃料燃烧的GRI-Mech3.0气相反应机理[14],该机理包含219个基元反应,涉及36种组分。选用离散坐标DO辐射模型计算辐射传热,结合基于Smith等人[15]提出的灰气体加权和模型(WSGG)计算气体介质和碳烟的辐射特性。碳烟模型采用以乙炔的聚合作为碳烟成核步骤和乙炔作为表面生长过程添加物种的The-Moss-Brookes碳烟模型[16],该模型包括碳烟的成核、表面增长和氧化过程。Moss-Brookes模型[17]求解归一化自由基核摩尔分数和碳烟质量分数的输运方程如式(1)—式(4)所示。
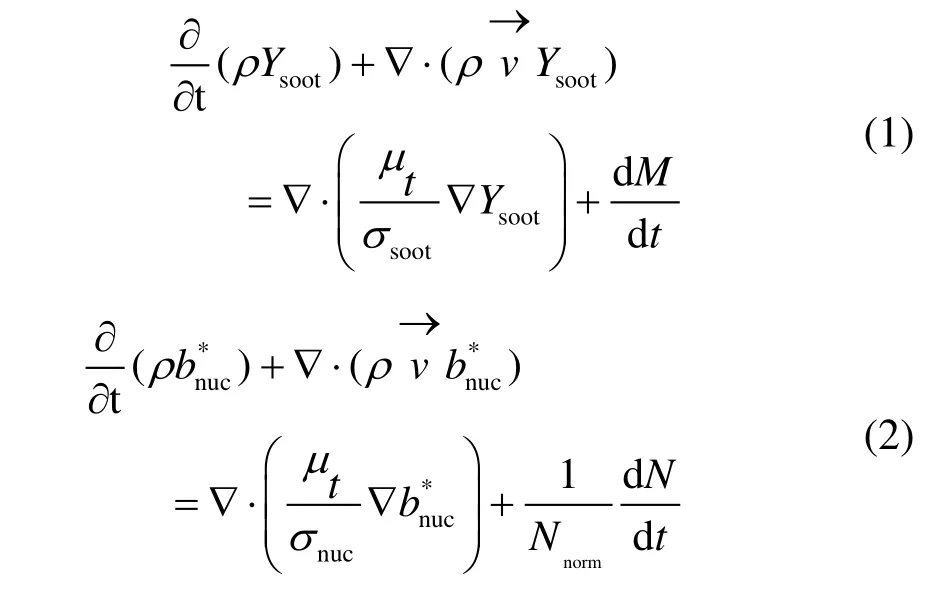
式中:ρ为密度,kg/m3;Ysoot为碳烟质量分数;μt/ρDt缺省设置值为0.7,Dt为物质扩散系数;σsoot为碳烟湍流施密特数;M为碳烟质量浓度,kg/m3;b*nuc为每千克归一化的自由基核数,颗粒数×10-15;N为碳烟颗粒数密度,颗粒数/m3;σnuc为碳烟颗粒间湍流施密特数;Nnorm=1015,碳烟颗粒的产生速率由式(3)给出,其主要与气相成核以及自由分子状态下凝聚有关;dM/dt为碳烟质量浓度,kg/(m3·s),其源项由式(4)建模,包括了成核、表面生长和氧化3个步骤。

式中:Cα=54/s;Cβ=1.0和l为模型常数;P为压力,Pa;R为摩尔气体常数为8.31 J/(mol·K);T为温度,K;NA为阿伏伽德罗常数;Xprec为碳烟前驱体的摩尔分数;ρsoot为碳烟的质量密度,假定为2 000 kg/m3;dp为碳烟颗粒的平均直径,nm。

式中:初生碳烟颗粒的质量Mp=144 kg/kmol;Xsgs为参与表面生长物质的摩尔分数;XOH为参与氧化过程物质的摩尔分数;碳烟开始速率的温度Tα=21 000 K;凝聚速率的模型常数Cβ=1.0;表面生长速度比例因子Cγ=11 700 kg·m/(kmol·s);表面生长率活化温度Tγ=12 100 K;氧化模型常数Cw=105.812 5 kg·m/(kmol·K1/2·s);碰撞效率参数ηcoll=0.04;氧化率缩放参数Coxid=0.015。
数值算法选用基于压力耦合的求解器,利用SIMPLE数值算法处理压力和速度的耦合。所有工况均使用Fluent 14.0计算,考虑到部分自由基团会在较小区域内大幅变化,难以收敛,通过设定温度监视,当温度达到稳定值,默认结果收敛[18]。本次模拟先进行了冷态模拟,后加入化学反应,同时在丙烷和伴流气冷态混合区域进行局部初始化高温,模拟“点火”状态。
2 模型验证
为验证模型的准确性,将丙烷在氧体积分数为21%和25%时的模拟结果与Chu等人[19]进行了比较。取火焰高度30 mm处的径向温度和碳烟体积分数进行对比,结果如图2和图3所示,本文模拟与文献[19]结果呈现相同趋势,2种氧体积分数氛围下的火焰温度在临近火焰中心轴线处误差较大,氧体积分数为21%时的温度分别为1 253.4 K和1 402 K,误差约为10.5%;氧体积分数为25%时的温度分别为1 350.4 K和1 500 K,误差约为9.9%。碳烟峰值体积分数在氧体积分数为21%时分别为和2.67 μL/L和2.52 μL/L,误差约为5.9%;在氧体积分数为25%时分别为4.98 μL/L和4.85 μL/L,误差约为2.6%。由此可知,本文建立的模型能准确反映扩散火焰中温度和碳烟体积分数的分布。

图2 φ(O2)=21%时z=30 mm处径向温度和碳烟体积分数分布Fig.2 Distribution of radial temperature and soot volume fraction at z=30 mm when φ(O2)=21%
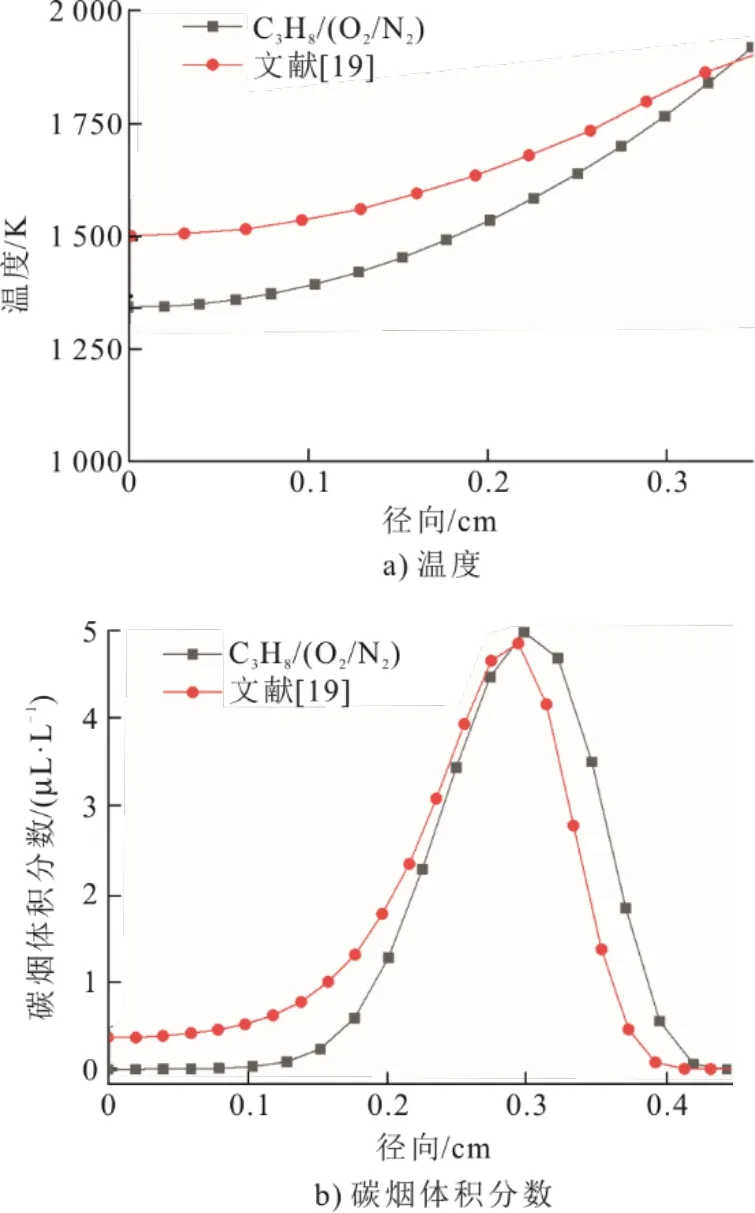
图3 φ(O2)=25%时z=30 mm处径向温度和碳烟体积分数分布Fig.3 Distribution of radial temperature and soot volume fraction at z=30 mm when φ(O2)=25%
3 结果与分析
3.1 火焰温度
温度分布是描述火焰燃烧特性的重要指标。为了解不同氧体积分数和CO2取代N2对丙烷同向流动火焰特性的影响,图4显示了在不同氧体积分数下伴流气气流中使用N2和CO2作为稀释剂时的二维温度分布。由图4可见,随着氧体积分数的增加,C3H8/(O2/N2)和C3H8/(O2/CO2)的火焰温度均显著升高。高温区主要发生在火焰两翼区域,峰值温度随氧体积分数增加而升高的趋势也在图4中得到证实,这可能归因于同流伴流气中氧体积分数的增加,导致火焰对O2的夹带能力增强,O和OH等活性自由基增多,从而促进下游的燃烧反应[20]。与O2/N2氛围相比,在O2/CO2氛围下有显著降低火焰温度的趋势,这主要是由CO2的热效应和化学效应造成的。CO2的热效应是由于CO2的热容比N2大,而CO2的化学效应是由于抑制了链式反应H+O2<=>O+OH,从而降低了火焰温度[21]。

图4 火焰温度二维分布Fig.4 Two-dimensional distribution of flame temperature
丙烷在O2/N2和O2/CO2氛围下火焰峰值温度如图5所示。
由图5可见,火焰在C3H8/(O2/N2)和C3H8/(O2/CO2)氛围下的峰值温度变化在氧体积分数较低时差异较大,这表明伴流气中较高的氧体积分数减弱了CO2对温度的影响,这可能是因为氧体积分数的增加显著提高了放热速率,促进了链状载流子自由基的形成,从而在较高氧体积分数条件下减弱了CO2对火焰温度的影响[21]。
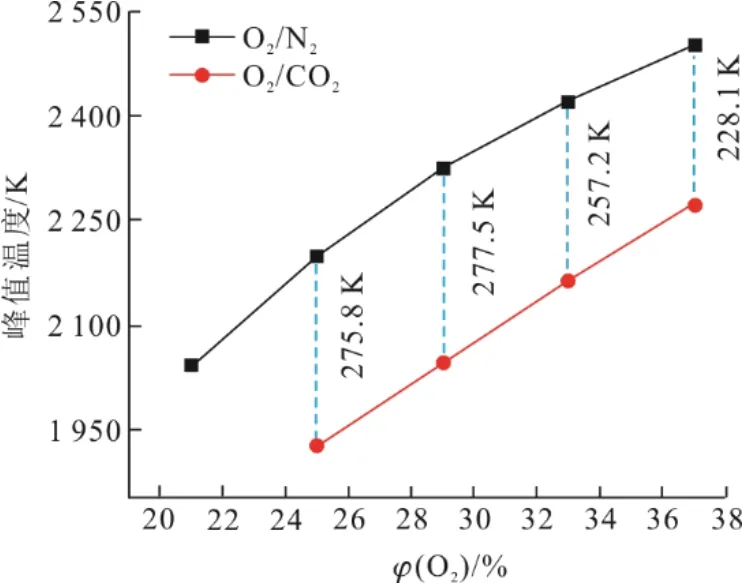
图5 O2/N2和O2/CO2氛围下火焰峰值温度Fig.5 Peak flame temperature in O2/N2 and O2/CO2 atmospheres
3.2 火焰高度
由于火焰高度信息可用来检验火焰结构的模型,其被认为是同流层流扩散火焰的重要结构参数,通常被定义为火焰中心线温度或OH自由基摩尔分数达到峰值时的位置[22-24]。图6显示了火焰在C3H8/(O2/N2)和C3H8(O2/CO2)氛围下不同氧体积分数时火焰温度和OH自由基摩尔分数峰值所定义的火焰高度。由图6可见,氧体积分数为29%时,C3H8/(O2/N2)氛围下2种定义的火焰高度相差最大,误差为6%;氧体积分数为25%时,C3H8/(O2/CO2)氛围下2种定义的火焰高度相差最大,误差为7.5%,虽然在相同氧体积分数时2种定义下的火焰高度存在一定差异,但总体而言,C3H8/(O2/CO2)氛围下2种定义的火焰高度均高于C3H8/(O2/N2)氛围,说明上述2种有关火焰高度的定义均可用来检验火焰结构模型。随着氧体积分数的增加,2种氛围下的火焰高度均显著降低,轴向停留时间逐渐缩短。这主要是由于随着氧体积分数的增加,火焰在更低的位置就可以获得充足的氧气使燃料燃烧更加完全,不必扩散到更高处[25],而在O2/CO2氛围下,火焰高度有所增加。

图6 O2/N2和O2/CO2氛围下火焰高度Fig.6 Flame height in O2/N2 and O2/CO2 atmospheres
OH自由基在燃烧和碳烟氧化中起着重要作用,是反映火焰燃烧状态的重要组分。CO2对火焰高度的影响可以通过OH自由基的分布进一步说明,火焰在C3H8/(O2/N2)和C3H8/(O2/CO2)氛围下的OH自由基摩尔分数二维分布如图7所示。由图7可见,OH自由基主要出现在高温区,与图4中的温度分布有很好的相关性。随着氧体积分数的增加,OH自由基摩尔分数峰值逐渐增加,这主要归因于H+O2<=>O+OH正向反应速率的提高。而在O2/CO2氛围下,OH自由基摩尔分数峰值有所降低,这除了CO2的热效应对其产生的影响外,还主要通过抑制链式反应H+O2<=>O+OH来降低OH自由基摩尔分数峰值[21],CO2的这种抑制作用与Xu等人[12]的观察结果一致。此外,与C3H8/(O2/N2)火焰相比,C3H8/(O2/CO2)火焰的OH自由基摩尔分数二维分布向下游延伸,表明O2/CO2氛围下火焰高度增加。
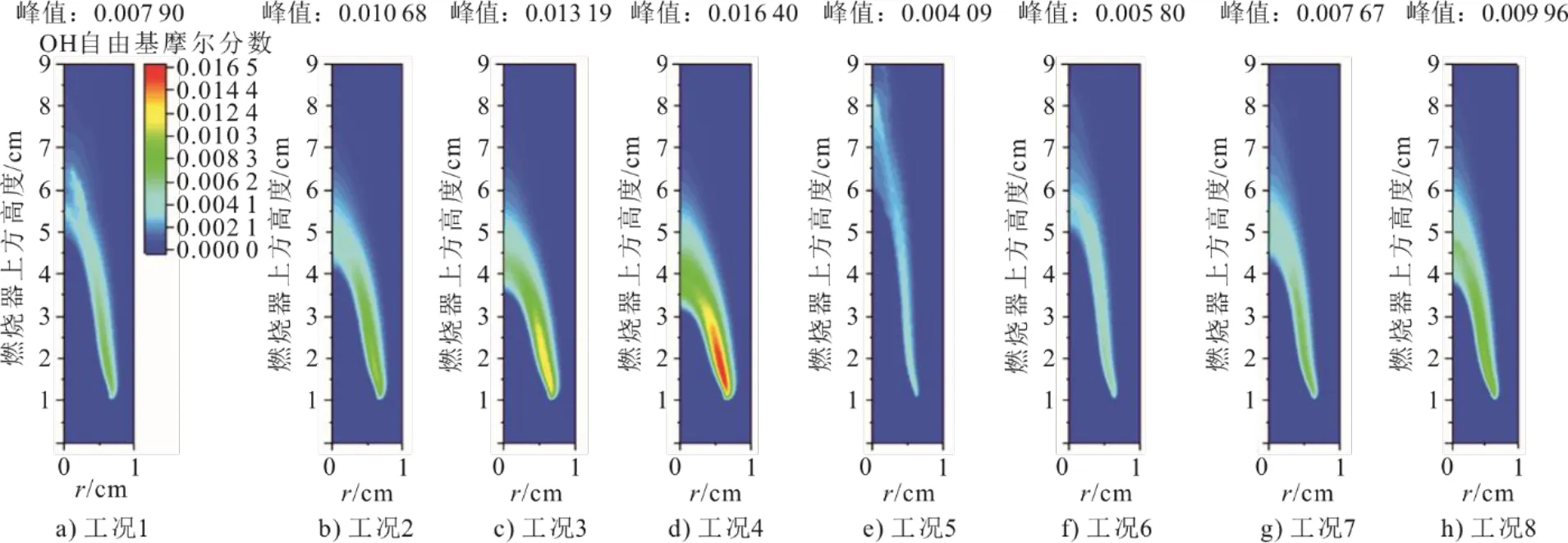
图7 OH自由基摩尔分数二维分布Fig.7 Two-dimensional distribution of OH mole fraction
3.3 碳烟体积分数分布
图8显示了在伴流气侧不同氧体积分数O2/N2和O2/CO2氛围下碳烟体积分数二维分布。由图8可见,随着氧体积分数的增加,O2/N2氛围下碳烟峰值体积分数从5.127 μL/L增加到6.064 μL/L,O2/CO2氛围下碳烟峰值体积分数从1.239 μL/L增加到 4.129 μL/L。火焰高度不仅是描述火焰形状的重要参数,而且还提供了碳烟颗粒从开始到完全氧化停留时间的指示。还可看出,碳烟区域可见火焰显著缩短,这是因为碳烟体积分数的分布受到伴流气气流中氧含量的强烈影响,氧体积分数增加提高了相应高度处氧的扩散速率,燃烧反应更为剧烈,碳烟初生位置提前,这与Zhang等人[26]在C2H4/(O2/N2)和C2H4/(O2/CO2)火焰中的测量与数值模拟研究得出的结论保持一致。同时注意到,在同一氧体积分数下伴流气侧CO2取代N2时,碳烟起始位置有一定的延迟,C3H8/(O2/CO2)火焰中的碳烟起始位置比相应的C3H8/(O2/N2)火焰中的碳烟起始位置更高,可见火焰更高,碳烟峰值体积分数更低。结果表明,当用CO2取代N2时,C3H8/(O2/CO2)火焰中碳烟的生成受到了抑制。
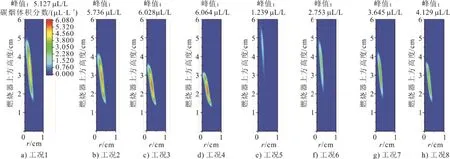
图8 碳烟体积分数二维分布Fig.8 Two-dimensional distribution of soot volume fraction
图9显示了不同氧体积分数时,O2/N2和O2/CO2氛围下碳烟质量成核速率和表面生长速率。图9结果表明,随氧体积分数增加,碳烟质量成核速率和表面生长速率均呈上升趋势,即氧体积分数的增加促进了碳烟成核和表面生长过程,而对比在O2/CO2氛围下同一氧体积分数时,碳烟质量成核速率和表面生长速率显著降低,即CO2的添加抑制了碳烟成核和表面生长过程。

图9 O2/N2和O2/CO2氛围下碳烟质量成核速率及表面生长速率Fig.9 Soot mass nucleation rate and surface growth rate in O2/N2 and O2/CO2 atmospheres
火焰的温度分布与碳烟形成有一定关系[27-28],比较图4和图8也可以印证这一点。为进一步探究温度对碳烟形成的影响,取燃烧器上方不同高度处温度和碳烟体积分数沿径向分布的情况,结果如图10和图11所示。

图10 O2/N2氛围下不同高度处温度和碳烟体积分数径向分布Fig.10 Radial distribution of temperature and soot volume fraction at different heights in O2/N2 atmosphere

图11 O2/CO2氛围下不同高度处温度和碳烟体积分数径向分布Fig.11 Radial distribution of temperature and soot volume fraction at different heights in O2/CO2 atmosphere
在同一氧体积分数氛围下,C3H8/(O2/N2)和C3H8/(O2/CO2)火焰底部的碳烟均处于形成阶段,火焰温度较低,碳烟体积分数较小;随着火焰径向距离的增大,火焰温度逐渐升高,反应加剧,碳烟体积分数迅速变大;而随着火焰径向距离继续增大,H摩尔分数的降低影响了碳烟质量成核和表面生长速率,碳烟体积分数逐渐降低,这在下文有进一步分析。此外,对比图10和图11中沿径向分布的温度和碳烟体积分数可以发现,火焰温度分布具有一定的规律性,即同一氧体积分数时,火焰最高温度随径向截面高度的增加而降低,同一径向截面处,火焰最高温度出现的位置随氧体积分数增加而提前,而碳烟体积分数分布的规律性不明显,这与以往学者的实验结果一致[27,29]。
3.4 CO2综合效应对关键物种的影响
为探究CO2稀释剂对不同氧体积分数下与碳烟生成相关的重要前体物质的化学影响,本文分析了氧体积分数为25%和37% 2种氛围下CO2稀释剂对碳烟生成的影响。图12显示了C2H2摩尔分数在不同截面处的径向分布。
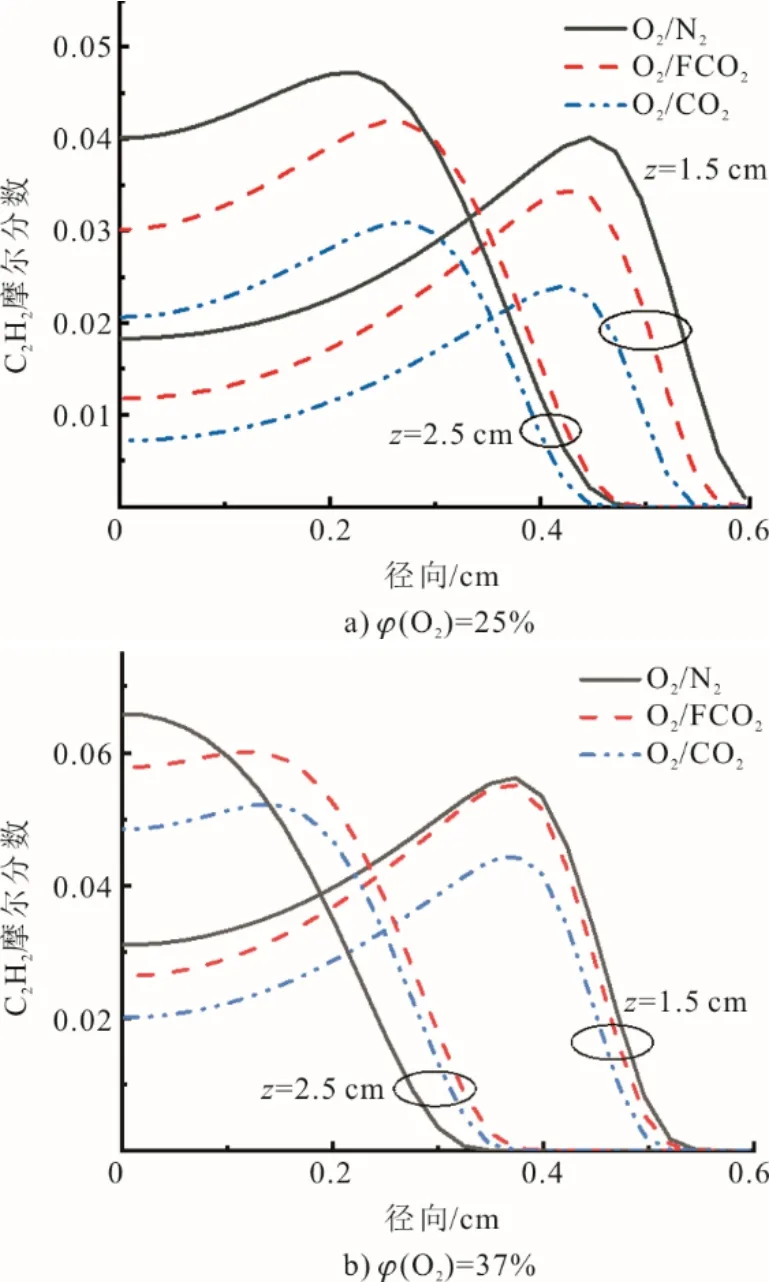
图12 C2H2摩尔分数径向分布Fig.12 Radial distribution of C2H2 mole fraction
由图12可见,在伴流气气流中用FCO2取代N2时,C2H2摩尔分数显著降低,这归因于CO2的热效应。C3H8/(O2/FCO2)和C3H8/(O2/CO2) 2种氛围下的差异反映了CO2的化学效应对C2H2摩尔分数产生的影响,在低火焰区域CO2化学效应显著降低了C2H2摩尔分数,虽然当z=2.5 cm,φ(O2)=37%时在径向距离大于0.1 cm处O2/CO2氛围下的C2H2摩尔分数高于O2/N2,但CO2化学效应仍起到抑制作用。
H自由基无论是对于初期碳烟成核,还是对于碳烟的生长都具有非常重要的作用,H自由基是通过影响HACA机理中活性中心的形成速率继而影响C2H2加成速率[26]。H自由基摩尔分数的径向分布如图13所示,O2/CO2氛围下火焰中H自由基的摩尔分数较低,这主要是由CO2的热效应和化学效应共同作用所致,继而影响了C2H2加成速率。影响碳烟及相关重要小分子生成的链式反应为CO2+H<=>CO+OH,CO2的添加使得反应朝着消耗更多H自由基而产生更多OH自由基的方向进行,OH自由基摩尔分数的径向分布如图14所示,CO2的热效应和化学效应均抑制了OH自由基的生成,降低了氧化速率。由此可知,伴流气中CO2主要是通过降低H自由基摩尔分数从而影响碳烟质量成核和表面生长速率,而不是通过促进碳烟氧化过程来抑制碳烟的生成,这与Guo等人[30]针对C2H4/(O2/CO2)火焰研究得出的结论较为一致。

图13 H自由基摩尔分数径向分布Fig.13 Radial distribution of H mole fraction
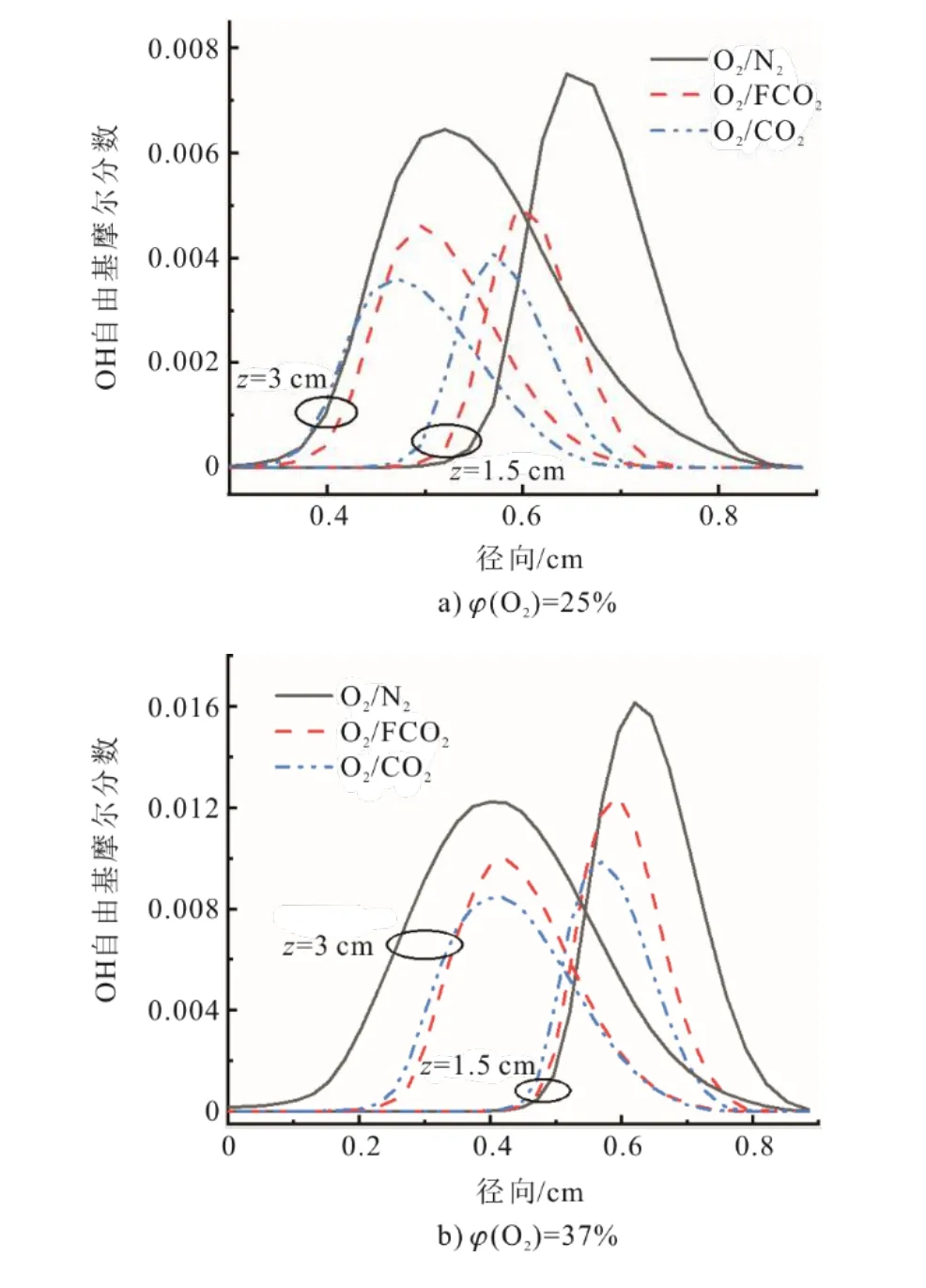
图14 OH自由基基摩尔分数径向分布Fig.14 Radial distribution of OH mole fraction
为研究CO2的化学效应对丙烷火焰的影响,本文对有关CO2参与的主要基元反应进行了敏感性分析,如图15所示。
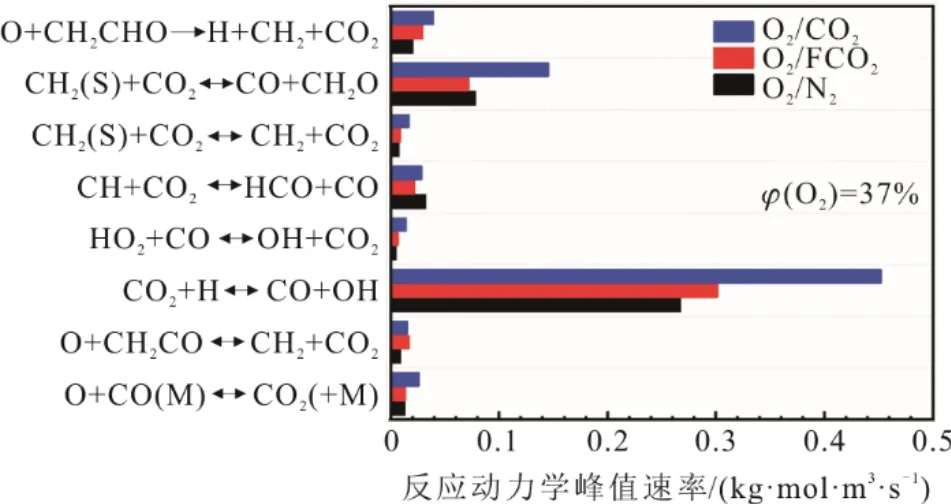
图15 基元反应动力学峰值速率Fig.15 Kinetic peak rate of elementary reaction
CO2+H<=>CO+OH是CO2参与的重要反应,受CO2的化学效应最为敏感,在O2/CO2氛围下的反应动力学速率大于O2/N2和O2/FCO2氛围,高摩尔分数CO2通过提高基元反应CO2+H<=>CO+OH的正向反应速率,从而降低CO的氧化放热,降低H自由基的浓度。此外,O+CH2CHO=>H+CH2+CO2和CH2(S)+ CO2<=>CO+CH2O也是CO2参与较为重要的基元反应,在O2/CO2氛围下的反应动力学速率大于O2/N2和O2/FCO2氛围。
4 结 论
本文对氧体积分数为25%~37%的C3H8/(O2/N2)和C3H8/(O2/CO2) 2种氛围下丙烷同向流动扩散火焰的火焰结构和碳烟形成进行了数值计算,得出以下结论:
1)在O2/N2和O2/CO22种氛围下,氧体积分数的增加均加速了丙烷的热解过程,提高了火焰温度。与O2/N2氛围相比,在O2/CO2氛围下有显著降低火焰温度的趋势,这主要是由CO2的热效应和化学效应导致的。而在较高的氧体积分数下,O2体积分数的增加显著提高了放热速率,从而减弱了CO2对火焰温度的影响。
2)随着氧体积分数的增加,2种定义下的火焰高度在C3H8/(O2/CO2)与C3H8/(O2/N2) 2种氛围下均显著降低,轴向停留时间逐渐缩短。而在O2/CO2氛围下,OH自由基摩尔分数二维分布向下游延伸,表明O2/CO2氛围下火焰高度增加。
3)随着氧体积分数的增加,火焰在C3H8/(O2/CO2)与C3H8/(O2/N2) 2种氛围下的碳烟体积分数均增大,而在O2/CO2氛围下,碳烟体积分数有所降低。火焰的温度分布与碳烟形成有一定关系,但火焰温度分布具有一定规律性,而碳烟体积分数分布的规律性不明显。
4)CO2热效应和化学效应共同对碳烟起到了抑制作用,降低了碳烟形成过程中重要物质的摩尔分数,包括H、OH自由基和C2H2。主要通过基元反应CO2+H<=>CO+OH降低H自由基摩尔分数从而影响碳烟质量成核和表面生长速率,而不是通过促进碳烟氧化过程来抑制碳烟的生成。
