饲料中添加胆酸钠对大口黑鲈生长及糖代谢的影响
2022-08-30丁斐斐周楠楠杜震宇张美玲
丁斐斐 周楠楠 张 乐 乔 芳 杜震宇 张美玲
(华东师范大学生命科学学院, 水生动物营养与环境健康实验室, 上海 200241)
胆汁酸(Bile acids, BAs)是生物体在肝中以胆固醇为前体合成并在胆囊中储存的黄绿色混合物。在生理条件下, 胆汁酸以盐形式存在, 具有多种生理功能[1]。此外, 胆汁酸还可影响肠道微生物的定植和组成, 从而影响机体代谢[2]。目前, 胆汁酸作为饲料添加剂在鱼类的生长性能[3—7]、抗氧化能力[6,8,9]、免疫功能[6,9]、脂代谢[10—12]及肠道菌群组成变化[13,14]中的作用已受到广泛关注, 但在鱼类的糖代谢方面[7]的研究鲜少见报道。已知在哺乳动物中, 胆汁酸可参与调节生物体的糖代谢稳态, 例如,胆酸-7-硫酸 (Cholic acid-7-sulfate, CA7S)可降低肥胖小鼠(Mus musculus)的血糖含量[15]; 6α位羟基胆汁酸可显著提高猪(Sus scrofa)的糖耐受能力[16], 并且研究发现, 肠道菌群的组成变化也会影响生物体的糖代谢。例如, 二甲双胍可通过改变肠道菌群中脆弱拟杆菌的丰度从而改变胆汁酸谱, 最终改善小鼠2型糖尿病[17]。在水产动物中, 对鱼类糖代谢的研究仅见于饲料中添加混合胆汁酸可抑制大口黑鲈(Micropterus salmoides)的肝脏糖异生[7], 胆汁酸对鱼类糖代谢改变的具体机制的探究还较为有限。
目前, 水产上常用的胆汁酸添加剂主要是猪脱氧胆酸(Hyodeoxycholic acid, HDCA)、猪胆酸(Hyocholic acid, HCA)和鹅脱氧胆酸(Chenodeoxycholic acid, CDCA)的混合物[3,7,14]。高等动物中的研究已经表明不同胆汁酸可能具有不同的功能, 例如,仅胆酸-7-硫酸可通过G蛋白偶联胆汁酸受体(Takeda G protein-coupled receptor 5, TGR5)依赖性方式降低肥胖小鼠的血糖[15]; 猪中一类6α位羟基的胆汁酸能提高猪的糖耐受能力[16], 表明系统评估单一胆汁酸的作用效果非常重要。在水产上, 已有部分研究揭示在饲料中添加单一胆汁酸对水生动物的作用效果, 如7-脱氧胆酸(7-Deoxycholic acid, 7-DCA)可以增强生长激素对鲤(Cyprinus carpio)的促生长作用[18]; 牛磺石胆酸钠(Sodium taurolithocholate,TLCAS)可以改变草鱼(Ctenopharyngodon idella)肝转录组和肠道菌群的组成[19]。然而, 也有研究发现膳食补充牛磺胆酸钠(Sodium taurocholate, TCAS)并不能改善大西洋鲑(Salmo salar)的生长、营养代谢和肠道炎症[20], 这说明不同类型的胆汁酸对鱼体生长和生理代谢的调控作用并不相同。目前的研究表明大部分鱼类中主要的胆汁酸种类为胆酸、鹅脱氧胆酸和牛磺胆酸[21—24], 胆酸作为鱼类中最丰富的胆汁酸之一, 对鱼类的生长和代谢调节作用尚不明确。
鱼类尤其是肉食性鱼类, 对碳水化合物的代谢能力有限。大口黑鲈是一种典型的肉食性鱼类, 对碳水化合物的利用能力较差。在对大口黑鲈的研究中, 以生长和抗氧化性能为评价指标, 通过折线回归模型获得大口黑鲈饲料中混合胆汁酸最适添加量分别为440.5、283.3和253.8 mg/kg。方差分析和后续实验结果显示在饲料中添加300 mg/kg胆汁酸对大口黑鲈的生长、抗氧化和肪代谢等功能具有最佳的调节能力[5]。随后, 研究发现日粮添加350 mg/kg的混合胆汁酸可以有效改善高淀粉饲料饲喂下大口黑鲈幼鱼的生长性能, 增强肝功能和免疫能力,并减少其应激反应[6]。另一项研究表明, 300 mg/kg混合胆汁酸(8.0%猪胆酸、70.9%猪脱氧胆酸和20.2%鹅脱氧胆酸)可有效缓解由高淀粉饮食引起的大口黑鲈的低增重率, 并可以通过抑制肝脂合成和肝脏糖异生改善高淀粉饮食引起的肝纤维化[7]。以上研究显示, 饲喂大口黑鲈的胆汁酸最适添加量约为300 mg/kg。因此本实验以300 mg/kg的胆酸钠作为饲料添加剂, 测定大口黑鲈的生长性能、肠道菌群和糖代谢指标, 为胆酸钠在饲料中的合理应用提供理论依据。
1 材料与方法
1.1 实验饲料
参考已有研究[5—7]基础确定大口黑鲈的营养需求, 以进口鱼粉、豆粕和鸡肉粉为主要蛋白源,豆油为主要脂肪源, 面粉、谷朊粉和木薯淀粉为糖源配制了2种实验饲料, 实验用胆酸钠(来源于牛或羊胆汁, ≥99%)购自Sigma-aldrich(上海)贸易有限公司, 在2种饲料中的添加量分别为0和300 mg/kg。将饲料原料用粉碎机粉碎并过60目筛网, 准确称量后按照逐级放大法充分混匀, 然后加入油脂和水混合揉匀, 制成粒径为3 mm的颗粒饵料, 自然风干至水分低于10%, 自封袋包装后放于−20℃冰箱中保存备用。具体饲料原料与营养成分见表 1。

表1 实验饲料组成和营养水平(风干基础)Tab. 1 Experimental diet composition and nutritional levels (airdried basis)
1.2 饲养管理
实验用大口黑鲈的鱼苗从广州市添发鱼苗发展有限公司购买, 养殖实验在华东师范大学水产动物养殖基地进行。在养殖系统中用购自无锡通威生物科技有限公司的商品饲料驯化鱼苗, 1个月后开始正式实验。正式实验分成两组, 每组设置3个平行。鱼苗禁食24h后开始分选。将随机挑选的状态良好的鱼苗(10.7±0.2) g以每缸30尾的规格均匀分配到6个养殖缸中, 养殖缸的位置随机排列。两组实验分别饲喂添加有0和300 mg/kg胆酸钠的配合饲料共8周, 每日按鱼苗体重的4%(饱食投喂)分别在8:00和16:00各投喂1次, 每2周称一次体质量以调整饲料投喂量。实验期间养殖水源为充分曝气的自来水, 水温26.0℃左右, 溶氧量6.0 mg/L左右,pH 7.0—8.0。
1.3 样品采集
大口黑鲈8周养殖实验结束后禁食12h。依次将各个缸中的大口黑鲈捞出, 使用20 mg/L的MS-222麻醉剂麻醉后称重。每缸随机选取12尾鱼, 使用1 mL的无菌注射器尾静脉采集血液, 4℃静置过夜, 3000 r/min离心10min, 取上层血清于1.5 mL离心管中并储存在−80℃冰箱中待测。测定随机选取的12尾鱼的体长、体质量、内脏团、肝和腹部脂肪重, 去头和去鳍后精确称量躯壳重, 用于生长指标分析。用75%酒精擦拭消毒鱼体体表后, 在无菌操作条件下收集新鲜的肌肉、肝、肠组织和肠道内容物, 储存在−80℃冰箱中待测。取1/3新鲜的肝和肌肉固定在4%的多聚甲醛中, 用于制备高碘酸希夫氏(Periodic acid-schiff stain, PAS)染色法的糖原染色切片。每个实验组预留6尾鱼用于全鱼水分、粗脂肪、粗蛋白和粗灰分的测定。
大口黑鲈饲养8周后的增重率、肥满度、躯壳比、脏体比、肝体比和脂体比的计算如下:

式中,Wt为终末体重(g),W0为初始体重(g),L为鱼体长(cm),Wd为鱼头重(g),Ws为鱼鳍重(g),Wv为鱼内脏重(g),Wh为鱼肝重(g),Wm为鱼腹腔脂肪重(g),W为鱼体重(g)。
每组实验取6尾鱼检测全鱼体成分, 2组饲料做2个技术重复检测饲料组成。全鱼和饲料粗蛋白采用凯氏定氮法(FOSS Kjeltec 8200)测定, 全鱼和饲料粗脂肪采用氯仿-甲醇法(FOSS Soxtec 2055), 全鱼水分在105℃下烘干至恒重(24h)检测, 全鱼灰分用马弗炉灼烧法在550℃下灼烧14h测定。以上检测均按照国际标准法AOAC(1995)[25]。
大口黑鲈的肝和肌肉组织用4%多聚甲醛固定24h, 脱水后用石蜡包埋, 切成6 μm薄的切片。PAS染色法染色, 在尼康显微镜(Nikon Eclipse TS100)下对染色切片进行分析。
每组12条鱼的糖原和血糖的检测均采用南京建成生物工程研究所生产的相关试剂盒测定, 每组实验随机选择3个样本检测肝和肌肉的糖原合成酶(Glycogen synthase, GCS)和糖原磷酸化酶a(Glycogen phosphorylase a, GPa)的酶活使用北京百奥莱博科技有限公司生产的试剂盒测定, 所有实验操作严格参照说明书进行。
1.4 基因表达检测
每组取6尾大口黑鲈的肝、肌肉或肠组织20 mg,采用MagZol Reagent(Magen)提取总RNA, 经Nanodrop 2000紫外分光光度计(Thermo)检测总RNA的浓度, 并用1%的琼脂糖凝胶电泳检测其完整性。取2 μgA260/280值在1.8—2.2、电泳后28S rRNA﹕18S rRNA条带亮度约等于2﹕1的质量和完整性良好的RNA, 按照FastKing RT Kit with gDNase Fastking cDNA(Tiangen)说明书去基因组后逆转录合成cDNA, 保存于–80℃用于检测基因mRNA的表达。
根据已有文献报道[6, 7]和NCBI数据库中法尼醇X受体(Farnesoid X receptor,FXR)基因序列(Gen-Bank登录号为KT827789.1)设计实时荧光定量PCR(Quantitative real-time PCR, qPCR)引物(表 2), 选择β-actin和延伸因子 1α (Elongation factor 1α ,EF1-1α)作为双内参基因, 以保证内参基因在不同处理中的稳定性。qPCR检测方法是将1 μL合成的cDNA用3 μL的无菌水稀释后, 将0.5 μL的上游引物、0.5 μL的下游引物和5 μL的2×SYBR qPCR Mix(艾德莱)混匀后于CFX ManagerTMSoftware 3.1(Bio-Rad)检测基因mRNA表达。反应条件: 95℃预热10min; 95℃ 5s, 60℃ 15s, 共40个循环, 每个循环均采集荧光。样品设置2个技术重复。用2−∆∆Ct方法[26]计算mRNA的相对表达。
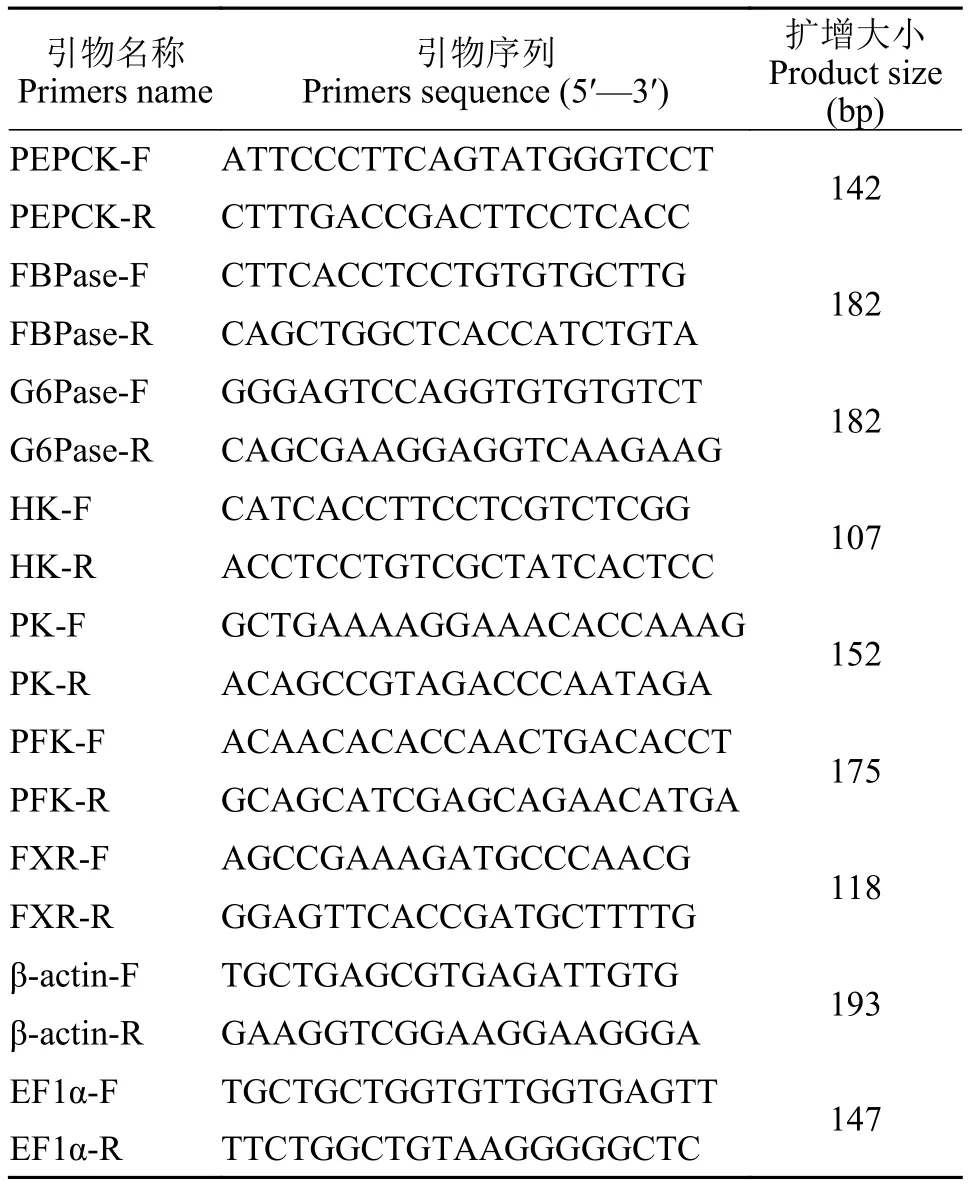
表2 本研究相关引物Tab. 2 Primers used in this study
1.5 肠道菌群分析
从每个处理中随机选择5尾大口黑鲈的肠道内容物(>0.5 g)送至上海派森诺生物科技股份有限公司,使用正向引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和反向引物806R(5′-GGACTACHVGGGTWTC TAAT-3′)扩增肠道细菌16S rRNA基因的V3—V4可变区。对Illumina测序获得的原始数据初步筛查后,使用QIIME2 dada2分析流程对获得的序列进行序列质控、去噪、连接、去除嵌合体获得以100%相似度聚类的ASVs(Amplicon sequence variants)。根据样品ASVs与NCBI数据库(ftp://ftp.ncbi.nih.gov/blast/db/)的相似性对比结果进行物种注释。根据分类学统计结果分析肠道微生物的群落组成和结构, 使用R语言ggplot2包进行α多样性分析, 计算Chao1、Shannon和Simpson指数, 分析每组组内单个样本肠道菌群的多样性, 其中Chao1反应菌群的丰富度[27], Shannon和Simpson指数反应菌群的多样性[28,29]。使用R语言ape包等计算各样本的距离矩阵进行主坐标分析(Principal coordinates analysis, PCoA)的β多样性分析, PCoA分析中的weighted UniFrac距离分析[30]用于表征这两个样本间的群落差异。以上操作通过派森诺生物科技股份有限公司的云平台分析完成。大口黑鲈肠道菌群测序原始数据上传至NCBI/SRA数据库, 登录号为PRJNA705573。
1.6 数据分析
本实验所有的数据分析使用IBM SPSS Statistics 23软件, 用平均值±标准误(Mean±SE)表示。对照组和胆酸钠组之间的差异分析使用Student’st检验分析,P<0.05表示差异显著。
2 结果
2.1 饲料添加胆酸钠对大口黑鲈生长和体成分的影响
在8周的养殖实验结束后, 为探究胆酸钠对大口黑鲈生长性能和体成分的影响, 本研究分别检测增重率、肥满度、躯壳比、脏体比、肝体比和脂体比6种生长性能指标, 和检测水分、粗蛋白、粗脂肪和粗灰分4种体成分指标。结果显示, 与对照组相比, 胆酸钠组大口黑鲈的增重率、躯壳比稍有降低, 但没有显著性差异(P>0.05); 而肥满度、脏体比、肝体比和脂体比略微升高, 也没有显著性差异(P>0.05; 表 3)。该结果说明饲料添加300 mg/kg的胆酸钠对大口黑鲈的生长没有显著影响。此外, 饲料补充胆酸钠饲喂大口黑鲈后, 大口黑鲈全鱼的粗灰分降低, 但没有显著差异(P>0.05); 而水分、粗蛋白和粗脂肪增加, 也没有显著性差异(P>0.05; 表 3),该结果说明300 mg/kg的胆酸钠对大口黑鲈的体成分变化未造成显著影响。

表3 饲料添加胆酸钠对大口黑鲈生长和体成分的影响Tab. 3 Effects of sodium cholate supplementation on the growth and body composition of largemouth bass
2.2 饲料添加胆酸钠对大口黑鲈肠道菌群的影响
对照组和胆酸钠组大口黑鲈肠道内容物16S rRNA测序共获得631124条ASVs序列, 每个样本测序量超过35000条, 平均长度约为418 bp。与对照组相比, 胆酸钠组肠道菌群的3种α多样性指数Chao1指数、Shannon指数和Simpson指数略有下降, 但没有显著性差异(图 1A)。该结果表明胆酸钠对大口黑鲈肠道菌群在α多样性水平上的物种丰富度和多样性没有显著影响。基于ASVs的PcoA分析结果显示, PC1为54.3%, PC2为20.4%, 且对照组和胆酸钠组聚集在一起(图 1B)。该结果表明300 mg/kg的胆酸钠对肠道菌群的群落组成的β多样性无显著影响。比较分析对照组和胆酸钠组大口黑鲈肠道微生物的分类学组成, 展示相对丰度最高的10个物种,其余物种的相对丰度合并, 并归为其他(Others)。结果显示, 在门分类水平上, 两组之间的肠道微生物群落组成相似, 肠道优势菌群也较为一致(图 1C)。其中软壁菌门(Tenericutes; 29.62%)、放线菌门(Actinobacteria; 22.21%)、变形菌门(Proteobacteria;18.12%)和梭杆菌门(Fusobacteria; 14.44%)在样本中的相对丰度较高, 这4类优势菌群占肠道菌群的比例为84.39%, 其后依次是拟杆菌门(Bacteroidetes;7.61%)、厚壁菌门(Firmicutes; 4.83%)、疣微菌门(Verrucomicrobia; 1.24%)、异常球菌-栖热菌门(Deinococcus-Thermus; 0.04%)、浮霉菌门(Planctomycetes; 0.04%)和酸杆菌门(Acidobacteria; 0.03%),排名前10的细菌丰度之和占肠道菌群的比例超过98%, 这与我们观察到的肠道菌群的α多样性和β多样性结果一致, 两组之间的肠道菌群组成也没有显著性差异。综上, 饲料添加300 mg/kg的胆酸钠不能显著改变大口黑鲈肠道菌群的组成、物种丰富度和多样性。

图1 肠道微生物α (A)和β多样性分析(B)和分类学组成分析(C)Fig. 1 Intestinal microbial α (A) and β diversity analysis (B) and composition (C)
2.3 饲料添加胆酸钠对大口黑鲈糖原合成和血糖的影响
为探究胆酸钠对大口黑鲈糖代谢的影响, 本研究检测了大口黑鲈糖原和血糖的含量。结果显示,饲喂300 mg/kg胆酸钠的大口黑鲈与对照相比, 每克组织中肝糖原的含量显著增加(P<0.05; 图 2A),但肌糖原的含量几乎没有变化(P>0.05; 图 2B); 并且血糖含量呈现降低的趋势, 但无显著差异(P>0.05; 图 2C)。此外, 肝和肌肉的PAS染色切片结果显示, 胆酸钠组大口黑鲈肝中糖原染色比对照组更加明显, 而肌肉中糖原染色两组间无明显差异, 这与肝糖原和肌糖原的含量测定结果相似(图 2D)。以上结果表明, 饲料添加300 mg/kg胆酸钠可以增加肝糖原合成, 但对肌糖原的合成和血糖没有显著影响。
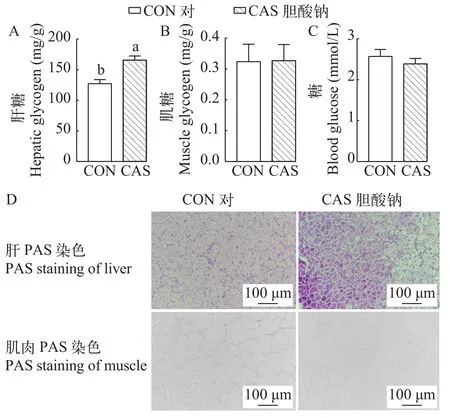
图2 饲料添加胆酸钠对大口黑鲈糖原合成和血糖的影响Fig. 2 Effects of sodium cholate on glycogen synthesis and blood glucose of largemouth bass
2.4 饲料添加胆酸钠对大口黑鲈糖原合成酶和糖原分解酶a酶活性的影响
探究影响糖原含量的两个关键酶的酶活, 包括糖原合成途径中的关键酶糖原合成酶和糖原分解途径中的关键酶糖原磷酸化酶a。结果显示, 与对照组相比, 胆酸钠组大口黑鲈肝中糖原合成酶的活性显著增加(P<0.05; 图 3A), 但糖原磷酸化酶a的酶活没有显著变化(P>0.05; 图 3B)。同样, 肌肉糖原合成酶和糖原磷酸化酶a的酶活没有显著差异(P>0.05; 图 3A和3B)。该结果说明饲料添加300 mg/kg胆酸钠可以增强肝糖原合成酶的活性, 从而增加肝糖原的合成。
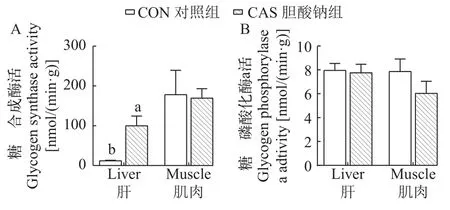
图3 饲料添加胆酸钠对大口黑鲈糖原合成酶和糖原磷酸化酶a活性的影响Fig. 3 Effects of sodium cholate on glycogen synthase and glycogen phosphorylase a activities of largemouth bass
2.5 饲料添加胆酸钠对大口黑鲈糖异生的影响
为探究单一类型胆酸钠的添加是否可以调节大口黑鲈的糖异生, 检测糖异生途径中3个关键酶基因的mRNA表达, 包括磷酸烯醇丙酮酸羧化激酶(Phosphoenolpyruvate carboxykinase, PEPCK)、果糖-1,6-二磷酸酶(Fructose-1,6-bisphosphatase, FBPase)和葡萄糖-6-磷酸酶(Glucose-6-phosphatase,G6Pase)。结果显示, 与对照组相比, 日粮添加300 mg/kg胆酸钠可促进肝糖异生途径中PEPCK基因的表达(P>0.05), 并显著促进FBPase和G6Pase基因的表达(P<0.05; 图 4A)。在肌肉组织中, 胆酸钠可促进FBPase和G6Pase基因的表达, 降低PEPCK基因的表达, 但对肌肉糖异生基因的表达无显著影响(P>0.05; 图 4B)。综上, 饲料添加300 mg/kg胆酸钠能够显著增强肝的糖异生, 但不影响肌肉的糖异生。

图4 饲料添加胆酸钠对大口黑鲈糖异生的影响Fig. 4 Effects of sodium cholate on gluconeogenesis of largemouth bass
2.6 饲料添加胆酸钠对大口黑鲈糖酵解的影响
糖酵解也是生物体糖代谢的关键代谢途径,3个关键酶为己糖激酶(Hexokinase, HK)、丙酮酸激酶(Pyruvate kinase, PK)和磷酸果糖激酶(Phosphofructokinase, PFK)。研究显示, 与对照组相比,添加300 mg/kg的胆酸钠, 显著降低大口黑鲈肝中糖酵解关键酶PK基因的表达(P<0.05), 降低PFK基因的表达(P>0.05), 但使HK基因的表达量略微升高(P>0.05; 图 5A)。在肌肉组织中,PK、HK和PFK基因的表达量均呈现降低趋势, 其中HK基因的表达量显著降低(P<0.05; 图 5B)。总体而言, 300 mg/kg的胆酸钠降低大口黑鲈肝和肌肉中的糖酵解。

图5 饲料添加胆酸钠对大口黑鲈糖酵解的影响Fig. 5 Effects of sodium cholate on glycolysis of largemouth bass
2.7 饲料添加胆酸钠对胆汁酸受体FXR基因表达的影响
为探究胆酸钠的添加是否影响大口黑鲈体内胆汁酸受体FXR基因的表达, 检测肝和肌肉中FXR的表达量。结果显示, 饲料添加300 mg/kg的胆酸钠显著降低大口黑鲈肝中FXR基因mRNA的表达(P<0.05), 对肠组织中FXR基因的表达量无显著影响(P>0.05; 图 6)。结果说明, 胆酸钠可以调节肝中FXR受体的表达。

图6 饲料添加胆酸钠对胆汁酸受体FXR表达的影响Fig. 6 Effects of sodium cholate on bile acids receptor FXR of largemouth bass
3 讨论
3.1 饲料添加胆酸钠对大口黑鲈生长性能和体成分的影响
已有研究表明, 混合胆汁酸作为饲料添加剂在适宜浓度下可改善鱼类的生长性能。例如, 0.15 g/kg的混合胆汁酸(猪脱氧胆酸、鹅脱氧胆酸和猪胆酸)显著提高吉富罗非鱼的增重率和肥满度等, 而1.35 g/kg(过量)胆汁酸抑制其生长[3]。同样, 在大口黑鲈的研究中, 饲料添加混合胆汁酸(猪脱氧胆酸、鹅脱氧胆酸和猪胆酸)0到600 mg/kg, 中间浓度300 mg/kg是促进大口黑鲈生长的最佳剂量[7]。此外, 多项研究表明300 mg/kg的混合胆汁酸可显著促进鱼类生长。例如, 饲料中添加300 mg/kg混合胆汁酸也可显著提高齐口裂腹鱼的增重率和特定生长率等[10]。因此, 本研究以300 mg/kg作为参考剂量, 探究胆酸钠对大口黑鲈的生长是否有促进作用, 但是结果表明饲料添加300 mg/kg的胆酸钠对大口黑鲈的生长指数(增重率、肥满度、躯壳比、脏体比、肝体比和脂体比)均无显著影响, 并且胆酸钠未显著改变大口黑鲈的体成分组成(水分、粗蛋白、粗脂肪和粗灰分)。推测胆酸钠作为单一种类的胆汁酸, 不能够像混合胆汁酸一样协同发挥促生长作用。此外, 市面上常见的胆汁酸类饲料添加剂主要是猪胆酸、猪脱氧胆酸和鹅脱氧胆酸的混合物[3,7], 而不同的胆汁酸种类可能具有不同的功能。例如, 在水产动物的研究中, 膳食补充单一类型的胆汁酸TCAS也不能改善大西洋鲑的生长性能[20]。因此, 胆酸钠是否促进鱼类生长, 还需要设置多个浓度的胆酸钠添加实验提供更为全面的数据, 在后续的实验中, 我们将对多个浓度梯度的胆酸钠功能进行探究, 评估其对鱼体生长性能和体成分的影响。
3.2 饲料添加胆酸钠对大口黑鲈肠道菌群的影响
胆汁酸可影响肠道菌群的结构和组成, 肠道微生物的结构和组成又会影响宿主的能量吸收和代谢稳态[2]。已有研究表明, 胆汁酸作为饲料添加剂可以改变鱼类肠道菌群的组成。例如, 猪源混合胆汁酸可以降低欧洲鳗鲡肠道菌群的多样性, 增加厚壁菌门和拟杆菌门等的丰富度, 降低变形菌门、梭杆菌门和放线菌门等的丰富度[14]。混合胆汁酸(猪脱氧胆酸、鹅脱氧胆酸和猪胆酸)降低草鱼肠道菌群的多样性, 增加拟杆菌门、梭杆菌门等和螺旋体门的相对丰度, 减少厚壁菌门和放线菌门的相对丰度[13]。此外, 研究还发现饲料添加单一胆汁酸牛磺石胆酸钠可以增加草鱼肠道中变形杆菌和厚壁菌的相对丰度, 降低梭杆菌的相对丰度[19]。在本研究中, 对照组和胆酸钠组的肠道微生物群落组成类似,肠道优势菌与先前研究相比, 也主要为软壁菌门、放线菌门、变形菌门和梭杆菌门等, 但α多样性指数Chao1、Shannon和Simpson指数及β多样性PcoA分析结果均无显著差异, 该研究说明300 mg/kg胆酸钠并不能显著改变大口黑鲈肠道菌群组成。已有研究发现某些肠道细菌如拟杆菌具有庞大的多糖代谢基因, 能够分解宿主无法消化吸收的碳水化合物以及动物性多糖[31], 厚壁菌门可使多糖在牛蛙体内发酵[32]。然而本研究中大口黑鲈肠道拟杆菌门和厚壁菌门的丰富度并没有发生显著性的改变,说明300 mg/kg的胆酸钠对鱼体糖代谢的调节可能与肠道菌群没有直接关系。
3.3 饲料添加胆酸钠对大口黑鲈糖代谢的影响
胆汁酸可调节生物体的糖原合成、糖异生和糖酵解等糖代谢过程并维持血糖稳定。在本研究中, 胆酸钠可显著促进大口黑鲈肝糖原的合成, 增加肝中糖原合成酶GCS的活性, 对肝中糖原分解酶GPa的活性没有显著影响, 这与哺乳动物中发现胆酸可促进小鼠肝糖原合成的情况类似[33,34]。此外,本研究发现, 胆酸钠可显著促进肝脏糖异生, 而该研究与鹅脱氧胆酸抑制小鼠肝脏糖异生[35]和混合胆汁酸(猪脱氧胆酸、鹅脱氧胆酸和猪胆酸)抑制大口黑鲈肝糖异生[7]结果相反。推测原因可能为不同种类的胆汁酸具有不同的功能。已有研究发现, 鹅脱氧胆酸可抑制小鼠肝脏糖酵解[36], 同样, 本研究发现胆酸钠也可抑制大口黑鲈肝和肌肉糖酵解。综上, 该研究结果表明胆酸钠可以促进大口黑鲈肝脏糖原合成和糖异生并抑制肝和肌肉糖酵解。
已知胆汁酸主要与肝和肠组织中的FXR作用调节生物体的糖代谢, 如哺乳动物中的研究表明胆酸可激活小鼠肠FXR最终促进肝糖原合成[33,34], 鹅脱氧胆酸可激活小鼠肝FXR抑制糖异生和糖酵解[35,36]。然而在本研究中, 检测大口黑鲈肝和肠中FXR的表达发现, 饲料添加300 mg/kg的胆酸钠显著抑制肝中FXR基因的表达, 对肠中FXR基因的表达没有显著影响。该研究结果与小鼠中FXR的激活相反, 分析其可能的原因为FXR在进化过程中, 由于从其配体结合结构域(Ligand binding domain, LBD)中缺失序列导致了FXR的胆汁酸配体特异性[37], 从而使不同胆汁酸对于不同种类的FXR的调节结果不同。比如在水生动物猥白鳐(Leucoraja erinacea)的研究中就发现与人的FXR相比, 猥白鳐FXR对胆汁酸的感应能力较弱[37]; 此外日本青鳉(Oryzias latipes)2个不同亚型的FXR显示出对C24胆汁酸的不同应答效果[38]。
4 结论
本研究探讨了饲料添加300 mg/kg的胆酸钠对大口黑鲈生长和糖代谢的影响。结果表明300 mg/kg的胆酸钠不能有效提高大口黑鲈的生长性能和体指数, 不改变肠道菌群组成, 但可能通过抑制肝FXR基因的表达实现对大口黑鲈糖代谢的调节, 通过促进大口黑鲈肝糖异生, 抑制肝和肌肉的糖酵解,并促进肝糖原合成。该研究表明, 胆酸钠虽然可调节大口黑鲈的糖代谢, 但作为饲料添加剂在水产促生长等的应用上还需设置多个浓度梯度系统评估。
