CD1d在小鼠皮肤移植排斥反应中的作用及机制研究①
2022-08-30许相范徐显辉叶承祖林艳丽
许相范 徐显辉 叶承祖 林艳丽
(中国人民解放军陆军第七十三集团军医院病理科,厦门 361003)
器官移植术后免疫抑制治疗是临床上必不可少的措施,但移植免疫排斥反应复杂多样,难以达到长期疗效。因此,挖掘精准有效的分子免疫调节疗法是保护移植器官长期存活、维持其功能的现代医疗模式。同种异体移植免疫排斥反应是由受体T细胞通过自身抗原受体(TCR)直接、间接或半直接识别供体抗原而引起的。在这个过程中参与抗原递呈细胞(APC)、细胞因子和调节性T/B(T/Breg)细胞,并决定受体排斥还是接受移植物的关键作用[1-2]。
本研究旨在探讨CD1d 在小鼠皮肤移植排斥反应中的免疫调节作用及其机制。CD1d 是啮齿类动物特有的非多态性脂质抗原递呈分子,可为NKT 细胞提呈磷酸化和糖肽类脂质抗原。皮肤的皮下组织主要由纤维脂肪组织所组成,因此在皮肤移植模型中自然富于脂类抗原适于CD1d分子功能研究[3]。Ⅰ型NKT(ⅠNKT)是CD1d 限制性T 细胞中研究最深入的亚群,可识别脂类抗原,活化后表现出直接细胞毒作用,且大量分泌多种细胞因子,在Th1 或Th2 为主导的免疫反应中起调节作用[4]。因此调节以CD1d-ⅠNKT 为轴的免疫反应进而诱导移植物的免疫耐受是有望实现的。
1 材料与方法
1.1 材 料 实 验 用 小 鼠 C57BL/6(B6,H-2b)、BALB. B(BALB/c,H-2b)、BALB/c(H-2d)以及相关背景的CD1d 缺失小鼠(标为CD1d-/-),均购自Jackson实验室,并在SPF级别动物实验室喂养并开展实验。用于实验的小鼠均为出生第6~8 周以及体质量20~25 g 的雌性小鼠。检测小鼠细胞因子的抗IL-4(11B11)、抗 IFN-γ(R46-A2)和抗 NK1.1(PK136)抗体;用于流式细胞仪(FACS)染色的抗体,如PE 或Cych-抗 CD4、FITC 或 PE-抗 CD8、PE-抗 NK1.1、FITC-抗CD1d,Cych-TCR;大鼠抗小鼠IL-10 阻断单抗以及大鼠IgG1单抗,以上抗体均购自PharMingen。α-GalCer 溶解于含有 0.5% 吐温-20 的 PBS 中,浓度为220 μg/ml,备用。
1.2 方法
1.2.1 小鼠皮肤移植模型的建立 如文献[5]所述,供体小鼠尾部皮肤移植到受体小鼠左侧胸背部。脱颈处死供体小鼠后切取鼠尾并剥离尾部全层皮肤,将其切成一片5 mm×6 mm 的皮片待用。供者小鼠用3-溴乙醇麻醉后在左侧胸背部移植区常规脱毛、消毒后用皮肤剪切除皮肤做植皮床基;移植后7 d 取下植皮固定绑带,并每天观察移植皮片存活状态,持续观察60 d 以上;当90%以上的移植皮肤组织坏死时,判定为完全排斥。
实验一般分组:供体雌性BALB.B CD1d-/-小鼠的皮肤移植到受体雌性B6 CD1d-/-小鼠的胸背部,作为基因缺失实验组;供受体均为雌性BALB. B CD1d-/-小鼠,作为基因缺失对照组;供体雌性BALB. B 小鼠的皮肤移植到受体雌性B6 小鼠的胸背部,作为野生型实验组;供受体均为雌性B6 或BALB.B小鼠,作为野生型对照组;每组5只小鼠。
在CD1d 对小鼠植皮存活时间的影响实验中具体分组:第一组,基因缺失实验组;第二组,基因缺失对照组;第三组,野生型实验组;第四组,野生型对照组。
在CD1d 与小鼠皮肤移植物寿命相关性实验中具体分组:第一组,未接受手术的野生型BALB.B小鼠尾部皮肤,作为阴性对照组;第二组,基因缺失实验组;第三组,基因缺失对照组;第四组,野生型实验组;第五组,野生型对照组。
在CD1d 对引流淋巴结NKT 细胞活化和增殖的影响实验中具体分组:第一组,CD1d 基因缺失对照组;第二组,CD1d 基因缺失实验组;第三组,野生型对照组;第四组,野生型实验组。
在CD1d 对受体细胞因子水平的影响实验中具体分组:第一组,基因缺失对照组;第二组,基因缺失实验组;第三组,野生型对照组;第四组,野生型实验组。
在分析CD1d 调节移植物排斥反应的主要机制实验中具体分组:第一组,注射对受体小鼠无影响的抗体IgG1(对照组);第二组,注射抗IL-10 单克隆抗体(IL-10 阻断组);第三组,给受体小鼠移植同种野生型脾淋巴细胞;第四组,α-GalCer 治疗组(NKT细胞激活组)。
部分实验小鼠脱颈处死,并采集相关组织或器官用于分析。α-GalCer受试的受体小鼠则在从移植前7 d 开始至移植后7 d 每隔3 d 腹腔注射2-Galter 6 μg/次。IL-10阻断实验时给受体小鼠从移植前7 d开始至移植后7 d每隔3 d腹腔注射50 μg抗IL-10抗体悬液。
1.2.2 小鼠皮肤移植后NKT 细胞募集的检测 移植后第7 天受试小鼠脱颈处死,切取引流淋巴结和/或移植皮片,并立即液氮冷冻。用Trizol 试剂(Invitrogen,Carlsbad,California)分离总RNA,用Nanodrop分光光度计测定浓度,取2 μg总RNA并按照试剂盒说明书进行cDNA 的合成和PCR 扩增。Vα14 基因相应的引物:正向5′-CTAAGCACAGCACGCTGCACA-3' 和 反 向 5′-AGGTATGACAATCAGCTGAGTCCC-3';GAPDH 基因相应的引物:正向5′-CCCACTAACATCAAATGGGG-3' 和 反 向 5′-ATCCACAGTCTTCTGGGTGG-3'。PCR反应设计为95 ℃下45 s,62 ℃下45 s,72 ℃下45 s;循环30次。
1.2.3 流式细胞术检测小鼠引流淋巴结NKT 细胞受试小鼠脱颈处死,切取引流淋巴结并研磨和尼龙网过滤制备成单细胞悬液,用PBS 洗涤,用0.5%牛血清蛋白PBS 中重新洗涤后,根据说明对细胞进行荧光标记抗体染色(PE-抗NK1.1 和Cych-TCR),并用流式细胞仪(BD Biosciences)分析。
1.2.4 实时荧光定量PCR 分析 取实验小鼠腋下淋巴结并按方法1.2.2 提取总RNA,将1 μg 总RNA反向转录成cDNA。再按照试剂盒说明书各取cDNA,正反引物和靶探针制作PCR 反应体系。使用序列检测系统(Agilent Mx3005P qPCR System,USA)检测。以 18S 核糖体 RNA 为内参基因,并用 2-ΔΔCt×1010方法计算目标细胞因子mRNA表达的相对水平[6]。IFN-γ基因相应的引物及探针:正向5'-AGCAACAGCAAGGCGAAAA-3',反向 5'-CTGGACCTGTGGGTTGTTGA-3',探针FAM 5'-CCTCAAACTTGGCAATACTCATGAATGCATCC-3' TAMRA;IL-4:正向5'-CATCGGCATTTTGAA-3',反 向 5'-CGTTTGGCACATCCATCTCC-3',探针为 FAM 5'-CACAGGAGAAGGGACGCCATGCA-3' TAMRA;IL-10:正向5'-TTTGAATTCCCTGGGTGAGAA-3',反向 5'-ACAGGGGAGAAATCGATGACA-3',探针为 FAM 5'-TGAAGACCCTCAGGATGCGGCTG-3' TAMRA;TGF-β:正向5'-GCAACATGTGGAACTCTACCAGAA-3',反向 5'-GACGTCAAAAGACAGCCACTCA-3',探针为FAM 5'-ACCTTGGTAACCGGCTGCTGACCC-3'TAMRA;18S rRNA:正向5'-CGGCTACCACATCCAAGGAA-3',反向5'-GCTGGAATTACCGCG-3'GCT,探针为VIC 5'-TGCTGGCACCAGACTTGCCCTC-3'TAMRA。
1.2.5 脾淋巴细胞的移植实验 无菌条件下切取野生型B6 小鼠的脾脏,并研磨和过筛获取细胞悬液,利用Percoll 浓度梯度法提取单核淋巴细胞,并将细胞稀释备用。小鼠皮肤移植前处理,即首先利用低剂量(600 rad)的辐射方法抑制受体B6 CD1d-/-小鼠体内淋巴细胞活性后,第2 天静脉注射野生型B6 小鼠的1.2×108个脾淋巴细胞用于植皮实验,在SPF条件下饲养6 d后开展皮肤移植实验。
1.3 统计学分析 采用统计学软件SPSS23.0处理数据,数据以表示。当两组在同一时间点进行比较时均采用Studentt检验,在同一时间点多组比较时采用单因素方差分析(ANOVA)。P<0.05 表示差异有统计学意义。
2 结果
2.1 观察CD1d 基因缺失对小鼠植皮存活时间的影响 为探讨CD1d 分子在移植免疫排斥反应作用,利用野生型或CD1d 基因缺失的BALB. B 和B6小鼠建立同种异体皮肤移植模型。实验结果如图1所示,基因缺失对照组和野生型对照组的移植皮片完全存活,且存活时间均超过60 d。野生型实验组在移植后第18天开始出现移植皮片皮肤皱褶消失、发白、失去光泽等免疫排斥反应,其移植皮片平均存活时间为(24.4±1.1)d。而CD1d 基因缺失实验组的移植皮片平均存活时间为(39.2±4.8)d,与野生型相比显著延长(P<0.001)。另外,BALB/c 小鼠雄性Y抗原相关的皮肤移植模型实验中也得到同样的结果,如图2所示CD1d基因缺失时移植皮片的平均存活时间为(48.6±2.2)d,比野生型[(22.0±2.4)d]显著延长(P<0.001)。
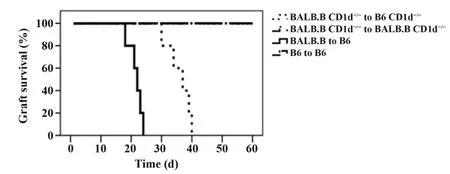
图1 同种异体移植物存活曲线Fig.1 Allografts survival curve of skin

图2 雄性Y抗原相关移植物的存活曲线Fig.2 Y-antigen related grafts survival curve
2.2 探讨CD1d延长小鼠皮肤移植物寿命的机制各实验组小鼠接受皮肤移植手术后第7天切取其移植皮片,采用RT-PCR 方法检测NKT 细胞所特异的Vα14 基因表达,结果如图3 所示,阴性对照组正常皮肤中未检测到NKT 细胞特异性Vα14 基因表达,而在基因缺失实验组、野生型实验组和野生型对照组中均能明显检测到。基因缺失对照组Vα14 基因表达明显弱于其他3个移植实验组。

图3 移植物中NKT细胞的募集情况Fig.3 Recruitment of NKT cells in grafts
2.3 探讨皮肤移植术后CD1d 对引流淋巴结NKT细胞活化和增殖的影响 皮肤移植后第7天切取受体小鼠腋窝淋巴结,应用流式细胞仪定量分析皮肤移植术后受体小鼠腋窝淋巴结NKT 细胞的增殖情况,结果如图4 所示,CD1d 基因缺失实验组的引流淋巴结内NKT 细胞比例与野生型实验组相比显著降低(P<0.05);另外,CD1d 基因缺失对照组的NKT细胞比例与野生型对照组相比显著降低(P<0.05)。

图4 引流淋巴结NKT细胞增殖率Fig.4 Proliferation rate of NKT cells in draining lymph nodes
2.4 检测CD1d 对受体细胞因子水平的影响 移植后第7 天,检测受体小鼠腋窝引流淋巴结内相关细胞因子 mRNA 的表达,结果如图 5 所示,CD1d 基因缺失实验组与野生型实验组相比,细胞因子IL-10和TGF-β 水平均显著升高(P<0.05 和P<0.001);反而,IFN-γ 和IL-4 水平则显著降低(均为P<0.05)。另外两个对照组对细胞因子无明显影响。

图5 受体小鼠腋下淋巴结相关细胞因子mRNA表达Fig.5 Relative mRNA expressions of cytokines in axillary lymph nodes of recipient mice
2.5 证实CD1d调节移植物排斥反应的主要机制前面研究结果表明CD1d 基因缺失可抑制NKT 细胞活化,而增加 IL-10 和 TGF-β 表达,推测这些与移植物的延寿相关。为了证实上述观点,建立小鼠基因缺失实验组模型:即供体均为BALB.B CD1d-/-小鼠,受体均为B6 CD1d-/-小鼠,每组5 只小鼠。受试的受体小鼠从移植前7 d至移植后7 d,每隔3 d腹腔注射相应试剂或抗体悬液,结果如图6所示,给受体小鼠移植同种野生型脾淋巴细胞组和NKT 细胞激活组的移植皮片存活时间比对照组显著缩短(P<0.01和P<0.05)。IL-10 阻断组尽管与对照组相比差异无统计学意义(P>0.05),但亦可观察到移植物生存时间的缩短,这一结果并不排除小样本相关的误差。
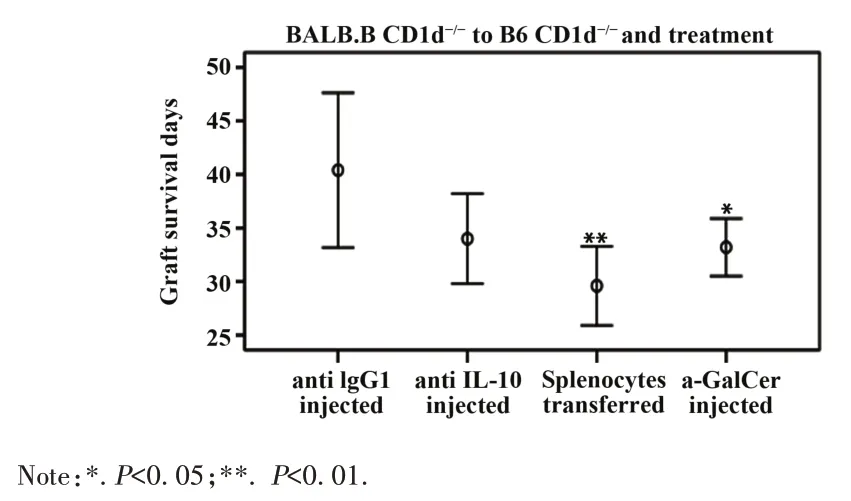
图6 治疗后移植皮片的存活时间Fig.6 Days of grafts survival after treatment
3 讨论
众所周知,器官移植是一项重要的临床治疗手段,但机体对移植物的排斥反应是极其复杂难以控制的医疗问题。器官移植后对移植物的排斥反应可分为早期急性排斥反应和晚期适应性免疫反应,前者被认为决定后者,即排斥还是免疫耐受的关键一环。急性排斥反应是由供体器官的获取、保存以及植入等一系列过程中,组织细胞的损伤所释放的危险信号触发受体的先天性免疫系统而启动。
本研究旨在观察CD1d 对小鼠皮肤移植急性排斥反应的影响,并探讨其作用机制。CD1d是一种非多态性MHCⅠ类家族蛋白。CD1d 作为一种抗原递呈分子为NKT 细胞提供脂类抗原,以此激活和增殖[7]。在啮齿动物中,CD1d 是唯一的脂类抗原递呈分子,通常在成熟的T 细胞以外的多种淋巴造血系统细胞中表达。最引人注目的是由APC 表达,此外脂肪细胞也广泛表达。因此,利用富含脂类抗原的小鼠皮肤移植实验是研究CD1d分子的最佳选择。
本研究结果BALB.B(H-2b)小鼠尾部全层皮肤移植到B6(H-2b)小鼠胸背部的动物模型中,当CD1d基因缺失时,移植皮片平均存活时间与野生型相比显著延长,说明CD1d 基因的缺失导致移植皮片的排斥反应减弱,有利于移植物的延寿。在另一个配对实验中也可以观察到同样的结果,即雌性BALB/c(H-2d)小鼠对雄性Y 抗原相关的移植免疫排斥反应中,当CD1d 基因缺失时移植物平均存活时间明显长于野生型。本实验在设计上考虑到组织相容性复合物抗原性的大小,即MHCⅠ和/或MHCⅡ完全不一致时,移植物的抗原性太强,移植物存活时间过短不便于观察靶基因的功能。因此,选择了小鼠组织相容性复合物(H-2)一致而次要组织相容性复合物不同的小鼠做皮肤移植实验。
LI 等[8]在小鼠肾脏缺血再灌注损伤实验中,发现用单克隆抗体阻断CD1d 时明显减轻肾损伤,其保护机制与阻断CD1d 介导的NKT 细胞活化和细胞因子 IFN-γ 分泌有密切相关。还认为分泌 IFN-γ 的主要细胞为GR-1+CD11b+中性粒细胞所组成,但也含有 CD1d 限制性 NKT 细胞。LAPPAS 等[9]研究者在肝脏再灌注损伤的实验结果,也证实了CD1d 介导的糖脂递呈给NKT 细胞,使其激活并急速产生IFN-γ 是肝损伤的主要原因。本研究的结果同样证实了类似的现象,在小鼠皮肤移植模型实验中当CD1d基因缺失时,移植物的生存时间明显长于野生型,而且其细胞因子IFN-γ 的表达明显低于野生型对照组。由此,推理阻断CD1d-NKT细胞为轴的生物学效应时,NKT 细胞的直接细胞毒作用和细胞因子风暴受到阻尼是保护移植物使其延寿的主要机制。
CD1d 是 NKT 细胞的抗原递呈分子,而 NKT 细胞是一种进化的先天性免疫细胞样T 淋巴细胞亚型。其具有与NK 细胞相同的表型和直接的细胞毒作用,并表达高度特异的T 细胞受体。根据其TCR表达可进一步分为Ⅰ型NKT 细胞和Ⅱ型NKT 细胞[10]。然而,最近研究表明存在许多不同功能的NKT 细胞亚群。FARR 等[11]通过分子和功能的比对方法证明了CD1d 非依赖性NKT 细胞群的存在。EBERL 等[12]也发现了 Vα14 NKT 细胞一样表达NK1.1 的一类微量淋巴细胞群体,分为CD1d 依赖性和CD1d 非依赖性Vα14 NKT 细胞。本实验结果在所有接受手术的移植物中都能检测到NKT 特异性 Vα14 信号 RNA 的表达,包括 CD1d 基因缺失组;并且CD1d 基因缺失导致引流淋巴结内NKT 细胞比例显著减少。早在 1986 年 MOSMANN 等[13]提出了移植免疫相关的免疫偏离学说,即当Th1 偏离Th2时,移植物产生免疫耐受,反之产生免疫排斥反应,这些免疫偏离现象又受相关细胞因子的调节。
皮肤移植免疫排斥反应的过程中,普遍认为APC 介导的免疫反应主要在次级淋巴器官中启动。在此过程中,APC 通过MHC、CD1d 等分子将识别的抗原提呈在细胞表面,使TCR 受体识别引起激活和扩增相应的免疫细胞,并迅速释放大量细胞因子[14]。本实验结果表明,当BALB.B 小鼠为供体B6小鼠为受体进行皮肤移植实验时,手术创伤应激和同种异体抗原诱导下,受体野生型小鼠产生正常的免疫排斥反应,此时NKT 细胞数量以及细胞因子IFN-γ 和 IL-4 分泌均增加;然而 CD1d 基因缺失时NKT 细胞比例减少,细胞因子 IL-10 和 TGF-β 均明显增高。因此,CD1d抑制移植物排斥反应的机制是通过阻尼NKT 细胞的活化和增殖,并且通过CD1d-NKT 细胞为轴调控其他各种免疫细胞分泌细胞因子来实现。这一推理在脾淋巴细胞过继免疫、α-GalCer治疗和单克隆抗体阻断IL-10中得到证实。众所周知,IFN-γ 作为一种促炎症细胞因子,主要由Th1细胞、活化的APC以及NKT等细胞分泌,在同种异体免疫反应中促进排斥反应;而IL-10和TGF-β是有利于移植物免疫耐受的抗炎症细胞因子[15-16]。杜文静等[17]也认为 IL-10 和 TGF-β 作为抑制型细胞因子,在RA 疾病过程中重要的细胞因子,它们还可能介导免疫耐受和抑制过度免疫反应。
总之,CD1d 分子通过CD1d-NKT 细胞为轴的免疫反应,抑制NKT 细胞的激活和细胞因子微环境的改变,在器官移植早期免疫排斥反应中起到举足轻重的作用。早期免疫排斥反应又决定着晚期的适应性免疫反应,即决定器官移植成败的结局。因此,本文基于传统的免疫抑制疗法,以CD1d 分子为靶标,开发新型有效的生物药物提供一定的理论依据。
