MEK1/2抑制剂曲美替尼对体外多房棘球蚴原头节的作用研究
2022-08-30李德伟侯昕伶张传山
李德伟,施 阳,李 亮,侯昕伶,王 慧, 张传山,李 静
泡型棘球蚴病(alveolar echinococcosis, AE)为一种慢性地方性寄生虫病,主要寄生于肝脏,呈浸润性生长[1-2]。据报道,未治疗的AE患者10~15年后死亡率高达90%[1]。多年来,AE患者主要采用手术与药物相结合的治疗方式控制疾病进展与复发,但使用常用药物阿苯达唑与甲苯达唑治疗只抑制寄生虫生长而非有效杀死寄生虫,同时,部分患者还会产生严重不良反应,如肝毒性[2-4]。产生肝毒性的患者只能被迫中断药物治疗,导致后续复发率相对较高[3]。因此,辅助手术治疗的药物亟待改进。
经研究,多房棘球绦虫(Echinococcusmultilocularis,Em)在肝脏寄生,其发育微环境与宿主表皮生长因子(epidermal growth factor, EGF)有关[5];当宿主EGF与Em的表皮生长因子受体(epidermal growth factor receptor, EGFR)结合,将激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路之一的MEK/ERK信号通路,并依次通过激活MAPK激酶激酶(MAPK kinase kinase,MEKK)、MAPK激酶(MAPK kinase,MEK)及MAPK的方式,驱动信号由细胞表面传递到细胞核内,调节细胞增殖、分化与应激反应,进而加速虫体生长发育[4-7],推测抑制该通路可抑制虫体的发育进程。因此,本试验以1、50、100 μmol/L的MEK1/2抑制剂曲美替尼(trametinib)进行体外干预多房棘球蚴原头节实验,从虫体形态、活性和表面超微结构观察曲美替尼的作用效果,并辅以同源建模,讨论基于曲美替尼靶向治疗的可能性。
1 材料与方法
1.1 材 料
1.1.1 原头节 取自新疆医科大学动物实验中心提供的感染Em的沙鼠肝脏。
1.1.2 主要试剂 曲美替尼(GSK-1120212,Batch No.S267309)购自美国Selleck公司。
1.1.3 伦理批准和患者知情同意 该试验获新疆医科大学第一附属医院伦理委员会批准(批准号:20140411-05),不涉及患者知情同意。
1.2 方 法
1.2.1 取材 病灶取自经腹腔注射Em感染3个月的沙鼠模型。分离并研磨病灶后取混合液于离心管,PBS反复清洗病灶研磨后的混合液。
1.2.2 培养 弃上清,加入足量培养基(1%双抗、10% FBS、RPMI 1640),于CO2培养箱中培养3 d后待用。
1.2.3 体外干预 DMSO室温溶解曲美替尼,根据文献[4]的方法建立空白对照组、DMSO组及1、50、100 μmol/L曲美替尼干预组。按照每组3孔,每孔300原头节/200 μL培养液的方式加入96孔板,CO2培养箱中培养3 d、6 d、9 d、12 d,3 d换液1次。
1.2.4 活性检测 取各时间段各组原头节,伊红染色10 min后镜下统计原头节活性情况。
1.2.5 表面超微结构观察 取12 d各组原头节,经成像前处理(固定、脱水、干燥及喷金)后SEM观察原头节表面超微结构。
1.2.6 Em MEK1/2同源建模 从NCBI(https://www.ncbi.nlm.nih. gov/)查询Em的MEK1/2氨基酸序列,Swiss Model(https://swissmodel.expasy.org)进行同源建模,构建Em MEK1/2分子三级结构并根据文献[8-9]的方法比较与人MEK1/2分子的同源性。
1.2.7 统计学方法 数据处理使用SPSS 25.0,分别采用单因素方差分析和配对t检验进行组间和组内差异性比较,检验水准为α=0.05。
2 结 果
2.1 曲美替尼体外干预后原头节活性变化 原头节活性变化及差异性分析见图1及表1。随着干预时间的延长,1 μmol/L曲美替尼干预3 d、6 d、9 d原头节活性并无明显变化,其活性分别为(84.72±0.27)%、(87.32±2.01)%、(85.12±3.64)%;而干预至12 d时,原头节活性(37.82±2.12)%较9 d突然出现转折式下降(t=15.87,P<0.01)。同样,干预6 d时100 μmol/L曲美替尼组原头节活性(2.13±0.10)%较3 d时(10.30±3.82)%下降(t=33.75,P<0.01),干预9 d时50 μmol/L曲美替尼组原头节活性(3.86±3.97)%较6 d时(47.48±3.11)%下降(t=12.22,P<0.01)。随着干预浓度的增加,50 μmol/L与100 μmol/L曲美替尼组干预12 d原头节活性分别为(1.62±0.43)%、(0.00±0.00)%,原头节活性被抑制。虫体活性与作用浓度和时间成反比,且虫体活性被抑制的关键节点随干预浓度的增加而提前。
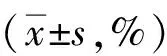
表1 曲美替尼作用原头节存活率Tab.1 Protoscolex survival rate under trametinib treatment
2.2 曲美替尼体外干预后原头节形态变化 空白对照组与DMSO组原头节均为外翻型,顶突结构正常,小钩大部分排列整齐,4个吸盘分布有序,整体结构比例均衡,活性良好(图2A-B);1 μmol/L曲美替尼组原头节部分红染,染色始于头部并蔓延至整个虫体,头尾比例失调,但仍可见部分排列整齐的小钩(图2C);50 μmol/L 曲美替尼组原头节红染数量较1 μmol/L曲美替尼组高,周围散落小钩增加;100 μmol/L曲美替尼组原头节头部结构损坏严重,吸盘结构明显不可见,虫体已无活性(图2D)。随着干预浓度的增加,虫体活性逐渐降低,结构畸形和分解的程度也逐渐加重。
2.3 曲美替尼体外干预后原头节表面超微结构变化 空白对照组虫体结构完整,吸盘对称分布且中央内陷(图3A);DMSO组虫体顶突小钩及体表被微绒毛充分包裹且分布均匀、密集(图3B);100 μmol/L曲美替尼组虫体结构严重损坏,微绒毛聚集,体表暴露,小钩具有脱落趋势且部分顶突与体表严重分离(图3C-D)。
2.4E.multilocularisMEK1/2三级结构预测 NCBI查询Em MEK1/2氨基酸序列登录号分别为FN434110.1和FN434111.1。Swiss Model构建Em MEK1/2分子三级结构(图4)。与人MEK1模板4an2.1.A和MEK2模板1s9i.1.B相比,序列相似度分别为38.43%和49.67%,GMQE值分别为0.58和0.43,表明Em MEK1/2与人MEK1/2分子具有同源性。二者同源性虽然不高,但提示可以设计高特异性针对Em抗原表位的抗体。
3 讨 论
我国在抗包虫病方面近年来已具有一套完善的诊断、手术及术后药物治疗方案,但术后药物的选择目前仍面临诸多难题[10]。在宿主-寄生虫共同进化的过程中,宿主利用自身各种免疫机制去清除寄生虫,虫体则通过自身基因组多样化和逃避宿主的免疫应答形成寄生。研究表明,虫体成功寄生的关键因素与宿主先天免疫功能以及信号通路有关,如MAPK信号通路[11-14]。该通路包括P38 MAPK、JNK与MAPK/ERK等分支,对寄生虫与宿主间的相互作用具有重要意义,如影响细胞分化、增殖、凋亡等功能[11-12]。抑制相应的MAPK信号通路可降低寄生虫的致病性及侵袭能力,如低浓度p38 MAPK抑制剂SB202190在不影响人细胞p38蛋白激酶的活性的同时可有效抑制Em生长发育[14-15];JNK抑制剂SP600125通过抑制JNK信号诱导细粒棘球蚴原头节凋亡[14]。同时,报道发现Em存在的EGFR可与宿主EGF结合,激活EGFR介导的MAPK/ERK信号通路,导致虫体发育迅速[4,16-19]。MEK作为该通路重要的信号分子,将为AE治疗带来新的途径。
Em存在一群多功能干细胞(neoblasts),具有强大的自我更新能力,是Em在宿主体内生长发育需具备的基本条件之一,也是整个生命周期中细胞增殖的唯一来源[16-17]。维持这群细胞的功能需要不断利用细胞外源信号引发内在信号级联反应来实现[16-17]。EGFR作为MEK/ERK信号通路上游调控分子,在干细胞的维持和调节中具有重要作用[16-19]。当虫体EGFR与宿主来源的EGF结合,细胞质酪氨酸激酶被激活并驱动尾部酪氨酸残基磷酸化,诱导生长因子受体结合蛋白2(GRB2)分子复合物到达细胞膜激活RAS,活化的RAS通过磷酸化等激活被募集在细胞膜上的RAF,从而直接调节MEK1/2,导致下游信号ERK1/2磷酸化并进入细胞核调节细胞生长的相关基因转录,使Em迅速增殖[16,19-20]。目前,尚不清楚EGFR/ERK信号促进增殖的作用是Em干细胞的直接反应,还是其分化细胞在宿主EGF刺激下产生第二信号的间接反应[16],仍待进一步研究。
曲美替尼作为高特异性MEK1/2抑制剂,用于肿瘤患者治疗往往产生剂量限制性毒性作用,如皮疹、腹泻甚至中心性浆液性视网膜病变,而剂量低于2 mg/d其毒副作用可被有效控制[21],且对ERK1/2的激酶活性没有抑制作用。实验发现,1 μmol/L(0.123 mg/d)曲美替尼体外作用于Em可破坏虫体结构、影响虫体活性,对原头节活性的抑制作用高于另一种MEK1/2抑制剂(U0126)[4];50、100 μmol/L(6.15 mg/d、12.3 mg/d)体外对虫体活性的抑制作用极强,但该剂量用于临床治疗将产生严重的药物毒性作用[21]。另外,Em感染早期ERK1/2和下游靶点如细胞周期蛋白A(Cyclin A)等激活可促进肝细胞增殖并介导其抗凋亡反应,减少肝组织损伤,但过度激活将导致患者肝脏异常肿大[22],严重危害肝脏功能。综合分析本实验及前期研究结果,提示低剂量曲美替尼治疗可良好抑制虫体活性,且在不影响肝脏自身发挥保护作用的同时,还可有效防止肝脏肿大,为其作为抗Em靶点提供了可靠依据。
程序性死亡受体1(programmed cell death protein 1, PD-1)作为重要的免疫抑制分子,与配体结合将抑制T细胞活化[23]。已有研究表明,其抑制剂联合曲美替尼治疗将协同恢复T细胞功能,增强患者抗肿瘤反应[23]。因此,低剂量曲美替尼与PD-1抑制剂的联合运用可能弥补曲美替尼具有剂量限制性毒性的缺点,这将为探索包虫病防治新途径提供重要思路。
利益冲突:无
引用本文格式:李德伟,施阳,李亮,等. MEK1/2抑制剂曲美替尼对体外多房棘球蚴原头节的作用研究[J]. 中国人兽共患病学报,2022,38(8):673-677. DOI:10.3969/j.issn.1002-2694.2022.00.105
